补肾强筋胶囊含药血清对IL-1β刺激的人原代软骨细胞的影响
2017-05-19姚楠陈能许学猛黄雪君蔡大可刘文刚
姚楠, 陈能, 许学猛, 黄雪君, 蔡大可, 刘文刚
(1广东省中医药工程技术研究院/广东省中医药研究开发重点实验室,广东 广州510095;2广东省第二中医院 骨科,广东 广州510095;3广州中医药大学 研究生院,广东 广州510405)
补肾强筋胶囊含药血清对IL-1β刺激的人原代软骨细胞的影响
姚楠1, 陈能2,3, 许学猛2, 黄雪君1, 蔡大可1, 刘文刚2
(1广东省中医药工程技术研究院/广东省中医药研究开发重点实验室,广东 广州510095;2广东省第二中医院 骨科,广东 广州510095;3广州中医药大学 研究生院,广东 广州510405)
目的 研究补肾强筋胶囊含药血清对IL-1β刺激的人原代软骨细胞的影响。方法 采用IL-1β(10 ng/mL)刺激人原代软骨细胞,并且加入不同浓度的补肾强筋胶囊含药血清处理24 h。然后用格式试剂法和酶联免疫法分别检测软骨细胞上清液中NO和PGE2水平,采用RT-qPCR检测软骨细胞COX-2、iNOS、MMP-1、MMP-13、TIMP-1 mRNA表达。结果 补肾强筋胶囊含药血清可明显降低软骨细胞NO和PGE2水平,并显著降低COX-2、iNOS、MMP-1、MMP-13 mRNA表达,而对TIMP-1 mRNA表达无明显影响。结论 补肾强筋胶囊含药血清对IL-1β刺激的人原代软骨细胞有一定保护作用,其作用机制与降低COX-2、iNOS、MMP-1、MMP-13 mRNA表达有关。
补肾强筋胶囊含药血清;白介素-1β;软骨细胞
膝骨关节炎 (knee osteoarthritis,KOA)是全球范围内最常见的与老龄化相关的退行性关节病,严重影响患者的生活质量,同时给其家庭及社会均带来沉重的负担。骨关节炎在我国传统医学中属于 “痹证”、 “骨痹” 的范畴。 中医理论认为,KOA的病机特点包括 “肾虚血瘀”、 “肾虚络阻”等,并且绝经后妇女的中医辨证多属 “肾虚”, “补肾活血法”成为了中医治疗该病的大法。本课题组许学猛教授在中医整体观和辨证论治的观点指导下提出治疗KOA的主要原则是补肾活血、活血通络、祛风除湿,进而根据该原则筛选中药组成补肾活血胶囊 (后更名为补肾强筋胶囊)。方中选用杜仲、补骨脂、骨碎补进行补肝肾、强筋骨,熟地滋阴补肾,这四药共为君药,血竭活血通络为臣药,另外以全蝎祛风除湿、通络止痛为佐药,六药合用有强筋壮骨、活血通络之功。该方为院内制剂,目前已通过临床试验以及分子实验证实了该方对膝骨关节炎具有良性干预作用[1-2],但其在细胞水平上的调节作用机制尚不明确。因此,本实验采用IL-1β诱导退变的软骨细胞,研究补肾强筋胶囊含药血清对IL-1β刺激的软骨细胞NO和PGE2含量,以及对COX-2、iNOS、MMP-1、MMP-13和TIMP-1 mRNA表达的影响,从分子水平探讨其治疗膝骨关节炎的作用机制,现将结果报道如下。
1 材料
1.1 仪器电子分析天平 (德国Sartorius公司);5424型小型高速离心机(德国 Eppendorf公司);-80℃ 超低温冰箱 (美国Thermo公司);IQTM5型荧光定量PCR仪 (美国Bio-Rad公司);SmartSpec plus核酸蛋白测定仪 (美国 Bio-Rad公司);Milli Q Plus超级纯水仪 (美国Millipore公司);HH-6数显恒温水浴锅 (金坛市富华仪器有限公司);Varioskan Flash型全波长多功能酶标仪 (美国Thermo公司);ClassⅡType B2型生物安全柜 (新加坡Esco公司);CO2细胞培养箱 (美国Thermo公司);Cellometer Mini自动细胞计数仪 (美国Nexcelom公司);DMI8倒置荧光显微镜 (德国Leica公司)。
1.2 药物和试剂补肾强筋胶囊由广东省第二中医院制剂室提供;高糖DMEM培养基、胎牛血清、胰酶和DPBS(美国Gib co公司);总RNA提取试剂Trigol(北京鼎国昌盛生物技术有限责任公司),RevertAidTMFirst Strand cDNA Synthesis Kit(美国 Thermo公司);MaximaTMSYBR Green/Fluorescein qPCR Master Mix(2×) (美国Thermo公司);特异性引物 (上海英潍捷基贸易有限公司);NO检测试剂盒 (碧云天生物技术有限公司);人PGE2ELISA试剂盒 (美国R&D公司);氯仿、异丙醇、无水乙醇均为国产分析纯。
2 方法
2.1 补肾强筋胶囊含药血清制备取SPF级 SD雌性大鼠15只,其中 10只为给药组,分别按高、低剂量 (0.486 g生药/kg、0.243 g生药/kg)各灌胃5只;5只为正常对照组,不给药,用等体积生理盐水灌胃。所有大鼠连续灌胃7 d,最后1次给药后1 h,大鼠腹主动脉取血,3 000 rpm离心5 min,取上清液,56℃、30 min灭活,经0.45 μm滤膜抽滤除菌,分装,-80℃保存备用,即为空白血清及高、低两种浓度的含药血清。
2.2 细胞培养和造模选取本单位骨科手术室行膝关节置换手术的绝经后女性患者(年龄>65岁)的软骨,迅速转移至细胞培养室,在超净工作台用眼科剪切取软骨组织,越细越好,至6 mm3大小的碎块,放入培养皿,加 DPBS溶液清洗 2次,5 min/次,除去上清后加入0.25%胰酶消化30 min,然后吸弃上清液,加入0.02%Ⅱ型胶原酶于37℃、5%CO2培养箱内消化过夜。消化后将细胞悬液用 100 μm细胞滤网过滤,加入含10%FBS的高糖DMEM培养基终止消化,1 000 rpm离心5 min,弃上清,细胞沉淀用含10%FBS的高糖DMEM培养基培养,每天在倒置荧光显微镜下观察生长情况,每2天换液1次,待软骨细胞铺满瓶底后,用0.25%胰酶进行消化和传代,传代后继续用含10%FBS的高糖DMEM培养基培养。用IL-1β刺激软骨细胞作为体外KOA模型。将培养的第二代的人软骨细胞按每孔 3×105个细胞种植于6孔板,培养至细胞融合度达到约80%时,吸弃培养基,用DPBS洗2次后,分为四组:正常对照组只添加细胞培养液 (高糖DMEM培养基+10%大鼠空白血清);模型对照组添加细胞培养液 (高糖DMEM培养基 +10%大鼠空白血清),并加入10 ng/mL IL-1β;含药血清高、低剂量组:添加细胞培养液 (DMEM培养基+10%大鼠高或低浓度含药血清),并加入10 ng/mL IL-1β。以上各组细胞设3个复孔,继续培养24 h后收集各组细胞以及上清液。
2.3 细胞上清液NO和PGE2的检测根据试剂盒说明书要求,分别检测细胞上清液的NO和PGE2含量。
2.4 基因表达的检测首先采用Trigol、氯仿和异丙醇等试剂提取软骨细胞总 RNA,然后采用 RevertAidTMFirst Strand cDNA Synthesis Kit提供的实验方法进行反转录操作,其中加入上述提取的总RNA,合成First-strand cDNA。引物设计利用Primer 6.0生物软件,基因的引物由上海英潍捷基贸易有限公司合成。设计的引物信息如表1所示。

表1 扩增的基因引物信息
将9.5 μL灭菌超纯水、1 μL cDNA、特异性引物 F和 R(终浓度均是1 μM)各1 μL、MaximaTMSYBR Green/Fluorescein qPCR Master Mix(2×)12.5 μL混合后共25 μL放入定量PCR仪进行扩增。步骤如下:①94℃,5 min;②94℃,30 s;55℃,40 s;72℃,50 s(45个循环);③72℃,7 min。反应结束后,记录Ct值,运用2-△△Ct法计算各组基因相对表达量。
2.5 统计学分析采用SPSS 17.0软件,所有结果以均数 ±标准差 (±s)表示。多组间均数比较用单因素方差分析(One-Way ANOVA)。组间均数两两比较,方差齐时采用SNK法,方差不齐时采用Dunnett's T3法,P<0.05为差异有统计学意义。
3 结果
3.1 补肾强筋胶囊含药血清对软骨细胞NO和PGE2含量的影响模型对照组软骨细胞上清液中NO和PGE2含量明显高于正常对照组 (P<0.01);与模型对照组比较,补肾强筋胶囊含药血清高、低剂量均能显著降低软骨细胞上清液中NO和PGE2含量 (P<0.05)。见表2。
表2 各组软骨细胞NO和PGE2的含量比较 (±s)
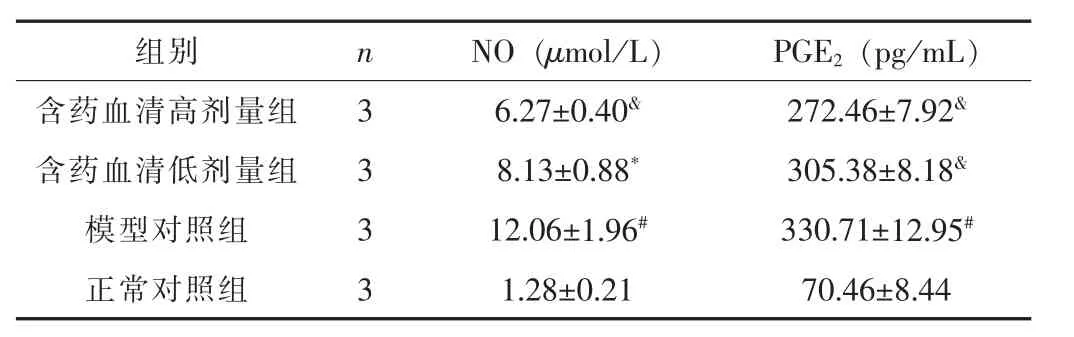
表2 各组软骨细胞NO和PGE2的含量比较 (±s)
注:与模型对照组比较,&P<0.01,*P<0.05;与正常对照组比较,#P<0.01。
组别 n NO(μmol/L) PGE2(pg/mL)含药血清高剂量组 3 6.27±0.40& 272.46±7.92&含药血清低剂量组 3 8.13±0.88* 305.38±8.18&模型对照组 3 12.06±1.96# 330.71±12.95#正常对照组 3 1.28±0.21 70.46±8.44
3.2 补肾强筋胶囊含药血清对软骨细胞相关基因mRNA表达的影响与正常对照组比较,模型对照组软骨细胞的COX-2、iNOS、MMP-1、MMP-13 mRNA表达均明显升高 (P<0.05),而TIMP-1 mRNA表达明显降低 (P<0.05);与模型对照组比较,补肾强筋胶囊含药血清高和低剂量均显著降低了COX-2、iNOS、MMP-1、MMP-13 mRNA表达 (P<0.05),但对TIMP-1 mRNA表达无明显影响 (P>0.05)。见表3。
表3 各组软骨细胞相关基因mRNA表达比较 (±s)
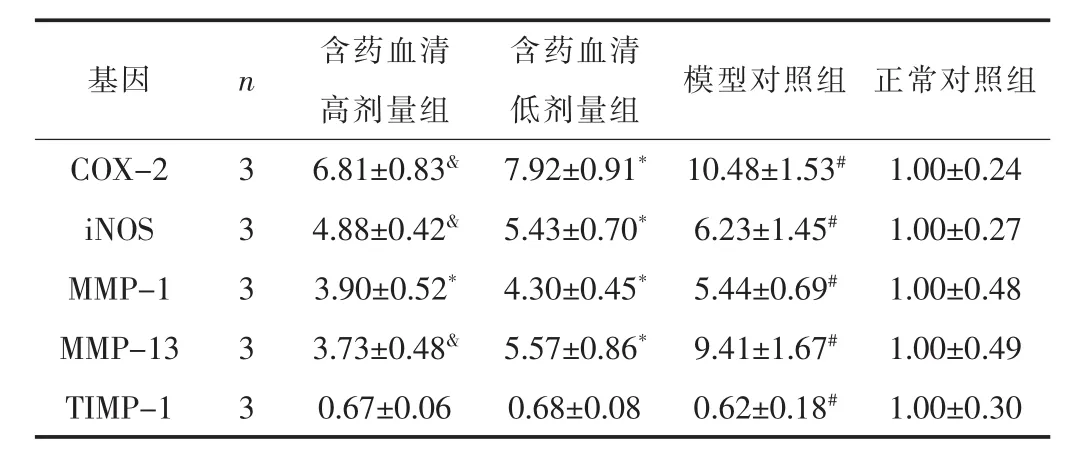
表3 各组软骨细胞相关基因mRNA表达比较 (±s)
注:与模型对照组比较,&P<0.01,*P<0.05;与正常对照组比较,#P<0.01。
基因 n 含药血清 含药血清 模型对照组 正常对照组高剂量组 低剂量组COX-2 3 6.81±0.83& 7.92±0.91* 10.48±1.53# 1.00±0.24 iNOS 3 4.88±0.42& 5.43±0.70* 6.23±1.45# 1.00±0.27 MMP-1 3 3.90±0.52* 4.30±0.45* 5.44±0.69# 1.00±0.48 MMP-13 3 3.73±0.48& 5.57±0.86* 9.41±1.67# 1.00±0.49 TIMP-1 3 0.67±0.06 0.68±0.08 0.62±0.18# 1.00±0.30
4 讨论
膝骨关节炎 (KOA)自发病早期开始,其病理变化主要为关节组织的炎症伴随不同程度的退变,在这个过程中,有许多炎性细胞因子的参与,其中IL-1是炎性致病机制的决定因子之一[3],它主要通过增加基质金属蛋白酶 (MMP)的合成和一氧化氮 (NO)的释放,参与关节软骨的退变降解过程。而阻断IL-1β的产生则能够快速且持续地降低大部分自身炎性疾病[4]的严重程度。
一方面,MMP家族在KOA软骨细胞外基质的降解中发挥重要作用,其中MMP-1和MMP-13是MMP家族中非常重要的两种酶,它们在很大程度上对胶原蛋白的降解产生影响[5-6]。而基质金属蛋白酶组织抑制剂 (TIMP)能够抑制MMP酶活性,调节MMP酶发挥正常的功能,两者共同维护细胞外基质稳态。当MMP与TIMPs之间的平衡被打破后,就会引发KOA。另一方面,氧化应激也是导致KOA发生和发展的重要原因。IL-1β能够刺激iNOS和COX-2的表达,分别增加NO和PGE2的含量[7-10],最终导致MMPs的表达上调[11-12],进而MMP与TIMPs之间的平衡被打破,最终诱发和加重KOA。
关于补肾强筋胶囊组方中所含的单味中药,王胜楠[13]的研究发现,杜仲苷可抑制IL-1β刺激的软骨细胞分泌iNOS、COX-2、MMP-3、MMP-9和MMP-13。王毅等[14]的研究发现,含骨碎补的药物血清可降低IL-1β刺激的软骨细胞MMP-3/TIMP-1水平。
本实验结果显示,与模型对照组比较,补肾强筋胶囊含药血清能够明显降低IL-1β刺激下软骨细胞上清液中NO和PGE2的含量 (P<0.05),并且降低软骨细胞COX-2、iNOS、MMP-1和MMP-13 mRNA表达 (P<0.05),而对TIMP-1 mRNA无明显影响 (P>0.05),提示其治疗KOA的机制可能与其缓解炎症、抑制软骨细胞外基质降解进而保护软骨有关。本实验结果虽与上述单味中药研究结果具有相似性,但由于中药复方具有复杂性,其作用机制仍有待进一步的深入研究。
综上所述,本实验从细胞水平初步探讨了中药补肾强筋胶囊在体内入血后干预KOA的可能机制,即补肾强筋胶囊含药血清对IL-1β刺激的人原代软骨细胞有一定的保护作用,其作用机制与降低COX-2、iNOS、MMP-1、MMP-13 mRNA表达有关,为阐明该药治疗KOA的作用机制奠定了一定的基础。
[1]赵传喜,刘欣,吴淮,等.关节镜清理术配合补肾强筋胶囊治疗退行性膝关节炎远期疗效观察 [J].现代中西医结合杂志,2012(33): 3713-3714.
[2]赵传喜,吴淮,曹金梅,等.补肾活血中药干预对去卵巢膝骨关节炎大鼠E2及CTX-Ⅱ的影响 [J].风湿病与关节炎,2012,1(3): 43-45.
[3]Wojdasiewicz P,Poniatowski LA,Szukiewicz D.The role of inflammatory and anti-inflammatory cytokines in the pathogenesis of osteoarthritis[J].Mediators Inflamm,2014,(2):561459.
[4]Dinarello CA.Blocking interleukin-1β in acute and chronic autoinflammatory diseases[J].J Intern Med,2011,269(1):16-28.
[5]Burrage PS,Mix KS,Brinckerhoff CE.Matrix metalloproteinases:role in arthritis[J].Front Biosci,2006,11:529-543,
[6]Punzi L,Oliviero F,Plebani M.New biochemical insights into the pathogenesis of osteoarthritis and the role of laboratory investigations in clinical assessment[J].Crit Rev Clin Lab Sci,2005,42(4): 279-309.
[7]Abramson SB.Inflammation in osteoarthritis[J].J Rheumatol Suppl, 2004,70:70-76.
[8]Maneiro E,López-Armada MJ,de Andres MC,et al.Effect of nitric oxide on mitochondrial respiratory activity of human articular chondrocytes[J].Ann Rheum Dis,2005,64(3):388-395.
[9]Miyaura C,Inada M,Suzawa T,et al.Impaired bone resorption to prostaglandin E2 in prostaglandin E receptor EP4-knockout mice[J]. J Biol Chem,2000,275(26):19819-19823.
[10]Dannhardt G,Kiefer W.Cyclooxygenase inhibitors-current status and future prospects[J].Eur J Med Chem,2001,36(2):109-126.
[11]Sasaki K,Hattori T,Fujisawa T,et al.Nitric oxide mediates interleukin-1-induced gene expression of matrix metalloproteinases and basic fibroblast growth factor in cultured rabbit articular chon-drocytes[J].J Biochem,1998,123(3):431-439.
[12]Tung JT,Arnold CE,Alexander LH,et al.Evaluation of the influence of prostaglandin E2 on recombinant equine interleukin-1beta-stimulated matrix metalloproteinases 1,3,and 13 and tissue inhibitor of matrix metalloproteinase 1 expression in equine chondrocyte cultures [J].Am J Vet Res,2002,63(7):987-993.
[13]王胜楠.杜仲苷对IL-1β诱导的软骨细胞分解代谢和凋亡的影响及其作用机制 [D].广州:南方医科大学,2015.
[14]王毅,邢国胜,于顺禄,等.IL-1β诱导软骨细胞培养金属蛋白酶/金属蛋白酶抑制剂水平及药物对其影响 [J].中华风湿病学杂志, 2003,7(12):718-721.
(责任编辑: 常海庆)
Effect of Bushenqiangjin Capsule-Contained Serum on Interleukin-1β-Stimulated Human Chondrocytes
YAO Nan1,CHEN Neng2,3,XU Xuemeng2,HUANG Xuejun1,CAI Dake1,LIU Wen'gang2
(1Guangdong Province Engineering Technology Research Institute of TCM/Guangdong Provincial Key Laboratory of Research and Development in Traditional Chinese Medicine,Guangzhou 510095,China;2Department of Orthopedics,Guangdong Second Traditional Chinese Medicine Hospital,Guangzhou 510095,China;3Graduate School,Guangzhou University of Traditional Chinese Medicine,Guangzhou 510405,China)
Objective To study the effect of Bushenqiangjin capsule-contained serum on interleukin-1β(IL-1β)-stimulated human chondrocytes.Methods The cultured human chondrocytes were treated with IL-1β(10 ng/mL)in the presence or absence of different concentration of Bushenqiangjin capsule-contained serum for 24 h.Nitric oxide(NO)and prostaglandin E2(PGE2)levels of cell culture supernate were assessed by Griess reaction and enzyme-linked immunosorbent assay(ELISA)respectively,mRNA expressions of cyclooxgenase-2(COX-2),inducible nitric oxide synthase(iNOS),matrix metalloproteinase-1(MMP-1),matrix metalloproteinase-13 (MMP-13)and tissue inhibitors of metalloproteinase-1(TIMP-1)in chondrocytes were detected by RT-qPCR.Results Bushenqiangjin capsule-contained serum significantly reduced the NO and PGE2levels,also the mRNA expressions of COX-2,iNOS,MMP-1 and MMP-13. No obvious effect was found on the TIMP-1 mRNA expression in IL-1β-stimulated human chondrocytes.Conclusions Bushenqiangjin capsule-contained serum has certain protective effect on IL-1β-stimulated human chondrocytes and the protective mechanism is related with the decrease of mRNA expressions of COX-2,iNOS,MMP-1 and MMP-13 mRNA.
Bushenqiangjin capsule-contained serum;Interleukin-1β;Chondrocytes
R285.5
:A
10.3969/j.issn.1674-4659.2017.03.0327
2016-10-31
广东省自然科学基金 (2014A030310128);广东省科技厅社会发展领域科技计划项目 (2013B021800213);广东省科技厅社会发展领域科技计划项目 (2013B021800214);广东省中医优势病种突破项目(粤中医函 [2015]19号)
姚楠 (1980-),男,博士学位,主管中药师,主要从事中药分子药理学研究,E-mail:nanyao2000@126.com。
