白细胞介素17A在急性百草枯中毒小鼠肾损伤中的作用
2017-05-19宋宏伟杨琛刘伟刘志
宋宏伟,杨琛,刘伟,刘志
(中国医科大学附属第一医院急诊科,沈阳110001)
白细胞介素17A在急性百草枯中毒小鼠肾损伤中的作用
宋宏伟,杨琛,刘伟,刘志
(中国医科大学附属第一医院急诊科,沈阳110001)
目的探讨白细胞介素17A(IL-17A)在急性百草枯中毒小鼠肾损伤中的作用及其机制。方法72只ICR小鼠随机分为3组:生理盐水组(NS组)、百草枯中毒(PQ)组和抗体组(PQ+Ab组),每组24只。PQ与PQ+Ab组均采用一次性灌胃PQ溶液建立PQ中毒模型,PQ+Ab组于染毒2 h后一次性腹腔注射IL-17A抗体,NS组分别给予等量生理盐水。各组于染毒后8、24、48、72 h取6只小鼠处死,分别收集血清和肾组织样本,ELISA法检测血清IL-17A、血肌酐(SCr)、血尿素氮(BUN)水平,化学比色法检测肾组织髓过氧化物酶(MPO)活性,肾组织经苏木素-伊红(HE)染色后观察组织形态变化并评分,免疫组化法和实时定量PCR法分别检测IL-17A蛋白及mRNA的表达。结果与NS组比较,PQ与PQ+Ab组小鼠血清中IL-17A水平升高,肾组织中MPO活性增加,血SCr、BUN升高(均P<0.01);与PQ组比较,PQ+Ab组小鼠血清中IL-17A显著降低、肾组织中MPO活性降低、血SCr、BUN水平下降(均P<0.01),肾病理损伤减轻。结论IL-17A可能通过活化、募集中性粒细胞促进急性PQ中毒小鼠肾损伤,抗体阻断IL-17A能减轻该损伤。
白细胞介素17A;百草枯;中毒;肾损伤;小鼠
百草枯(paraquat,PQ)是一种杂环类除草剂,对人畜均有极强的毒性。有意或无意口服PQ溶液是中毒的主要途径,一旦中毒能引起多器官损伤。肾脏是PQ中毒后受累较早的器官,PQ中毒早期死亡患者多并发肾损伤。白细胞介素17A(interleukin-17A,IL-17A)是一种细胞因子,有研究[1]证实,IL-17A参与炎症性疾病导致的急性肾损伤(acute kidney injury,AKI),敲除IL-17A基因能保护脓毒症导致的AKI[2],本研究通过建立急性PQ中毒小鼠模型,腹腔注射IL-17A抗体阻断IL-17A,探讨IL-17A在急性PQ中毒肾损伤中的作用及其可能途径。
1 材料与方法
1.1 动物和试剂
8周龄健康雌性ICR小鼠(SPF级,26~30 g)购于辽宁长生生物技术有限公司[SCXK(辽)2015-0001],建模实验前适应性喂养1周,小鼠自由活动、饮水、摄食,12 h光照/12 h黑暗处理。动物实验过程均符合伦理学。PQ溶液(浓度为25%,陕西加伦多有限公司),IL-17A、BUN、SCr ELISA试剂盒(北京博奥森有限公司),小鼠IL-17A中和性抗体(美国eBiosicence公司),IL-17A免疫组化试剂盒(英国Abcam公司),Trizol试剂(美国Invitrogen公司),逆转录试剂盒(日本TaKaRa公司),mRNA引物(上海生工生物工程股份有限公司),其他试剂均由中国医科大学科学实验中心提供。
1.2 动物分组与干预
72只小鼠随机均分为3组:对照组(NS组)、中毒组(PQ组)、抗体组(PQ+Ab组),每组24只。NS组一次性灌胃等体积生理盐水,PQ和PQ+Ab组一次性灌胃PQ溶液(25 mg/kg),PQ+Ab组每只小鼠灌胃PQ溶液2 h后一次性腹腔注射IL-17A中和性抗体(5 mg/kg)。各组小鼠分别于染毒后8、24、48、72 h各取6只,腹腔注射10%水合氯醛麻醉后处死。血液样本经2 000 r/min离心后留取上层清液,保存于-20℃冰箱,待检;取左肾组织剪碎,加入适量生理盐水制成10%的组织匀浆,3 000 r/min,离心10 min,取上清液保存于-20℃冰箱,待检;取部分右肾组织固定于10%中性甲醛溶液,4℃冰箱保存,剩余部分保存于-80℃冰箱,待做PCR。
1.3 血清IL-17A、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)测定
采用酶联免疫吸附(enzyme-linked immuno sorbent assay,ELISA)法检测血清IL-17A、BUN、SCr水平,具体步骤按ELISA试剂盒说明书操作。
1.4 髓过氧化物酶(myeloperoxidase,MPO)检测
采用化学比色法检测肾组织匀浆上清液中MPO活性,具体操作步骤严格按照试剂盒说明书进行。在460 nm处读取吸光度值,MPO活性计算公式:MPO活性(U/g)=(A测定管-A对照管)/(11.3×取样量)。
1.5 肾组织病理学检测
肾组织常规脱水、石蜡包埋,用于制备石蜡切片。5 μm切片,HE染色后,光学显微镜下观察肾组织病理变化,Paller法[3]评估肾小管损伤程度:每张肾组织切片随机选择3个无重叠视野(×200),每个视野下随机选择3处肾小管,共9个肾小管计分,结果取平均值,分数越高表示肾小管损伤越严重。
1.6 免疫组化(immunohistochemistry,IHC)检测IL-17A表达
将固定好的肾组织经脱水、石蜡包埋和组织切片等步骤制作成5 μm的切片。IHC操作步骤严格按照IL-17A免疫组化试剂盒说明书进行。IHC切片在光学显微镜下观察。
1.7 实时定量PCR法检测肾组织IL-17A mRNA表达
肾组织匀浆,Trizol试剂提取总RNA,逆转录试剂盒合成cDNA,实时定量PCR扩增按照试剂盒说明书进行,反应体系按以下条件进行扩增:37℃逆转录15 min,85℃预变性2 min,85℃变性30 s,40℃退火延伸30 s,共40个循环。通过目的基因IL-17A与内参基因GAPDH比较测定IL-17AmRNA表达量。同时绘制溶解曲线,以保证PCR的效果。IL-17A与GAPDH序列由PubMed数据库查得,委托上海生工生物工程有限公司合成引物:IL-17A(344 bp),上游5’-TGTCAATGCGGAGGGAAAG-3’,下游5’-GCAGTTTGGGACCCCTTTAC-3’;GAPDH(183 bp),上游5’-GGTTGTCTCCTGCGACTTCA-3’,下游5’-TGGTCCAGGGTTTCTTACTC-3’。
1.8 统计学分析
利用SPSS 22.0软件进行统计,计量资料以x±s表示。多组间比较采用单因素方差分析,方差齐时采用LSD-t检验,方差不齐时采用Games-Howell法检验,双变量分析采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况比较
NS组小鼠未见明显异常。中毒小鼠可见躁动不安、倦怠、活动减少、行动迟缓、呼吸急促、口唇分泌物增多等表现。与PQ组相比,PQ+Ab组小鼠呼吸急促、口唇分泌物等表现较轻。
2.2 肾组织形态学观察及病理损伤评分
PQ组小鼠肾脏明显肿胀、变大,PQ+Ab组小鼠肾组织肿胀、变大程度较PQ组小鼠稍显轻微,见图1。肾组织HE染色镜下观察NS组小鼠每个观察时间点均无明显病理改变;PQ与PQ+Ab组可见肾小管上皮细胞水肿并逐渐加重,管腔逐渐狭窄甚至闭塞,部分肾小球逐渐增大至结构紊乱、间质充血、水肿,并有炎症细胞浸润;72 h时可见肾小管上皮细胞水肿减轻、管腔开放、间质充血水肿减轻、炎症细胞浸润减少,见图2。肾组织病理损伤评分结果显示,与NS组比较,PQ与PQ+Ab组明显升高,48 h时最高(均P<0.01);与PQ组比较,PQ+Ab组病理损伤评分较低(均P<0.01),见表1。
2.3 各组小鼠血清IL-17A水平比较
NS组小鼠血清IL-17A各时间无明显变化。与NS组比较,PQ与PQ+Ab组血清中IL-17A明显升高,并在观察时间内持续升高(均P<0.001);与PQ组比较,PQ+Ab组各时间点血清IL-17A水平均下降(均P<0.05),见表1。
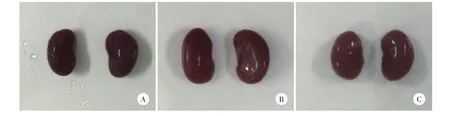
图1 小鼠肾脏大体观察Fig.1General observation of mouse kidneys
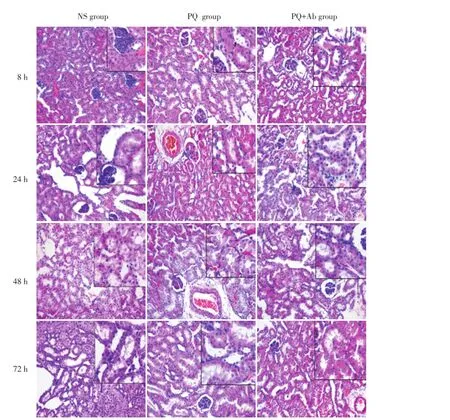
图2 各组小鼠肾组织病理学所见Fig.2Histopathology of kidney tissue
表1 各组小鼠肾组织病理评分及血清IL-17A水平Tab.1Kidney tissue pathological score and serum IL-17A in mic
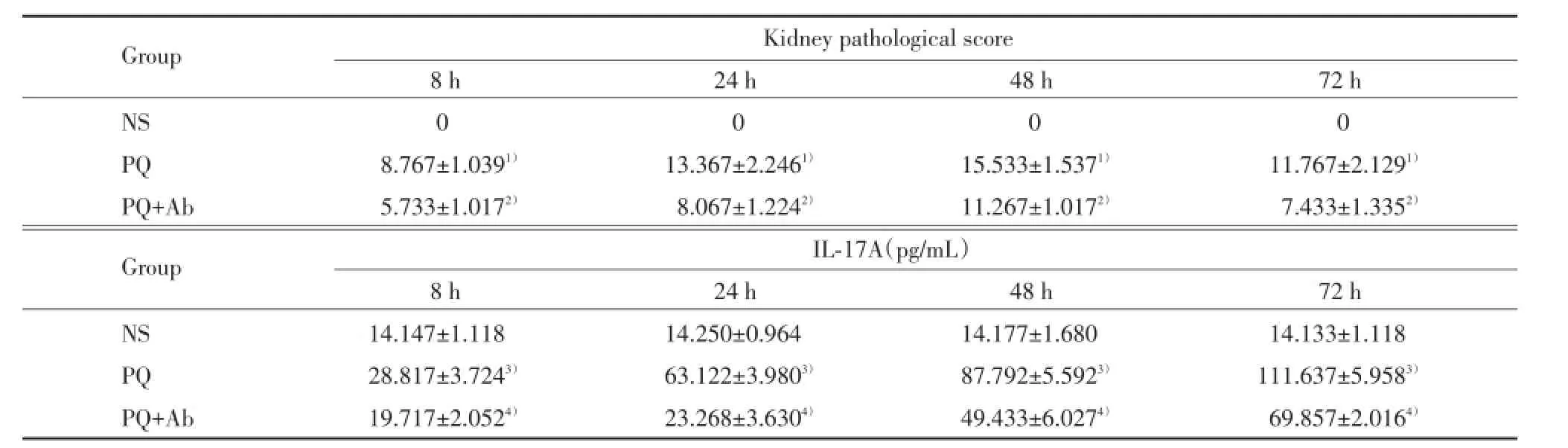
表1 各组小鼠肾组织病理评分及血清IL-17A水平Tab.1Kidney tissue pathological score and serum IL-17A in mic
1)P<0.01 vs NS group;2)P<0.01 vs PQ group;3)P<0.001 vs NS group;4)P<0.05 vs PQ group.
?
2.4 肾组织病理评分与肾血清中IL-17A的关系
结果显示,肾病理损伤程度与肾血清中IL-17A含量成正相关(r=0.671,P<0.001)。
2.5 各组小鼠血清BUN、SCr水平比较
NS组小鼠血清BUN、SCr各时间无明显变化。与NS组比较,PQ与PQ+Ab组血清BUN、SCr水平明显升高,均在48 h时达高峰,差异有统计学意义(均P<0.01);与PQ组比较,PQ+Ab组小鼠血清BUN、SCr降低(均P<0.01)。见表2。
2.6 各组小鼠肾组织MPO活性比较
表2 各组小鼠血清BUN、SCr水平Tab.2Levels of BUN and SCr of mice
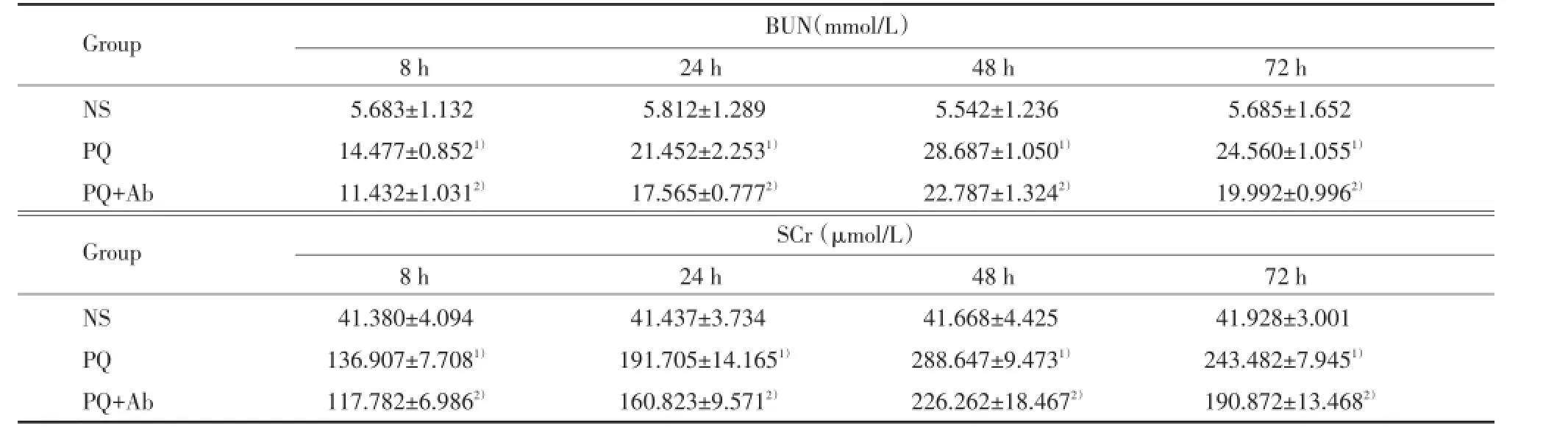
表2 各组小鼠血清BUN、SCr水平Tab.2Levels of BUN and SCr of mice
1)P<0.01 vs NS group;2)P<0.01 vs PQ group.
?
NS组小鼠肾组织MPO活性各时间无明显变化;与NS组比较,PQ和PQ+Ab组小鼠肾组织MPO活性迅速升高(均P<0.01);与PQ组比较,PQ+Ab组MPO肾组织活性降低(均P<0.01),见表3。
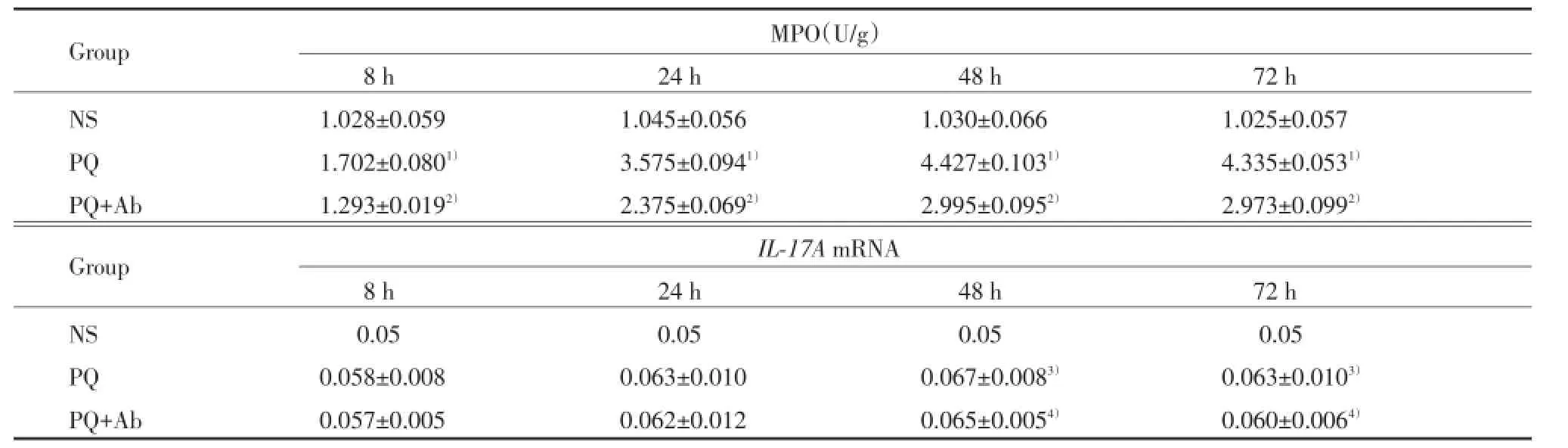
表3 小鼠肾组织MPO活性及IL-17A mRNA的表达Tab.3Activity of MPO and IL-17A mRNA expression in mouse kidneys
2.7免疫组化检测各组小鼠IL-17A表达比较
IL-17A主要存在于细胞胞质中,NS组的肾组织中未见表达IL-17A的细胞;PQ与PQ+Ab组小鼠肾组织中偶见表达IL-17A的细胞散在于肾小球和肾小管中,呈棕色;与NS组比较,3组间细胞表达未见明显差异。肾间质中可见IL-17A存在,见图3。
2.8 各组小鼠肾组织IL-17AmRNA表达比较
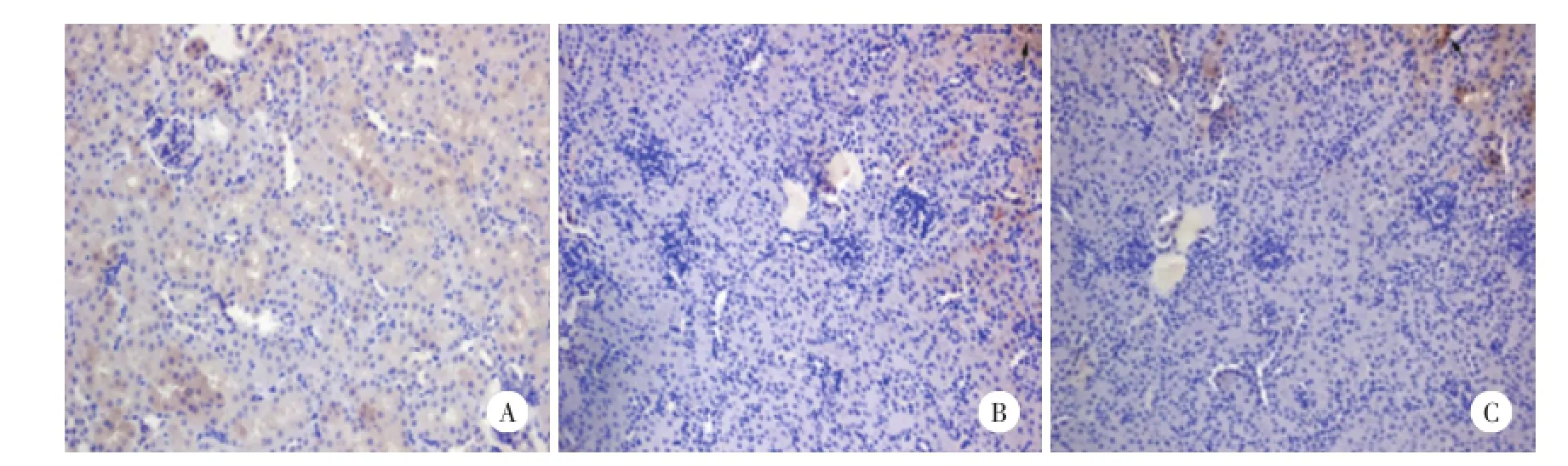
图3 免疫组化检测各组小鼠肾组织IL-17A表达DAB×200Fig.3Expression of IL-17A in mouse kidney tissue,assayed using IHC DAB×200
NS组小鼠肾组织中IL-17AmRNA极少量表达,与NS组比较,PQ组和PQ+Ab组小鼠肾组织IL-17A mRNA表达升高(P<0.05);与PQ组比较,PQ+Ab组降低(P<0.05),见表3。
3 讨论
肾脏是人体主要的排泄器官,进入人体内的PQ主要经肾脏排泄,因此肾也是PQ中毒损伤的主要靶器官。本研究显示,PQ中毒后,小鼠血浆BUN、SCr的水平迅速显著升高。有研究[5]表明,PQ能引起以肾小管和间质损伤为主的AKI表现。实验观察到PQ中毒小鼠出现肾小管上皮细胞水肿、管腔逐渐狭窄甚至闭塞,部分肾小球增大、结构紊乱、炎症细胞浸润等肾损伤的病理改变;IL-17A抗体阻断后,上述病理改变减轻。
有关PQ中毒肾损伤的机制目前认为,一方面PQ在肾组织诱发脂质过氧化反应,引起细胞凋亡,凋亡细胞释放出炎症介质和细胞因子加重肾组织病理损伤[6-7];另一方面,PQ中毒后,血清中升高的炎症介质也可参与肾损伤[8],同时肾组织中炎性细胞因子的表达也升高[9]。IL-17A是一种促炎细胞因子,主要由辅助性17细胞(T helper 17 cell,Th17)分泌,少量由巨噬细胞、自然杀伤细胞、中性粒细胞分泌[10],可参与炎症反应、自身免疫性疾病等,并在其中发挥重要作用[11]。本研究发现,PQ中毒后,血清中IL-17A水平显著升高;抗体阻断IL-17A后,伴随着血清中IL-17A含量降低,血清BUN、SCr浓度下降,肾组织病理损伤程度减轻。通过分析血清IL-17A的浓度与肾病理评分的关系发现血清中IL-17A含量越高,肾病理损伤越重。本研究结果表明,IL-17A促进急性PQ中毒后小鼠AKI。此外,通过IHC和PCR检测分析发现,PQ中毒后肾损伤的过程中,IL-17A在肾组织中极少表达,据此推测急性PQ中毒肾组织中参与肾损伤的IL-17A主要来自于外周循环。
既往研究[12]表明,IL-17A主要通过募集、活化中性粒细胞和单核巨噬细胞放大局部炎症反应加重组织损伤。MPO是由活化的中性粒细胞分泌的标志酶,具有杀灭病原体、损伤组织的作用[13]。MPO的活性可以反应局部组织中中性粒细胞的活化和聚集程度,其活性越高,则活化的中性粒细胞聚集越多,对组织的损伤也就越严重[14]。研究[15]证实,PQ中毒后,血中白细胞升高,中性粒细胞百分比增多。本实验PQ中毒后,小鼠肾组织中MPO活性显著升高,而阻断IL-17A后,肾组织中MPO活性降低。实验结果表明PQ中毒肾损伤的发生有中性粒细胞的参与,同时也说明,IL-17A可以通过活化、募集中性粒细胞参与PQ中毒后肾损伤。
本研究表明,小鼠PQ中毒后,IL-17A从外周血循环进入肾组织,并通过活化、募集中性粒细胞促进肾损伤,抗体阻断IL-17A能显著减轻PQ中毒小鼠的肾损伤,为抗体治疗急性PQ中毒提供了实验基础。
[1]CHAN AJ,ALIKHAN MA,ODOBASIC D,et al.Innate IL-17A-producing leukocytes promote acute kidney injury via inflammasome and Toll-like receptor activation[J].Am J Pathol,2014,184(5):1411-1418.DOI:10.1016/j.ajpath.2014.01.023.
[2]LUO CJ,LUO F,ZHANG L,et al.Knockout of interleukin-17A protects against sepsis-associated acute kidney injury[J].Ann Intensive Care,2016,6(1):56-65.DOI:10.1186/s13613-016-0157-1.
[3]PALLER MS,HOIDAL JR,FERRIS TF.Oxygen free radicals in ischemic acute renal failure in the rat[J].J Clin Invest,1984,74(4):1156-1164.DOI:10.1172/JCI111524.
[4]KAEMMERER D,PETER L,LUPP A,et al.Comparing of IRS and-Her2 as immunehistochemical scoring schemes in gastroentero-pancreatic neuroendocrine tumors[J].Int J Clin Exp Pathol,2012,5(3):187-194.
[5]HONG GL,LIU JM,ZHAO GJ,et al.Cycloartenyl ferulate inhibits paraquat-induced apoptosis in HK-2 cells with the involvement of ABCC1[J].J Cell Biochem,2016,117(4):872-880.DOI:10.1002/jcb.25370.
[6]WEI T,TIAN W,LIU F,et al.Protective effects of exogenous β-hydroxybutyrate on paraquat toxicity in rat kidney[J].Biochem Biophys Res Commun,2014,447(4):666-671.DOI:10.1016/j. bbrc.2014.04.074.
[7]杨琛,马涛,刘志.急性百草枯中毒大鼠肾损伤的研究[J].中华劳动卫生职业病杂志,2015,33(5):370-374.DOI:10.3760/cma. j.issn.1001-9391.2015.05.016.
[8]焦路阳,宋志善,郭庆合,等.急性百草枯中毒大鼠肾损害时血清中炎性因子的变化[J].中华劳动卫生职业病杂志,2011,29(3):227-229.DOI:10.3760/cma.j.issn.1001-9391.2011.03.020.
[9]TOMITA M,OKUYAMA T,HIDAKA K.Changes in mRNAs of inducible nitric oxide synthase and interleukin-1 beta in the liver,kidney and lung tissues of rats acutely exposed In paraquat[J].Leg Med(Tokyo),1999,1(3):127-134.
[10]LO RE S,DUMOUTIER L,COUILLIN I,et al.IL-17A-producing gamma-delta T and Th17 lymphocytes mediate lung inflammation but not fibrosis in experimental silicosis[J].J Immunol,2010,184(11):6367-6377.DOI:10.4049/jimmunol.0900459.
[11]NEMBRINI C,MARSLAND BJ,KOPF M.IL-17-producing T cells in lung immunity and inflammation[J].J Allergy ClinImmunol,2009,123(5):986-994.DOI:10.1016/j.jaci.2009.03.033.
[12]BRAUN RK,FERRICK C,NEUBAUER P,et al.IL-17 producing +δ T cells are required for a controlled inflammatory response after bleomycin-induced lung injury[J].Inflammation,2008,31(3):167-179.DOI:10.1007/s10753-008-9062-6.
[13]NIKULSHIN S,TOLSTIKOVA I,BARTULE A,et al.Intracellular neutrophil myeloperoxidase level in pediatric patients:significant age and gender variability[J].Int J Lab Hematol,2015,37(1):120-124.DOI:10.1111/ijlh.12252.
[14]SHARMA J,RASTOQI P,CREER MH,et al.Polymorphonuclear leukocytes isolated from umbilical cord blood as a useful research tool to study adherence to cell monolayers[J].J Immunol Meth,2009,351(1/2):30-35.DOI:10.1016/j.jim.2009.09.008.
[15]张翠萍,王胜武,李丽.白细胞及中性粒细胞对百草枯中毒患者预后的意义[J].中国医药,2012,7(9):1173-1175.DOI:10.3760/cma.j.issn.1673-4777.2012.09.051.
(编辑 武玉欣)
Effects of Interleukin-17A on Acute Paraquat-intoxication-induced Kidney Injury in Mice
SONG Hongwei,YANG Chen,LIU Wei,LIU Zhi
(Department of Emergency,The First Hospital,China Medical University,Shenyang 110001,China)
ObjectiveTo investigate the effects of interleukin-17A on kidney injury induced by paraquat(PQ).MethodsSeventy-two ICR mice were randomly divided into 3 groups:NS,PQ,and PQ+Ab(n=24 for each).The PQ-poisoning model was established by administering a gavage of PQ solution;mice in the PQ+Ab group were then administereda dose of anti-IL-17A antibody 2 hours later by i.p.injection,whereas the NS group were administered a corresponding volume of normal saline instead.The mice were killed at 8,24,48,or 72 h to obtain renal tissues and serum.An enzyme-linked immunosorbent assay(ELISA)was used to determine serum IL-17A,serum creatinine(SCr),and blood urea nitrogen(BUN)levels.Chemical colorimetry was used to detect the viability of myeloperoxidase(MPO)in renal tissue,and hematoxylin-eosin(HE)staining was used to observe the renal pathologic changes.Immunohistochemistry(IHC)and PCR were used to examine IL-17A expression in renal tissues.ResultsSerum IL-17A,renal tissue MPO viabilities,BUN,and SCr were increased in the PQ and PQ+Ab groups,compared to those in the NS group(P<0.01).However,the above-mentioned parameters were lower in the PQ+Ab group than in the PQ group(P<0.01).ConclusionIL-17A promotes mouse kidney injury induced by acute PQ-intoxication through activating and/or recruiting neutrophils;therefore,blockade IL-17A,with antibody can attenuate the injury.
interleukin-17A;paraquat;intoxication;kidney injury;mice
R594.4
A
0258-4646(2017)05-0392-05
10.12007/j.issn.0258-4646.2017.05.003
国家自然科学基金(81571882);辽宁省科学技术计划(2013225303)
宋宏伟(1989-),男,硕士研究生.
刘志,E-mail:Liuzhicmu@163.com
2016-10-13
网络出版时间:
