地塞米松对人牙周膜细胞白细胞介素6和白细胞介素8表达的调节作用
2017-05-19唐晓琳潘春玲李琛
唐晓琳,潘春玲,李琛
(中国医科大学口腔医学院牙周科,沈阳110002)
地塞米松对人牙周膜细胞白细胞介素6和白细胞介素8表达的调节作用
唐晓琳,潘春玲,李琛
(中国医科大学口腔医学院牙周科,沈阳110002)
目的探讨地塞米松(Dex)对人牙周膜细胞(hPDLCs)中白细胞介素(IL)6和IL-8表达的调节作用。方法Dex或牙龈卟啉单胞菌(P.g)-脂多糖(LPS)分6组处理hPDLCs:10-9mol/L Dex组,10-6mol/L Dex组,10 μg/mLP.g-LPS组,10-9mol/L Dex+ 10 μg/mLP.g-LPS组,10-6mol/L Dex+10 μg/mLP.g-LPS组,0.1%无水乙醇(对照组)。分别用ELISA法和实时定量PCR法检测IL-6、IL-8蛋白和mRNA表达水平。结果24 h和48 h时,10-9mol/L Dex组和10-6mol/L Dex组IL-6和IL-8蛋白表达水平显著低于对照组(P<0.05)。48 h时10-9mol/L Dex组和10-6mol/L Dex组hPDLCsIL-6mRNA水平显著低于对照组(P<0.05);而10-6mol/L Dex组IL-8mRNA的表达水平显著高于对照组(P<0.05)。24 h和48 h时10-9mol/L Dex+10 μg/mLP.g-LPS组和10-6mol/L Dex+10 μg/mLP.g-LPS组IL-6蛋白和mRNA表达水平显著低于10 μg/mLP.g-LPS组(P<0.05)。24 h时10-9mol/L Dex+10 μg/mL P.g-LPS组和10-6mol/L Dex+10 μg/mLP.g-LPS组IL-8蛋白表达水平显著低于10 μg/mLP.g-LPS组(P<0.05),但48 h未见统计学差异。48 h时,10-6mol/L Dex+10 μg/mLP.g-LPS组IL-8mRNA水平显著高于10 μg/mLP.g-LPS组(P<0.05)。结论Dex可以显著抑制hPDLCs固有的和P.g-LPS诱导产生的IL-6的表达,但是Dex对hPDLCs IL-8的表达具有复杂的调节作用,需注意高浓度Dex长时间作用时对hPDLCs IL-8表达的促进作用。
地塞米松;糖皮质激素;牙周膜细胞;骨向诱导;白细胞介素6;白细胞介素8
牙周炎是一种发生在牙周组织的慢性炎症性疾病,主要特点是牙周袋形成和牙槽骨吸收。人牙周膜细胞(human periodontal ligament cells,hPDLCs)是牙周组织的重要细胞,在特定条件下可以分化为成骨细胞,进而修复牙周组织。此外,hPDLCs在细菌及其毒力因子作用下可以分泌白细胞介素(interleukin,IL)6和IL-8等多种促炎性因子[1]。众所周知,糖皮质激素能够调节细胞分化和免疫炎症反应。地塞米松(dexamethasone,Dex)是一种常见的人工合成糖皮质激素。Dex主要用于牙周组织工程学研究,即诱导牙周膜干细胞骨向分化为成骨细胞[2-4];其次,在牙周治疗中可作为止痛辅剂[5]。但是Dex对hPDLCs促炎性细胞因子表达的调节作用尚不清楚。本研究的目的是观察Dex和牙龈卟啉单胞菌(Porphyromonas gingivalis,P.g)-脂多糖(lipopolysaccharide,LPS)对hPDLCs IL-6和IL-8表达水平的调节作用,从而为Dex的临床应用提供依据。
1 材料与方法
1.1 主要试剂和仪器
Dex(美国Sigma公司);胎牛血清(德国PAA公司);活性炭处理胎牛血清(天津灏洋生物制品技术有限公司);DMEM培养基(美国GIBCO公司);ELISA试剂盒、Trizol试剂盒和反转录试剂盒(美国Invitrogen公司);P.g-LPS(中国医科大学口腔医学院牙体牙髓科仇丽鸿教授惠赠);酶标仪(美国Bio Rad公司);实时定量PCR试剂(日本Takara公司)。
1.2 hPDLCs原代培养
细胞来源于3名正畸治疗患者的前磨牙。术前获得患者的知情同意。采用组织块法行hPDLCs原代培养[6]。个体来源细胞培养至第3代后混合,进行传代培养和后续实验。
1.3P.g-LPS提取
热酚水法提取P.gATCC 33277 LPS,冻干得LPS精制品,-70℃冻存备用。
1.4 Dex和P.g-LPS处理方法和分组
Dex溶解于无水乙醇中,-70℃冻存备用。消化第4代细胞,2×104/孔接种于24孔板(为第5代),在去酚红DMEM培养基和5%活性炭处理的胎牛血清中培养至第8天,分为6组处理:10-9mol/L Dex组,10-6mol/L Dex组,10 μg/mLP.g-LPS组,10-9mol/L Dex+10 μg/mLP.g-LPS组,10-6mol/L Dex+10 μg/mLP.g-LPS组,对照组(培养基中加入0.1%无水乙醇),每组重复6孔。
1.5 ELISA法检测hPDLCs IL-6和IL-8蛋白的表达水平
在上述处理24 h和48 h时收集培养基,1 000 r/min、4℃离心15 min,取上清液,-70℃冻存待检。依据IL-6和IL-8试剂盒说明,ELISA法检测上清液中的IL-6和IL-8含量。酶标仪450 nm波长读取光密度值,根据标准曲线计算上清中IL-6和IL-8含量。
1.6 实时定量PCR法检测IL-6和IL-8mRNA表达水平
各种因素处理细胞48 h,按照试剂盒说明,用Trizol试剂裂解细胞并提取细胞总RNA,反转录试剂盒反转录为cDNA,实时定量PCR法检测IL-6和IL-8mRNA表达水平,GAPDH做为内参照。引物序列:IL-6,上游引物5’-GGAGACTTGCCTGGTGAAA-3’,下游引物5’-CAGGGGTGGTTATTGCATCT-3’,产物片段179 bp;IL-8,上游引物5’-AGCTCTGTGTG AAGGTGCAG-3’,下游引物5’-AATTTCTGTGTTGG CGCAGT-3’,产物片段148 bp;GAPDH,上游引物5’-GAAGGTGAAGGTCGGAGTC-3’,下游引物5’-GAA GATGGTGATGGGATTTC-3’,产物片段226 bp。目的基因mRNA表达水平的计算方法为相对定量法,计算公式为2-ΔΔCT。
1.7 统计学分析
2 结果
2.1 Dex对hPDLCs固有IL-6和IL-8表达的调节作用
10-9mol/L Dex组和10-6mol/L Dex组IL-6蛋白表达水平显著低于对照组(均P<0.001),24 h时分别为对照组的42.52%和15.49%,48 h分别为对照组的23.86%和6.59%。48 h时,10-9mol/L Dex组和10-6mol/L Dex组IL-6mRNA表达水平显著低于对照组(均P<0.001),分别为对照组的53.10%和10.13%。见表1。
10-9mol/L Dex组或10-6mol/L Dex组IL-8蛋白表达水平显著低于对照组(均P<0.001),24 h时分别为对照组的32.51%和24.67%;48 h分别为对照组的37.77%和53.84%。48 h时10-6mol/L Dex组IL-8mRNA表达水平显著高于对照组(P=0.016),为对照组的2.74倍。见表1。
2.2P.g-LPS对hPDLCs IL-6和IL-8表达的调节作用
10 μg/mLP.g-LPS组IL-6蛋白表达水平显著高于对照组(均P<0.001),24 h时为对照组的9.08倍,48 h时为对照组的4.82倍。48 h时10 μg/mLP.g-LPS组IL-6mRNA的表达水平显著高于对照组(P<0.001),为对照组的8.97倍。见表1。
10 μg/mLP.g-LPS组IL-8蛋白表达水平显著高于对照组(均P<0.001),24 h时为对照组的28.15倍,48 h为对照组的37.53倍。48 h时10 μg/mLP.g-LPS组IL-8mRNA的表达水平显著高于对照组(P<0.001),为对照组的74.64倍。见表1。
2.3 Dex和P.g-LPS联合作用对hPDLCs IL-6和IL-8表达的影响
10-9mol/L Dex+10 μg/mLP.g-LPS组或10-6mol/L Dex+10 μg/mLP.g-LPS组IL-6蛋白的表达水平均显著低于10 μg/mLP.g-LPS组(均P<0.001),24 h时分别为10 μg/mLP.g-LPS组的72.00%和37.30%,48 h时分别为10 μg/mLP.g-LPS组的84.64%和 66.85%。48 h时10-9mol/L Dex+10 μg/mLP.g-LPS组(P=0.014)和10-6mol/L Dex+10 μg/mLP.g-LPS组(P=0.009)IL-6mRNA表达水平显著低于10 μg/mLP.g-LPS组,分别为10 μg/mLP.g-LPS组的38.56%和27.03%。见表1。
24 h时10-9mol/L Dex+10 μg/mLP.g-LPS组或10-6mol/L Dex+10 μg/mLP.g-LPS组IL-8蛋白的表达水平均显著低于10 μg/mLP.g-LPS组(均P<0.001),分别为10 μg/mLP.g-LPS组的68.29%和69.45%。但48 h时,Dex对10 μg/mLP.g-LPS诱导产生的IL-8蛋白表达未见显著作用。48 h时10-6mol/L Dex+10 μg/mLP.g-LPS组IL-8mRNA表达水平显著高于10 μg/mLP.g-LPS组(P<0.001),为10 μg/mLP.g-LPS单独作用的3.95倍。见表1。
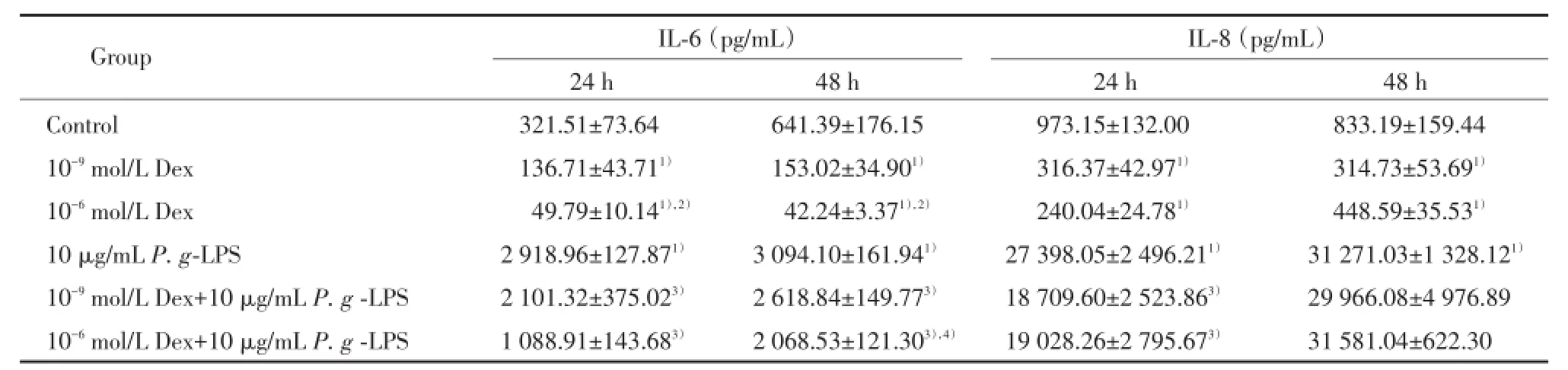
表1 Dex和P.g-LPS对hPDLCs IL-6和IL-8蛋白表达的调节作用Tab.1Effects of Dex and P.g-LPS on IL-6 and IL-8 protein expression in hPDLCs
3 讨论
Dex在牙周领域的应用主要为诱导牙周干细胞骨向分化,很少用于治疗牙周炎症反应。笔者推测,局部应用Dex可以避免全身应用的诸多不良反应[7],一方面能够诱导hPDLCs细胞骨向分化,另一方面可以发挥调节炎症反应的作用。但是局部应用Dex对牙周炎的调节作用尚存在争议[8-9]。本研究以hPDLCs为研究对象,探讨Dex对促炎性因子表达的调节作用和剂量选择。
IL-6积极参与牙周炎的发生发展过程,具有促进破骨细胞成熟、抑制牙周膜再生、促进炎症反应等多项功能。本研究发现,Dex强烈抑制hPDLCs固有的和P.g-LPS诱导产生的IL-6蛋白和mRNA的表达,从而可能抑制牙周炎症反应。NEBEL等[10]的研究发现,Dex显著抑制大肠杆菌LPS诱导的hPDLCs IL-6的表达,但是未探讨Dex对hPDLCs固有IL-6表达的调节作用。此外,NEBEL等[10]的研究中未发现1~5 μg/mLP.g-LPS对hPDLCs的调节作用,本研究预实验发现10 μg/mLP.g-LPS能显著促进hPDLCs IL-6蛋白和mRNA的表达,且与更高浓度LPS组比较细胞的状态未发生显著变化,因此选择该浓度。多项研究结果显示,P.g-LPS通过多种途径促进IL-6的表达,包括丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路[11]、核因子κB通路[12]、miRNA-146分子[13]等。ANTON等[14]发现Dex能够抑制MAPK的活化,进而抑制LPS刺激绒毛外滋养细胞IL-6和IL-8的表达。但是在hPDLCs中,Dex调节IL-6表达的具体途径还需要深入研究。
IL-8是人白细胞趋化和活化因子家族成员,研究证实IL-8在牙周炎的炎症进程中发挥重要作用[15-16]。本研究结果显示,Dex对IL-8具有复杂的调节作用。本研究发现,Dex对hPDLCs固有IL-8蛋白有显著的抑制作用,但是48 h时高浓度(10-6mol/L)Dex组IL-8蛋白和mRNA表达水平显著高于10-9mol/L Dex组,IL-8mRNA水平显著高于对照组。此外,虽然Dex作用24 h显著抑制P.g-LPS诱导产生的IL-8蛋白水平,但是48 h时Dex对P.g-LPS诱导产生IL-8蛋白的抑制作用消失,且10-6mol/L Dex强烈促进P.g-LPS诱导IL-8mRNA的表达。
本研究中,培养基上清液中检测到的IL-8蛋白和细胞中IL-8mRNA表达的趋势不甚一致,主要是由检测方法导致。本研究中通过ELISA法检测培养基上清中的IL-8水平,由于早期Dex对细胞IL-8蛋白的显著抑制作用,导致Dex组上清液中IL-8水平较低,而随后Dex虽然可能促进了IL-8蛋白的表达,但是未能抵消原有的抑制量,所以未能检测出Dex对IL-8蛋白的促进作用。此外,本研究发现48 h时10-6mol/L Dex组IL-8蛋白和mRNA水平都显著高于10-9mol/L Dex组,且Dex对LPS诱导产生IL-8蛋白的抑制作用消失,也可以提示48 h时10-6mol/L Dex对IL-8蛋白表达的促进作用。根据LEE等[17]的报道,Dex能显著抑制MAPK途径,进而抑制hPDLCs中肿瘤坏死因子α诱导IL-8的表达,但是仅检测了24 h时间点,未对48 h时间点进行检测,因此无法与本研究的结果类比。此外,SADIKOT等[18]研究显示,高剂量Dex能够增强内毒素处理小鼠核因子κB活性,从而促进炎症发生。AGRAWAL等[19]的研究发现,Crohn病患者全身应用Dex能够增加腹腔内和盆腔内脓肿的危险性。根据本研究结果,Dex对IL-8表达的调节具有双向作用。短时间内Dex可能抑制IL-8的表达,而高浓度Dex长时间作用可能促进内源性和LPS诱导的IL-8的表达,但是具体机制还需要深入研究。
本研究中应用的特定实验条件考虑了如下因素。本研究在细胞培养至第8天后施加各种处理因素,此时细胞生长已到达平台期,可以排除Dex对细胞生长的影响。Dex是骨向诱导剂的重要成分,以往研究报道的浓度范围为10-9~10-6mol/L,因此本研究应用这一浓度范围处理细胞。研究中采用去酚红DMEM培养基和活性炭处理胎牛血清,能够最大限度降低培养体系中激素对实验结果的影响。为了增强可比性,24 h和48 h的检测结果均来源于同一批细胞。所以仅在处理结束即48 h时,对裂解细胞进行了mRNA检测。
综上所述,Dex能够显著抑制IL-6的表达,从而可能抑制牙周炎症反应。但是,Dex对IL-8的调节作用较为复杂,具有双向性,特别是高浓度Dex长时间作用可能促进IL-8的表达进而可能促进炎症反应。因此,在临床应用时需要注意Dex的合理浓度范围。今后尚需研究Dex对hPDLCs IL-6和IL-8表达调节的具体机制,并探讨体内应用方式。
[1]TANG X,PAN Y,ZHAO Y.Vitamin D inhibits the expression of interleukin-8 in human periodontal ligament cells stimulated with Porphyromonas gingivalis[J].Arch Oral Biol,2013,58(4):397-407. DOI:10.1016/j.archoralbio.2012.09.010.
[2]AN S,GAO Y,LING J.Characterization of human periodontal ligament cells cultured on three-dimensional biphasic calcium phosphate scaffolds in the presence and absence of L-ascorbic acid,dexamethasone and beta-glycerophosphate in vitro[J].Exp Ther Med,2015,10(4):1387-1393.DOI:10.3892/etm.2015.2706.
[3]ROOZEGAR MA,MOHAMMADI TM,HAVASIAN MR,et al.In vitro osteogenic impulse effect of dexamethasone on periodontal ligament stem cells[J].Bioinformation,2015,11(2):96-100.DOI:10.6026/97320630011096.
[4]KIM SM,KIM YG,PARK JW,et al.The effects of dexamethasone on the apoptosis and osteogenic differentiation of human periodontal ligament cells[J].J Periodontal Implant Sci,2013,43(4):168-176.DOI:10.5051/jpis.2013.43.4.168.
[5]STEFFENS JP,SANTOS FA,PILATTI GL.Postoperative periodontal pain prevention using two dexamethasone medication protocols:a double-blind,parallel-group,placebo-controlled randomized clinical trial[J].Am J Dent,2011,24(6):354-356.
[6]TANG X,HAN J,MENG H,et al.Downregulation of RANKL and RANKL/osteoprotegerin ratio in human periodontal ligament cells during their osteogenic differentiation[J].J Periodontal Res,2016,51(1):125-132.DOI:10.1111/jre.12291.
[7]SOUSA LH,LINHARES EV,ALEXANDRE JT,et al.Effects of atorvastatin on periodontitis of rats subjected to glucocorticoidinduced osteoporosis[J].J Periodontol,2016,87(10):1206-1216. DOI:10.1902/jop.2016.160075.
[8]BREIVIK T,GUNDERSEN Y,OSMYNDSEN H,et al.Neonatal dexamethasone and chronic tianeptine treatment inhibit ligatureinduced periodontitis in adult rats[J].J Periodontal Res,2006,41(1):23-32.DOI:10.1111/j.1600-0765.2005.00833.x.
[9]CABAGNI J,SOLETTI AC,GAIO EJ,et al.The effect of dexamethasone in the pathogenesis of ligature-induced periodontal disease in Wistar rats[J].Braz Oral Res,2005,19(4):290-294.DOI:10.1590/S1806-83242005000400010.
[10]NEBEL D,ARVIDSSON J,LILLQVIST J,et al.Differential effects of LPS from Escherichia coli and Porphyromonas gingivalis on IL-6 production in human periodontal ligament cells[J].Acta Odontol Scand,2013,71(3/4):892-898.DOI:10.3109/00016357. 2012.734415.
[11]SEO T,CHA S,KIM TI,et al.Porphyromonas gingivalis-derived lipopolysaccharide-mediated activation of MAPK signaling regulates inflammatory response and differentiation in human periodontal ligament fibroblasts[J].J Microbiol,2012,50(2):311-319.
DOI:10.1007/s12275-012-2146-x.
[12]CHI XP,OUYANG XY,WANG YX,et al.Hydrogen sulfide synergistically upregulates Porphyromonas gingivalis lipopolysaccharideinduced expression of IL-6 and IL-8 via NF-kappaB signalling in periodontal fibroblasts[J].Arch Oral Biol,2014,59(9):954-961.DOI:10.1016/j.archoralbio.2014.05.022.
[13]JIANG SY,XUE D,XIE YF,et al.The negative feedback regulation of microRNA-146a in human periodontal ligament cells after Porphyromonas gingivalis lipopolysaccharide stimulation[J].Inflamm Res,2015,64(6):441-451.DOI:10.1007/s00011-015-0824-y.
[14]ANTON L,BROWN AG,PARRY S,et al.Lipopolysaccharide induces cytokine production and decreases extravillous trophoblast invasion through a mitogen-activated protein kinase-mediated pathway:possible mechanisms of first trimester placental dysfunction[J].Hum Reprod,2012,27(1):61-72.DOI:10.1093/humrep/ der362.
[15]POLEPALLE T,MOOGALA S,BOGGARAPU S,et al.Acute phase proteins and their role in periodontitis:a review[J].J Clin Diagn Res,2015,9(11):ZE01-ZE05.DOI:10.7860/JCDR/2015/ 15692.6728.
[16]CHIU HC,FU MM,YANG TS,et al.Effect of high glucose,Porphyromonas gingivalis lipopolysaccharide and advanced glycation end-products on production of interleukin-6/-8 by gingival fibroblasts[J].J Periodontal Res,2017,52(2):268-276.DOI:10.1111/jre.12391.
[17]LEE HJ,CHO JW,KIM SC,et al.Roles of p38 and ERK MAP kinases in IL-8 expression in TNF-alpha-and dexamethasone-stimulated human periodontal ligament cells[J].Cytokine,2006,35(1/ 2):67-76.DOI:10.1016/j.cyto.2006.07.009.
[18]SADIKOT RT,JANSEN ED,BLACKWELL TR,et al.High-dose dexamethasone accentuates nuclear factor-kappa b activation in endotoxin-treated mice[J].Am J Respir Crit Care Med,2001,164(5):873-878.DOI:10.1164/ajrccm.164.5.2008059.
[19]AGRAWAL A,DURRANI S,LEIPER K,et al.Effect of systemic corticosteroid therapy on risk for intra-abdominal or pelvic abscess in non-operated Crohn’s disease[J].Clin Gastroenterol Hepatol,2005,3(12):1215-1220.DOI:10.1016/S1542-3565(05)00759-7.
(编辑 陈姜)
Effect of Dexamethasone on the Expression of Interleukin-6 and Interleukin-8 in Human Periodontal Ligament Cells
TANG Xiaolin,PAN Chunling,LI Chen
(Department of Periodontology,School of Stomatology,China Medical University,Shenyang 110002,China)
ObjectiveTo explore the effect of dexamethasone(Dex)treatment on the expression of interleukin(IL)-6 and IL-8 in human periodontal ligament cells(hPDLCs).MethodshPDLCs were subjected to one of the following treatments for 24 h or 48 h:10-9mol/L Dex;10-6mol/L Dex;10 μg/mLPorphyromonas gingivalis(P.g)-lipopolysaccharide(LPS);10-9mol/L Dex+10 μg/mLP.g-LPS;10-6mol/L Dex+10 μg/mL P.g-LPS;or 0.1%absolute ethyl alcohol(control).Protein and mRNA expression was detected using ELISA and real-time PCR,respectively.ResultsAt 24 h and at 48 h,IL-6 and IL-8 protein expression in the 10-9mol/L Dex-and 10-6mol/L Dex-treated groups was significantly lower than that in the control group(P<0.05).At 48 h,IL-6mRNA expression in the 10-9mol/L Dex-and 10-6mol/L Dex-treated groups was significantly lower than that in the control group(P<0.05),whileIL-8mRNA expression in the 10-6mol/L Dex-treated group was significantly higher than that in the control group(P<0.05).At 24 h and at 48 h,IL-6 protein and mRNA expression in the 10-9mol/L Dex+10 μg/mLP.g-LPS-treated group and the 10-6mol/L Dex+10 μg/mLP.g-LPS-treated group was significantly lower than that in the 10 μg/mLP.g-LPS-treated group(P<0.05).At 24 h,IL-8 protein expression in the 10-9mol/L Dex+10 μg/mLP.g-LPS-treated group and the 10-6mol/L Dex+10 μg/mLP.g-LPS-treated group was significantly lower than that in the 10 μg/mLP.g-LPS-treated group(P<0.05),while no such significant difference existed at 48 h.At 48 h,IL-8mRNA expression in the 10-6mol/L Dex+10 μg/mLP.g-LPS-treated group was significantly higher than that in the 10 μg/mLP.g-LPS-treated group(P<0.05).ConclusionDex inhibits the innate andP.g-LPS-induced expression of IL-6 in hPDLCs.However,Dex exerts profound effects on IL-8 expression,and treatment with high doses of Dex may promote IL-8 expression over an extended period.
dexamethasone;glucocorticoid;periodontal ligament cell;osteogenic induction;interleukin-6;interleukin-8
R781.4
A
0258-4646(2017)05-0449-05
10.12007/j.issn.0258-4646.2017.05.016
中国博士后科学基金(20090461190)
唐晓琳(1973-),女,副教授,博士. E-mail:xltang@cmu.edu.cn
2016-12-29
网络出版时间:
