脂多糖干预对大鼠周围神经损伤后瓦勒变性的影响
2017-05-18熊乐张倩沈若武边洪琳孙广强王毅张凤玉张蓓
熊乐,张倩,沈若武,边洪琳,孙广强,王毅,张凤玉,张蓓*
(1.青岛大学基础医学院,山东 青岛 266071;2.青岛阜外心血管病医院,山东 青岛 266034)
研究报告
脂多糖干预对大鼠周围神经损伤后瓦勒变性的影响
熊乐1,张倩2,沈若武1,边洪琳1,孙广强1,王毅1,张凤玉1,张蓓1*
(1.青岛大学基础医学院,山东 青岛 266071;2.青岛阜外心血管病医院,山东 青岛 266034)
目的 探讨脂多糖对于大鼠坐骨神经损伤瓦勒变性早期髓鞘碎片清除的影响。 方法 将50只Wistar大鼠随机分成假手术组(10只),模型组(20只)和脂多糖LPS组(20只),LPS组及模型组横断大鼠右侧坐骨神经后,行神经外膜端端吻合;假手术组仅游离出坐骨神经,然后关闭切口。LPS组大鼠在神经断端显微注射LPS (2 g/ L) 1 μL,模型组及假手术组大鼠注射同等体积生理盐水。于术后1.5、24 h和7 d 取术侧坐骨神经。实时定量PCR(qRT-PCR)检测坐骨神经中白介素1β(IL-1β)mRNA、单核细胞趋化蛋白-1 (MCP-1) mRNA水平;免疫荧光法检测坐骨神经中CD68+巨噬细胞的表达;HE染色观察坐骨神经的病理变化;油红O染色观察坐骨神经脱髓鞘程度;LFB染色观察坐骨神经髓鞘变化;坐骨神经功能指数(SFI)评价大鼠运动功能的恢复情况。结果 实时定量PCR显示,与假手术组相比,术后1.5 h模型组IL-1β mRNA和MCP-1 mRNA的表达均明显升高(P<0.001,P<0.001),与模型组相比,术后1.5 h LPS组IL-1β mRNA和MCP-1mRNA的表达明显升高(P<0.001,P<0.001)。术后24 h模型组IL-1β mRNA和MCP-1m RNA的表达均明显升高(P<0.001,P<0.001),与模型组相比,术后24 h LPS组IL-1β mRNA和MCP-1 mRNA的表达明显升高(P<0.01,P<0.01)。免疫荧光可见,与模型组相比,术后7 d LPS组中CD68+细胞表达显著上调(P<0.05)。术后7 d坐骨神经HE染色可见, LPS组坐骨神经断端较多炎性细胞浸润,许旺细胞增殖活跃,模型组神经断端炎性细胞和许旺细胞较少。术后7 d坐骨神经ORO染色可见,与模型组相比,LPS组断端远侧脱髓鞘程度较高。术后7 d坐骨神经LFB染色可见,模型组和LPS组坐骨神经断端均出现脱髓鞘反应,但与模型组相比,LPS组神经断端残余髓鞘碎片明显减少(P<0.05)。SFI显示,与模型组相比,LPS组大鼠在术后10、20、30、40和50 d分别不同程度升高,术后20 d明显增高, 差异有显著性(P<0.05)。结论 脂多糖通过激活固有免疫系统加快大鼠坐骨周围神经损伤后瓦勒变性早期髓鞘碎片的清除。
周围神经;瓦勒变性;脂多糖;髓鞘碎片
周围神经损伤长久以来都是临床医生面临的巨大挑战。周围神经损伤后发生瓦勒变性,即由于各种创伤、牵拉、缺血、高低温、电击等原因,直接使神经纤维受损中断,周围神经损伤后远段发生的轴突坏死、髓鞘分解消失和神经鞘膜增生等一系列蜕变和细胞吞噬过程。变性崩解的髓鞘碎片会抑制近心段神经轴突的再生[1, 2],所以快速有效地清除髓鞘碎片对神经再生意义重大,而巨噬细胞在此过程中发挥了巨大的作用。近年来, 关于巨噬细胞参与瓦勒变性在远端轴突再生中发挥作用的研究十分广泛, 它对周围神经再生的影响主要有两个:一是吞噬变性组织,为再生神经清除障碍;二是分泌活性物质直接或通过雪旺细胞间接为轴突再生提供适宜的微环境。Toll样受体(TLRs)作为一种模式识别受体,介导天然免疫应答,除了识别病原相关分子模式外,也可识别损伤相关分子模式,如坏死细胞、热休克蛋白(HSP60,HSP70)和细胞外基质成分[3],已有研究表明TLRs表达于神经系统[4]。脂多糖(LPS)是革兰阴性细菌细胞壁上的主要成分,可以通过激活相应TLRs信号通路有效刺激巨噬细胞和神经胶质细胞活化。已有研究发现小鼠脊髓损伤模型中,腹腔注射LPS能促进瓦勒变性过程中的髓鞘碎片的清除[5]。在外周神经损伤大鼠模型中,通过在大鼠神经断端单次显微注射微量LPS,探究LPS对瓦勒变性中炎性细胞募集及髓鞘碎片清除的影响,旨在从分子免疫学角度,在损伤早期缩短瓦勒变性时间,提高神经修复速度及质量,为周围神经辅助治疗提供新思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
SPF 级 Wistar 雄性大鼠50只,体重(200±20)g,由青岛市实验动物和动物实验中心提供【SCXK(鲁)20011-0007】。饲养于饲养箱,每箱 5 只大鼠,通风良好,环境安静,温度为(24±2) ℃,相对湿度为45%~55%,自由饮食与进水,买回大鼠适应环境 1 周后开始实验。大鼠的组织取材于青岛大学动物实验设施内进行【SYXK(鲁) 2011-0012】。
1.1.2 试剂及仪器
LPS购于美国Sigma公司。免疫组化用的兔抗大鼠的相关多克隆抗体购于北京博奥森生物技术公司。逆转录试剂盒、SYBR Green Premix Ex Taq 荧光定量试剂盒为TaKaRa公司产品。荧光显微镜为Olympus公司产品。
1.2 实验方法
1.2.1 坐骨神经损伤模型制备
10%水合氯醛(300 mg/kg)腹腔注射麻醉,麻醉成功后,用8%硫化钠脱毛术区皮肤,消毒后将动物俯卧位固定,无菌条件下显露右侧坐骨神经,于梨状肌下缘0.8 cm处用利刀横行切断坐骨神经,以神经外膜上走行的血管为标记,用8/0无损伤缝合线行神经外膜端端吻合,吻合口缝合4针,逐层关闭切口。假手术组仅游离出坐骨神经,然后关闭切口。
1.2.2 分组与给药
50只Wistar大鼠随机分为假手术组(10只),模型组(20只)和LPS组(20只)。LPS组大鼠端端缝合后,在神经断端显微注射LPS (2 g/L) 1 μL,模型组及假手术组大鼠尾静脉注射同等体积生理盐水。1.3 观察与研究指标
1.3.1 实时定量PCR测坐骨神经IL-1β和MCP-1mRNA的表达
用 Trizol 法提取各组大鼠坐骨神经总RNA。由TaKaRa公司生产的逆转录试剂盒进行 cDNA 合成,按照TaKaRa公司 SYBR® Premix Ex TaqTM(Tli RNaseH Plus)( no.RR420A) 荧光定量试剂盒说明进行real-time PCR反应。管家基因 β-actin 是用来规范的总RNA量。IL-1β 引物序列: 上游引物 5’-GCCAACAAGTGGTATTCTCCA-3’,下游引物 5 ’-CCGTCTTTCATCACACAGGA-3’,扩增片段为118 bp; MCP-1 引物序列: 上游引物 5’-AGGACTTCAGCACCTTTGA-3’,下游引物 5 ’-TTCTCTGTCATACTGGTCACTTC-3’,扩增片段为116 bp; β-actin 内参序列: 上游引物 5’-CACCCGCGAGTACAACCTTC-3’,下游引物 5 ’-CCCATACCCACCATCACACC-3 ’,扩增片段为 206 bp。反应条件:95℃预变性30 s,95℃ 5 s,60℃ 45 s,40个循环。每份RNA样本均进行3次重复检测,取其平均Ct值用于结果分析,采用2-△△Ct方法对IL-1β、MCP-1 mRNA的表达水平进行相对定量。
1.3.2 免疫荧光技术检测坐骨神经CD68蛋白的表达
取神经组织冰冻切片,用PBS水化20 min;10%羊血清40℃封闭 1 h;PBS 漂洗3次,每次5 min;加入一抗后,4℃孵育过夜;PBS 漂洗3次,每次5 min;加入二抗 Cy3山羊抗兔37℃孵育2 h;PBS 漂洗3次,每次5 min;荧光封片剂封片,荧光显微镜观察及照片拍摄,每张切片随机取5个非重叠视野,利用Image-Pro Plus 6.0软件定量分析免疫阳性细胞面积占总面积比值。
1.3.3 大鼠坐骨神经病理学观察
以坐骨神经缝合口为中心切取10 mm长的神经组织,远端缘用9/0无损伤缝线标记方向,4%多聚甲醛中固定24 h,然后经过乙醇梯度脱水、透明、进一步石蜡包埋等过程制成石蜡切块,做纵行切片连续切片,切片厚度为4 μm,然后作HE染色(苏木素-伊红染色),在光镜下观察坐骨神经的基本结构及有无细胞增生、炎细胞浸润等改变。
1.3.4 大鼠坐骨神经油红0染色
取0.5%油红O/异丙醇储存液与蒸馏水按 3∶2 比例混匀,静置10 min后过滤获得油红O染液。 切片用甲醛-钙固定10 min,蒸馏水冲洗后 60%异丙醇浸洗。 将组织切片置于预先配置好的油红 O 染液中浸染10~15 min,60%异丙醇漂洗至背景无色后蒸馏水清洗。 在 Harris 苏木精染液中复染30 s后,盐酸、乙醇适度分色,室温中放置稍干后甘油明胶封片。显微镜下观察并拍照。
1.3.5 坐骨神经髓鞘固兰染色
以坐骨神经缝合口为中心切取10 mm长的神经组织,远端缘用9/0无损伤缝线标记方向,4%多聚甲醛中固定24 h,然后经过乙醇梯度脱水、透明、进一步石蜡包埋等过程制成石蜡切块,做纵行切片连续切片,切片厚度为4 μm,切片脱蜡后,然后作Luxol fast blue (LFB)染色。用LFB液在60℃温度浸泡12 h;随后应用95%酒精浸洗5 min;加入0.05%碳酸锂15 s;再应用70%酒精洗涤,蒸馏水漂洗,进行脱水后,透明封片,在光镜下观察坐骨神经的髓鞘改变,每张切片随机取5个非重叠视野,利用Image-Pro Plus 6.0软件定量分析LFB染色阳性区域的积分光密度(IOD)平均值。
1.3.6 大鼠坐骨神经功能指数(SFI)测定
制作长约50 cm,宽约8.5 cm,高约8 cm的硬纸暗箱,两端均留门,箱底垫上白纸,将大鼠双后足蘸墨水后,在纸箱内从一端到另一端行走,每条纸每侧足留下4~5个足印,选实验侧及正常侧足清晰的足印测量3个变量,精确到mm,算出每只鼠各变量的平均值。术后10、20、30、40和50 d检测,测量足印长度(print length,PL),第1足趾到第5足趾的距离(toe spread,TS),第2足趾到第4足趾的距离(intermediary toe spread,IT),E和N分别代表实验侧和正常侧。将上述3个变量带入Bain公式计算出SFI:SFI=-38.3(EPL-NPL)/NPL + 109.5 (ETS-NTS)/NTS + 13.3 (EIT-NIT)/NIT-8.8。正常SFI为0,神经功能完全丧失为 -100。
1.4 统计学分析
2 结果
2.1 大体观察
整个实验过程中,各组大鼠无死亡。假手术组大鼠术后与术前步态无变化,无行动困难,模型组和LPS组均出现右下肢功能活动受限,足趾挛缩不能伸展,术侧腿部肌肉萎缩,呈拖曳步态。术后10 d即可见,与模型组相比, LPS组大鼠术侧肢体拖曳程度较轻,抬起幅度较高,足趾挛缩程度较轻,伸展幅度较大。术后30 d,模型组和LPS组大鼠存在不同程度右足踝部皮肤红肿,足趾溃疡,肌肉萎缩现象,针刺反应消失,但LPS组大鼠肢体活动幅度明显大于模型组。术后50 d,模型组和LPS组大鼠均红肿消失,溃疡全部愈合,针刺反应灵敏,模型组仍有一只大鼠出现肌肉萎缩现象,LPS组大鼠无肌肉萎缩。2.2 实时定量PCR测坐骨神经组织IL-1β和MCP-1mRNA的表达融解曲线分析显示两组基因扩增均呈单峰,退火温度一致,无非特异性扩增。与假手术组相比,在术后1.5 h,模型组的IL-1β和MCP-1 mRNA表达水平均升高,差异有显著性(P<0.001)。与模型组相比,LPS组的IL-1β和MCP-1 mRNA表达水平均升高,差异有显著性(P<0.001)。而在术后24 h,模型组的IL-1β和MCP-1 mRNA表达水平均升高,差异有显著性(P<0.001)。与模型组相比,LPS组的IL-1β和MCP-1 mRNA表达水平均升高,差异有显著性(P<0.01)。结果见图1。

注: **P < 0.01, ***P < 0.001差异有显著性。图1 大鼠坐骨神经组织中IL-1β和MCP-1 mRNA的表达Note.**P < 0.01,***P < 0.001 vs. control group. There were significant differences.Fig.1 IL-1β and MCP-1 mRNA expression levels in sciatic nerve tissues of the rats
2.3 免疫荧光法测坐骨神经组织CD68+巨噬细胞细胞的表达
术后7 d神经组织切片免疫特异性巨噬细胞 CD68 抗体染色可见,假手术组无CD68+巨噬细胞浸润,模型组神经断端有少量CD68+巨噬细胞浸润,而与模型组相比,LPS组CD68+巨噬细胞明显增多。通过定量,分析距离损伤中心2 mm内远端免疫阳性细胞面积所占比值显示,LPS组CD68+巨噬细胞明显增加,差异有显著性(P<0.05),见图2。
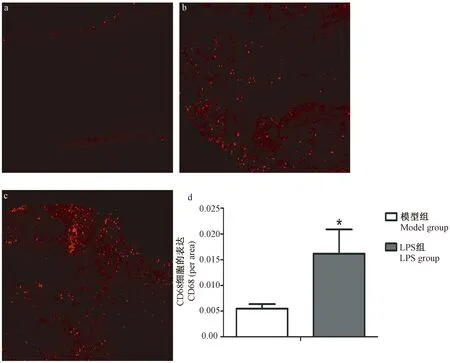
注:与模型组相比,*P<0.05。a.假手术组; b.模型组;c.LPS组;d. CD68+巨噬细胞半定量分析。图2 大鼠坐骨神经组织中CD68+和iba1+细胞的表达 (10×20)Note. *P<0.05, vs model group. a. Sham group; b. Model group; c. LPS group; d. Semi-quantitative analysis of CD68+ macrophages.Fig.2 Expression of CD68+ and iba1+ cells in sciatic nerve tissue of the rats
2.4 大鼠坐骨神经组织HE染色
术后7 d坐骨神经HE染色,低倍镜下可见假手术组大鼠坐骨神经组织结构完整,纤维排列整齐,无炎性细胞浸润,模型组和LPS组轴突完全断裂,髓鞘崩解,与模型组相比,LPS组有较多炎性细胞浸润断端吻合口处形成小结节,如箭头所示。高倍镜下可见,模型组吻合口处炎性细胞浸润,雪旺细胞增殖;LPS组可见吻合口周围大量炎性细胞浸润,雪旺细胞增生活跃。结果见图3。
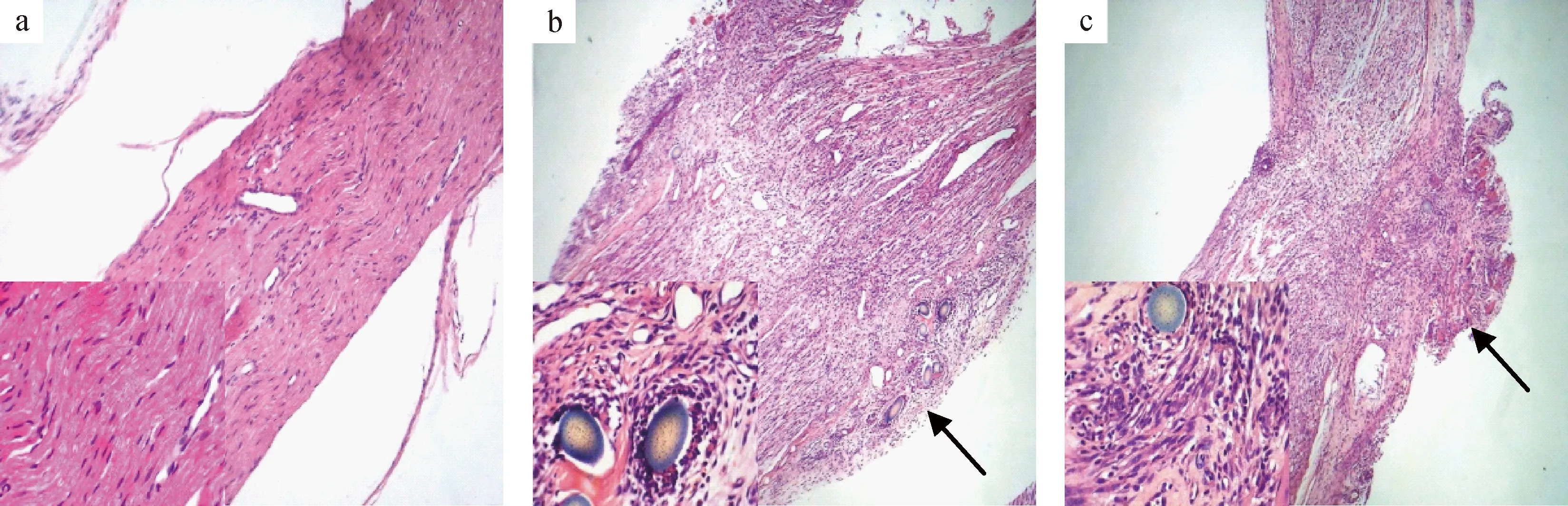
注:a.假手术组; b.模型组; c.LPS组。箭头指向吻合口。图3 大鼠坐骨神经组织病理变化 (HE 染色, 40×10)Note. a. Sham group; b. Model group; c. LPS group. The arrow points to the anastomosis.Fig.3 Pathological changes in sciatic nerve tissues of the rats
2.5 大鼠坐骨神经脂滴油红O染色
术后7 d坐骨神经油红O染色可见,变性的髓鞘磷脂以及被巨噬细胞吞噬的髓鞘能被特异性染成橘红色,细胞核呈蓝色,背景为白色,反映神经断端脱髓鞘程度。模型组神经断端有少量髓磷脂堆积;而与模型组相比,LPS组大量脂滴堆积明显增加,脱髓鞘程度明显高于模型组,结果见图4。

注:a. 模型组;b. LPS组。图4 大鼠坐骨神经脂滴油红O染色(ORO 染色,40×10)Note. a. Model group; b. LPS group.Fig.4 Lipid droplet in the sciatic nerves of rats (Oil red O staining)
2.6 大鼠坐骨神经髓鞘固兰染色
术后7 d坐骨神经LFB染色可见,髓鞘被特异性染成天蓝色,轴突不着色,背景为白色, 反映在坐骨神经损伤远端崩解的髓鞘碎片被巨噬细胞清除的情况。假手术组大鼠坐骨神经髓鞘结构完整,排列规则,显示了正常的髓鞘形态;模型组和LPS组神经断端可见髓鞘淡染,显示变性崩解的髓鞘,与模型组相比,LPS组残余髓鞘碎片较少,通过定量分析,计算距离损伤中心2 mm内远端被染色髓鞘的积分光密度(IOD)平均值,可见与模型组相比,LPS组残余髓鞘碎片较少,差异有显著性(P<0.05),反映了LPS组的崩解髓鞘碎片清除速率明显高于模型组。结果见图5。
2.7 大鼠坐骨神经功能指数(SFI)测定
模型组和处理组大鼠在术后10、20、30、40和50 d,行足迹实验分析坐骨神经功能指数,评价大鼠运动功能的恢复情况。各组大鼠行走时步态稳定,足迹清晰。结果显示,两组大鼠SFI均逐步上升,LPS组在损伤后20 d分别明显高于模型组,差异有显著性(P<0.05)。结果见图6。
3 讨论
周围神经损伤后病理过程复杂,因此神经损伤后的形态学变化和各种促进神经再生及功能恢复的方法成为一直是研究的热点。周围神经损伤后,能够通过神经再生重新支配相应的靶器官,而成功的神经再生依赖巨噬细胞参与瓦勒变性。周围神经损伤后,崩解的髓鞘碎片上可能存在抑制轴突再生的因子,及时清除变性的髓鞘为轴突的再生提供更有利的环境,有利于神经早期再生修复[5]。

注:与模型组相比,*P<0.05。a.假手术组; b.模型组; c.LPS组; d.髓鞘阳性染色半定量分析。图5 大鼠坐骨神经髓鞘固兰染色结果(LFB 染色,20×10)Note. *P<0.05, vs.model group. a. Sham group; b. Model group; c. LPS group; d. Semi-quantitative analysis of the myelin sheath.Fig.5 Histology of sciatic nerve myelin in the rats(LFB staining) LFB staining.

注:与模型组相比,*P<0.05。图6 大鼠坐骨神经功能指数(SFI)检测Note. *P<0.05, vs.model group. Fig.6 Sciatic function indexes (SFI) of the rats
我们利用Wistar大鼠建立坐骨神经损伤模型,首先检测断端注射LPS后对大鼠坐骨神经上相关炎性因子的表达影响。MCP-1是单核/巨噬细胞趋化因子,能导致单核/巨噬细胞在病变组织中大量浸润,IL-1β是由活化的巨噬细胞分泌的细胞因子,同时IL-1β 能诱导 MCP-1在损伤后第1天表达达到高峰,保证了单核/巨噬细胞的募集。Carroll等[6]研究发现,周围神经损伤后1.5 h在损伤区域已经有MCP-1mRNA表达,在神经损伤后24 h达到高峰。因此本研究分别在术后1.5 h和24 h利用qRT-PCR检测大鼠坐骨神经组织上MCP-1和IL-1β的基因表达水平,研究结果与上述结果保持一致,在损伤后1.5 h的检测结果显示,与假手术组相比,模型组已有IL-1β和MCP-1表达,与模型组相比,LPS组表达大幅提升。在损伤后24 h的检测结果显示,与假手术组相比,模型组MCP-1和IL-1β增高,与模型组相比,LPS组表达明显提升。说明LPS可有效增加MCP-1和IL-1β分泌。
其次我们检测大鼠坐骨神经断端巨噬细胞募集和变性髓鞘碎片清除情况。本研究采用免疫荧光检测巨噬细胞的募集,发现在术后7 d与模型组相比,LPS组神经断端巨噬细胞募集明显增加,说明LPS能有效增加神经断端巨噬细胞募集。HE染色显示,与模型组相比,术后7 d LPS组大鼠神经断端有大量炎性细胞募集,许旺细胞增殖明显活跃。ORO染色显示,在术后7 d LPS组神经断端脱髓鞘程度明显高于模型组。同时术后7 d坐骨神经LFB染色也表明,与模型组相比,LPS组神经断端残余髓鞘碎片明显减少。以上两种染色结果均与巨噬细胞减少保持一致。说明LPS能有效募集巨噬细胞清理变性崩解的髓鞘碎片,从而缩短瓦勒变性时间。
最后,我们探究以上对瓦勒变性过程的干预是否影响后期大鼠运动功能的恢复。有一些研究指出,在中枢神经系统TLR2和TLR4信号的过度活化会导致组织损伤甚至行为障碍[7-12]。与此相反,有研究证明大鼠挤压伤后,全身性注射LPS明显减小脊髓空洞的大小[13],Kigerl等[14]发现在脊髓挫伤小鼠模型中,TLR2和TLR4的基因敲除小鼠运动功能恢复能力减弱,提示在神经损伤后,TLRs信号可能具有神经保护的作用。SFI 反映下肢协调功能和肌力恢复情况,是从行为学的角度评价周围神经功能的可靠指标。我们研究结果显示,LPS组大鼠SFI同期均高于模型组,在术后20 d明显高于模型组。说明缩短瓦勒变性时间可能有利于后期运动功能的恢复。但我们考虑到运动功能的恢复受多种因素作用,如LPS激活TLRs信号后是否增加了神经元的存活等,这些都需要我们日后更加深入的研究。
本研究通过在受损神经断端显微注射LPS激活TLRs信号通路活化单核/巨噬细胞募集,来观察对瓦勒变性中髓鞘碎片清除的影响。研究结果让我们进一步明确了瓦勒变性中巨噬细胞的作用,从分子免疫学角度为周围神经损伤修复辅助治疗提供一个新策略。
[1] Mueller M, Leonhard C, Wacker K, et al. Macrophage response to peripheral nerve injury: the quantitative contribution of resident and hematogenous macrophages [J]. Lab Invest, 2003, 83(2): 175-185.
[2] Perry VH, Tsao JW, Fearn S, et al. Radiation-induced reductions in macrophage recruitment have only slight effects on myelin degeneration in sectioned peripheral nerves of mice [J]. Eur J Neurosci, 1995, 7(2): 271-280.
[3] Takeda K, Kaisho T, Akira S. Toll-like receptors [J]. Ann Rev Immunol, 2003, 21: 335-376.
[4] Lehnardt S. Innate immunity and neuroinflammation in the CNS: the role of microglia in Toll-like receptor-mediated neuronal injury [J]. Glia, 2010, 58(3): 253-263.
[5] Vallieres N, Berard JL, David S, et al. Systemic injections of lipopolysaccharide accelerates myelin phagocytosis during Wallerian degeneration in the injured mouse spinal cord [J]. Glia, 2006, 53(1): 103-113.
[6] Carroll SL, Frohnert PW. Expression of JE (monocyte chemoattractant protein-1) is induced by sciatic axotomy in wild type rodents but not in C57BL/Wld(s) mice [J]. J Neuropathol Exp Neurol, 1998, 57(10): 915-930.
[7] Fitch MT, Doller C, Combs CK, et al. Cellular and molecular mechanisms of glial scarring and progressive cavitation: in vivo and in vitro analysis of inflammation-induced secondary injury after CNS trauma [J]. J Neurosci 1999, 19(19): 8182-8198.
[8] Hoffmann O, Braun JS, Becker D, et al. TLR2 mediates neuroinflammation and neuronal damage [J]. J Immunol (Baltimore, Md : 1950), 2007, 178(10): 6476-6481.
[9] Lehnardt S, Henneke P, Lien E, et al. A mechanism for neurodegeneration induced by group B streptococci through activation of the TLR2/MyD88 pathway in microglia [J]. J Immunol (Baltimore, Md : 1950), 2006, 177(1): 583-592.
[10] Lehnardt S, Lachance C, Patrizi S, et al. The Toll-like receptor TLR4 is necessary for lipopolysaccharide-induced oligodendrocyte injury in the CNS [J]. J Neurosci, 2002, 22(7): 2478-2486.
[11] Lehnardt S, Massillon L, Follett P, et al. Activation of innate immunity in the CNS triggers neurodegeneration through a Toll-like receptor 4-dependent pathway [J]. Proc Natl Acad Sci U S A. 2003, 100(14): 8514-8519.
[12] Popovich PG, Guan Z, Mcgaughy V, et al. The neuropathological and behavioral consequences of intraspinal microglial/macrophage activation [J]. J Neuropathol Exp Neurol, 2002, 61(7): 623-633.
[13] Guth L, Zhang Z, Diprospero N A, et al. Spinal cord injury in the rat: treatment with bacterial lipopolysaccharide and indomethacin enhances cellular repair and locomotor function [J]. Exp Neurol, 1994, 126(1): 76-87.
[14] Kigerl KA, Lai W, Rivest S, et al. Toll-like receptor (TLR)-2 and TLR-4 regulate inflammation, gliosis, and myelin sparing after spinal cord injury [J]. J Neurochem, 2007, 102(1): 37-50.
Effect of lipopolysaccharide on Wallerian degeneration after peripheral nerve injury in rats
XIONG Le1,ZHANG Qian2,SHEN Ruo-wu1,BIAN Hong-lin1, SUN Guang-qiang1, WANG Yi1, ZHANG Feng-yu1, ZHANG Bei1*
(1.Medical College,Qingdao University,Qingdao 266071,China; 2.Qingdao Fu Wai Cardiovascular Hospital,Qingdao 266034)
Objective To investigate the effects of lipopolysaccharide (LPS) on myelin phagocytosis during Wallerian degeneration after early peripheral nerve injury in rats. Methods Fifty male Wistar rats were recruited and randomly divided into LPS group (n=20), model group (n=20) and sham group (n=10). The right sciatic nerves of rats in the LPS and model groups were cut and sutured end-to-end, while the sciatic nerve of sham group rats were only exposed. Immediately after surgery, the rats in LPS group were given microinjections of LPS (2 g/L) into the surgical site in a final volume of 1 μL, and the rats in other two groups were injected with the same volume of saline. The sciatic nerves were taken at 1.5 h, 24 h and 7d after surgery. Real-time quantitative PCR (qRT-PCR) was applied to detect the dynamic expressions of IL-1β mRNA and MCP-1 mRNA. Immunofluorescence staining was used to test the expression of CD68+macrophages in sciatic nerves. HE staining was used to observe the pathological alterations of sciatic nerves tissue. ORO staining was used to observe sciatic nerves demyelination. LFB staining was used to detect the sciatic nerves myelin. Sciatic function index was used to evaluate the recovery of motor function in rats. Results Compared with the model group, qRT-PCR indicated that the expression of IL-1β and MCP-1 from LPS group were increased at 1.5 h and 24 h after surgery (P<0.001,P<0.001), respectively. Compared with the model group, the expression of CD68+cells was increased significantly at 7th day after surgery (P<0.05). Histological examination showed that compared with the model group, a lot of inflammatory cells and Schwann cells were found at sciatic nerve stump in the LPS group at 7th day after operation. ORO staining showed that the degree of demyelination in the LPS group was higher than that in the model group. LFB staining showed that the sciatic nerve stump demyelination appeared in both model group and the LPS group at 7th day after operation, but compared with the model group, myelin debris clearance in the LPS group was significantly accelerated (P<0.05). Finally, compared with the model group, the SFI in the LPS group was increased significantly at 20 d after surgery (P<0.05). Conclusions The results confirm that LPS is possible to manipulate the innate immune response to accelerate myelin clearance during Wallerian degeneration after early peripheral nerve injury in rats.
Peripheral nerve; Wallerian degeneration; Lipopolysaccharide; Myelin debris
ZHANG Bei, E-mail: zhangbei124@aliyun.com
山东省高等学校科技计划(编号J14LK10,J16LK04)。
熊乐(1991-),女,硕士研究生,研究方向:神经免疫。E-mail: 369113603@qq.com
张蓓(1973-),女,副教授,博士,研究生导师,研究方向:临床免疫。E-mail: zhangbei124@aliyun.com
Q95-33
A
1005-4847(2017) 02-0211-07
10.3969/j.issn.1005-4847.2017.02.018
2016-06-08
