形觉剥夺树鼩视皮质17区的可塑性
2017-05-18周广龙杨冬梅梁佳芮陈黎代蕊张弛李娜胡敏代解杰
周广龙,杨冬梅,梁佳芮,陈黎,代蕊,张弛,李娜,胡敏*,代解杰*
(1. 云南省第二人民医院眼科中心,云南省眼科研究所,昆明 650021;2.中国医学科学院医学生物研究所/北京协和医学院,树鼩种质资源中心,昆明 650118)
研究报告
形觉剥夺树鼩视皮质17区的可塑性
周广龙1,杨冬梅1,梁佳芮1,陈黎1,代蕊1,张弛1,李娜2,胡敏1*,代解杰2*
(1. 云南省第二人民医院眼科中心,云南省眼科研究所,昆明 650021;2.中国医学科学院医学生物研究所/北京协和医学院,树鼩种质资源中心,昆明 650118)
目的 初步探索树鼩作为一种新的弱视模型的可行性分析研究;探讨形觉剥夺树鼩初级视皮质的可塑性机制,为进一步认识弱视形成及恢复机制提供理论依据。方法 60只出生30 d左右树鼩随机分为5组(每组12只):右眼缝合1月组;右眼缝合2月组;右眼缝合1月打开换缝合左眼1月,即换缝合组;对照组1, 为A组同龄大小树鼩正常环境饲养;对照组2,为B、C组同龄大小树鼩正常环境饲养。造模完成后进行视皮质定位取材,观察不同条件下树鼩视皮质组织学、超微结构、神经元细胞凋亡情况以及c-fos 的表达变化情况。结果 与对照组相比各实验组视皮质组织学及电镜均出现了不同程度的损害,且缝合2月组损伤更为明显;凋亡染色显示实验组跟对照组无差异性;c-fos蛋白及mRNA表达量在各实验组均出现了降低,且缝合右眼两月组表达量最低,换缝合以后表达量有一个小幅度的升高,对照组间c-fos表达无差异性。结论 不同程度的形觉剥夺性弱视引起了不同的组织病理学变化; 弱视引起的神经元损伤具有可塑性;树鼩可作为形觉剥夺性弱视的理想动物模型。
视皮质;组织学;可塑性;形觉剥夺;树鼩
弱视是指在视觉发育期由于单眼斜视、未矫正的屈光参差、高度屈光不正及形觉剥夺引起的单眼或双眼最佳矫正视力低于相应年龄的视力,在视觉关键期内经过恰当的治疗后视力可以提高或恢复正常[1]。而形觉剥夺性弱视是弱视中最严重的一种类型[2],治疗效果更差。弱视不仅加重国家及个人经济负担,还因择业受限等影响个人生活质量[3]。
作为弱视神经病理学研究的先驱Hubel等[4]缝合幼猫的一侧眼睑,制成弱视动物模型,病理观察发现接受弱视眼传入信息的外侧膝状体相应层次的细胞比接受健眼信息的细胞数量减少,体积缩小,同时大脑皮质也同样是双眼视细胞大量减少,甚至只有单眼视细胞发育。后期的研究也证实,接受弱视眼信息输入的外侧膝状体相应层次的细胞较接受健眼信息的相应层细胞体积缩小18%[5],皮质视觉优势柱的宽度变小[6],皮质神经元突触出现不同程度的退变和萎缩, γ-氨基丁酸 (γ-aminobutyric acid, GABA)能神经元减少[7], 当打开剥夺眼后,尽管其瞳孔反射和视网膜电图都正常,但剥夺眼仍没有视觉,绝大多数接收剥夺眼视皮质细胞没有反应。在关键期内,视觉剥夺对视觉系统发育造成的影响是不可逆的。然而,在临床工作中,若在视觉发育的关键期对弱视眼进行干预,其视功能可以部分甚至完全恢复正常。但是弱视发生和恢复的病理机制少有研究。
我们选取与人类视觉系统发育较接近的树鼩为实验对象,首先从视皮质17区研究入手,通过视皮质17区的组织学、超微结构观察形觉剥夺造成的组织学改变及神经元细胞的超微结构改变,探讨视皮质细胞、组织层面的可塑性及弱视的病理发生机制;观察形觉剥夺是否造成视皮质神经元的凋亡而影响神经元的可塑性;通过检测c-fos蛋白的表达,探讨c-fos基因在形觉剥夺弱视中可能的作用机制。
1 材料与方法
1.1 实验动物
分组:实验选取出生后30 d树鼩60只。由中国医学科学院医学生物学研究所树鼩种质资源中心提供【SCXK(滇)2013-0001】,随机分为5组:右眼形觉剥夺1月组(A组);右眼形觉剥夺2月组(B组);换遮盖组(C 组:右眼缝合1个月打开,换缝合左眼1个月);2个对照组(D1:A组对照;D2:B/C组对照)。同年龄大小正常环境饲养。每组又分2个小组:6只用于HE染色、免疫组化、Nissl染色、TUNEL染色;6只用于RT-PCR、电镜检测。
1.2 方法
1.2.1 模型建立
将出生30 d幼年树鼩称重后,按50 mg/kg体重腹腔注射1%戊巴比妥钠全身麻醉,分别自内眦至外眦剪除上下眼睑睑缘1.5~2.0 mm,缝合上下眼睑创缘以封闭术眼。正常对照组和单眼形觉剥夺组共同在同等条件下饲养。(见图1)
1.2.2 HE染色、Nissl染色、c-fos免疫组化染色和TUNEL染色
造模完成后,灌注固定取材,充分暴露上方皮质,按树鼩视皮质解剖[8]切取左侧枕叶大脑皮质冠状面,然后组织脱水、石蜡包埋、切片后分别进行HE染色、Nissl染色、TUNEL染色、免疫组化染色。(见图2)
1.2.3 c-fos mRNA
将每组6只树鼩称重后,戊巴比妥钠全身麻醉后,组织剪迅速剪开枕叶颅骨,用血管钳小心咬开颅骨,暴露枕叶视皮质区域,参照树鼩脑解剖定位[8],剪取初级视皮质脑组织约200 mg,进行RNA的抽提、质检、 计算。
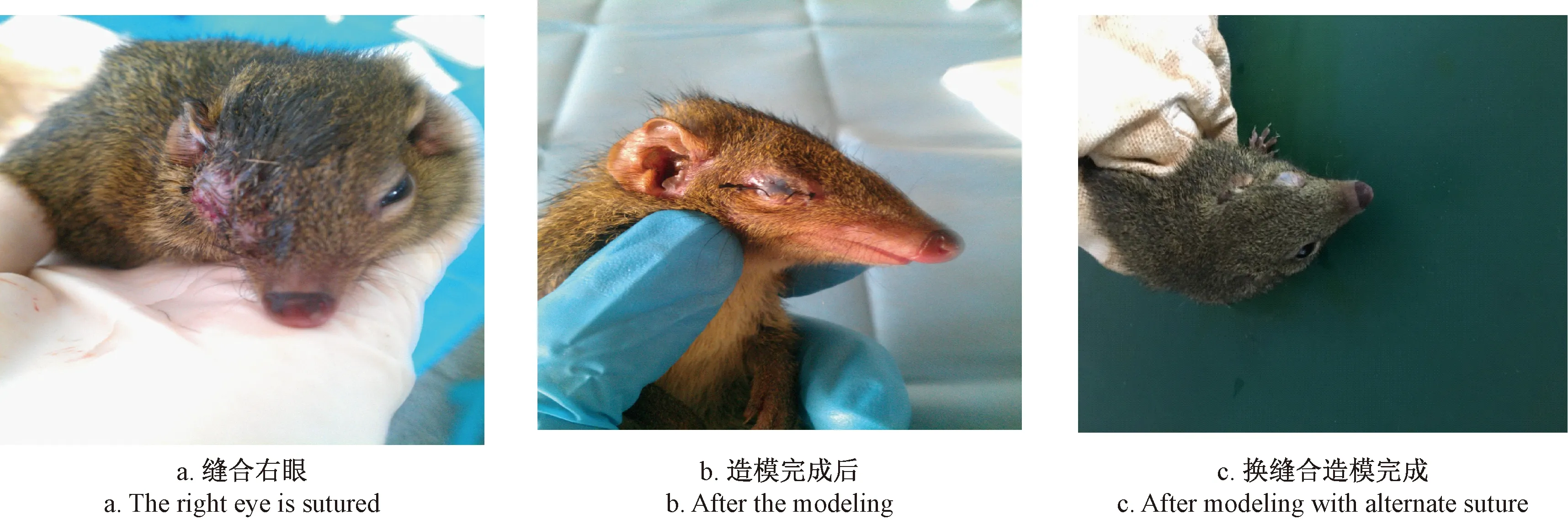
图1 形觉剥夺模型建立Fig.1 Establishment of the tree shrew model of form deprivation

图2 手术定位及取材部位Fig.2 Surgical localization and sampling site
1.2.4 透射电镜
戊巴比妥钠过量麻醉,脱颈处死,去除枕叶露骨,暴露视皮质17区,挖取左侧枕部后缘组织约2 mm×2 mm大小,进行电镜标本的制备、观察、摄片。
1.3 统计学分析
2 结果
2.1 组织学结果
缝合右眼1月组:视皮质神经元多灶性萎缩,神经元细胞数量减少,局部胶质细胞增生;缝合右眼2月组:皮质神经元多灶性萎缩,神经元细胞数量减少,皮质局部胶质细胞增生,小灶状海绵状变性,部分锥体细胞变性、水肿;缝合右眼1月打开换缝合左眼1月:主要病理变化为视皮质神经元多灶性萎缩,神经元数量减少,胶质细胞增生。(见图3)
神经元数量的变化:神经元数量在对照组1、对照组2最多,差异无显著性(P>0.05)。各实验组的神经元数量均低于对照组(P<0.01),各实验组间神经元数量差异无显著性(P>0.05)。(见表1)

表1 各组树鼩视皮质神经元数量变化对比分析Tab.1 Comparative analysis of changes in the number of neurons in visual cortex in the tree shrew groups
注:对照组1与对照组2、实验组间比较,P>0.05; 实验组与对照组比较,P<0.05。
Note. The control group 2 compared with the control group 1 and between experimental groups,P>0.05; Comparison between the experimental and control groups,P<0.05.

注: a. D1组,正常对照; b. A组 红圈为胶质细胞增生,箭头为神经元萎缩; c. D2组,正常对照; d. B组 红色箭头示海绵状变性; e. B组 红圈示锥体细胞变性; f. B组 红圈示海绵状变性; g. D2组,正常对照; h. C组 红圈示胶质细胞增生; i. C组 红圈示胶质细胞增生; j. C组,红色箭头示神经元萎缩。图3 各组光镜下视皮质神经元的变化情况(HE×10)Note. a. Group D1, the control group; b. Group A, the red circle shows glial cell proliferation, the arrow indicates neuronal atrophy; c. Group D2, the control group; d. Group B, the red arrows indicate cavernous degeneration; e. Group B, the red circle shows degeneration of pyramidal cells; f. Group B, the red circles show cavernous degeneration; g. Group D2, the control group; h. Group C, the red circle indicates glial cell proliferation; i. Group C, the red circle indicates glial cell proliferation; j. Group C, the red arrows show neuronal atrophy.Fig.3 Microscopic changes of visual cortical neurons in each group
2.2 电镜观察神经元细胞超微结构改变

注:a、b.正常神经元; c. A组 神经元萎缩,异染色质增多(红圈); d. A组,线粒体肿胀(红箭头); e. 线粒体肿胀(红箭头); f. B组 神经元皱缩、内质网池形成(红圈); g. B组髓鞘分离(红箭头); h. C组 神经元萎缩,内质网池形成(红圈); i. C组 神经毡水肿(红箭头)。图4 各组电镜下视皮质神经元的变化情况Note. a,b. Normal neurons; c. Group A, the red circle indicates neuronal atrophy and abundant heterochromatin;d. Group A, the red arrows indicate mitochondrial swelling;e. Group A, the red arrows indicate mitochondrial swelling;f. Group B, the red circle shows neuron shrinkage, endoplasmic reticulum pool formation;g. Group B, the red arrows show myelin sheath separation;h. Group C, the red circle indicates neuron shrinkage and endoplasmic reticulum pool formation;i. Group C, the red arrows indicate neuropil edema.Fig.4 Ultrastructural changes of visual cortical neurons in the tree shrews of each group
各实验组均发现神经元细胞胞核固缩、体积缩小、异染色质增多、核不规则、内质网池形成,线粒体肿胀,血管周围神经毡水肿、淤血,局部髓鞘分离。部分可见早期凋亡细胞:核染色质边集浓缩。而正常神经元细胞胞核圆润、饱满,核膜完整,染色质均匀,线粒体嵴规则、无皱缩。(见图4)
2.3 TUNEL染色检测视皮质神经元凋亡情况
光镜下,TUNEL染色阳性细胞为细胞核中有棕黄色颗粒为阳性细胞,而在各实验组及对照组中仅见视皮质个别(1~2)神经元细胞染色阳性,各组间未见明显差异。(见图5)
2.4 免疫组化染色观察c-fos蛋白水平表达变化
光镜下,c-fos蛋白免疫阳性细胞发生在神经元的细胞核,呈棕黄色,视皮质各层均可见阳性细胞且萎缩的神经元细胞均无染色,以第III、IV层多见。c-fos阳性细胞在对照组1、对照组2表达最强,差异无显著性(P>0.05)。各实验组的表达均低于对照组,其中右眼缝合2月组(B组)表达量最低,换缝合组(C组)表达量高于A、B组。其平均光密度值在A组为(0.4767±0.02201),B组为(0.4033±0.01498),C组为(0.5400±0.1238),跟正常组相比差异均有显著性(P<0.01)。实验组各组间表达差异有显著性(P<0.01)。(见图6、7)
2.5 实时荧光定量PCR(RT-PCR)检测c-fos mRNA表达变化
c-fos mRNA 在各组视皮质中均有表达。c-fos mRNA在右眼缝合1月组(A组)的相对表达量为(0.4543±0.02682),右眼缝合2月组(B组)为(0.3078±0.02864),换缝合组(C组)为(0.6080±0.01564),对照组1(D1组)为(1.1287±0.05852),对照组2(D2组)为(1.1377±0.05078)。单因素方差分析各实验组跟对照组相比c-fos mRNA的表达量均有显著下降(P<0.05)。其中B组较A组下降明显(P<0.05),C组较A组有明显升高(P<0.05),C组较B组有明显升高(P<0.01)。对照组间差异无显著性(P=0.873>0.05)。(见图8)
3 讨论
3.1 树鼩形觉剥夺性弱视模型可行性
本研究的研究对象选取的是跟人类血缘关系较密切的树鼩为实验对象,其研究结果用于人类的可信度大大增加。我们的研究结果表明:树鼩视皮质V1区在形觉剥夺模型中出现了明显的形态学改变,传统弱视的研究模型大多选用猫、大鼠为研究对象,而猫和大鼠的视觉系统跟人差距较大,其研究结果的可信度大大降低;猴虽然跟人类视觉系统较接近,研究结果的可信度也较高,但其价格昂贵,研究成本高,且受到伦理的限制;而树鼩与灵长类相比,其上丘相对较大,而且分层明确,已有研究表明:树鼩上丘参与了弱视的发病机制[9]。初级视皮层上锥体细胞的分支类型与灵长类动物类似,其分支和棘突比婴猴和猕猴多。树鼩的初级视觉皮层也含有顺序排列的朝向性选择柱,与灵长类相似,但是大鼠没有类似结构及形态分布。树鼩为昼行性动物,视网膜以锥体细胞为主(占96%),颜色识别能力较强,一些研究表明:树鼩已初步具有双眼视觉或立体视觉[10]。Petry等[11]用显微分光光度测定法发现树鼩存在两种视锥细胞,即长波长敏感视锥细胞(long-wavelength sensitive cones, LWS),占97.05%;短波长敏感视锥细胞(short-wavelength sensitive cones, SWS),占2.95%。近年来,有学者[12]对树鼩进行了全基因组的测序,发现树鼩在神经及免疫系统与人类有较高的同源性。因此,树鼩的视觉系统与灵长类接近,是研究人类视觉相关行为的较好的模式动物。
3.2 单眼形觉剥夺树鼩视皮质17区组织学及超微结构
有研究表明:在弱视眼的视网膜上并没有解剖和生理上的显著区别[13],类似的,人们发现在外侧膝状体神经元细胞反应基本正常[14],然而,外侧膝状体上细胞形态的改变显著:在接受缝合眼输入的外膝体层次,细胞胞体只有正常的一半[15],但这些形态的改变不足以解释在动物和人类弱视中生理功能的改变。人们普遍认为:弱视眼早期功能和解剖的异常所导致的行为缺失,主要发生在皮质的V1区[16]以及后来的研究工作[17、18],都说明了异常的视觉经验导致了V1区功能特征和解剖结构的变化。并且这种改变在早期形觉剥夺性弱视动物模型比屈光参差或斜视性弱视模型中更加严重。
本研究发现单眼形觉剥夺造成了树鼩双侧视皮质不同程度的组织学损害,主要表现为:视皮质神经元多灶性萎缩,神经元细胞数量减少,伴胶质细胞增生。而神经胶质细胞分布在神经元和神经纤维束之间,其作用是支持营养神经元,推测胶质细胞增生是弱视形成一种代偿机制。在缝合右眼2月组除上述变化外还出现了小灶状海绵状变性及部分锥体细胞变性、水肿;推测其可能为重度弱视的病理学基础。缝合右眼1月打开换缝合左眼1月:主要病理变化为胶质细胞增生、神经元细胞萎缩,未见小灶状海绵状变性及锥体细胞变性、水肿,提示反转缝合在一定程度上抑制了形觉剥夺引起的进一步损害。
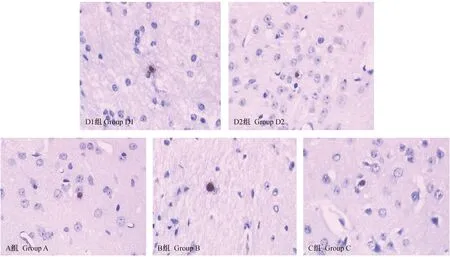
图5 各组视皮质神经元的凋亡情况 (TUNEL染色,×40)Fig.5 Apoptosis in cortical neurons in the tree shrews of each group
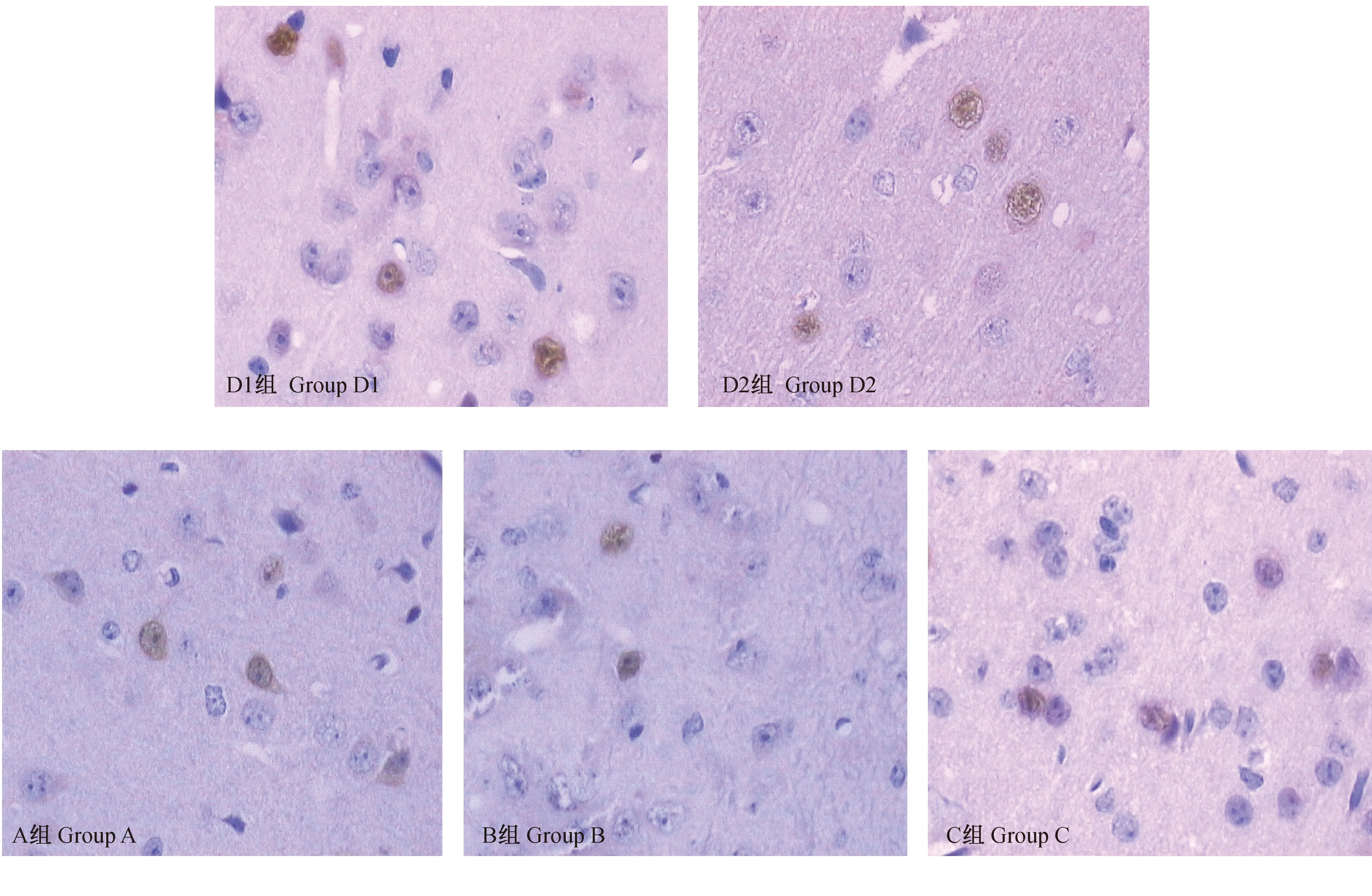
图6 各组视皮质神经元c-fos蛋白免疫组化染色情况(HE×40)Fig.6 Expression of c-fos protein in cortical neurons of the tree shrews of each group. Immunohistochemical staining.
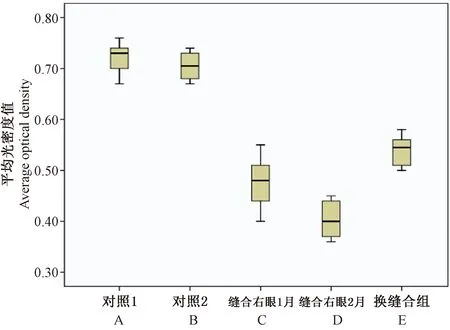
图7 各组 c-fos 蛋白平均光密度值比较Fig.7 Comparison of average optical density of c-fos protein in each group.A.Control 1.B.Control 2.C.The right cye sutured for 1 month.D.The right cye sutured for 2 months.E.The alternate suture group.
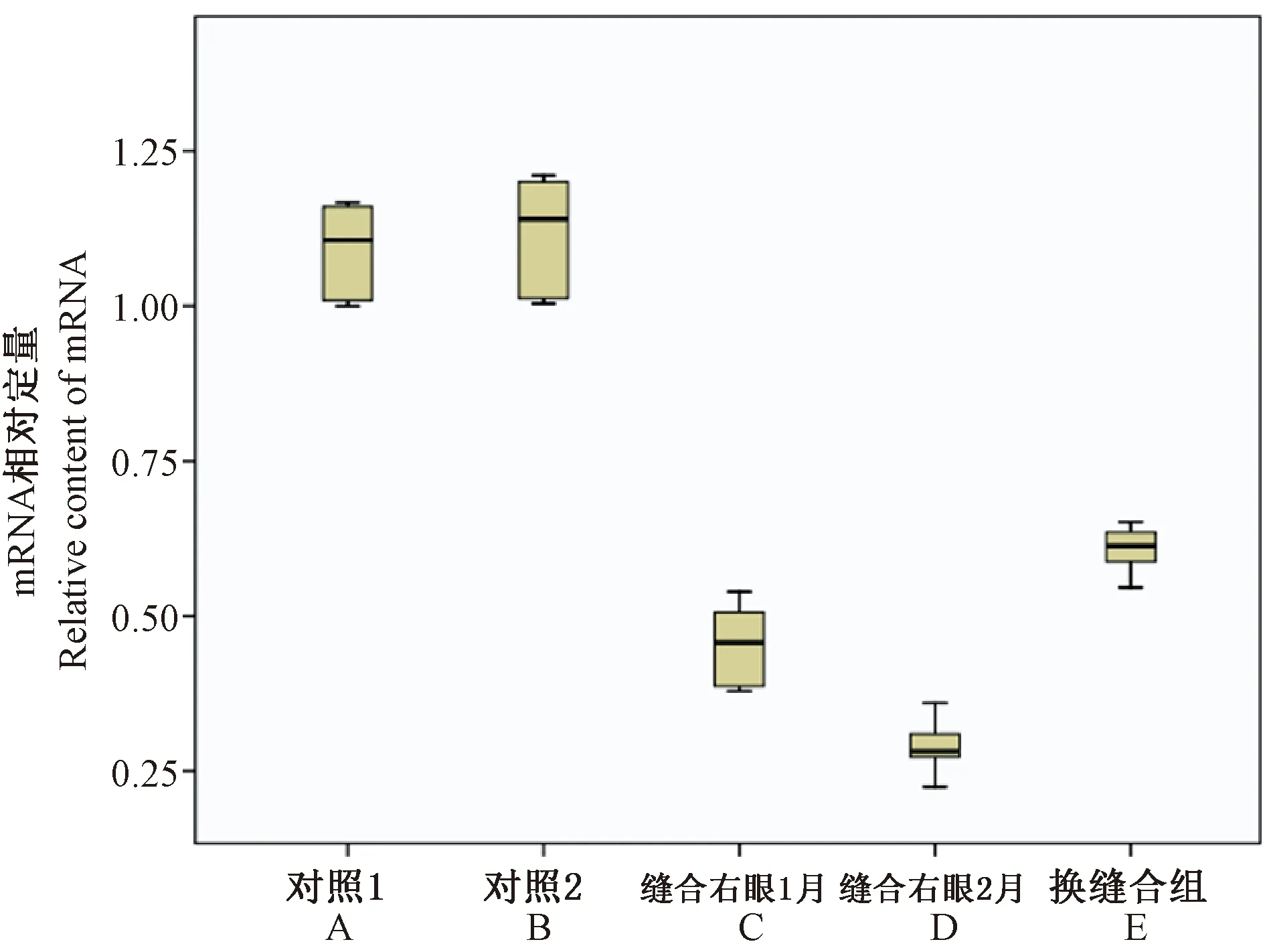
图8 各组c-fos mRNA相对含量Fig.8 Relative content of mRNA c-fos in each group A,B,C,D,E.The same as in the Fig.7.
视皮质电镜表现为:实验组各组均出现了神经元细胞胞核固缩、体积缩小、异染色质增多、核不规则、内质网池形成,线粒体肿胀,血管周围神经毡水肿、淤血,局部髓鞘分离。神经组织电镜特点显示神经元的损害是一种退行性改变,当损害因素去除后神经元细胞可以恢复正常,具有可塑性。右眼缝合2月较缝合1月神经元损伤的程度加重。邵立功等[19]研究弱视猫三级神经元及其突触的超微结构也发现:视皮质17区神经元超微结构特征表明神经元的损害具有可逆性。近年来也有研究通过给予弱视猫多巴胺甲酯可以使受损的神经元恢复正常[20]。
实验组组织学及电镜发现在换缝合以后仍然出现了神经元的损害,其原因是遮盖右眼是引起的神经元未恢复还是遮盖左眼引起了新的神经元损害?或者二者同时存在?还需要进一步的研究加以证实。树鼩婴儿期的范围是从出生到生后30 d,最早从第35天精子发生的开始,到第90天完成精子的发生[21];而我们开始反转缝合的时间是在树鼩生后第60天,大概是在儿童期;因此,出生60 d的树鼩仍有可能对形觉剥夺敏感,可能是反转缝合引起了新的损害,或者并未引起新的损害,而是旧的损害未恢复,或者新旧损害同时存在。究竟是什么原因所致,还需要后期实验加以证实。
3.3 凋亡
有研究[22]发现形觉剥夺引起了外膝体细胞的凋亡,从而导致外膝体细胞数量的急剧减少。我们的HE结果也显示了视皮质17区神经元数量的减少,但是视皮质凋亡染色在实验组跟对照组均出现了散在凋亡细胞(1~2个),无明显差异性,推测为与形觉剥夺无关的神经元细胞的正常程序性死亡,考虑可能是形觉剥夺抑制了神经元数量的增加而引起视皮质神经元数量的相对减少,并非为视皮质神经元凋亡所引起,这也是神经元细胞可塑性的前提。
3.4 视皮质c-fos蛋白及c-fos mRNA的表达变化
有研究[23]对树鼩进行不同颜色的光刺激,用免疫组织化学方法检测发现不同颜色的光刺激引起了视皮质V1区c-fos蛋白表达量的不同,推测c-fos蛋白水平的免疫组化检测可作为中枢神经系统神经元形态功能、神经元活动标志的有利工具。另有学者[24]研究发现不同发育阶段的大鼠其c-fos的表达也存在差异:其中从出生到生后16 d,c-fos mRNA处于一个较高水平的表达,表达最高的是在胚胎期第18天的脑膜和生后第30天的大脑皮质和小脑,而整个大脑的表达水平在生后30 d趋于稳定,并能维持一年半左右,而在出生后第50天有一个短暂的降低,可能跟青春期的开始有关。
本实验免疫组化方法及RT-PCR方法检测发现:c-fos蛋白表达量及mRNA相对定量在实验组各组较对照组均下降,缝合右眼两月组下降更明显,换缝合组表达量较缝合1月组及缝合2月组表达量均明显上升,且实验组萎缩神经元细胞表达均阴性,提示c-fos蛋白参与了弱视的形成及恢复,并揭示了弱视具有可塑性。正常对照组之间c-fos的表达无显著差异,说明c-fos蛋白在出生后2个月与出生后3个月阶段的表达较恒定。
综上所述,本实验通过树鼩单眼形觉剥夺模型的建立,阐述了弱视损伤及恢复相应的组织学及超微结构变化,推测弱视发生及恢复可能的病理机制,这些组织学及超微结构的特征提示我们形觉剥夺引起的神经元损伤具有可恢复性,也就是神经元具有可塑性;凋亡检测并未发现神经元明显的凋亡现象,是神经元可塑性的前提;树鼩的进化地位、视皮质的解剖特点及我们的实验结果显示形觉剥夺引起了视皮质的明显损害都说明了树鼩可以作为良好的形觉剥夺弱视模型,并揭示c-fos基因和蛋白可能参与了形觉剥夺视皮质神经元的损伤及可塑性,为临床治疗弱视提供理论依据和新的治疗思路,也为今后进一步研究树鼩视锥细胞可塑性及视皮质可塑性关系问题做铺垫。
[1] 李凤明,谢立信. 中华眼科学 [M]. 北京:人民卫生出版社. 第三版,2014.3007、3024.
[2] McKee SP, Levi DM, Movshon JA. The pattern of visual deficits in amblyopia [ J ]. Vis. 2003(3): 380-405.
[3] van de Graaf ES, van der Sterre GW, Polling JR, et al. Amblyopia & Strabismus Questionnaire: Design and initial validation [J]. Strabismus. 2004,12: 181-193.
[4] Hubel DH, Wiesel TN. Receptive field, binocular interaction and functional architecture in the cat’s visual cortex [J]. J Physiol 1962, 160: 106-154.
[5] Norcia AM, Hale J, Pettet MW, et al. Disparity tuning of binocular facilitation and suppression after normal versus abnormal visual development [J]. Invest Ophthalmol Vis Sci. 2009,50: 1168-1175.
[6] Bi H, Zhang B, Tao X, et al. Neuronal responses in visual area V2 (V2) of macaque monkeys with strabismic amblyopia [J]. Cereb Cortex. 2011(21): 2033-2045.
[7] 邵立功, 章应华. 弱视猫外侧膝状体γ-氨基丁酸能神经元变化的免疫细胞化学研究 [J]. 中华眼科杂志 1994, 30(6): 437-440.
[8] Wong P, Kaas JH. Architectonic subdivisions of neocortex in the tree shrew(Tupaiabelangeri) [J]. Anat Rec, 2009, 292: 994-1027.
[9] Shi XF, Xu LM, Li Y, et al. Fixational saccadic eye movements are altered in anisometropic amblyopia [J]. Restor Neurol Neurosci, 2012, 30(6): 445-462.
[10] 郑永唐,姚永刚,徐林. 树鼩基础生物学与疾病模型 [M]. 云南:云南科技出版社. 第1版. 2014,(59、151).
[11] Petry HM, Harosi FI. Visual pigments of the tree shrew and greater galago: a microspectrophotometric investigation [J]. Vision Res, 1990, 30(6): 839-851.
[12] Fan Y, Huang ZY, Cao CC, et al. Genome of the Chinese tree shrew [J]. Nature Communications, 2013, 4: 1426.(Dio : 10.1038/ncomms2416).
[13] Szigeti A, Tatrai E, Szamosi A, et al. A morphological study of retinal changes in unilateral amblyopia using optical coherence tomography image segmentation [J]. PLoS One, 2014, 9 e88363.
[14] Zele AJ, Wood JM, Girgenti CC. Magnocellular and parvocellular pathway mediated luminance contrast discrimination in amblyopia [J]. Vision Res. 2010, 50: 969-976.
[15] Wiesel TN, Hubel DH. Effects of visual deprivation on morphology and physiology of cells in the cats lateral geniculate body [J]. J Neurophysiol. 1963, 26: 978-993.
[16] Wiesel TN, Hubel DH. Single-cell responses in striate cortex of kittens deprived of vision in one eye [J]. J Neurophysiol. 1963, 26: 1003-1017.
[17] Hubel DH, Wiesel TN, LeVay S. Plasticity of ocular dominance columns in monkey striate cortex [J]. Philos Trans R Soc Lond B Biol Sci. 1977, 278: 377-409.
[18] Wiesel TN. Postnatal development of the visual cortex and the influence of environment [J].Nature. 1982, 299: 583-591.
[19] 邵立功,章应华,张东杲. 弱视猫视觉系统三级神经元及其突触的超微结构研究 [J]. 中华眼科杂志,1994,30(1): 53-56.
[20] Li R, Liang T, Chen ZN, et al. L-Dopa methyl ester attenuates amblyopia-induced neuronal injury in visual cortex of amblyopic cat [J]. Gene, 2013, 527: 115-122.
[21] Collins PM, Tsang WN. Growth and reproductive development in the male tree shrew (Tupaia belangeri) from birth to sexual maturity [J]. Biol Reprod, 1987, 37: 261-267.
[22] Nucci C, Morrone L, Rombola L, et al. Multifaceted roles of nitric oxide in the lateral geniculate nucleus: from visual signal transduction to neuronal apoptosis [J]. Toxicol Lett, 2003, 139: 163-173.
[23] Poveda A, Kretz P. c-fos expression in the visual system of the tree shrew (Tupaiabelangeri) [J]. J Chem Neuroanat, 2009, 37: 214-228.
[24] Herrere DG, Robertson HA. Activation of c-fos in the brain [J]. Progr Neurobiol, 1996, 50(2-3): 83-107.
Plasticity of the visual cortex area 17 after form deprivation in tree shrews
ZHOU Guang-long1,YANG Dong-mei1,LIANG Jia-rui1,CHEN Li1,DAI Rui1,ZHANG Chi1,LI Na2,HU Min1*,DAI Jie-jie2*
(1. Department of Ophthalmology, the Second People’s Hospital of Yunnan Province & the Fourth Affiliated Hospital of Kunming Medical University, Kunming 650021,China;2. Institute of Medical Biology, Chinese Academy of Medical Sciences and Peking Union Medical College, Tree Shrew Germplasm Resource Center, Kunming 650018)
Objective To preliminarily explore the feasibility of tree shrew as a new kind of animal model in research of amblyopia, to discuss the primary visual cortex plasticity mechanism of form deprivation in tree shrew, and to provide a theoretical basis for further understanding the mechanism of amblyopia formation and recovery. Methods Sixty 30-days old tree shrews were divided into five groups, 12 in each group: the group A had the right eye sutured for 1 month; the group B had the right eye sutured for 2 months; the group C had the left eye sutured for 1 month and then opened and the righ eye was sutured for 1 month, in other words, the group C was performed by alternating suture; the tree shrews of control group 1 (D1) were in the same age as the the group A, but fed in normal breeding environment; the tree shrews of control group 2 (D2) were at the same age of groups B and C, but fed with a normal diet. Samples of the visual cortex were taken after the completion of modeling, and were processed to observe the histology and ultrastructure of the visual cortex, the neuron apoptosis, and the c-fos protein expression in the tree shrews of different groups. Results Damages to different degrees were found by histological and electron microscopic examination of the visual cortex in each experimental group, and they were more obvious in the group sutured for 2 months. TUNEL staining showed that there were no significant differences between the apoptosis in the experimental and control groups. The expression of c-fos mRNA and protein in the experimental groups was decreased, and it was the lowest in the group sutured for 2 months. There was a small increase in the c-fos expression after the alternate suture, and no significant difference of c-fos expression was found in the control groups. Conclusions Different degrees of deprivation amblyopia lead to different histopathological changes. There is a plasticity in the neurons affected by amblyopia. Tree shrew can be used as an ideal animal model for the studies of form deprivation amblyopia.
Visual cortex; Plasticity, neurons; Form deprivation; Amblyopia; Histology; Ultrastructure; Tree shrew
HU Min, E-mail: fudanhumin@sina.com;DAI Jie-jie, E-mail: 278206145@qq.com
国家科技支撑计划项目 (2014BAI01B01);云南省联合支持国家计划项目(2015GA009);国家自然科学基金(81560168);云南省科技计划项目(2014FA017)。
周广龙 (1985 - ),男, 硕士研究生, 研究方向: 斜视弱视小儿眼病。E-mail: 1127564996@qq.com
胡敏。E-mail: fudanhumin@sina.com;代解杰。E-mail: 278206145@qq.com
Q95-33
A
1005-4847(2017) 02-0123-09
10.3969/j.issn.1005-4847.2017.02.003
2016-12-08
