糊精改性酪蛋白的制备及乳化特性研究
2017-05-17赵建伟王丽华杨新颖李丹丹田耀旗
赵建伟, 王丽华, 杨新颖, 李丹丹, 田耀旗*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122)
糊精改性酪蛋白的制备及乳化特性研究
赵建伟1,2, 王丽华1,2, 杨新颖1,2, 李丹丹1,2, 田耀旗*1,2
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡214122)
酪蛋白是一种优良的乳化剂,在等电点PI=4.6附近容易凝沉,采用糊精对酪蛋白进行接枝改性,拓宽酪蛋白在酸性食品中的应用范畴。作者以目标蛋白乳化性为指标进行正交试验设计,确定了糊精改性酪蛋白制备的最佳工艺,并研究了该改性酪蛋白在不同pH条件下的乳化性和乳化稳定性。结果表明,在pH为7.8,温度为110℃,酪蛋白质量浓度为20mg/mL,酪蛋白与糊精质量比为3∶1,反应时间为60min条件下,制备得到的改性酪蛋白乳化性达到0.887。此外,发现改性酪蛋白在pH 4和pH 5的条件下,乳化性较改性前分别提高了50.9%和110.7%,乳化稳定性与改性前相比,在pH 4和pH 5时分别提高了54.8%和108.7%。
改性酪蛋白;糊精;乳化性;乳化稳定性
酪蛋白是乳蛋白质中的一大类,含有人体必需的8种氨基酸,是一种全价蛋白质(含有全部必需氨基酸的蛋白质)[1-2]。除具备营养功能外,酪蛋白还具有一定的乳化性,在食品制造中有广泛地应用。然而酪蛋白的乳化性对环境变化非常敏感,尤其是在其等电点PI=4.6附近,蛋白的溶解性及乳化性显著降低,因此在酸性食品体系中的应用受到了极大限制。糊精是一种葡萄糖值(DE)较小的淀粉不完全水解产物,它无色无味安全性高,制备工艺简单,且具有多羟基结构,溶解性好,同时生产量大,价格低廉[3]。酪蛋白改性有很多方法,主要有物理,化学和酶法改性。各种方法对酪蛋白改性机理不同,对其功能性质影响也不同。目前,最常用的方法有酶解、热处理和葡聚糖接枝等,而糊精对酪蛋白的改性研究未见报道。作者拟采用美拉德反应,将糊精与酪蛋白进行接枝反应,旨在提高其在酸性条件下的乳化性,以扩大酪蛋白在食品工业中的应用范围。
1 材料与方法
1.1 材料与仪器
1.1.1 实验材料 玉米淀粉,济南郭氏伟业化工有限公司产品;酪蛋白,河南向富精细化工发展有限公司产品;中温α-淀粉酶活力10 000 U/g;大豆油,上海嘉里食品工业有限公司;十二烷基硫酸钠(SDS),上海耐因实业有限公司;其他所有试剂均为分析纯。
1.1.2 实验仪器 Ntcolet 5DXC红外光谱仪:Nteolet公司产品;TU-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司产品;SHZ-88水浴恒温振荡器:北京中仪提供;pH510型台式pH仪:杭州科盛机电设备有限公司产品;HH-S恒温数显油浴锅:杭州天一化工仪器设备有限公司产品;LGJ-10冷冻干燥机:北京四环科学仪器厂产品。
1.2 试验方法
1.2.1 糊精制备 称取25 g玉米淀粉→加100 mL蒸馏水置入84℃水浴锅中,充分搅拌20 min溶解→使用0.1 mol/L NaOH或者HCl调节pH至6.0→移入已84℃恒温的蒸馏水中,加适量的中温α-淀粉酶水解→100℃煮沸10 min灭酶→烘箱干燥12 h。酶解工艺条件:温度84℃、时间20min、酶用量16 U/g[4]。
1.2.2 糊精改性酪蛋白制备 称取一定量的酪蛋白,溶于0.05 mol/L pH 7.8的磷酸盐缓冲液中,按一定比例加入糊精,充分搅拌溶解。取8mL混合液于带塞的旋口试管中,适当的反应温度下,反应一定时间后置于冰浴冷却,冰箱保存备用。冷冻干燥后得到改性酪蛋白[5-9]。
1.2.3 糊精改性酪蛋白优化工艺 根据前期试验结果,选取L9(33)正交表进行试验,因素水平表如表1所示。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal experimental design
1.2.4 乳化性测定 蛋白乳化特性的测定是采用Pearce描述的方法[10]并稍加改进。取15mL质量浓度为lmg/mL的待测样品溶液,用1 mol/L的盐酸调节到所需pH,加入5 mL大豆色拉油,在室温下以6 000 r/min高速剪切3min,取适量样品,以1mg/mL的SDS将其稀释100倍后,以SDS溶液为空白对照,测量500 nm处的吸光值A0。用0min的吸光度A0表示乳化性。
1.2.5 乳化稳定性测定 方法同乳化性的测定。取15 mL质量浓度为lmg/mL的待测样品溶液,用盐酸调节到所需pH,加入5 mL大豆色拉油,在室温下以6 000 r/min搅拌3min,在10min取样,以1 mg/mL的SDS稀释100倍,测量500 nm处的吸光值A1,以SDS溶液为空白。用10min的吸光度A1表示乳化稳定性。
2 结果与讨论
2.1 糊精改性酪蛋白条件优化
根据预试验结果,综合考虑选取酪蛋白质量浓度、糊精酪蛋白质量比,时间3个因素设计正交试验,选取L9(33)正交表,具体方案和结果见表2。
结果表明,糊精与酪蛋白反应中,酪蛋白浓度对改性酪蛋白乳化性的影响最大,反应时间影响次之,底物配比影响最小。实验得到改性酪蛋白制备的最佳条件为:酪蛋白质量浓度20 mg/mL,酪蛋白与糊精质量比为3∶1,反应时间60min。在最优制备条件下,改性酪蛋白乳化性达到0.887。
2.2 改性酪蛋白与原酪蛋白乳化性对比
酪蛋白和改性酪蛋白(酪蛋白质量浓度20 mg/ mL,酪蛋白与糊精质量比为3∶1,反应时间60 min)的乳化性与pH的关系如图1所示。由图1可知,酪蛋白的乳化性受pH值影响较大。在pH值4~5之间,由于等电点的出现,使其溶解性下降,因而导致了其乳化活性的下降。当pH值远离等电点,分子间的静电斥力增加,使溶液界面膜加厚,同时有利于胶束的形成[11],因此乳化活力得到提高。而接枝酪蛋白乳化性在pH=4时提高了50.9%,pH=5时提高了110.7%。即当pH达到酪蛋白的等电点,改性酪蛋白乳化活性显著提升,说明了接枝分子对蛋白质的保护作用。
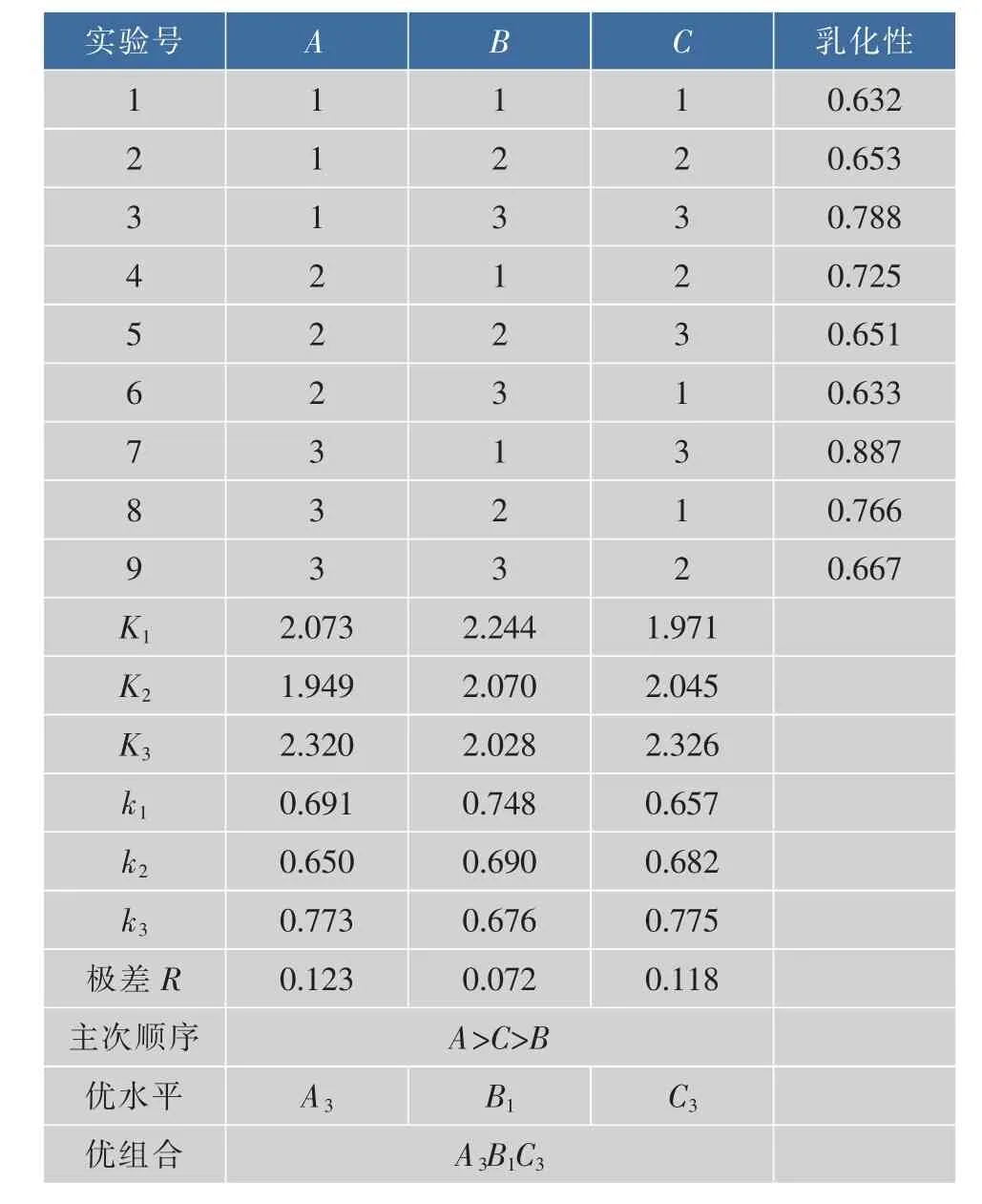
表2 正交试验方案和结果Table 2 Results of orthogonal experimental design

图1 不同pH下酪蛋白及改性酪蛋白的乳化性Fig.1 Emulsibility of the casein and the dextrin-modified casein at different pHs
2.3 改性酪蛋白与原酪蛋白乳化稳定性对比
由图2可知,pH对酪蛋白和改性酪蛋白的乳化稳定性影响较大。与原酪蛋白乳化稳定性相比,改性酪蛋白在pH=4时提高了54.8%,pH=5时提高了108.7%。改性酪蛋白在pH=4.6左右乳化性和乳化稳定性较高的原因可能是改性酪蛋白的等电点向高酸性偏移(偏移至pH=4)的结果,因此在pH= 4.6时溶解度大大增加。
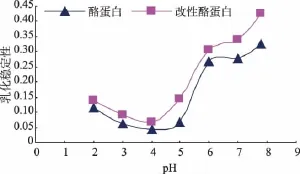
图2 不同pH下的乳化稳定性Fig.2 Emulsion stability of the casein and the dextrinmodified casein at different pHs
2.4 红外光谱分析
红外光谱是分析物质结构和化学组成的变化的一种有效手段。图3分别显示了改性酪蛋白和糊精-酪蛋白混合物的红外光谱图。结果发现,在波长为1 350 cm-1左右时,接枝物的透过率明显增强,这是O-H面内变形振动造成的。当蛋白与麦芽糊精反应时,末端的羰基与蛋白的氨基以化学共价键相连,从而引起末端糖环内的羟基产生变形振动[12],这说明发生了酪蛋白和糊精发生了接枝反应。
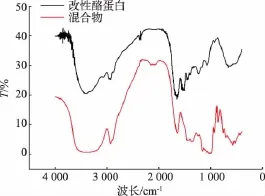
图3 红外光谱图Fig.3 FT-IR spectra of modified casein and physical m ixture of casein and dextrin
3 结语
1)由正交试验得出,在110℃,pH=7.8时糊精改性酪蛋白反应的最适条件为:酪蛋白质量浓度20mg/mL,酪蛋白与糊精质量比为3∶1,反应时间60 min。在此条件下,改性酪蛋白在pH=4和pH=5时乳化性分别提高了50.9%和110.7%。
2)采用红外光谱图证实了酪蛋白与糊精的反应生成了接枝共聚物,使改性酪蛋白等电点向低pH环境偏移,从而显著提高酪蛋白在等电点区域的溶解度、乳化性和乳化稳定性。
3)该改性酪蛋白适用于于酸性饮料等食品中,弥补了酪蛋白在酸性饮料中容易凝沉的缺陷。
[1]YANGM in,LIANG Qi,QIAO Haijun,etal.Study on the influence of glucose on the stability of caseinm icelles in skim milk[J]. Science and Technology of Food Industry,2012,33(24):81-84.(in Chinese)
[2]ZHU Shaojuan,SHIYonghui,LE Guowei.Effects of ultrasound on the hydrolysis of casein by trypsin[J].Journal of Food Science and Biotechnology,2005(2):50-54.(in Chinese)
[3]XU Jin,XU Xuem ing,JIN Zhengyu,etal.Influence of limitdextrin onwheatstarch retrogradation[J].Journal of Food Science and Biotechnology,2014,11:1136-1141.(in Chinese)
[4]PFFox,A Brodkorb.The caseinm icelle:Historicalaspects,currentconceptsand significance[J].International Dairy Journal,2008,18(7):677-684.
[5]LIU Y,GUO R.pH-dependentstructuresand propertiesof caseinm icelles[J].Biophysical Chem istry,2008,136:67-73.
[6]SRINIVASS,PRAKASH V.Bioactive peptides from bovin a-casein:isolation,characterization and multifunction properties[J]. International Journal of Peptide Research and Therapeutics,2010,16:7-15.
[7]JING H,KITTSD D.Chemical and biochemical properties of casein-sugarmaillard reaction products[J].Food and Chem ical Toxicology,2002,40:1007-1015.
[8]ANEMA SG,SIEW K L,EDWIN K L,etal.Rheologicalpropertiesofacid gels prepared from heated pH-adjusted skim milk[J]. Agricultural Food Chem istry,2004,52:337-343.
[9]HAO Xiaomin,WANGSui,CUILingfei.Study on enzymatic hydrolysis to corn starch byα-amylase[J].Food Science,2006,27(2):141-143.
[10]ANEMA SG.Effectofm ilk concentration on heat-induced,pH-dependent dissociation of casein from m icelles in reconstituted skim m ilk at temperaturesbetween 20 and 120℃[J].Agricultural Food Chem istry,1998,46:2299-2305.
[11]刘娟.酪蛋白-葡聚糖接枝改性研究[D].无锡:江南大学,2008.
[12]ZHANG Yan,SHIGuqin.Preparation and emulsibility of dextrin-modified casein[J].Enzyme and M icrobial Technology,2010,46:438-443.
Casein M odification by Dextrin and Emulsibility Characterization of theCom p lex
ZHAO Jianwei1,2, WANG Lihua1,2, YANG Xinying1,2, LIDandan1,2, TIAN Yaoqi*1,2
(1.State Key Laboratory of Food Science and Teconolgy,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi214122,China)
The isoelectric precipitation atpH 4.6 of casein lim its itsapplication asa good emulsifier in food industry.In this study,dextrin-modified casein was prepared which could be used in acid foods.The optim ization of protein emulsibility was carried out by orthogonal experiment.The emulsibility and emulsion stability of dextrin-modified casein were studied under different pH values.The optimal conditions for themodificationwere as follows:3mg/m L of casein,3∶1 of casein to dextrin (w/w),pH 7.8,and 110℃for 60m in.The emulsibility of themodified casein reached to 0.887.Furthermore,the emulsibility of dextrin-modified caseinwas increased by 50.9%and 110.7% atpH=4 and pH=5,w ith theemulsion stability increased by 54.8%and 108.7%,respectively.
modified casein,dextrin,emulsibility,emulsion stability
TQ 93
A
1673—1689(2017)04—0389—04
2015-04-28
国家“十二五”科技支撑计划项目(2012BAD37B01-04)。
赵建伟(1971—),男,江苏无锡人,工学硕士,副教授,主要从事食品科学与工程研究。E-mail:zhaojw@jiangnan.edu.cn
*通信作者:田耀旗(1981—),男,湖北黄冈人,工学博士,副教授,主要从事食品科学与工程研究。E-mail:yqtian@jiangnan.edu.cn
赵建伟,王丽华,杨新颖,等.糊精改性酪蛋白的制备及乳化特性研究[J].食品与生物技术学报,2017,36(04):389-392.
