复合酶法提取漳平水仙饼茶多糖的工艺优化
2017-05-17陈雪梅李文霞石小琼
黎 英, 陈雪梅, 张 灵, 李文霞, 石小琼
(龙岩学院 闽西食品研究所,福建 龙岩 364012)
复合酶法提取漳平水仙饼茶多糖的工艺优化
黎 英, 陈雪梅, 张 灵, 李文霞, 石小琼
(龙岩学院 闽西食品研究所,福建 龙岩 364012)
以漳平水仙饼茶为原料,多糖得率为指标,先采用正交试验确定复合酶最佳配比,进而在单因素试验基础上,利用Plackett-Burman试验设计筛选影响多糖得率的显著因素,再结合Design-Expert7.1.3软件中Box-Behnken中心组合设计原理进行响应面回归分析优化。结果表明:果胶酶、木瓜蛋白酶和纤维素酶的最佳活力单位配比为:15∶10∶18;酶解pH对提取漳平水仙饼茶多糖达到极显著效应,加酶量、酶解温度达到显著水平;最佳工艺参数为液料体积质量比为80 mL∶1 g,加酶量3.0%,酶解温度49℃,酶解pH为6.0,酶解时间90 min,在此条件下,水仙饼茶多糖得率为4.26%。
水仙饼茶;多糖 ;复合酶;Plackett-Burman设计;响应面法
Keywords:Shuixian Tea Cake,polysaccharides,complex enzymes,Plackett-Burman design,response surfaceanalysis
福建漳平水仙茶自元代开始种植,其茶梗粗壮,叶张肥厚,迄今种植面积约2万亩,常年产量达2 500 t,并于2009年获农业部颁发的农产品地理标志登记证书。水仙茶饼又名“纸包茶”是乌龙茶中唯一的压紧茶,其制作工艺独特(木模压制成方形后用纸包固定,焙干成形),于国内属首创,产品外形见方扁平,经久藏,耐冲泡,色泽乌褐油润,滋味醇厚,香气清高[1-5]。
茶多糖是一种酸性糖蛋白高分子化合物,研究表明茶多糖除具植物多糖的药理活性特性如抗辐射、降血糖等功效外,还在增强人体非特异性免疫功能及减慢心率方面起明显作用[6-8],但关于水仙饼茶多糖的提取工艺的研究尚未见报道。作者利用纤维素酶、果胶酶和木瓜蛋白酶作用条件温和,能高效降解细胞壁、细胞间的果胶质和水解蛋白质,使细胞中目标分离物充分、快速从组织内分离出来,对多糖的结构和活性影响小等优点,达到高效提取水仙饼茶多糖的目的[9-11]。通过Plackett-Burman试验设计筛选影响水仙饼茶多糖得率的主要因素,用中心组合设计试验对主要因素进行优化[12-18],获得水仙饼茶多糖最佳提取条件。
1 材料与方法
1.1 材料、试剂与仪器
水仙饼茶:漳平九鹏茶叶有限公司提供;纤维素酶(1 800 U/mg)、果胶酶(1 000 U/mg)、木瓜蛋白酶(1 000 U/mg):上海金穗生物科技有限公司;无水乙醇、丙酮、氯仿、正丁醇、硫酸、苯酚等所用试剂均为分析纯:上海国药集团产品。葡萄糖标准品:Sigma化学公司产品;试验主要仪器为旋转蒸发器(RE52AA型):上海亚荣生化仪器厂产品;电子分析天平(TB-114型):北京赛多利斯仪器系统有限公司产品;高速冷冻离心机(TGL-16G-A型):上海安亭科学仪器厂产品;真空冷冻干燥机 (FD-1-50型):北京博医康实验仪器有限公司产品;紫外可见分光光度计(UV-2102C型):尤尼柯仪器有限公司产品。
1.2 试验方法
1.2.1 葡萄糖标准曲线的绘制 精确称取5.015 mg经105℃干燥至质量恒定的葡萄糖标准品,蒸馏水溶解,移入50 mL容量瓶并定溶,配制成质量浓度为0.100 3mg/mL的葡萄糖标准溶液。依次吸取0、2.0、4.0、6.0、8.0、10.0 mL葡萄糖标准液于50 mL容量瓶并加蒸馏水至刻度,摇匀备用。移取上述系列溶液2 mL于6个25 mL具塞刻度试管中,各精密加入1.0 mL体积分数5%苯酚溶液和5 mL浓硫酸溶液混匀,加蒸馏水定容,室温下静置30min。以0号管为空白对照,490nm波长下测吸光度,绘制标准曲线(见图1)。得线性回归方程
y=6.897 2x-0.006 6,R2=0.999 5。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
1.2.2 水仙饼茶多糖得率的测定 准确称取经50℃烘至恒重、粉碎过60目筛的水仙饼茶粉5.0 g,按试验设定的条件加蒸馏水进行酶提取处理,4 000 r/min离心10 min,真空抽滤,滤渣以同样的条件再重复操作1次,合并滤液浓缩至1/4,加入4倍体积的体积分数95%乙醇,于4℃冷藏柜中静置过夜,离心得沉淀,用无水乙醇、丙酮反复洗涤2次,真空干燥后蒸馏水复溶定容至50mL。取定容后的水仙饼茶多糖样品液2 mL于25 mL具塞刻度试管中,用上述标准曲线得操作步骤测水仙饼茶多糖的吸光度值,重复3次,取平均值。按以下公式计算多糖得率。
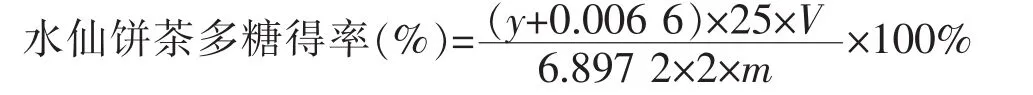
式中,m为称取的水仙饼茶干粉质量,mg;y为吸光度值;V为样品体积,mL。
1.2.3 复合酶配比试验 在150mL烧杯中各加入5.0 g水仙饼茶粉,加入100倍蒸馏水,用柠檬酸钠和磷酸二氢钠溶液调pH值至6.0,加入不同用量的果胶酶、纤维素酶和木瓜蛋白酶进行组合试验(见表3),于60℃,200 r/min恒温摇床中提取120 min后用冰水灭酶15min,抽滤除杂,测多糖。每组试验重复3次,取平均值。选择提取效果最好的复合酶配比进行后续试验。
1.2.4 水仙饼茶总多糖得率的单因素试验 称取水仙饼茶粉5.0 g,复合酶质量比为15∶10∶18配比添加,在液料体积质量比(20、40、60、80、100、120mL/g),加酶量(1.0%、2.0%、3.0%、4.0%、5.0%、6.0%),酶解温度 (20、30、40、50、60、70℃),酶解pH(2.0、3.0、4.0、5.0、6.0、7.0),酶解时间(30、60、90、120、150、180 min)的条件下提取。以水仙饼茶多糖得率为指标进行单因素实验。
1.2.5 水仙饼茶总多糖得率的响应面法优化试验设计 选取Plackett-Burman实验设计筛选出来的对提取率影响显著3个因素,利用Box-Behnken试验设计原理进行3因素3水平的试验设计(见表1)。R为多糖得率,%。
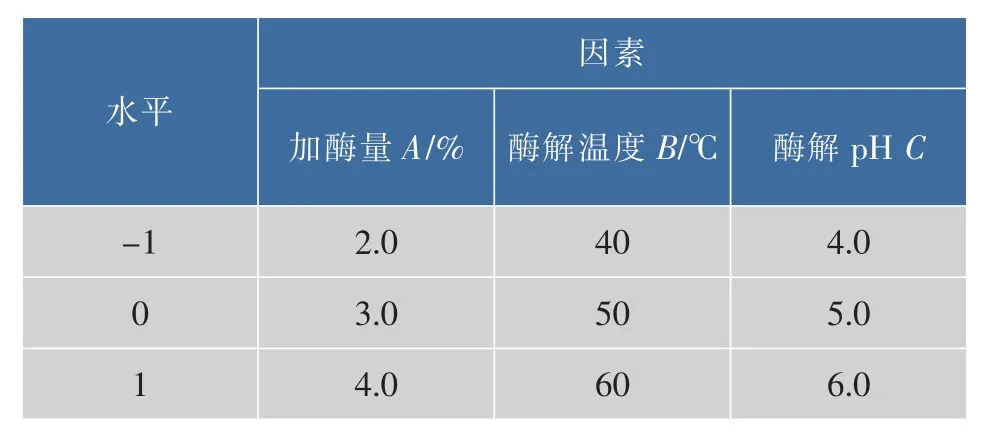
表1 响应面分析因素与水平编码Table 1 Factors and levels of central com posite design experiments for RSA
2 结果与分析
2.1 复合酶配比试验结果
从表2正交试验结果可知,对水仙饼茶多糖得率影响最大的是木瓜蛋白酶,其次是果胶酶和纤维素酶。最佳工艺A3B2C2,即果胶酶3 000 U、木瓜蛋白酶2 000 U、纤维素酶3 600 U。由于A3B2C2不在所列正交试验表内,按此组合平行进行3次验证试验,多糖得率平均值为4.18%,高于其他组合,故后续试验复合酶活力单位配比均采用15∶10∶18。
2.2 单因素试验结果
2.2.1 液料体积质量比对水仙饼茶多糖得率的影响 从图2可以看出,当液料体积质量比小于80 mL/mg时,随着液料体积质量比的加大,水仙饼茶多糖得率不断上升,当液料体积质量比大于80 mL/mg时,随着蒸馏水用量的增加,多糖得率却呈下降趋势。可能是因为当蒸馏水加入量过少时,不利于水仙饼茶粉的充分溶解,提取效果不佳;而蒸馏水加入过量会不利于酶的水解反应进行,导致提取效果下降。综合考虑溶剂用量、浸提效果和经济成本,确定液料体积质量比80mL/mg时最佳条件。
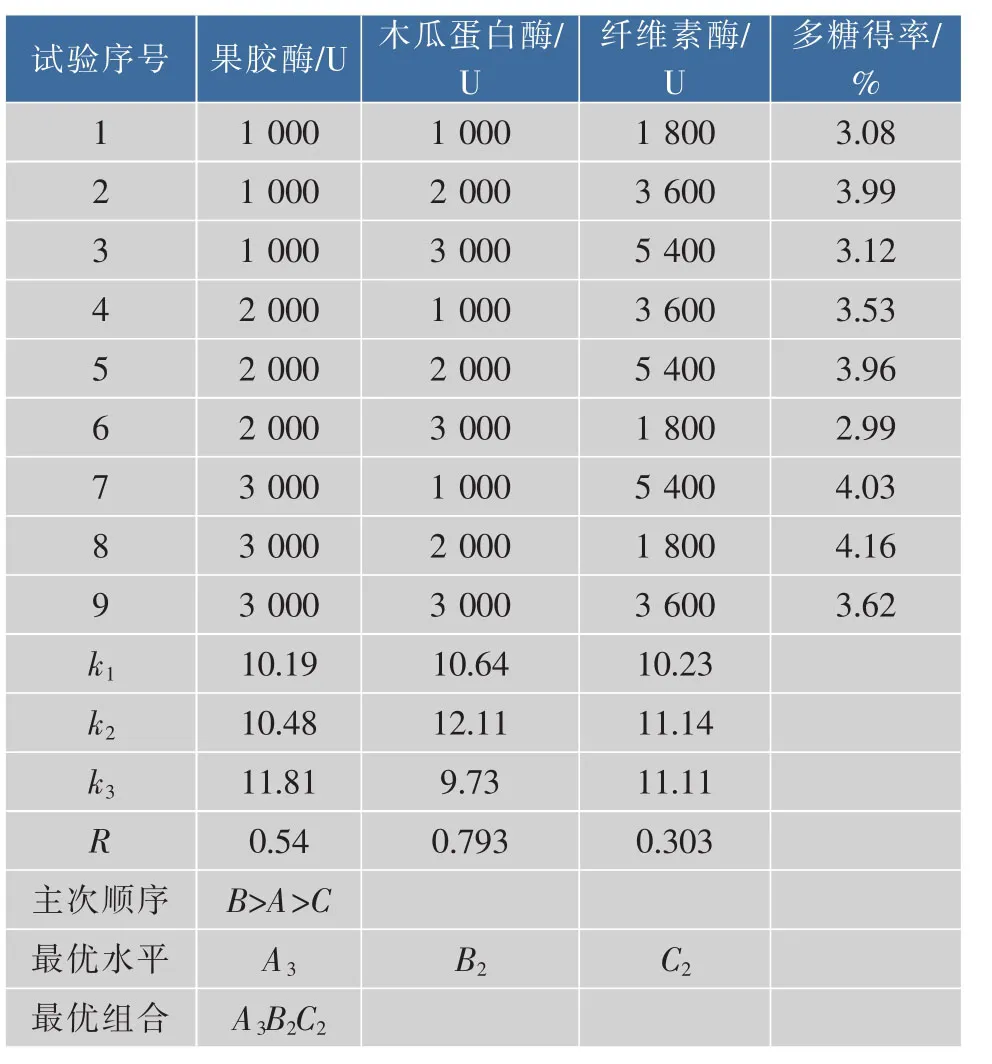
表2 正交试验设计及结果Table 2 Orthogonal test design and results
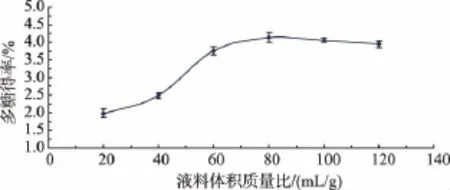
图2 液料体积质量比对水仙饼茶多糖得率的影响Fig.2 Effect of solid-liquid ratio on the extraction yield of polysaccharides from Shuixian Tea cake
2.2.2 加酶量对水仙饼茶多糖得率的影响 在其他因素不变,持续增加复合酶用量的情况下,水仙饼茶多糖得率开始显著提高,但加酶量达到3%后,多糖得率增加却趋于平缓。这可能是由于复合酶能高效、快速使多糖化合物从细胞中分离出来,在一定浓度范围内,随着复合酶浓度上升,酶与底物接触的机会大增,多糖溶出量相应增加;当复合酶用量达到饱和后,由于一部分复合酶失去与底物结合的机会,因此虽加大复合酶用量,但多糖得率增加并不明显,还造成酶的浪费。故确定加酶量以3%为最佳实验条件。
2.2.3 酶解温度对水仙饼茶多糖得率的影响 在试验设定的酶解温度范围内,随着酶解温度的升高,水仙饼茶多糖得率呈现先增加后减少的趋势。原因可能是酶的活性受温度影响较大,温度较低时,酶的活性受到抑制,导致提取效果不佳;随着温度的上升,既加剧物质分子的扩散运动,又使酶的活性逐渐增强,到最适温度时,酶的活性达到最强,多糖得率相应也达到最大值;超过最适温度后,随着温度的升高,一方面酶的活性反而逐渐减弱,甚至失活,另一方面高温也可能导致水仙饼茶多糖的结构变化,故多糖得率反而下降。因此,酶解温度设定为50℃。
2.2.4 酶解pH对水仙饼茶多糖得率的影响 pH值对水仙饼茶多糖得率影响较显著,可能与每种酶的最适pH值(果胶酶为2.5~6.0;木瓜蛋白酶为5~7;纤维素酶为4.0~5.5)有关,复合酶在偏酸性条件下复合酶活力最强,酸碱度过酸或过碱都会导致酶活性降低,从而影响多糖的提取。水仙饼茶多糖得率在pH值为5.0时效果最好。故选择5.0为最佳酶解pH。
2.2.5 酶解时间对水仙饼茶多糖得率的影响 水仙饼茶多糖得率随着酶解时间的延长先明显持续增大,当酶解时间为90 min时,达最大值,而后随酶解时间增加得率反而减小。这可能是由于开始时酶不能充分发挥其水解作用,随后可能是因为在长时间加热作用下,既会使水仙饼茶多糖的结构改变,也会导致复合酶失活,故造成得率减小。因此,最佳酶解时间确定为90min。
2.3 Plackett-Burman试验设计及筛选关键因素结果
利用Minitab 15软件对液料体积质量比、加酶量、温度、pH、时间等5个因素进行Plackett-Burman实验设计拟合和方差分析。
在5个影响多糖得率因素中,强弱依次排序为:X4(pH)>X3(温度)>X2(加酶量)>X5(时间)>X1(液料体积质量比)。其中酶解pH对水仙饼茶多糖得率的影响达到极显著水平,酶解温度和加酶量的影响达到显著水平,而液料体积质量比和酶解时间则影响不显著。因此选择酶解pH、酶解温度和加酶量这3个因素进一步做响应面优化分析。液料体积质量比和酶解时间这两个因素根据其呈现的正负效应和节约成本的原则,并结合单因素试验,将其固定在较好水平上,即液料体积质量比为80mL/g,酶解时间90min进行试验。
2.4 水仙饼茶多糖得率的响应面优化结果分析
在Plackett-Burman实验结果的基础上,以水仙饼茶多糖得率为分析指标,采用Design-Expert7.1.3软件中心组合设计原理,设计3因素3水平共17个试验,建立数学模型,分析各因素之间的交互作用对结果的影响。
试验数据对自变量编码A、B及C进行分析,可得到相关回归系数,其二次多项式方程为:
Y=-1.653 75+1.058 75*A+0.142 12*B+0.305 00*C-1.500 00×10-4*A*B+5.000 00×10-3*A*C-1.000 00× 10-3*B*C-0.176 25*A2-1.362 50×10-3*B2-0.023 750*C2
上述回归模型P<0.000 1,模型极显著,失拟项P=0.268 4>0.05,影响不显著,说明试验设计可靠,拟合程度良好,可用本试验所得的二次回归方程对相应值进行预测;同时其决定系数R2=0.995 9,校正决定系数R2=0.990 7,说明试验可靠性和精确度较好;另外变异系数CV=0.29%,也表明可以用该回归方程对水仙饼茶多糖得率进行预测和分析。其中一次项C和二次项中的A2、B2、C2对多糖得率影响都极显著(P<0.01),A、B对R值得影响显著(P<0.05),交互项AB、AC、BC不显著 (P>0.05)。且A、B和C的显著性结果和Plackett-Burman试验设计中显著性分析相一致。
从响应曲面等值线的形状接近椭圆形和曲面倾斜度较陡可看出,酶解pH值对水仙饼茶多糖得率的影响最为显著,而酶解温度和加酶量次之,表现为曲线较为平缓和等值线形状接近圆形。利用Design-Expert7.1.3软件对回归模型进行分析获得水仙饼茶多糖的最佳提取工艺条件。
2.5 优化条件下水仙饼茶多糖得率的验证试验
按上述条件下进行3次平行水仙饼茶多糖提取试验,所得水仙饼茶多糖得率分别为4.28%、4.25%、4.24%,平均为4.26%,RSD值为0.489%。实际值与预测值接近。
3 结语
1)提取水仙饼茶多糖所用的复合酶最佳配比:果胶酶3 000U、木瓜蛋白酶2 000U、纤维素酶3 600 U。影响强弱依次为:木瓜蛋白>果胶酶>纤维素酶。
2)在单因素试验基础上,利用Plackett-Burman结合响应面分析法,有效地从水仙饼茶多糖得率的5个影响因素中筛选出主要的影响因素,并实现条件优化。获得最佳提取条件参数为:液料体积质量比为80 mL/g,加酶量3.0%,酶解温度49℃,酶解pH为6.0,酶解时间90min,在此条件下,通过3次验证试验,水仙饼茶多糖得率平均为4.26%,与预测值(4.29%)的相对误差为0.699%,差异不显著。
[1]TANG Xieru.Zhangping,Fujian Shuixian Tea obtain geographical indications[J].Tea W ord,2009(3):38.
[2]CHEN Yumei.Problems and countermeasures of the production of Zhangping Shuixian tea[J].Chinese horticultural Digest,2013(9):224-225.
[3]LIN Zanhuang.Shaping and baking technology for Zhangping Shuixian tea cake[J].Tea Science and Technology,2002(3):37-38.
[4]DENG Changhai,GUO Yaling.Study onmolding packagingmaterials of Zhangping Shuixian tea cake[J].Tea Science and Technology,2004(3):14.
[5]屠幼英.茶与健康[M].北京:世界图书出版公司,2011.
[6]WU Jiadi.Advance in study of polysaccharide[J].Jorunal of Shenyang Normal University(Natural Science),2008,26(2):221-223.
[7]XU Chengping,YANG Chenchen,ZHENG Jianqiang,etal.Review on extraction and biologicalactivity of polysaccharides from plant leave[J].Food Research And Development,2014,35(14):111-114.
[8]CUIHongchun,ZHOU Tiefeng,ZHENG Xunxia,,et al.Study on progress of tea polysaccharide detection[J].Hangzhou Agriculture and Technology,2014(5):29-31.
[9]WANG Yuangfeng,MAO Fangfang,WEIXinlin.Characterization and antioxidant activities of polysaccharides from leaves,flowersand seedsofgreen tea[J].Carbohydrate Polymers,2012,1(880):146-153.
[10]CHEN Xiaoqiang,WANG Yuefei,WU Yalin,etal.Green tea polysaccharide-conjugates protecthuman umbilicalvein endothelial cells against impairments triggered by high glucose[J].International Journal of Biological M acromolecules,2011,1(49):50-54.
[11]吴士筠,周崧,张凡.酶工程技术[M].武汉:华中师范大学出版社,2009.
[12]YU Zeyuan,TENG Xin,XU Yaqin,etal.Study on extraction processof raspberry polysaccharidew ith compound enzymemethod [J].Journal of Northeast Agricultural University,2014,45(3):52-58.
[13]ZHU Shuangjie,SUN Yanhui,JIA Xiaoli,et al.Technology optim ization of purifing nostoc commune vauch polysaccharide by yeast fermentation[J].Journal of Food Science and Biotechnology,2012,31(11):1209-1215.
[14]LI Xiemei,SU Yuncong,WANG Jie.Optimized extraction technology of water-soluble scallop polysaccharide by response surfacemethodology[J].Journal of Chinese Institute of Food Science and Technology,2014,14(2):127-131.
[15]TANG Zheng,CHEN Xiaoxiang,HUANG Xiaozhu.Optim ization of the exrraction technology of dendrobium polysaccharides from dendrobium of ficinale bym ixedenzyme[J].Northern Horticulture,2014(6):132-134.
[16]LIYang,FENG Hongxia,WANG Huan,et al.The process of ultrasound technology assisted aqueous enzymatic extraction of safflowerseed oil[J].Journal of the Chinese Cereals and Oils Association,2014,29(7):63-67.
[17]ZHOU Xiaolian,WANG Dongfeng,LI Suzhen,et al.Effects of different extraction processesonthe components of tea po1ysaccharides[J].Journal of Tea Science,2007,27(2):27-32.
[18]YANG Ying,SUN Wenwu,ZHOU Chen,et al.Optimization of water-soluble polysaccharides extraction from rhizome of polygonatum odoratum using response surfacemethodology and its antioxidantactivities in vitro[J].Journal of Food Science and Biotechnology,2013,32(3):298-306.
Optim ization of Enzymatic Extraction of Polysaccharides from Zhangping Shuixian Tea Cake Using Com p lex Enzymes
LIYing, CHEN Xuemei, ZHANG Ling, LIWenxia, SHIXiaoqiong
(M inxi Food Research Institute,Longyan University,Longyan 364012,China)
The enzymatic extraction of polysaccharides from Zhangping Shuixian Tea Cake by complex enzymeswas optim ized according to the yield of polysaccharide yield firstly by the L9(34)orthogonal experiments to determ ine the best ratio of complex enzymes.Five significant factors based on the single factor experimentwere further studied using Plackett-Burman design,including solid-liquid ratio,amount of complex enzymes,enzymatic hydrolysis temperature,pH value for enzyme hydrolysis,and enzymolysis duration. Furthermore,the main factors affecting polysaccharides yield were investigated and optim ized by Box-Behnken center-united experiment and RSM.The best ratio of complex enzymes for pectinase,papain and cellulase enzyme was determined as 15∶10∶18.The pH value of enzyme hydrolysis showed extremely significanteffecton polysaccharides extraction,while the amount of complex enzymes and enzymolysis duration significantly affect polysaccharides extraction.The optimum extraction condition was using 80∶1 of solid-liquid ratio(m L/g)and 3.0%of complex enzymesamountat49℃under pH 6.0 for90min,underwhich the yield of polysaccharideswas4.26%.
S 571.1
A
1673—1689(2017)04—0443—05
2015-05-21
福建省教育厅科研项目(JA13310)。
黎 英(1974—),女,福建长汀人,高级实验师,主要从事食品科学研究。E-mail:liying213fjly@163.com
黎英 ,陈雪梅,张灵,等.复合酶法提取漳平水仙饼茶多糖的工艺优化[J].食品与生物技术学报,2017,36(04):443-447.
