双酶法催化玉米淀粉制备γ-CD
2017-05-17李林林张梦柯金征宇王丽华王金鹏
李林林, 张梦柯, 金征宇, 王丽华, 王金鹏*
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122)
双酶法催化玉米淀粉制备γ-CD
李林林1,2, 张梦柯1,2, 金征宇1,2, 王丽华1,2, 王金鹏*1,2
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.江南大学 食品学院,江苏 无锡 214122)
以玉米淀粉为底物,研究了来自于栖热水生菌的4α-糖基转移酶(4αGTase)和来自于嗜碱芽孢杆菌的环糊精葡萄糖基转移酶(CGTase)作用于淀粉制备γ-CD的影响因素。结果表明:两种酶的添加方式为先加入4αGTase、再加入CGTase;γ-CD的最佳制备条件为底物质量分数5%,4αGTase加酶量4 U/g淀粉,CGTase加酶量8U/g淀粉,反应时间30 h。在此条件下γ-CD的得率最高为12.83%,比对照组提高了76.7%。
4α-糖基转移酶;环糊精葡萄糖基转移酶;γ-环糊精;玉米淀粉
环糊精(cyclodextrin,简称CD)是由环糊精葡萄糖基转移酶 (cyclodextringlycosyltransferase,简称CGTase)酶解淀粉或者淀粉类似物产生的由D-吡喃型葡萄糖单元通过α-1,4-糖苷键连接而成的一类环状低聚化合物[1-2]。常见的为含有6、7和8个葡萄糖单元的分子,根据环中葡萄糖单元的数量,分别称为α-CD、β-CD和γ-CD。与α-CD、β-CD相比,γ-CD具有较大的空腔和较高的溶解度,能够包接较大的分子[2]。然而,尽管市场对γ-CD的需求很大,但是由于其转化率低、产物特异性差以及分离纯化困难造成的高成本大大限制了其工业化大规模生产,使其只占有较小部分的市场份额[3]。
由于野生型的CGTase作用淀粉产生的都是不同比例的3种环糊精的混合物,因而其产物特异性差,并且后期的分离纯化困难[4]。针对其产物特异性差的问题,目前很多人采用基因工程的手段,对现有的CGTase基因进行突变,从而提高其产物专一性。Kian Mau Goh等[5]对来自于Bacillus sp.G1菌株的CGTase进行突变,其突变体H43TCGTase产γ-CD的产率从 10%提高到了 39%。王峰等[6]从Bacillusmacorous中筛选出产γ-CGTase的菌株。此外,通过控制反应条件和加入有机溶剂,也可实现提高产物比例和产率[7-8]。Bender等[9]向反应体系中加入溴化苯和醋酸钠使γ-CD的产率达到了18.7%。Rendleman等[10]以质量分数10%的淀粉为底物,加入C12化合物反应24 h后,γ-CD的产率有较大的提高。但是,这些有机化合物对于工业生产而言成本较高并且在后期分离过程中很难除去。
淀粉作为底物生产环糊精过程中存在的基本问题是高浓度淀粉粘度大,阻碍了酶和底物之间的接触,使得环糊精产率低。因此可以通过物理、化学和酶法先对淀粉进行预处理[11]。比如用α-淀粉酶或者热稳定性的CGTase先液化淀粉,降低体系的粘度[12-13]。但是Ivan Pishtiyski等[14]发现添加α-淀粉酶后并没有使环糊精的产率增加。并且α-淀粉酶液化后必须要调节体系的pH,才能加入CGTase进一步反应,操作过程较复杂。另一种提高γ-CD产率的方法是用脱支酶比如异淀粉酶或者普鲁兰酶对淀粉先进行预处理。因为在反应过程中,脱支酶可以首先水解掉支链淀粉中的α-1,6糖苷键,之后再加入CGTase利用这部分淀粉发生环化作用[14-15]。Rendleman等[10]以质量分数10%的支链淀粉为底物,先后加入普鲁兰酶和α-CGTase在15℃反应,总环糊精的产率为84%。然而,先用脱支酶预处理淀粉后容易形成大量的直链淀粉晶体,使反应周期延长[16]。
4α-糖基转移酶(4αGTase)是淀粉代谢酶类,它可以产生含有16个葡聚糖单元及以上的大环糊精[17]。大环糊精可以转化为 β-CD和 γ-CD。并且4αGTase更能耐受高温,可以用4αGTase先预处理淀粉,降低淀粉的粘度,再加入CGTase进一步反应。而4αGTase是否有助于提高γ-CD的产率目前尚不清楚。作者将来自于栖热水生菌的4αGTase和来自于嗜碱性芽孢杆菌的G825-6的CGTase进行结合,探索双酶作用催化玉米淀粉对γ-CD产率的影响。
1 材料与方法
1.1 实验材料
马铃薯直链淀粉:Sigma公司产品;普通玉米淀粉:杭州普罗星淀粉有限公司产品;α-CD、β-CD及γ-CD标准样品:Sigma公司产品;可溶性淀粉:国药集团化学试剂有限公司产品;栖热水生菌4α-糖基转移酶及嗜碱性芽孢杆菌CGTase G825-6:作者所在实验室制备;其他试剂均为分析纯。
1.2 实验仪器
双光束紫外可见分光光度计(TU-1900):北京普析通用仪器有限责任公司产品;电热恒温水浴锅:上海浦东物理光学仪器厂产品;低速台式大容量离心机(RJTDL-50A):无锡瑞江分析仪器有限公司产品;高速冷冻离心机(BIOFUGE PRIMOR):美国Thermo Scientific有限公司产品;高效液相色谱仪(LC-20AT230V),示差折光检测器(RID-10A),AKTA purifier900蛋白纯化系统:岛津公司产品;Hypersil NH2色谱柱 (4.6 mm×250 mm,5 mAPS-2Hypersil微粒):美国Thermo公司产品;纯泰Ni-NTA亲和层析柱:GE Healthcare life sciences公司产品;ShodexOHpak SB-804 HQ色谱柱、OHpak SB-802.5 HQ色谱柱:日本昭和公司产品。
2 实验方法
2.1 栖热水生菌4α-糖基转移酶的制备
由基因工程菌E.coli培养发酵,再经Ni-NTA亲和层析柱分离纯化得到4α-糖基转移酶[18]。
4α-糖基转移酶酶活测定:淀粉-碘显色法[18]。
2.2 环糊精葡萄糖基转移酶的制备
从低温冰箱中取出一支甘油管保藏菌接种至含有50 mL LB培养基的250 mL三角瓶中,37℃、200 r/min振荡培养10h。按体积分数5%的接种量接种至含有100mL培养基的500mL三角瓶中,待A=1.0时加入IPTG使其终浓度为0.05 mmol/L,在18℃、200 r/min下诱导培养20 h。培养结束后,菌液5 000 r/min离心30 min,弃掉上清液,收集菌体。菌体悬浮于pH 8.5的Tris-HCl中超声破碎,离心后所得上清液即粗酶液。
粗酶液的纯化采用淀粉吸附法[19]:首先向粗酶液中加入质量分数5%的玉米淀粉和1 mol/L的硫酸铵,在4℃缓慢搅拌1 h,使酶充分被淀粉吸附;反应混合物6 500 r/min离心10 min,沉淀用预冷的1mol/L的硫酸铵洗涤两次,除去未被吸附的蛋白;为充分洗脱下吸附在淀粉上的CGTase,残渣用含有1 mmol/Lγ-CD的50 mmol/L、pH 8.5的Tris-HCl在37℃振荡培养30min得到洗脱液1;离心后的沉淀再用同样含有γ-CD的缓冲液洗脱,得到洗脱液2;两次得到的洗脱液合并,用50 mmol/L、pH 8.5的Tris-HCl缓冲液在4℃透析24 h,每隔6 h换一次缓冲液。
2.3 CGTase环化活力的测定
将适量 CGTase的酶液加入预先装有用50 mmol/L Tris-HCl缓冲液 (pH 8.5)配制的可溶性淀粉溶液(2 g/dL)的试管中,充分混匀,在50℃反应30min后,沸水浴10 min终止反应。用HPLC测定环糊精含量。
酶活力单位(U)定义为:在上述条件下每30 min生成1μmolγ-CD所需的酶量。
2.4 酶解淀粉产物测定
采用HPLC法对酶催化产物进行分析,色谱条件为:Hypersil NH2色谱柱 (4.6 mm×250 mm,5 mAPS-2Hypersil微粒),示差折光检测器 (RID-10A);流动相为70%乙腈水溶液,流量为1mL/min,柱温40℃。
2.5 淀粉相对分子质量测定
分别称取50 mg原淀粉和经4αGTase处理过的淀粉分散于5 mL体积分数90%的DMSO中,沸水浴煮沸1 h使其完全溶解并在室温下磁力搅拌12 h。取1mL经DMSO处理过的淀粉溶液用6mL的无水乙醇沉淀,5 000 r/min离心10 min沉淀淀粉。离心结束后弃上清液,向沉淀物中加入10mL的沸水溶解并在沸水浴中搅拌30min。样品经0.45 μm滤膜过滤,以未经4αGTase处理的玉米淀粉溶液为对照,进行高压体积排阻色谱(HPSEC)色谱分析。ShodexOHpak SB-804 HQ色谱柱和OHpak SB-802.5 HQ色谱柱串联后保持柱温50℃,超纯水作为流动相,流量为1.0 mL/min,进样量为20μL,分析时间为30min。在上述色谱条件下分析的葡聚糖标准样品 (相对分子质量为 9 600,21 100, 107 000,337 000,642 000)用于分子质量标准曲线的制作。
2.6 支链淀粉链长分布测定
分别称取20 mg原淀粉和经4αGTase处理过的淀粉分散于2 mL体积分数90%的DMSO中,沸水浴煮沸1 h使其完全溶解,用4倍体积的无水乙醇沉淀,5 000 r/min离心10min沉淀淀粉。离心结束后弃上清液,向沉淀物中加入2 mL预热的50 mmol/L的醋酸盐缓冲溶液(pH 3.5)使其溶解,再加入50 U/g的异淀粉酶40℃下反应24 h,沸水浴10 min终止反应。10 000 r/min离心10min,取上清液稀释10倍,经0.45μm滤膜过滤后,采用高效阴离子交换色谱(HPAEC)法测定链长分布。
色谱柱型号:CarboPacPA200,检测器为安培脉冲检测器;温度:25℃;流量:0.5 mL/min,流动相A为0.15 mol/L NaOH溶液,流动相B为0.15 mol/L NaOH和0.5mol/L醋酸钠混合液,采用梯度洗脱,程序为:体积分数60%流动相A+40%流动相B保持2 min,体积分数50%流动相A+50%流动相B保持8 min,体积分数40%流动相A+60%流动相B保持30 min,体积分数20%流动相A+80%流动相B保持20 min[20]。
2.7 酶的添加顺序对γ-CD产率的影响
采用同时加酶及先后加酶两种方式。配制质量分数5%的玉米淀粉溶液 (溶解于pH 8.5的Tris-HCl缓冲液中),电炉煮沸糊化10 min,冷却至反应温度。对于先后加酶的方式:向冷却后的淀粉溶液中分别加入一定量的4αGTase,充分混匀后在70℃、800 r/min下振荡反应24 h,反应结束后沸水浴30min灭酶,待溶液温度冷却至50℃左右时,向溶液中加入CGTase反应24 h。对于同时加酶的方式:向淀粉溶液中同时加入一定量的 4αGTase和CGTase,在不同温度下反应一定的时间。上述反应结束后,取样500μL,沸水浴10 min灭酶,10 000 r/min离心15 min除去变性的酶蛋白和未反应的淀粉,上清液经0.45μm滤膜过滤后取20μL进行HPLC分析。
2.8 单因素试验
对先后加酶方式进行单因素实验。首先对4αGTase的添加量进行了单因素实验,然后分别探讨了CGTase的添加量、反应时间及底物浓度对对γ-CD产率的影响,此时4αGTase加酶量为4 U/g淀粉,反应温度为70℃,反应时间为24 h。
2.8.1 4αGTase添加量对对γ-CD产率的影响 向以5%的淀粉为底物中分别加入1、2、4、8、16 U/g淀粉的4αGTase,70℃反应24 h后,加入8 U/g淀粉的CGTase,50℃反应24 h后进行产物分析。
2.8.2 CGTase添加量对γ-CD产率的影响 向以5%的淀粉为底物且经4αGTase反应后的溶液中加入CGTase,加入量分别为0.05、1、2、8、10 U每克淀粉,50℃反应24 h后进行产物分析。
2.8.3 CGTase反应时间对γ-CD产率的影响 向以5%的淀粉为底物且经4αGTase反应后的溶液中加入 8 U/g淀粉的 CGTase,50℃反应 2、5、8、11、24、30 h后对产物进行分析。
2.8.4 底物质量分数对γ-CD产率的影响 向以质量分数1%、3%、5%、10%、15%的淀粉为底物且经4αGTase反应后的溶液中加入 8 U/g淀粉的CGTase,50℃反应24 h后对产物进行分析。
2.9 正交试验
在单因素试验的基础上,采用L9(34)正交表对底物浓度,4αGTase添加量,CGTase添加量和CGTase反应时间进行优化,以γ-CD得率为评定指标,试验因素水平表见表1。
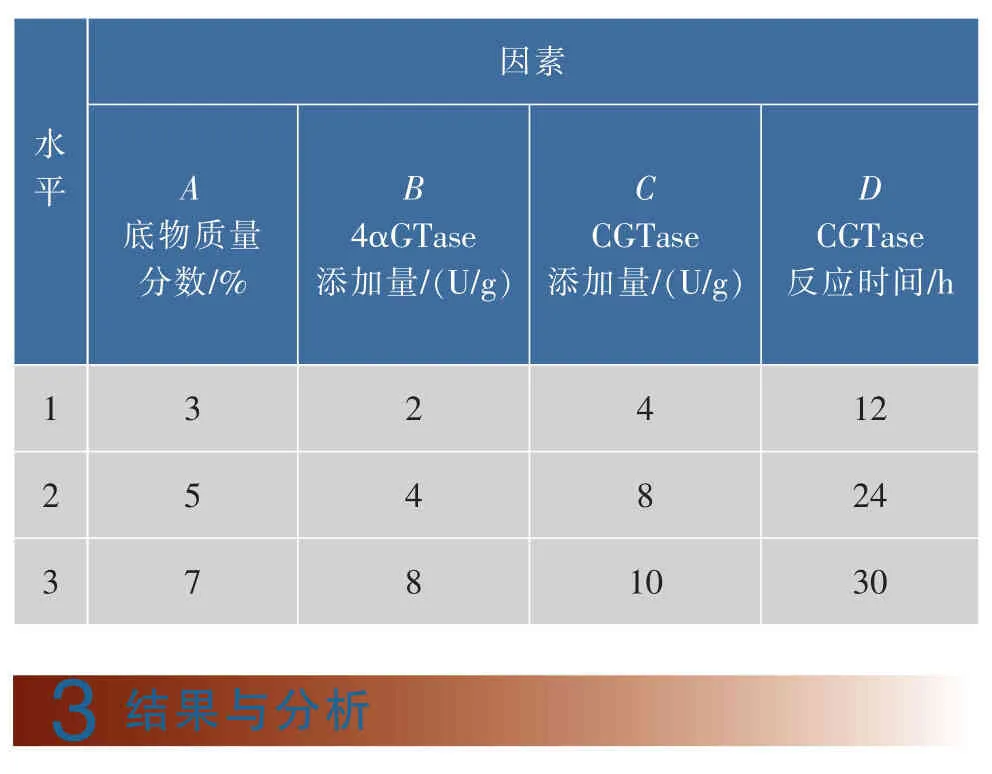
表1 正交试验因素与水平设计表Table 1 Design table of factor and level in orthogonal test
3.1 酶的添加顺序对γ-CD产率的影响
由图1可知:先加入4αGTase预处理淀粉后再加入CGTase这种先后加酶的方法所制备γ-CD的产率显著优于两种酶同时加入的方式,并且两种酶协同作用所产γ-CD的产率均显著高于对照组;当加入 4 U/g的 4αGTase时,γ-CD的产率最高为10.43%,比对照组多41.71%。
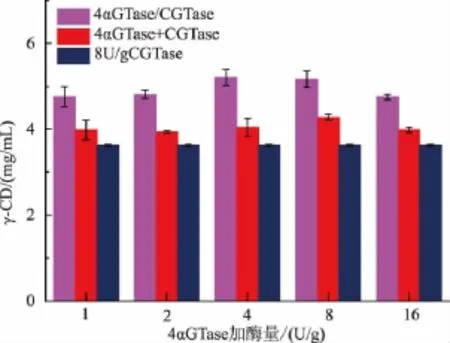
图1 酶的添加顺序对γ-CD产率的影响Fig.1 Effect of the adding sequence of enzymes on theγcyclodextrinyiled
推测造成这一现象的原因可能是因为加入4αGTase在70℃对淀粉预处理后淀粉的相对分子质量和结构发生了变化,使得经4αGTase处理后的淀粉比原淀粉更适合作为CGTase进一步反应的底物[21]。为验证这一推测,研究了普通玉米淀粉经4αGTase酶解后淀粉相对分子质量和分子结构的变化,结果如图2、图3所示。经测定未经处理的普通玉米淀粉的重均相对分子质量M w为3.36×107,而淀粉经4αGTase酶解10 h之后的重均相对分子质量M w为4.75×105,随着酶解时间延长为24 h淀粉重均相对分子质量M w变为2.35×105,而将这3种相对分子质量的淀粉作为底物,再经CGTase催化所得γ-CD的产率分别为7.26%、9.38%、10.43%。并且由图3可知,随着4αGTase酶添加量的增加,支链淀粉的A链(DP<12)、B2(DP 25-36)、B3链(DP>36)的相对含量都增加,而将这3种结构的淀粉作为底物,再经CGTase催化所得γ-CD的产率分别为9.52%、10.43%、10.34%。该结果表明,玉米淀粉经4αGTase作用后的分子大小及分子结构更适于作为CGTase的催化底物。
3.2 4αCGTase添加量对γ-CD产率的影响
由表2可以看出,随着 4αGTase添加量的增加,γ-CD的产率先上升后下降,4αGTase加入量为4 U/g时γ-CD的产率达到最高。原因可能是过多的4αGTase作用淀粉之后所产生的较小分子量的物质不适于作为CGTase的最佳底物。
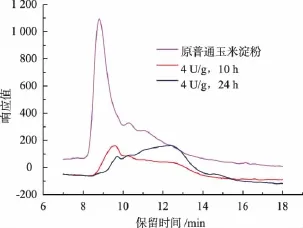
图2 普通玉米淀粉经4通GTase酶解前后相对分子质量分布图Fig.2 M olecular weight distribution of nativeand 4nGTase-treated corn starch

图3 普通玉米淀粉经4αGTase酶解前后支链淀粉链长分布图Fig.3 Chain length distribution ofnativeand 4αGTasetreated corn starch
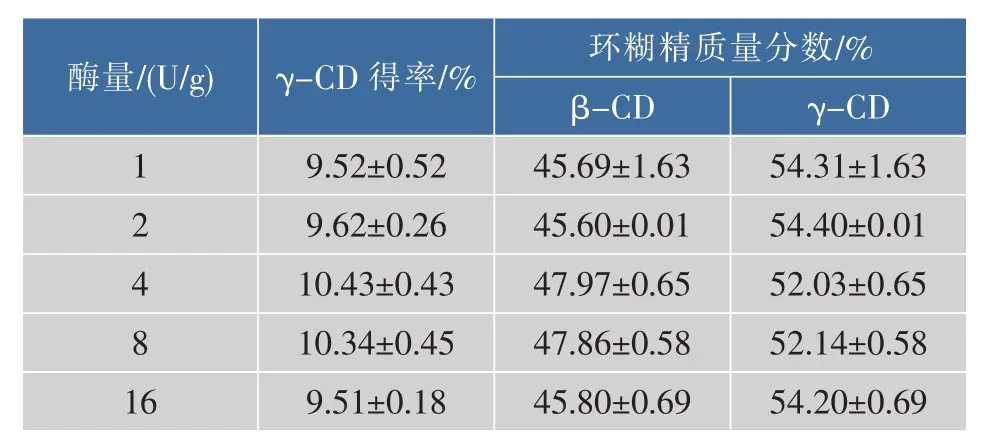
表2 4αGTase加酶量对γ-CD产率的影响Table 2 Effect of the amount of 4-α-glucosyltransferase on theγ-cyclodextrinyiled
3.3 CGTase添加量对γ-CD产率的影响
由表3可知,γ-CD的得率随着CGTase添加量的增加呈先上升后下降的趋势,当CGTase添加量为8 U/g时,γ-CD的得率达到最大,为11.93%;并且随着加酶量继续增加,不仅γ-CD的得率下降,而且γ-CD所占的百分比也减少,β-环糊精所占百分比增加。引起这一现象的原因可能是产生的γ-CD进一步被CGTase催化转化为β-CD或其他小分子低聚糖所致。
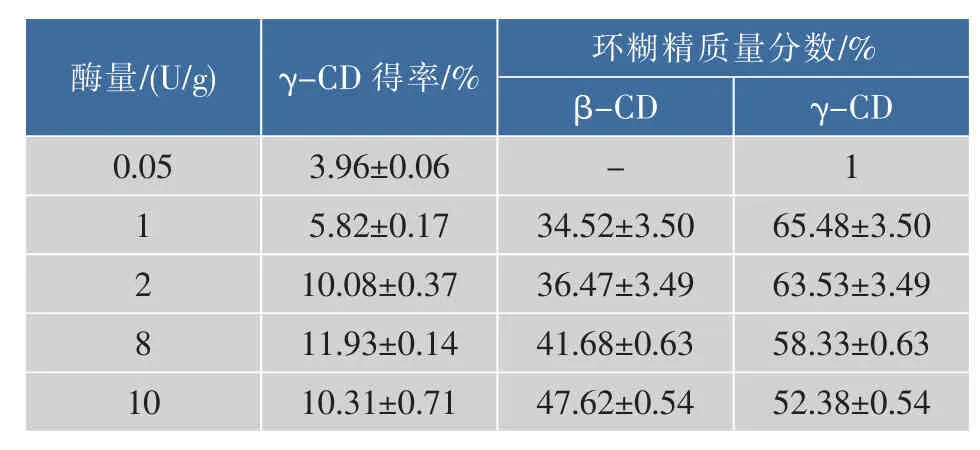
表3 CGTase加酶量对γ-CD产率的影响Table 3 Effect of the amount of cyclodextrin glucosyl trans ferase on theγ-cyclodextrinyiled
3.4 CGTase反应时间对γ-CD产率的影响
由图4可知,γ-CD的得率随着反应时间的增加呈先增加后下降的趋势,当反应24 h时γ-CD的得率最高,为11.83%,因此确定CGTase的最佳反应时间为24 h。
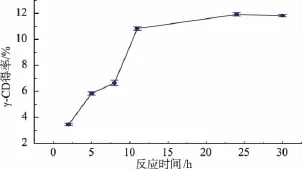
图4 反应时间对γ-CD产率的影响Fig.4 Effectof the reaction timeon theγ-cyclodextrinyiled
3.5 底物浓度对γ-CD产率的影响
由图5可知,随着反应底物质量分数的增加,γ-CD的得率呈现先增加后下降的趋势。当反应底物质量分数增加到5%时,γ-CD的得率最高,为10.43%;随着淀粉质量分数的进一步增加,γ-CD得率迅速下降。造成这一现象的原因可能有:随着底物质量分数从5%增加到15%,玉米淀粉的粘度增大,导致流动性变差,底物和酶分子之间无法充分相互接触,从而使得反应速率降低;其次是高浓度的底物,使得多个底物分子占据酶蛋白的部分活性位点,形成无效的中间产物,从而抑制了酶活性;此外,体系中较高质量分数的小分子物质将抑制CGTase的环化作用,增强其偶合和歧化作用,从而降低γ-CD的得率。
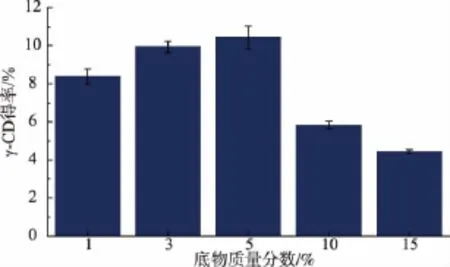
图5 底物质量分数对γ-CD产率的影响Fig.5 Effect of the substrate concentration on γcyclodextrin yield
3.6 正交试验结果
按照表1的设计进行正交试验,结果如表4所示。根据极差R的大小,由直观分析可知各因素对γ-CD产率影响的大小顺序为C(CGTase添加量)>A(底物浓度)>D(CGTase反应时间)>B(4αGTase添加量),最佳工艺为A2B2C2D3,即底物质量分数5%、4αGTase添加量 4 U/g、CGTase添加量 8 U/g、CGTase反应时间30 h。按照方案A2B2C2D3进行验证试验,γ-CD的产率为12.83%,比单酶法制备γ-CD产率提高了76.7%。
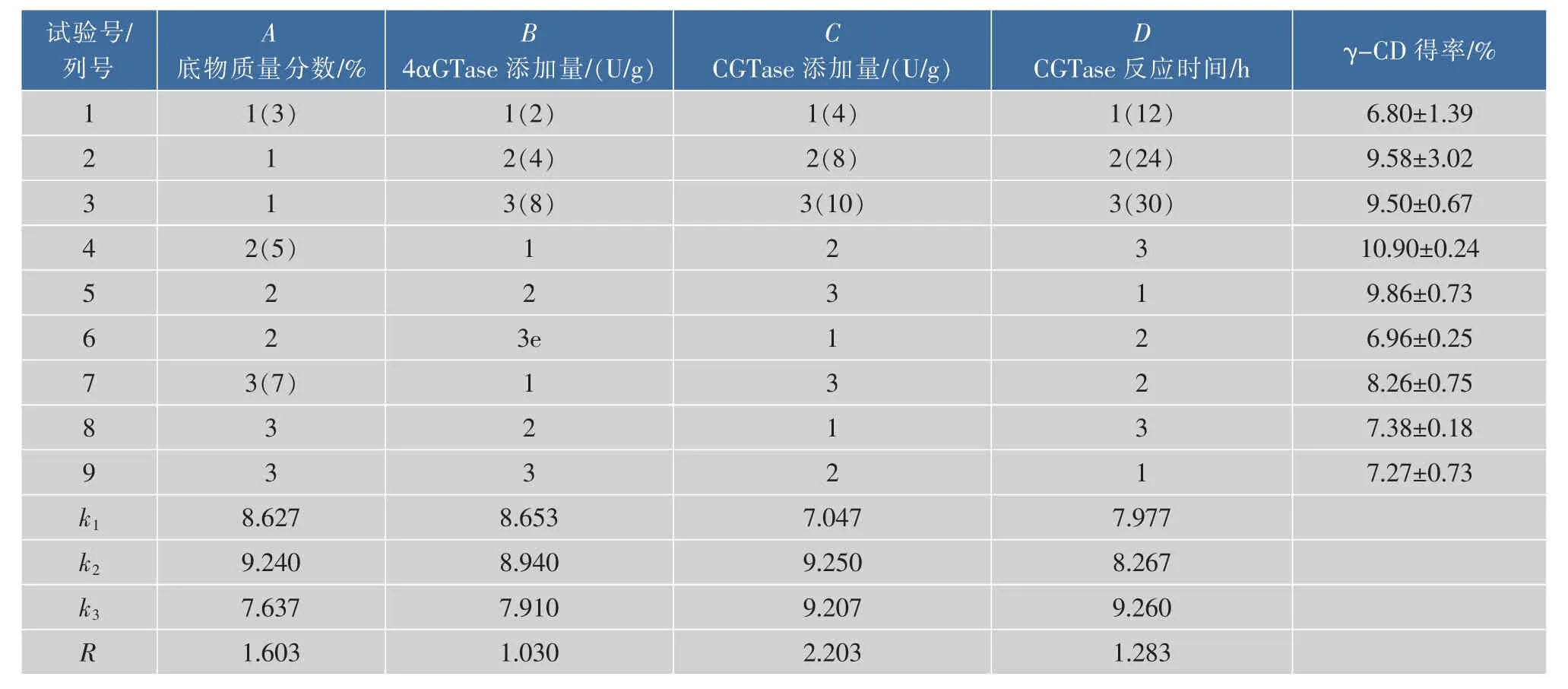
表4 正交试验结果Table 4 ResuLts of the orthogonal test
4 结语
通过4αGTase和CGTase双酶修饰淀粉,研究了其对γ-CD得率的影响。发现双酶法能够显著提高γ-CD的得率,双酶的添加顺序为先加入4αGTase,再加入CGTase;反应条件为底物质量分数5%,4αGTase添加量4 U/g淀粉,CGTase添加量8 U/g淀粉,反应时间30 h,在此条件下γ-CD的得率为12.83%,比单酶法制备γ-CD的得率提高了76.7%。
[1]FREUDENBERG K,CRAMER F.Notizen:Die Konstitution der Schardinger-Dextrineα,βandγ [J].Zeitschrift für Naturforschung B,1948,3(11-12):464-466.
[2]金征宇,徐学明,陈寒青,等.环糊精化学-制备与应用[M].北京:化学工业出版社,2005:1-35.
[3]LIZ,WANGM,WANG F,etal.γ-Cyclodextrin:a review on enzymatic production and applications[J].Applied M icrobiology and Biotechnology,2007,77(2):245-255.
[4]KIRK O,BORCHERT TV,FUGLSANG CC.Industrialenzyme applications[J].Current Opinion in Biotechnology,2002,13(4):345-351.
[5]GOH K M,MAHADINM,HASSAN O,etal.The effectsof reaction conditionson the production ofγ-cyclodextrin from tapiocastarch by using a novel recombinant engineered CGTase[J].Journal of M olecuLar Catalysis B:Enzymatic,2007,49(1):118-126.
[6]WANG F,DU G,LIY,etal.Optim ization of cuLtivation conditions for the production ofγ-cyclodextrin glucanotransferase by Bacillusmacorous[J].Food Biotechnology,2005,18(2):251-264.
[7]BIWER A,ANTRANIKIAN G,HEINZLE E.Enzymatic production of cyclodextrins[J].App lied M icrobiology and Biotechnology,2002,59(6):609-617.
[8]FUJITA Y,TSUBOUCHIH,INAGIY,et al.Purification and properties of cyclodextrin glycosyltransferase from Bacillus sp. AL-6[J].Journal of Fermentation and Bioengineering,1990,70(3):150-154.
[9]BENDER H.An improved method for the preparation of cyclooctaamylose,using starches and the cyclodextrin glycosyltransferase of K lebsiella pneumoniaeM 5 al[J].Carbohydrate Research,1983,124(2):225-233.
[10]RENDLEMAN JA.Enhanced production of cyclomaltooctaose (γ-cyclodextrin)through selective complexation w ith C 12 cyclic compounds[J].Carbohydrate Research,1992,230(2):343-359.
[11]CHAROENLAPN,DHARMSTHITIS,SIRISANSANEEYAKUL S,et al.Optimization of cyclodextrin production from sago starch[J].Bioresource Technology,2004,92(1):49-54.
[12]PEDERSEN S,DIJKHUIZEN L,DIJKSTRA BW,etal.A betterenzyme for cyclodextrins[J].Chem tech,1995,25(12):19-25.
[13]STARNESR L.Thermostable cyclodextrin glycosyl transferase and processesusing it:U.S.Patent6,184,001[P].2001-2-6.
[14]PISHTIYSKII,ZHEKOVA B.Effectof differentsubstratesand their preliminary treatmenton cyclodextrin production[J].World Journal of M icrobiology and Biotechnology,2006,22(2):109-114.
[15]RENDLEMAN J A.Enhancement of cyclodextrin production through use of debranching enzymes[J].Biotechnology and Applied Biochem istry,1997,26(1):51-61.
[16]POHU A,PUTAUX JL,PLANCHOTV,etal.Origin of the limitedα-amylolysis of debranchedmaltodextrins crystallized in the A form:A TEM study onmodelsubstrates[J].BiomacromolecuLes,2004,5(1):119-125.
[17]ZHENGM,ENDO T,ZIMMERMANNW.Enzymatic synthesisand analysisof large-ring cyclodextrins[J].Australian Journal of Chem istry,2002,55(2):39-48.
[18]JI Xuexia,WANG Jinpeng,XU Xuem ing,et al.Purification and properties of 4-a-glucanotransferase producing large-ring cyclodextrin[J].Journal of Food Science and Biotechnology,2010,29(3):336-41.(in Chinese)
[19]MARTINS R F,HATTI K R.A new cyclodextrin glycosyltransferase from an alkaliphilic Bacillus agaradhaerens isolate:purification and characterisation[J].Enzyme and M icrobial Technology,2002,30(1):116-124.
[20]CAIL,SHIY C.Structure and digestibility of crystalline short-chain amylose from debranched waxy wheat,waxy maize,and waxy potato starches[J].Carbohydrate Polymers,2010,79(4):1117-1123.
[21]YOSHINAO I,NOBUHIRO H,KAZUMASA S.Process forproducing cyclodextrins:Japan,Patent168295.1[P].1989.
γ-CD Catalyzed from M aize Starch by Dual Enzymatic Reaction
LILinlin1,2, ZHANGMengke1,2, JIN Zhengyu1,2, WANG Lihua1,2, WANG Jinpeng*1,2
(1.State Key Laboratory of Food Science and Technology,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi214122,China)
Theconjunction of4α-glycosyltransferase(4αGTase)w ith cyclodextringlycosyltransferase(CGTase)were screened for their ability ofproducingγ-cyclodextrin(CD)usingmaize starch as substrate.The studies on the influence factors showed that4αGTase should be added first,followed byCGTase.The optimal conditions forγ-CD production was as follow ing:4U of 4αGTase and 8U ofCGTasepergram ofsubstratewereused to convertmaizestarch(5%,w/v)intoγ-CDw ith the reaction time of30 h.the subsequentyield ofγ-CD was12.83%,whichwas76.7%higher than the control.This studyhaspotentialvalue for theindustrialproductionofγ-CD.
4α-glycosyltransferase,cyclodextringlycosyltransferase,γ-cyclodextrin,maizestarch
TS 236.9
A
1673—1689(2017)04—0357—07
2015-05-15
国家自然科学基金项目 (31230057,31401524);江苏省自然科学基金项目 (BK20140143);江苏省科技支撑计划项目(BE2013311)。
*通信作者:王金鹏(1984—),女,河南开封人,副教授,主要从事碳水化合物资源开发与利用研究。E-mail:jpwang1984@jiangnan.edu.cn
李林林,张梦柯,金征宇,等.双酶法催化玉米淀粉制备γ-CD[J].食品与生物技术学报,2017,36(04):357-363.
