建立良参胃安片质量控制方法的研究
2017-05-15朱燕曹恩惠李明春
朱燕,曹恩惠,李明春
建立良参胃安片质量控制方法的研究
朱燕,曹恩惠,李明春*
目的建立完善的良参胃安片质量控制方法。方法采用显微镜对制剂中以原粉入药药味吴茱萸、姜半夏进行显微鉴别;采用薄层色谱方法(TLC)对制剂中所含主要成分黄芩、延胡索、香附、乌药、丹参、郁金进行定性鉴别,采用高效液相色谱法(HPLC)对制剂中黄芩苷进行含量测定:Agilent XDB-C18(4.6 mm×250 mm,5 μm);甲醇-0.2%磷酸溶液(43∶57);流速:1.0 ml/min;检测波长:280 nm;柱温:30℃;进样量:10 μl,理论塔板数按黄芩苷峰计算应不低于2500。结果显微鉴别中,各供试品的显微特征与相应药味相符;在薄层色谱中,各供试品色谱与对照药材或对照品相应位置上显相同颜色的斑点,且阴性对照无干扰;黄芩苷在10.42~104.2 μg/ml范围内有良好的线性关系。结论该方法操作简单,重复性好,能够有效地控制良参胃安片的质量。
良参胃安片;质量标准;黄芩苷;高效液相色谱法;薄层鉴别
良参胃安片收载于《中国人民解放军医疗机构制剂规范》(2002年版),该制剂是由姜半夏、枳实、吴茱萸(炒)、香附、乌药、土茯苓、高良姜、郁金、儿茶、丹参、百合、延胡索、黄芩13味药材制成,具有温中散寒、理气活血、疏肝和胃的功效;用于慢性胃炎、消化性溃疡等症。为提高质量标准,本文在原标准的基础上增加鉴别项的同时尽量替换掉原质量标准中的易制毒试剂,以减少对环境的污染和对操作人员的毒害;增加原粉入药药味的显微鉴别和主要药味的含量测定项,最终达到检测方法简便、快速、准确、低毒的目的,为制剂质量的安全性和有效性提供更有力的监督和保障。
1 材料
1.1 仪器电热恒温水浴锅(上海梅香仪器有限公司);KDM型可调控温电热套(山东鄄城华鲁电热仪器有限公司);电热恒温鼓风箱(上海申贤恒温设备厂);紫外分析仪WD-9340C型(北京六一仪器厂);超声波仪SY2200-T(上海声源超声仪器设备有限公司);PH100-DB500U型摄影显微镜(凤凰光学集团有限公司);安捷伦1260高效液相色谱仪;硅胶G薄层板、硅胶GF254板(青岛海洋化工厂分厂)。
1.2 试药黄芩苷对照品(批号110715-201318;含量93.3%;20 mg)、延胡索乙素对照品(批号110726-201515,含量96.9%,20 mg)、辛弗林对照品(批号110727-201107;含量99.4%;20 mg)、黄芩对照药材(批号120955-201309)、延胡索对照药材(批号120928-201208)、乌药对照药材(批号121096-201405)、香附对照药材(批号121059-201407)、丹参对照药材(批号120923-201414)、郁金对照药材(批号120949-201407),购于中国食品药品检定研究院;良参胃安片样品(海军401医院);阴性样品均为本院自制;10%水合氯醛;甲醇(天津四友,一级色谱纯);水为自制蒸馏水;其他试剂均为分析纯。
2 方法与结果
2.1 显微鉴别
2.1.1 吴茱萸的显微鉴别取本品10片,研细粉,水合氯醛透化装片,置显微镜下观察可见:网纹导管,环纹导管或螺纹导管;油室碎片及油滴;非腺毛较多;螺纹导管和草酸钙簇晶;纤维状内果皮细胞,有时上下层交错,或分化成短纤维状细胞;腺毛头部近椭圆形,含黄棕色分泌物;果皮组织或花丝细胞含橙皮苷结晶;黏液细胞类圆形或长圆形。结果见图1。
2.1.2 姜半夏的显微鉴别取本品10片,研细粉,水合氯醛透化装片,置显微镜下观察可见:糊化的淀粉粒团块;针晶束;螺纹导管。结果见图2。

图1 吴茱萸的显微鉴别图

图2 姜半夏显微鉴别图
2.2 定性鉴别
2.2.1 黄芩的薄层鉴别[1-4]取本品研细称取3 g,加甲醇10 ml,超声15 min,滤过,挥干,残渣加30 ml水溶解,加稀盐酸调pH值到1~2,用乙酸乙酯提取2次,10 ml/次,合并提取液蒸干,加1 ml甲醇使溶解,制成供试品溶液。另取黄芩对照药材1 g同法制得对照药材溶液。再取黄芩苷对照品,加甲醇制成每1 ml含1 mg的溶液,作为对照品溶液。取缺黄芩的阴性对照样品3 g,按供试品溶液的制备方法制备阴性对照溶液。参照薄层色谱法(《中国药典》2015年版四部通则0502)试验,分别吸取上述4种溶液在同一硅胶G薄层色谱板上上样,以乙酸乙酯∶丁酮∶甲酸∶水=5∶3∶1∶1为展开剂,展开完毕后取出薄层色谱板,晾干,均匀喷以FeCl3-乙醇溶液加热至约105℃显色。供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。结果见图3(a)。
2.2.2 延胡索的薄层鉴别[5-7]取本品研细称取3 g,加甲醇50 ml,超声30 min,滤过,滤挥干,残渣加10 ml水溶解,再加氨水调溶液pH值至碱性后用10 ml乙酸乙酯萃取,重复3次,合并乙酸乙酯提取液,挥干,残渣加1 ml甲醇溶解,制成供试品溶液。取延胡索对照药材1 g,同法制得延胡索对照药材溶液。取缺少延胡索药材的阴性对照样品3 g,同法制得延胡索阴性对照溶液。参照薄层色谱法(《中国药典》2015年版四部通则0502)试验,分别吸取上述3种溶液在同一硅胶G薄层色谱板上上样,以石油醚∶丙酮=3∶1溶液为展开剂(其中石油醚60~90℃),展开完毕后取出薄层色谱板,晾干后置碘缸中,3 min后取出薄层色谱板待吸附碘挥尽,在紫外灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。结果见图3(b)。
2.2.3 香附的薄层鉴别[8-10]取本品研细称取3 g,加甲醇30 ml,超声30 min,滤过,挥干,残渣加1 ml甲醇溶解,作为供试品溶液。称取香附对照药材1 g,同法制得对照药材溶液。称取缺少香附药材的阴性对照样品3 g,同法制得阴性对照溶液。参照薄层色谱法(《中国药典》2015年版四部通则0502)试验,分别吸取上述3种溶液在同一硅胶G254薄层色谱板上上样,以二氯甲烷∶乙酸乙酯∶冰醋酸=80∶3∶1溶液为展开剂,展开完毕后取出薄层色谱板,晾干后置紫外灯(254 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。结果见图3(c)。
2.2.4 乌药的薄层鉴别[11-13]取本品研细称取3 g,加甲醇20 ml,超声10 min,滤过,挥干,残渣加1 ml乙酸乙酯溶解,作为供试品溶液。取乌药对照药材1 g,同法制得对照药材溶液。取缺少乌药药材的阴性对照样品3 g,同法制得阴性对照溶液。参照薄层色谱法(《中国药典》2015年版四部通则0502)试验,分别吸取上述3种溶液在同一硅胶G薄层色谱板上上样,以环己烷∶乙酸乙酯=5∶1溶液为展开剂,展开完全后取出薄层色谱板,晾干,均匀喷以5%香草醛硫酸溶液微热至显色。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。结果见图3(d)(注意样品溶液需新鲜配制使用)。
2.2.5 丹参的薄层鉴别[14,15]取本品研细称取3 g,加水10 ml,离心后取其上层清液加稀盐酸溶液调溶液pH值到2,再加乙酸乙酯20 ml萃取,待萃取完全后取乙酸乙酯层水浴蒸干,残渣加1 ml甲醇溶解,作为供试品溶液。称取丹参对照药材1 g,同法制得对照药材溶液。称取缺少丹参药材的阴性对照样品3 g,同法制得阴性对照溶液。参照薄层色谱法(《中国药典》2015年版四部通则0502)试验,分别吸取上述3种溶液在同一硅胶G薄层色谱板上上样,以二氯甲烷∶丙酮∶甲酸=25∶10∶4溶液为展开剂,展开完全后取出薄层色谱板,晾干后用氨气熏约5 min,置紫外灯(365 nm)下检视。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。结果见图3(e)。
2.2.6 郁金的薄层鉴别[16,17]取本品研细称取3 g,加入无水乙醇25 ml,超声30 min,滤过,挥干,残渣加无水乙醇1 ml溶解,作为供试品溶液。称取郁金对照药材1.5 g,同法制得对照药材溶液。称取缺郁金的阴性对照样品3 g,同法制得阴性对照溶液。参照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取上述3种溶液,分别在同一硅胶G薄层板上上样,以二氯甲烷-甲醇-醋酸=9∶1∶0.1溶液为展开剂,展开完全后取出,晾干,喷以10%磷钼酸溶液,105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的斑点,阴性对照无干扰。结果见图3(f)。
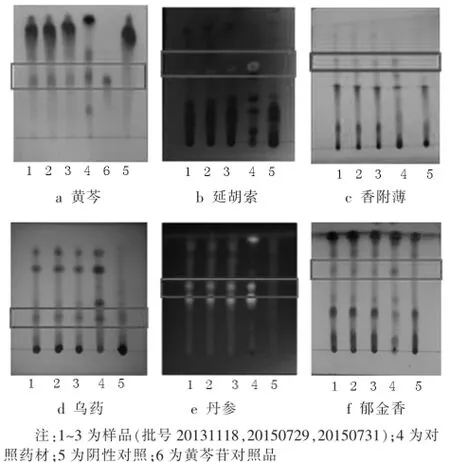
图36 种成分的博层鉴别图
2.3 黄芩苷的含量测定
2.3.1 色谱条件系统适应性试验[1,18-20]高效液相色谱仪:Agilent 1260;DAD检测器;四元泵;色谱柱:Agilent XDB-C18(4.6 mm×250 mm,5 μm);流动相:甲醇-0.2%磷酸溶液(43∶57);流速:1.0 ml/min;检测波长:280 nm;柱温:30℃;进样量:10 μl。理论塔板数按黄芩苷峰计算应不低于2500。
2.3.2 溶液的制备(1)对照品溶液制备。精密称取黄芩苷对照品11.17 mg,加70%甲醇溶解并定容,摇匀即得黄芩苷对照品贮备液(208.4 μg/ml)。依次精密吸取对照品贮备液(208.4 μg/ml)0.5、1.0、2.0、2.5、3.5、4.0、5.0 ml,分别放置带有标记的10 ml容量瓶中并用70%甲醇稀释至刻度,所得浓度分别为10.42、20.84、41.68、52.10、72.94、83.36、104.2 μg/ ml的1~7号系列黄芩苷对照品溶液。(2)供试品溶液制备。精密称取良参胃安片粉末0.3 g,精密加入70%甲醇50 ml,称重,超声处理(功率100 W,频率50 Hz)30 min,放冷,加入70%甲醇补足重量,摇匀,微孔滤膜滤过,取续滤液即为供试品溶液。(3)阴性对照溶液制备。取缺黄芩的阴性样品0.3 g,按照供试品溶液的制备方法制得阴性对照溶液。
2.3.3 专属性试验取“2.3.2”项下对照品溶液、良参胃安片供试品溶液、缺黄芩的阴性对照溶液各10 μl,分别按上述色谱条件测定,记录色谱峰。结果黄芩苷的保留时间在17 min左右,样品峰与其他组分良好分离,阴性对照对黄芩苷的检测无干扰。结果见图4。
2.3.4 线性关系考察精密吸取“2.3.2”项下的1~7号黄芩苷对照品溶液10 μl注入色谱仪,按“2.3.1”项下色谱条件分析。以峰面积(Y)为纵坐标,进样浓度(X)为横坐标,绘制标准曲线,得黄芩苷回归方程为:Y=24.75X-7.358,r=0.9999(n=7)。结果表明,黄芩苷在10.42~104.2 μg/ml范围内有良好的线性关系。
2.3.5 精密度试验吸取“2.3.2”项下3号黄芩苷对照品溶液(黄芩苷浓度为41.68 μg/ml)10 μl,注入色谱仪,重复进样6次,测定其峰面积,结果RSD为0.13%。表明仪器精密度良好。
2.3.6 重复性试验精密称取良参胃安片(批号20131118)粉末6份,每份约0.3 g,按“2.3.2”项下方法,分别制备供试品溶液,进样10 μl,测定峰面积,结果RSD为0.93%,表明方法重复性良好。
2.3.7 稳定性试验精密取2.3.6项下1号供试品溶液分别于0、2、4、6、10、12 h各进样一次,按上述色谱条件进行HPLC分析。根据所得待测成分的峰面积计算RSD为1.3%,结果表明供试品溶液在12 h内稳定性良好。

图4 黄芩苷含量测定HPLC色谱图
2.3.8 加样回收试验精密称取9份良参胃安片(批号20131118,黄芩苷含量为7.02 mg/g)粉末9份,每份约0.15 g,分别加入2.3项下1号对照品贮备液(黄芩苷含量为208.4 μg/ml)4.0、5.0、6.0 ml,每一浓度平行制备3份,按“2.3.2”项下供试品溶液制备方法制成供试品溶液,并照上述色谱条件测定,根据测得量和加入量,计算各待测成分的加样回收率,结果见表1。
2.3.9 含量测定分别取不同批次的良参胃安片片适量,研细,每批次取粉末3份,每份0.3 g,按照“2.3.2”项下方法制备供试品溶液,依法进行含量测定,结果见表2。

表1 黄芩苷加样回收率试验结果(n=9)

表2 十批样品的含量测定结果
3 讨论
良参胃安片的原质量标准中没有显微鉴别,本研究中增加了吴茱萸、姜半夏的显微鉴别。
在鉴别试验中增加了黄芩、延胡索、香附、乌药、丹参、郁金的薄层鉴别。黄芩原药材鉴别的展开系统含有甲苯,为了降低毒害影响,修订参考相关文献,选用乙酸乙酯-丁酮-甲酸-水(5∶3∶1∶1)为展开剂,斑点分离度良好。延胡索原药材鉴别的展开系统含有甲苯,为了降低毒害影响,修订用石油醚(60~90℃),斑点分离度良好。香附原药材鉴别的提取液由乙醚改用甲醇,降低毒害影响。乌药原药材鉴别的展开剂将含有甲苯的展开剂环己烷-乙酸乙酯(15∶1),斑点分离度良好。丹参原药材鉴别的提取液由乙醚改为乙酸乙酯,降低提取液的毒性。郁金原药材鉴别的展开系统斑点分离度不好,选用二氯甲烷-甲醇-醋酸(9∶1∶0.1)为展开剂,斑点分离度良好。
黄芩作为良参胃安片的主要药味之一,在原质量标准中没有进行含量测定,该研究中增加了黄芩中主要有效成分黄芩苷的含量测定。根据参考文献,研究中对流动相比例、供试品提取方法、提取时间、提取溶剂的用量等条件进行了调整和对比,最终确定了本实验中的色谱条件和供试品提取条件。
[1]国家药典委员会.中华人民共和国药典:一部[M].2015版.北京:中国医药科技出版社,2015:301.
[2]高永丰,马艳玲,赵永亮,等.黄芩薄层色谱鉴别研究[J].北方药学,2013,10(2):6.
[3]金星,张清波.肺力咳合剂质量标准的研究[J].中国药品标准,2012,13(2):95-98.
[4]王国栋,姜林,赵翡翠.麻白化痰颗粒的薄层定性质量标准研究[J].中国医院用药评价与分析,2014,14(4):314-316.
[5]国家药典委员会.中华人民共和国药典:一部[M].2015版.北京:中国医药科技出版社,2015:139-140.
[6]冯果,张石宁,宦翠翠.健脾温胃胶囊的薄层色谱研究[J].贵阳中医学院学报,2014,4(36):27-29.
[7]王彦青.延胡索不同炮制方法的薄层鉴别对比研究[J].中国医药指南,2014,4,12(11):50-51.
[8]国家药典委员会.中华人民共和国药典:一部[M].2015版.北京:中国医药科技出版社,2015:258.
[9]李培毅,冯玛莉,牛艳艳,等.舒胃胶囊质量标准研究[J].中成药,2004,12(26):1021-1024.
[10]肖薇,黄健,李洋,等.颈椎康复丸质量标准研究[J].中国中医药信息杂志,2012,19(8):59-60.
[11]国家药典委员会.中华人民共和国药典:一部[M].2015版.北京:中国医药科技出版社,2015:77-78.
[12]牟娟,张胜玉.不同产地乌药的质量研究[J].云南中医药杂志,2013,34(9):62-63.
[13]康云鹰,谢国芳.缩泉丸质量标准研究[J].亚太传统医药,2010,3(6):42-43.
[14]国家药典委员会.中华人民共和国药典:一部[M].2015版.北京:中国医药科技出版社,2015:76-77.
[15]曾振兴,顾雪竹.心安宁胶囊质量标准研究[J].中国试验方剂学杂志,2011,17(9):87-89.
[16]国家药典委员会.中华人民共和国药典:一部[M].2015版.北京:中国医药科技出版社,2015:208.
[17]朱晶晶,账清哲,王智民,等.郁金质量标准研究[J].中国中医杂志,2010,35(8):2106-2108.
[18]王光玲,孟建国,侯建平.陕西产黄芩HLPC指纹图谱研究[J].陕西中医学院学报,2014,37(2):88-91.
[19]王丹,张秋燕,徐风,等.中药黄芩HLPC指纹图谱的化学轮廓及其影响因素的研究[J].中国医学导报,2013,10(5):96-102.
[20]刘素丽,赵胜男,李守拙.相同产地黄芩HPLC指纹图谱研究[J].承德医学院院报,2013,4(30):283-285.
[2016-10-17收稿,2016-11-15修回][本文编辑:刘一洋]
Study on completing quality control method of Liangshenweian tablet
ZHU Yan,CAO En-hui,LI Mingchun.
Department of Pharmacy,No.401 Hospital of PLA Navy,Qingdao,Shandong 266000,China
ObjectiveTo establish the complete quality standard control methods for Liangshenweian tablet.MethodsThe main components of the preparation,Fructus evodiae,Pinelliae rhizome were identified by microscope,and other main components,Radix scutellariae,Rhizoma corydalis,Cyperus rotundus,Lindera aggregate,Salvia miltrorrhiza,Radix curcumae were identified by TLC.The assay of baicalin was determined by HPLC:Agilent XDB-C18(4.6 mm×250 mm,5 μm),mobile phase:methanol-0.2%phosphoric acid solution(43∶57),flow rate:1.0 ml/min,detection wavelength:280 nm,column temperature:30℃,injection volume:10 μl.According to the peak areaofbaicalin,thenumberoftheoreticalplatesshouldbehigherthan2500.ResultsInmicroscopic identification,the cell shapes were consistent with that of the main components respectively.The samples displayed the same spots and colour which were as the same Rf values as the reference substance by TLC,with no interference from negative control.Baicalin had good linear correlation in the range of 10.42-104.2 μg/ml. ConclusionThe method is simple and repeatable,and can be used for quality control of Liangshenweian tablet.
Liangshenweian tablet;Quality standard;Baicalin;HPLC;TLC
R927.11
A
10.14172/j.issn1671-4008.2017.05.025
266000山东青岛,海军401医院(朱燕,曹恩惠,李明春)
李明春,Email:LMC401y@163.com
