嗅鞘细胞分泌蛋白IGFBP-2对神经干细胞分化的作用
2017-05-15邓裕佳严卫萍滕晓华
邓裕佳,段 答,卓 毅,严卫萍,卢 明,滕晓华
(湖南师范大学第二附属医院,解放军第163医院,长沙 410003)
嗅鞘细胞分泌蛋白IGFBP-2对神经干细胞分化的作用
邓裕佳,段 答,卓 毅,严卫萍,卢 明,滕晓华
(湖南师范大学第二附属医院,解放军第163医院,长沙 410003)
目的:探讨嗅鞘细胞分泌蛋白IGFBP-2在诱导神经干细胞(NSCs)分化过程中的作用。方法:采用新生1 d昆明小鼠嗅球培养嗅鞘细胞(OECs),并制备无血清上清液。C17.2 NSCs置于含10% FBS的DMEM/F12培养基培养,传至第3代,待细胞生长至80%融合时,分别加入OECs无血清上清液(实验组)、H-DMEM/F12培养基(对照组)培养;实验组和对照组均分别加入终浓度为0 ng/mL、125 ng/mL、250 ng/mL、500 ng/mL的IGFBP-2。倒置显微镜下观察诱导后细胞生长情况,于诱导5d后收集各组细胞,行Western blot检测细胞巢蛋白(Nestin)、神经胶质酸性蛋白(GFAP)及β-微管蛋白Ⅲ(TUJ-1),蛋白激酶1/2(ERK 1/2)表达情况,免疫荧光染色鉴定GFAP,TUJ-1阳性细胞并计数,流式分析GFAP,TUJ-1阳性细胞。结果:Western blot、流式分析示对照组中各浓度组GFAP、TUJ-1表达差异无统计学意义;Western blot示实验组随IGFBP-2浓度升高,GFAP表达增多,TUJ-1表达减少,且加入IGFBP-2后ERK1/2表达迅速增多,免疫荧光鉴定表明,随着IGFBP-2浓度升高,GFAP阳性细胞增多,TUJ-1阳性细胞减少,结果有统计学意义。结论:IGFBP-2可以促进OCM诱导NSCs向星形胶质细胞分化,且与浓度呈正相关,其机制与ERK1/2通路有关。
IGFBP-2;神经干细胞;诱导分化;嗅鞘细胞
嗅鞘细胞(olfactory ensheathing cells,OECs)是来源于嗅球和嗅神经层的独特胶质细胞,拥有雪旺氏细胞和星形胶质的共同特征。越来越多的研究表明,OEC可以促进轴突再生、穿越胶质瘢痕、改善损伤处微环境等,而这可能得益于嗅鞘细胞条件培养基(OEC-conditioned medium,OCM)中的诸多分泌蛋白。最近有研究表明,OCM可以促进神经干细胞(neural stem cells,NSCs)向神经元分化[1],但Zhang等人的实验却表明,OCM能抑制NSCs向神经元分化,并促进其向胶质细胞分化[2]。我们猜测这种矛盾可能是由于两个实验中OECs纯度或状态的不同,从而导致OCM中的某种分泌蛋白浓度不同,而这种蛋白的含量变化可能与NSCs分化方向有重要关系。
胰岛素样生长因子结合蛋白-2(insulin-like growth factor binding protein-2,IGFBP-2)与神经系统关系密切,其不仅是IGFBP家族中在中枢神经系统中含量最多的一员,还是成人脑脊液中的主要蛋白[3]。另外,IGFBP-2在各级胶质瘤中均有表达,并随着胶质瘤恶性程度的增加,IGFBP-2的表达水平也随之增加,高级别胶质瘤患者血浆中IGFBP-2浓度远远高于低级别胶质瘤患者和正常人[4]。并且,我们的前期研究表明,OECs可高表达IGFBP-2。因此,我们猜测IGFBP-2在OCM诱导NSCs分化过程中起到重要作用。
为此,本实验通过在无血清培养基和OCM中添加不同浓度的外源性IGFBP-2,观察其对NSCs分化的影响,并验证其可能信号通路。
1 材料与方法
1.1 材料 新生昆明小鼠(出生1 d)10只,雌雄不限,体重3~5 g(中南大学湘雅医学院动物部),达尔伯克改良培养基(Dulbecco’s modified Eagle’s medium,DMEM)(Gibco),胰蛋白酶(Gibco),阿糖胞苷(Arabinofuranosyl Cytidine,Ara-C)(Sigma),多聚赖氨酸(Sigma),胎牛血清(Hyclone),IGFBP-2(R&D),兔抗小鼠巢蛋白(Nestin)一抗(Abcam),ERK1/2一抗(proteintech),p-ERK1/2一抗(Abcam),神经胶质酸性蛋白(GFAP),兔抗小鼠β-微管蛋白Ⅲ(TUJ-1)一抗(Abcam),β-actin一抗(Protein Tech),荧光显微镜(Leica),Quantity One 软件(Bio-Rad),C17.2 NSCs 系由中国科学院药物研究所李佳老师赠予。
1.2 小鼠OECs的分离培养及上清液制备 参考文献方法培养小鼠OECs及制备OCM[5],取新生1 d 的昆明小鼠10 只,浸入络合碘中溺死,在超净台内充分显露两侧大脑半球、小脑及嗅球,完整剥取嗅球。预冷的PBS 的轻柔洗涤3次,在解剖显微镜下仔细剥离嗅球表面血管和软脑膜,余下嗅球组织用眼科剪剪碎,置于37℃ 0.25%的胰蛋白酶中消化15 min,DMEM(含10% 胎牛血清)终止消化,巴氏管轻柔吹打后细胞筛过滤,离心滤液(800 r /min,8 min),弃上清后以DMEM(含10%胎牛血清)重悬细胞,接种入未包被的培养瓶(细胞密度5×104/mL)并置于37℃ 5% CO2培养箱中。培养1h 后轻振培养瓶,吸出细胞悬液种植到另一未包被的培养瓶中,培养8h 后,将细胞悬液接种到已使用多聚赖氨酸包被的培养瓶中。继续培养4 h后使用2 mg /L 的AraC处理细胞,培养4 h 后全量换液。每培养3 d半量换液一次。当细胞生长融合达到80% 时吸出上清,PBS 清洗3 次,加入新鲜培养基(无血清DMEM)孵育1 d,离心15 min后收集上清,-20℃保存备用。
1.3 实验分组 实验分为对照组和实验组,对照组:DMEM/F12培养基培养的正常第3代C17.2 NSCs;实验组:取第3代C17.2 NSCs,弃含血清培养基,PBS清洗2次,加入OECs无血清上清液培养。实验组和对照组均分别加入终浓度为0 ng/mL、125 ng/mL、250 ng/mL、500 ng/mL的IGFBP-2诱导5 d。
1.4 Western blot 检测 经不同浓的外源性IGFBP-2诱导5 d后,收集各组细胞,采用SDS Samplebuffer裂解,Bradford蛋白定量。取蛋白50μg,10%Tris-甘氨酸SDS-PAGE凝胶电泳2h,转膜,分别加入Nestin一抗(1:1000)、TUJ-1一抗(1:1000),GFAP一抗(1:1000)、总蛋白激酶1/2(total-extracellular regulated protein kinases 1/2,t-ERK 1/2)一抗(1:2000),活化蛋白激酶1/2(positive-extracellular regulated protein kinases 1/2,p-ERK 1/2)一抗(1:500),4℃孵育过夜,TBST洗膜3次。以1:2000比例稀释二抗,TBST洗膜3次,于暗室加1mL显影A、B混合液,根据荧光强度选择不同曝光时间,扫描仪获取荧光图谱。采用Quantity One软件分析免疫条带,以目的蛋白与内参β-actin的吸光度(A)值比值作为目的蛋白的相对表达量。
1.5 免疫荧光检测及计数 对实验组中经不同浓度IGFBP-2诱导5 d后的C17.2 NSCs进行免疫荧光鉴定。步骤:细胞经4%多聚甲醛固定5 min,PBS清洗3次,山羊血清封闭20 min,分别加入一抗GFAP(1:1000)、TUJ-1(1:1000)、兔抗p75(1:500),4℃过夜,常温下加入免疫荧光二抗孵育1h,清洗3次后滴加DAPI染核,荧光显微镜下观察,GFAP阳性表达呈绿染,TUJ-1为红染。技术方法:荧光显微镜下,随机选取8个视野,计算亮绿色(GFAP)和深红色(TUJ-1)的细胞个数。
1.6 流式细胞检测 对照组诱导5 d后分析细胞TUJ-1和GFAP的表达。每个培养瓶去培养基,PBS洗1遍,加入200μL 0.02%EDTA消化,用含血清的培养基终止反应,巴氏管轻柔吹打,离心后弃上清,PBS洗1遍,用PBS制成悬液每份1×105个细胞调整到100μL,按照说明书在细胞悬液中直接加入抗体,冰上避光孵育60 min,以1300 r/min离心3 min弃含荧光标记抗体的PBS,再用PBS洗一遍,去除未结合荧光抗体,降低背景干扰,100μL Buffer重悬细胞,在4℃下保存待测;用间接荧光标记的抗体时,首先加1μL一抗,冰上孵育60 min,用PBS洗一遍,再加1μL二抗(FITC标记),避光冰上孵育40 min,PBS洗一遍,100μL Buffer重悬细胞,在4℃下保存待测。
1.7 统计学方法 采用SPSS 17.0统计软件进行分析。数据以均数±标准差表示,组间比较采用单因素方差分析,两两比较采用SNK检验;检验水准α=0.05。
2 结果
2.1 OECs的培养与鉴定 体外培养OECs生长3d后细胞呈三角形、梭形或椭圆形,有突起细长(图1A),胞体折光性较好,细胞不规则排列,7d后行NGFR p75免疫荧光染色可见大量阳性细胞(图1B)

图1 嗅鞘细胞的形态学观察及鉴定A:OECs形态观察(Scale bar =200 μm);B:OECs 的p75 免疫荧光染色观察(Scale bar =50 μm)
2.2 外源性IGFBP-2在无血清培养基中对NSCs的分化无明显作用 C17.2 NSCs用血清培养融合至80%时,弃上清,PBS洗3遍,加入DMEM/F12培养基。分别在培养基中加入终浓度为0 ng/mL、125 ng/mL、250 ng/mL、500 ng/mL的IGFBP-2,诱导5 d后行western blot检测和流式分析。结果均显示诱导前后胶质细胞标志物GFAP和神经元标志物TUJ-1无明显改变(图2A,2B-M),差异无统计学意义(P>0.05)。证明不同浓度的外源性IGFBP-2加入DMEM/F12培养基后,对NSCs的分化无明显作用。

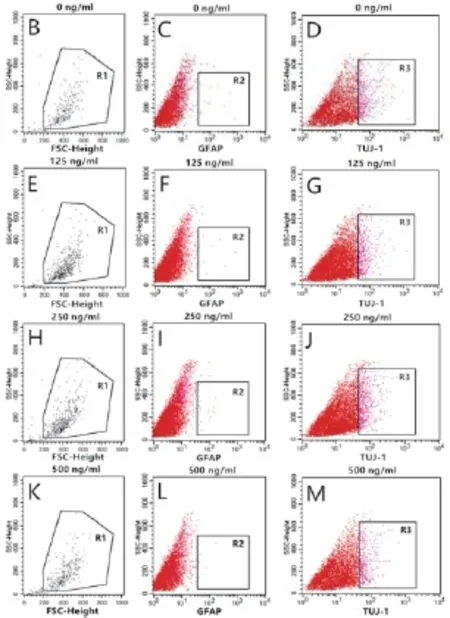
图2 单独添加外源性IGFBP-2对NSCs分化无明显影响A:IGFBP-2诱导5 d后,各浓度组GFAP和TUJ-1的western blot表达,差异无统计学意义,P>0.05;B:IGFBP-2诱导5 d后,各浓度组GFAP和TUJ-1的流式分析,R2,R3差异无统计学意义,P>0.05。其中图B、C、D 为0 ng/mL IGFBP-2诱导组;E、F、G为125 ng/mL IGFBP-2诱导组;H、I、J为250 ng/mL IGFBP-2诱导组;K、L、M为500 ng/mL IGFBP-2诱导组;R 1为总检测细胞,R 2为GFAP阳性细胞,R 3为TUJ-1阳性细胞。
2.3 外源性IGFBP-2在OCM中诱导NSCs分化
C17.2 NSCs用血清培养融合至80%时,弃上清,PBS 洗3遍,加入OECs无血清上清液培养。分别在培养基中加入终浓度为0 ng/mL、125 ng/mL、250 ng/mL、500 ng/mL的IGFBP-2,诱导5 d后行western blot检测和免疫荧光分析。Western blot结果显示随着IGFBP-2浓度的增加,GFAP表达逐渐增多,TUJ-1和未分化细胞标志物逐渐减少(图3A,3B)。免疫荧光检测到随着IGFBP-2浓度的增加,GFAP阳性细胞逐渐增多,TUJ-1阳性细胞逐渐减少(图3C,3D)。结果表明,外源性IGFBP-2促进NSCs向星形胶质细胞分化,抑制NSCs向神经元分化,且与浓度呈正相关关系。




图3 外源性IGFBP-2在OCM中诱导NSCs向星形胶质细胞分化A-B:外源性IGFBP-2诱导5 d后各浓度组GFAP和TUJ-1的western blot表达,差异有统计学意义,*P<0.05,**P<0.01;C:外源性IGFBP-2诱导 5 d 各浓度组免疫荧光染色鉴定(Scale bar =200 μm);D:外源性IGFBP-2诱导 5 d 后,TUJ-1阳性细胞明显减少和GFAP阳性细胞明显增多,差异有统计学意义,*P<0.05,**P<0.01
2.4 ERK1/2通路参与IGFBP-2诱导分化 为了探究ERK1/2通路在IGFBP-2诱导NSCs分化的中的作用,实验中取经外源性IGFBP-2处理5 min的实验组细胞,western blot检测总ERK1/2(t-ERK1/2)和活化ERK1/2 (p-ERK1/2)的变化。结果发现,经IGFBP-2处理后,p-ERK1/2在5 min内迅速升高,而t-ERK1/2无明显变化(图4)。证明ERK1/2参与了IGFBP-2的诱导分化过程。

图4 IGFBP-2加入OCM 前后,p-ERK1/2 、t-ERK1/2表达变化
3 讨论
为了探究IGFBP-2对NSCs分化的作用及其可能的作用通路,本实验将不同浓度的外源性IGFBP-2分别添加在无血清培养基和OCM中,观察其对NSCs分化的影响。结果证明,在无血清培养基中,IGFBP-2 对NSCs的分化无明显影响,而在OCM培养基中,IGFBP-2通过ERK1/2信号通路抑制NSCs向神经元分化并促进其向星形胶质分化。本实验为更全面的了解OCM诱导NSCs分化的作用提供了帮助,并为研究IGFBP-2介导的NSCs分化提供了必要的实验依据。
OECs能分泌大量营养因子,如神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brainderived neurotrophic factor,BDNF)、胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)等等,而这些已知的营养因子对调节神经元的存活、轴突生长、突触可塑性和神经传导有着重要的作用[6,7],体外实验证明,OCM既可以诱导NSCs向神经元分化,也可以诱导其向星形胶质细胞分化,出现差异性的原因,我们猜测可能与OECs分泌的某种蛋白有关。我们前期的研究结果表明发现,IGFBP-2在OECs中高表达。有文献报道,IGFBP-2能促进胶质瘤细胞的生长,增加其迁移能力和侵袭力[8],敲除或沉默IGFBP-2基因后可以减缓疾病进程,促进胶质瘤的凋亡[9,10],同时,患者IGFBP-2水平可预测其预后及生存期[11]。另外,IGFBP-2在诱导分化中也有重要作用,如诱导人骨髓间充质细胞向角膜细胞分化[12]、诱导成骨分化[13]、影响心肌分化[14]等。因此,我们推测IGFBP-2是影响NSCs分化的重要蛋白。
为了验证上述猜想,实验首先探究了单独的外源性IGFBP-2对NSCs分化的影响。免疫印迹和流式结果均显示,单独添加IGFBP-2对NSCs的分化无明显作用。而在OCM中,发现IGFBP-2可以促进NSCs分化成胶质细胞,且分化成胶质细胞的比例和IGFBP-2浓度呈正相关关系。因此,IGFBP-2可能与OCM中的某些蛋白达成协同作用,诱导NSCs向星形胶质细胞分化。
IGFBP-2 可以通过与胰岛素样生长因子(insulinlike growth factor,IGF)受体竞争性结合,调控IGF的生物学功能,还可以作为外分泌蛋白直接参与调控细胞的增殖、分化等过程[15]。IGF是在细胞的增殖分化、程序性死亡和转化中均有重要作用的因子。有研究发现,IGF可以促进NSCs增殖[16],将IGF基因导入NSCs后,可以诱导NSCs向少突胶质细胞分化[17],同时,还有研究表明,IGF在NSCs和MSC向神经元样细胞分化过程扮演着重要的角色[18,19]。可以发现,IGF对神经干细胞的功能是多样性的,但是尚无报道其可以诱导NSCs向星形胶质细胞分化,因此我们推断,本实验中IGFBP-2是通过非IGF依赖通路诱导NSCs向星形胶质细胞分化。
MAPK家族在调节细胞状态中至关重要,其成员中,ERK在细胞的分化和增殖中有着重要的作用。ERK是一组丝/苏氨酸蛋白激酶,能够被细胞外信号分子激活,继而将细胞表面信号转导到细胞核内,调节细胞的增殖和分化。有研究表明,IGFBP-2可以通过ERK信号通路促进胶质瘤细胞增殖和迁徙[8,20]。本研究证实IGFBP-2开始诱导NSCs 5 min后,p-ERK迅速增加,说明ERK通路与IGFBP-2的诱导分化有关。
综上所述,本研究结果证明了嗅鞘细胞分泌蛋白IGFBP-2对NSCs分化的作用,诱导效果和IGFBP-2的浓度呈正相关关系,且与ERK通路有关。而IGFBP-2 与OCM中哪些蛋白协同作用及其机制如何将有待我们进一步探讨。
[1] Wang L, Jiang M, Duan D, et al. Hyperthermia-conditioned OECs serum-free-conditioned medium induce NSC differentiation into neuron more efficiently by the upregulation of HIF-1 alpha and binding activity [J]. Transplantation, 2014, 97(12): 1225-32.
[2] Zhang J, Wang B, Xiao Z, et al. Olfactory ensheathing cells promote proliferation and inhibit neuronal differentiation of neural progenitor cells through activation of Notch signaling[J]. Neuroscience, 2008, 153(2): 406-13.
[3] Russo VC, Gluckman PD, Feldman EL, Werther GA. The insulin-like growth factor system and its pleiotropic functions in brain[J]. Endocr Rev, 2005, 26(7): 916-43.
[4] Han S, Meng L, Han S, Wang Y, Wu A. Plasma IGFBP-2 levels after postoperative combined radiotherapy and chemotherapy predict prognosis in elderly glioblastoma patients[J]. PLoS One, 2014, 9(4): e93791.
[5] Chen BY, Wang X, Wang ZY, et al. Brain-derived neurotrophic factor stimulates proliferation and differentiation of neural stem cells, possibly by triggering the Wnt/β-catenin signaling pathway[J]. J Neurosci Res, 2013, 91(1): 30-41.
[6] Woodhall E, West AK, Chuah MI. Cultured olfactory ensheathing cells express nerve growth factor, brain-derived neurotrophic factor, glia cell line-derived neurotrophic factor and their receptors[J]. Brain Res Mol Brain Res, 2001, 88(1-2): 203-13.
[7] Lipson AC, Widenfalk J, Lindqvist E, et al. Neurotrophic properties of olfactory ensheathing glia[J]. Exp Neurol, 2003, 180(2): 167-171.
[8] Han S, Li Z, Master LM, et al. Exogenous IGFBP-2 promotes proliferation, invasion, and chemoresistance to temozolomide in glioma cells via the integrin b1-ERK pathway[J]. Br J Cancer, 2014, 111(7): 1400-1409.
[9] Chen PH, Chang CK, Shih CM, et al. The miR-204-3p-targeted IGFBP2 pathway is involved in xanthohumol-induced glioma cell apoptotic death[J]. Neuropharmacology, 2016, 110(Pt A): 362-375.
[10] Phillips LM, Zhou X, Cogdell DE, et al. Glioma progression is mediated by an addiction to aberrant IGFBP2 expression and can be blocked using anti-IGFBP2 strategies[J]. . J Pathol, 2016, 239(3): 355-364.
[11] Huang LE, Cohen AL, Colman H, et al. IGFBP2 expression predicts IDH-mutant glioma patient survival[J]. Oncotarget, 2016 .
[12] Park SH, Kim KW, Kim JC. The Role of Insulin-Like Growth Factor Binding Protein 2(IGFBP2) in the Regulation of Corneal Fibroblast Differentiation[J]. Invest Ophthalmol Vis Sci, 2015, 56(12): 7293-7302.
[13] Xi G, Wai C, DeMambro V, et al. IGFBP-2 directly stimulates osteoblast differentiation[J]. J Bone Miner Res, 2014.29(11): 2427-2438.
[14] Wood AW, Schlueter PJ, Duan C. Targeted knockdown of insulin-like growth factor binding protein-2 disrupts cardiovascular development in zebrafish embryos[J]. Mol Endocrinol, 2005, 19(4): 1024-1034.
[15] Pereira JJ, Meyer T, Docherty SE, et al. Bimolecular interaction of insulin-like growth factor (IGF) binding protein-2 with alphavbeta3 negatively modulates IGF-I-mediated migration and tumor growth[J]. Cancer Res.2004.64(3): 977-984.
[16] Erickson RI, Paucar AA, Jackson RL, et al. Roles of insulin and transferrin in neural progenitor survival and proliferation[J]. J Neurosci Res, 2008, 86(8): 1884-1894.
[17] Shi B, Ding J, Liu Y, et al. ERK1/2 pathway-mediated differentiation of IGF-1-transfected spinal cord-derived neural stem cells into oligodendrocytes[J]. PLoS One, 2014, 9(8): e106038.
[18] Huat TJ, Khan AA, Pati S, et al. IGF-1 enhances cell proliferation and survival during early differentiation of mesenchymal stem cells to neural progenitor-like cells[J]. BMC Neurosci, 2014, 15: 91.
[19] Zhang X, Zhang L, Cheng X, et al. IGF-1 promotes Brn-4 expression and neuronal differentiation of neural stem cells via the PI3K/Akt pathway[J]. PLoS One, 2014, 9(12): e113801.
[20] Mendes KN, Wang GK, Fuller GN, Zhang W. JNK mediates insulinlike growth factor binding protein 2/integrin alpha5-dependent glioma cell migration[J]. Int J Oncol, 2010, 37(1): 143-153.
Effect of OECs secreted protein IGFBP-2 on differentiation of neural stem cells
Deng Yu-jia, Duan Da, Ge Li-te, Zhuo Yi, Yuan Ting, Yan Wei-ping, Huang Pei-qi, Lu Ming, Teng Xiao-hua
(Department of Neurosurgery, Second Affiliated Hospital of Hunan Normal University, Changsha 410003, China)
Objective To study the effect of OECs secreted protein IGFBP-2 on differentiation of neural stem cells. Methods OECs were isloated and cultured from the olfactory bulbs of 1-day-old postnatal mouse to prepare serum-free condition medium of OECs. After C17.2 NSCs were cultured with H-DMEM/F12 medium containing 10% FBS and the cell fusion reached 80%, the 3rd passage cells were induced by serum-free condition medium of OECs in the experimental group, by H-DMEM/F12 in the control group. Both the experimental group and control group were treated with 0, 100, 300, 500 ng/mL IGFBP-2. The growth condition of cells was observed with inverted microscope. After 5 days, analyzing expression patterns of neuroectodermal stem cell marker (Nestin), glial fibrillary acidic protein (GFAP), neuron specific class III beta tubulin (TUJ-1), ERK1/2 by western blot. GFAP and TUJ-1 positive cells were identified and counted by immunofluorescence staining. Meanwhile, flow cytometry were uesd to analyse the GFAP and TUJ-1 positive cells. Results In the control group, Western blot and flow cytometry analysis showed that there was no significant difference in the expression of GFAP and TUJ-1 between each concentration group. In the experimental group, Western blot analysis showed that With the increase of IGFBP-2concentration, the expression of GFAP was increased, the expression of TUJ-1 was decreased, and the expression of ERK1/2 increased rapidly after the addition of IGFBP-2. The immunofluorescence staining showed that GFAP positive cells increased and TUJ-1 positive cells decreased with the increase of IGFBP-2 concentration. Conclusion IGFBP-2 can promote the differentiation of NSCs into astrocyte induced by OCM in a dose-related way, and its mechanism is related to ERK1/2 pathway.
IGFBP-; Neural stem cells; Induced differentiation; Olfactory ensheathing cells
R329
A
1673-016X(2017)02-0004-05
2016-12-26
国家自然科学基金资助项目(81371358);湖南省教育厅项目(15C0832);湖南省自然科学基金(14JJ2060)
滕晓华,E-mail:txh1996@163.com
