FilipinⅢ对肺泡巨噬细胞caveolin-1的影响
2017-05-15陈阳晔瞿树林张坚松
杨 丹,李 懿,陈阳晔,张 冉,李 翔,瞿树林,张坚松,申 丽
(湖南师范大学医学院,长沙 410013)
FilipinⅢ对肺泡巨噬细胞caveolin-1的影响
杨 丹,李 懿,陈阳晔,张 冉,李 翔,瞿树林,张坚松,申 丽
(湖南师范大学医学院,长沙 410013)
目的:探索FilipinⅢ对肺泡巨噬细胞caveolin-1的影响。方法:采用肺泡灌洗的方法分离提取小鼠原代肺泡巨噬细胞,免疫细胞化学染色鉴定其纯度,Western印迹分析FilipinⅢ处理30min后caveolin-1蛋白水平的变化。利用细胞系RAW264.7观察FilipinⅢ处理后15min、30min、1h、2h、4h、6h的caveolin-1的动态变化。结果:FilipinⅢ处理30min后原代肺泡巨噬细胞及RAW264.7细胞caveolin-1的蛋白水平都有增加。结论:FilipinⅢ可以提高肺泡巨噬细胞及RAW264.7细胞caveolin-1的蛋白表达。
FilipinⅢ;caveolin-1;caveolae;肺泡巨噬细胞
FilipinⅢ是一种多烯类抗生素,主要用于真菌感染的治疗。它可以选择性的与细胞膜上的胆固醇结合形成复合体,导致细胞膜结构和功能的紊乱[1]。小窝(caveolae)是存在于细胞膜表面的囊状内陷的亚细胞结构,直径50-100nm,主要由小窝蛋白(caveolins)和脂质(胆固醇和鞘磷脂)构成。小窝蛋白-1(caveolin-1)是构成的caveolae的重要亚单位,在它的参与下,caveolae执行了很多重要的功能,包括物质的跨膜转运、脂质的调节、细胞间的信号调控等,是近年来研究的热点[2]。在有关caveolae的研究中,FilipinⅢ常被用于干扰caveolae的结构[3-5],以便观察caveolae结构破坏后,其功能有哪些变化。但是FilipinⅢ对caveolin-1本身有没有影响呢?有研究人员证实在人脐静脉内皮细胞(HUVECs)中,Filipin破坏caveolae结构,未发现caveolin-1的蛋白表达水平有变化[6]。
血液单核细胞源自骨髓中的前体细胞,随着血液循环到机体各处,进入组织形成巨噬细胞。巨噬细胞是参与机体防御保护与体内稳态维持的一个重要的细胞群体,一方面它可以通过吞噬作用杀灭和清除病原体、异物、损伤组织及细胞碎片,另一方面可通过加工和提呈抗原,启动免疫应答从而发挥进一步的防御功能[7]。肺泡巨噬细胞(alveolar macrophages,AMs)的数量占肺泡常驻细胞的80%,通过分泌细胞因子,吞噬,杀菌等作用参与肺部细胞间的调控和免疫应答反应,在肺部的急慢性炎症中都发挥着重要的作用,是肺部疾病防治研究中的重要领域。AMs上有caveolin-1的表达[8]。如果用FilipinⅢ干扰AMs上的caveolae,caveolin-1的表达有没有变化未见报道。本研究旨在探索FilipinⅢ对肺泡巨噬细胞caveolin-1的影响。
1 材料与方法
1.1 材料
1.1.1 主要试剂FilipinⅢ(F4767,美国SIGMA公司);兔抗caveolin-1多克隆抗体(#3267,美国cell signaling公司);兔抗GAPDH和鼠抗tublin(武汉塞维尔生物);BCA蛋白定量试剂盒(南京诺唯赞生物);ECL化学发光液(Advansta,德国拜耳公司);RIPA细胞裂解液(北京索莱宝生物);PMSF蛋白酶抑制剂(北京索莱宝生物);其余通用试剂为国产分析纯。
1.1.2 主要仪器电泳仪(北京六一仪器厂);Tanon 5500化学发光成像系统(上海天能科技有限公司);正置荧光显微镜(日本尼康ECLIPSETI CI);成像系统(日本尼康DS-U3)。
1.2 方法
1.2.1 AMs的提取分离 Balb/c小鼠麻醉后颈部解剖暴露气管,将12号针头插入气管,注入1mlPBS灌洗,反复回抽5次,灌洗3遍。回收肺泡灌洗液,于4℃、1000r/min离心10分钟,用含10%FBS的DMEM高糖培养基重悬细胞,进行细胞计数。将细胞接种于六孔板中置于37℃、5%CO2的培养箱中过夜,弃去上清,再添加10%FBS的DMEM高糖培养基培养。
1.2.2 免疫细胞化学方法检测AMs的纯度 将细胞接种于光学培养皿,用PBS浸洗3次,每次3min,用4%的多聚甲醛固定15min,PBS浸洗光学培养皿3次,每次3min,滤纸吸干PBS。在光学培养皿上滴加正常山羊血清,室温封闭30min,滤纸吸掉封闭液,滴加CD68一抗4℃孵育过夜。PBST浸洗光学培养皿3次,每次3min,滤纸吸干光学培养皿上多余液体后滴加荧光二抗,37℃孵育1h,PBST浸洗光学培养皿3次,每次3min。滴加DAPI避光孵育5min,对标本进行染核,PBST 洗4次每次5min,洗去多余的DAPI,用滤纸吸干光学培养皿上的液体,用含抗荧光淬灭剂的封片液压片,再在激光共聚焦显微镜下随机观察3个视野并计数CD68阳性细胞的百分率。
1.2.3 小鼠单核/巨噬细胞系RAW264.7的培养和传代 RAW264.7细胞购于中国科学院细胞库(中国上海市)。用含10% 胎牛血清、100U/mL青霉素和100 U/ mL链霉素的高葡萄糖DMEM培养基培养,置于37℃、饱和湿度的5% CO2培养箱中贴壁生长。待细胞汇合度为80%左右时,进行细胞传代。弃去培养基中的旧培养基,用2mL PBS冲洗2遍后,用0.05%胰蛋白酶(含EDTA)消化2min后,弃去胰蛋白酶,加入3mL含血清的新鲜培养基终止消化,并将细胞吹打成均匀的单细胞悬液,按1:3传代。
1.2.4 FilipinⅢ处理小鼠AMs及RAW264.7细胞
细胞用无血清的高葡萄糖DMEM培养基饥饿处理24小时,PBS洗两次,处理组加FilipinⅢ,终浓度为2.5μg/ mL;对照组加二甲基亚砜(DMSO),终浓度为2.5μg/ mL,处理30min后收集蛋白进行检测。
1.2.5 Western印迹分析 根据文献[9]常规提取细胞总蛋白,BCA试剂盒定量,以兔抗鼠caveolin-1多克隆抗体(稀释比例1:1000)进行;GAPDH及tublin用作内参对照。用Image J程序计算caveolin-1蛋白信号与内对照信号之比,获得的caveolin-1印迹条带相对密度比值。
1.3 统计学处理 实验数据用mean±SD表示,组间比较用单因素方差分析,均数间的比较用t检验。所有数据采用SPSS16.0统计软件进行分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 AMs的纯度鉴定 为了鉴定所提取的AMs的纯度,用DAPI对肺泡灌洗液里的所有细胞进行核染,用巨噬细胞表面标志物CD68[10]来标记巨噬细胞。在600×的激光共聚焦显微镜下,免疫染色的结果显示(图1),随机选取三个视野进行细胞计数,所提取AMs纯度为96±2%。
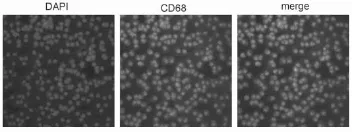
图1 原代肺泡巨噬细胞纯度鉴定
2.2 FilipinⅢ对AMs caveolin-1表达的影响 用FilipinⅢ处理AMs 30min后提取蛋白,常规Western blot检测caveolin-1蛋白表达(图2)。DMSO对照组与FilipinⅢ处理组caveolin-1分别为(0.764±0.0782),(0.871±0.0857);结果显示,相比于DMSO对照组,FilipinⅢ处理组caveolin-1蛋白水平升高,两组间caveolin-1有差异(P<0.05)。

图2 FilipinⅢ处理AMs caveolin-1的表达
2.3 FilipinⅢ对RAW264.7细胞caveolin-1表达的时效关系 为了明确FilipinⅢ处理后caveolin-1表达的动态变化,用FilipinⅢ分别处理RAW264.7细胞15min、30min、1h、2h、4h、6h后Western blot检测caveolin-1蛋白表达(图3)。结果用FilipinⅢ处理组的caveolin-1与内对照的灰度比再比上DMSO对照组的caveolin-1与内对照的灰度比表示。15min、30min、1h、2h、4h、6h的结果分别为0.8255±0.1577,1.0201 ±0.0359,1.1478±0.1836,1.6408±0.1885,0.7088 ±0.2238,0.8171±0.08858;图示结果说明在30min时,caveolin-1的表达同样为升高的趋势;在4h时,caveolin-1的表达开始下降。

图3 FilipinⅢ对RAW264.7细胞caveolin-1表达的时效关系
3 讨论
研究表明caveolae的主要功能不仅包括参与物质的跨膜转运,亦是细胞信号分子的富集区和信号传导的枢纽。Caveolin-1是构成caveolae的关键蛋白,可通过其脚手架区域对很多关键信号分子进行调节从而参与信号转导,可影响肺泡巨噬细胞IL-6,IL-10等因子的分泌,从而参与炎症的调节[8]。
Caveolae功能的实现与胆固醇脂质成分有关,Filipin能与胆固醇结合,从而扰乱caveolae的功能,同时保留细胞的完整性[11]。因此在众多的研究中FilipinⅢ常用来作为干扰caveolae的工具药物[12-14]。然而用FilipinⅢ扰乱caveolae结构之后caveolin-1的变化研究甚少。人脐静脉内皮细胞(HUVECs)中,Filipin没有引起caveolin-1的蛋白变化[6]。FilipinⅢ AMs caveolin-1的影响有待探索。
本研究提取小鼠AMs后,用FilipinⅢ处理30分钟,以Western blot检测caveolin-1的表达,结果发现与对照组相比,FilipinⅢ引起caveolin-1的表达升高。为了明确caveolin-1在FilipinⅢ处理下表达的动态过程,我们用巨噬细胞系RAW264.7做了时效关系。结果发现在30min时,caveolin-1表达上升,与AMs的趋势相同。提示,在研究AMs上的caveolin-1的功能时,用RAW264.7细胞系可以较好的模拟AMs的变化。
FilipinⅢ处理30min可以引起caveolin-1的表达升高,其机制仍待揭示。我们推测这样的增高有可能是因为caveolae结构被破坏,细胞为了维持自身功能的相对稳定而产生的一种代偿性变化。在使用FilipinⅢ作为干扰caveolae结构的工具药时,应该考虑到caveolin-1的变化可能参与其中。
本研究证实了caveolae的结构干扰剂FilipinⅢ对胞上caveolin-1的表达有影响,该发现对于设计caveolae研究策略具有重要参考价值。
[1] McGookey DJ, Fagerberg K, Anderson RG. Filipin-cholesterol complexes form in uncoated vesicle membrane derived from coated vesicles during receptor-mediated endocytosis of low density lipoprotein[J]. J Cell Biol, 1983.96(5): 1273-1278.
[2] Anderson RG. The caveolaemembrane system[J]. AnnuRevBiochem, 1998, 67: 199-225.
[3] Fortin DL, Troyer MD, Nakamura K, et al. Lipid rafts mediate the synaptic localization of alpha-synuclein[J]. J Neurosci, 2004, 24(30): 6715-6723.
[4] Awasthi-Kalia M, Schnetkam PP, Deans JP. Differential effects of filipin and methyl-beta-cyelodextrin on B cell receptor signaling[J]. BiochemBioPhys Res Commun, 2001, 287: 77-82.
[5] VetheijenI, Tourlousse D, Vandetheyden PM, et al. Effect of Saponin and filipin on antagonist binding to AT1 receptors in intact cells[J]. Biochem Pharmacol, 2004, 67(8): 1601-1606.
[6] 罗小林, 梁霄, 赵慧, 等. Filipin对人脐静脉内皮细胞小凹蛋白-1作用的研究[J]. 石河子大学学报 (自然科学版), 2012, 30(3):337-339.
[7] Mosser DM, Edwards JP. Exploring the full spectrum of macrophage activation[J]. Nat Rev Immunol, 2008, 8(12): 958-969.
[8] Wang XM, Kim HP, Song R, et al. Caveolin-1 confers antiinflammatory effects in murine macrophages via the MKK3/p38 MAPK pathway[J]. Am J Respir Cell Mol Biol, 2006, 34(4): 434-442.
[9] 习臻畅, 张坚松. LRG1基因在肝细胞癌中的表达情况研究[J]. 湖南师范大学学报 (医学版), 2015, 12(2):24-27.
[10] Fujino S, Andoh A, Bamba S, et al. Increased expression of interleukin 17 in inflammatory bowel disease[J]. Gut, 2003, 52(1): 65-70.
[11] Galan C, Woodard G E, Dionisio N, et al. Lipid rafts modulate the activation but not the maintenance of store-operated Ca (2+) entry[J]. BiochimBiophysActa, 2010, 1803(9); 1083-1093.
[12] Norkin LC, Wolfrom SA, Stuart ES. Association of caveolin with Chlamydia trachomatis inclusions at early and late stages of infection[J]. Exp Cell Res, 2001, 266: 229-238.
[13] Yang B, Oo TN, Rizzo V. Lipid rafts mediate H2O2prosurvival effects in cultured endothelial cells[J]. FASEB J, 2006, 20(9): 1501-1503.
[14] Kiyanagi T, Iwabuchi K, Shimada K, et al. Involvement of cholesterolenriched microdomains in class A scavenger receptor-mediated responses in human macrophages[J]. Atherosclerosis, 2011.215(1): 60-69.
Effect of FilipinⅢ on caveolin-1 expression in alveolar macrophages
Yang Dan, Li Yi, Chen Yang-Ye, Zhang Ran, Qu Shu-Lin, Zhang Jian-Song, Li Xiang, Shen Li
(The Medicine College of Hunan Normal University, Changsha 410013, China)
Objective to investigate the effect of FilipinⅢ on caveolin-1 expression in alveolar macrophages (AMs). Methods Bronchoalveolar lavage was adopted to extract the primary AMs in mice, which is followed by immunocytochemistry staining to ensure AMs purity. The protein levels of caveolin-1 in AMs treated by FilipinⅢ or DMSO were detected with Western blot. RAW264.7 cells treated by FilipinⅢ were used to observe the possible change of caveolin-1 15 min, 30 min, 1 h, 2 h, 4 h, 6 h later. Results The data showed that caveolin-1 protein levels increased in both AMs and RAW264.7 cells after Filipin Ⅲ-treatment for 30 min. Conclusion FilipinⅢ can increase the expression of caveolin-1 in AMs and RAW264.7 cells.
FilipinⅢ; caveolin-1; caveolae; alveolar macrophages
R563.8
A
1673-016X(2017)02-0001-03
2017-01-03
国家自然科学基金项目(81100054);留学回国人员科研启动基金资助【2013】693;湖南省教育厅科学研究项目(16C0959)
申丽,E-mail:shenli16@hotmail.com
