新型负载型催化剂在植物甾醇酯合成工艺中的应用
2017-05-15潘丹杰蒋晓杰孟祥河
潘丹杰,张 斌,蒋晓杰,叶 沁,孟祥河
(1.杭州市粮油中心检验监测站,杭州 310009; 2.浙江工业大学 海洋学院,杭州 310014)
油脂化工
新型负载型催化剂在植物甾醇酯合成工艺中的应用
潘丹杰1,张 斌2,蒋晓杰1,叶 沁2,孟祥河2
(1.杭州市粮油中心检验监测站,杭州 310009; 2.浙江工业大学 海洋学院,杭州 310014)
开发了一种新型、高效的纳米羟基磷灰石负载氧化铜催化剂,初步表征了负载型催化剂的性质(比表面积、孔结构、微观形貌及晶体结构),并优化了其催化植物甾醇、脂肪酸合成植物甾醇酯的工艺参数。结果表明:纳米羟基磷灰石经水蒸气扩孔、Cu(NO3)2浸渍、焙烧可有效制备氧化铜-纳米羟基磷灰石(CuO-NHAP)催化剂;酯化最佳条件为催化剂用量0.6%、酸醇摩尔比1.4∶1、反应温度160℃、反应时间6 h,在此条件下酯化率为99.3%;催化剂重复使用6个批次后,催化剂相对活力仍保持在85%以上。
甾醇酯;催化剂;氧化铜-纳米羟基磷灰石;重复使用
植物甾醇又称植物固醇,是一种天然的功能活性物质。有研究表明[1],植物甾醇及其酯化物可有效抑制胆固醇在小肠中的吸收,同时降低血浆中胆固醇浓度。此外,植物甾醇还具有独特的消炎、退热、抗肿瘤、抗氧化、美容、抑制血小板凝聚及调节动物生长等功能[2]。但是植物甾醇在水和油脂中的溶解度都相当有限,并且常温下为结晶形式,生理活性不高,因此在食品工业中的应用受到限制。而植物甾醇酯可大大改善植物甾醇的脂溶性,同时具有熔点低、生物利用率高等特点。植物甾醇酯可通过胰胆固醇脂酶水解成为游离甾醇被人体吸收,降胆固醇效果优于植物甾醇[3-4]。
目前,用于植物甾醇酯合成的方法主要有酶催化合成法[5-6]和化学合成法[7-8]两大类。Weber等[9]采用Candidarugosa固定化脂肪酶催化谷甾醇与油酸进行酯化合成,反应温度30~40℃,但是需要在真空下进行,且反应时间长达48 h;李瑞等[10]以固定化脂肪酶Chirazyme L-2催化合成共轭亚油酸β-谷甾醇酯,反应在正己烷介质中进行,72 h后的酯化率仅为72.63%。鉴于过高的酶成本、较低的酯化率及较长的反应时间,工业化酶法合成甾醇酯的优势不明显。陈茂彬[11]以硫酸氢钠为催化剂合成油酸甾醇酯的酯化率为84.13%。王明霞[12]则借助于微波技术进行α-亚麻酸的改性研究,研究表明当催化剂甲醇钠的添加量仅为0.75%时,α-亚麻酸甾醇酯的产率即达60.8%。但是,由于化学法反应温度高,容易发生副反应,从而导致不饱和脂肪酸氧化和植物甾醇脱水等。因此,寻找一种高效、环保且重复利用率高的催化剂对于植物甾醇酯工业化生产至关重要。
本实验选用纳米羟基磷灰石(NHAP)作为催化剂载体,自制负载型CuO催化剂,通过比表面积和孔径分布、扫描电子显微镜和X-射线衍射等催化剂表征手段对催化剂的制备效果进行评价;同时将自制新型催化剂应用于植物甾醇酯的催化合成,通过酯化反应的酯化率评判该负载型催化剂的可行性。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
羟基磷灰石,纳米级;三水合硝酸铜,分析纯;混合植物甾醇(纯度>95%,主要成分为豆甾醇24%、β-谷甾醇45%、菜油甾醇21%、菜籽甾醇5%)、混合脂肪酸(酸值(KOH)205 mg/g),购自江苏春之谷生物制品有限公司;薄层层析用硅胶板(G板);NaOH-CH3OH溶液(0.5 mol/L);正己烷,色谱纯。
1.1.2 仪器与设备
GS-0.1高压反应釜,RV5机械真空泵(英国爱德华),ASAP2010比表面积和孔径测定仪(美国麦克公司),S-4700型扫描电子显微镜(日本Hitachi 公司),XRD-600 X-射线衍射仪(日本岛津公司)。
1.2 实验方法
1.2.1 负载型催化剂CuO-NHAP的制备
1.2.1.1 载体水热扩孔预处理
称取2 g NHAP载体于100 mL反应釜中,加入60 mL去离子水,在温度120℃、压力1.2 MPa、N2作为保护气体条件下,载体水蒸气扩孔处理2 h后将其放入110℃真空干燥箱内,干燥6 h后除水分,在600℃马弗炉中焙烧4 h,冷却至室温后抽真空 30 min。
1.2.1.2 等体积浸渍
称取0.398 g Cu(NO3)2·3H2O并加入3.72 mL蒸馏水溶解,得到Cu(NO3)2溶液(Cu质量分数为5%)[13],加入2 g扩孔处理的NHAP,同时剧烈搅拌,保证载体和活性组分充分接触,间歇超声辅助浸渍2次,每次1 h,浸渍处理总时间24 h,将其放入120℃电热真空干燥箱,干燥12 h,形成多孔状蜂窝固体,再于600℃下焙烧3 h,得到负载型催化剂CuO-NHAP。
1.2.2 负载型催化剂表征
1.2.2.1 比表面积和孔结构的测定(BET-BJH)
BET-BJH测定是在-196℃液氮温度下用N2吸附法测得的。从吸附等温线以及滞后环的类型可以看出孔的结构与孔径分布情况,并可根据BET模型计算出催化剂的比表面积,再根据BJH等效圆柱模型计算出催化剂样品相应的孔径分布曲线。
1.2.2.2 扫描电镜(SEM)
在Hitachi S-4700型扫描电子显微镜上完成样品测定。
1.2.2.3 X-射线衍射(XRD)
X-射线衍射测试条件:入射光源CuKα1靶(λ=0.154 06 nm),管电流40 mA,管电压40 kV,扫描速率4(°)/min,扫描范围2θ5°~100°,步径0.02°。结果由JCPDS数据库判断物质晶相类型。
1.2.3 植物甾醇酯的制备
称取10 g混合植物甾醇于50 mL三口烧瓶内,在60℃烘箱干燥24 h,然后按一定的酸醇摩尔比加入混合脂肪酸(混合脂肪酸的平均摩尔质量按180 g/mol 计,混合植物甾醇的平均摩尔质量按400 g/mol 计),在抽真空状态下油浴加热,同时通过磁力搅拌至反应混合物完全溶解。待反应混合物升温至设定值后,加入一定量负载型催化剂CuO-NHAP开始计时,以薄层色谱监测反应进程[14]。最终酯化率根据高效液相色谱分析计算。
1.2.4 产物分析
1.2.4.1 植物甾醇酯的分离纯化
酯化合成的产物采用薄层色谱法(TLC)进行分离纯化。反应开始计时后,每隔1 h取样进行TLC分析以判断反应进程,每次点3个平行样。TLC所用硅胶板固定相为0.5 mm的硅胶,展开剂和显色剂参考张娟聪[15]和张斌[16]的方法。
1.2.4.2 植物甾醇酯的测定
产物中的植物甾醇酯通过高效液相色谱法测定。色谱条件为:Silica分析柱(5 μm,250 mm×4.6 mm);流动相为正己烷-异丙醇(体积比 95∶5);流速1.2 L/min;柱温90℃;放大系数2;蒸发光散射检测器(ELSD 2000)。
酯化率=酯化植物甾醇物质的量/反应初始时原料中植物甾醇物质的量×100%
1.2.5 催化剂重复使用性能测试
反应结束后,将粗产物趁热快速抽滤,分离出的负载型催化剂CuO-NHAP用无水乙醇冲洗,并在120℃的电热真空干燥箱内经干燥后重复使用,由催化剂相对活性变化趋势评定该催化剂重复使用性能。
2 结果与讨论
2.1 催化剂表征结果
2.1.1 比表面积和孔结构
表1为NHAP在扩孔前和扩孔后的比表面积、总孔容、平均孔径和介孔数据结果。由表1可以看出,扩孔后NHAP的比表面积与扩孔前相比,减小了45%,然而总孔容和平均孔径却分别提高了65%和197%,这说明在扩孔处理之后载体的孔径被高压釜中的水蒸气强烈冲击导致小孔间的孔壁被破坏,因此导致载体总孔容和介孔均增大。此外,研究还表明扩孔处理确实有利于载体孔径的增大,便于活性组分的进入。

表1 NHAP扩孔前后的BET-BJH性质对比
2.1.2 表面形貌
图1、图2为活性组分负载前后载体NHAP在放大倍数为5 000倍下的SEM图。从图1、图2可以清晰看到,催化剂载体主要呈现出疏松多孔的表面结构,这说明在扩孔处理之后的载体表面孔径有利于活性组分的负载。而经过负载后的NHAP载体表面孔径不再是疏松空洞的,而是出现了大量的碎片,这很有可能是经过活性组分Cu(NO3)2在焙烧下产生的金属氧化物CuO碎片。

图1 活性组分负载前NHAP的SEM图

图2 活性组分负载后NHAP的SEM图
2.1.3 衍射峰晶面分析
活性组分负载前后NHAP的XRD图见图3、图4。
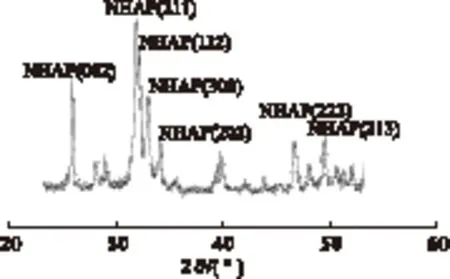
图3 活性组分负载前NHAP的XRD图
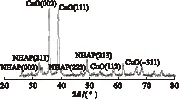
图4 活性组分负载后NHAP的XRD图
由图3可以看出,在2θ=25.864°、31.786°、32.186°、32.908°、34.054°、46.701°和49.478°,有较明显的衍射峰,由Jade软件分析可知分别对应为NHAP的(002)、(211)、(112)、(300)、(202)、(222)和(213)晶面,表明NHAP是密集的六方结构晶体。但在图4中可以看出,由于负载了Cu(NO3)2溶液,载体NHAP在2θ=25.864°和31.786°时所对应的最强衍射峰强度发生了明显的下降,而在2θ=35.462°和38.642°时分别出现了明显的CuO衍射峰,分别对应CuO(002)和(111)晶面。这说明CuO是催化剂的主要活性组分,其碎片在NHAP表面高度分散,导致NHAP本身的衍射峰强度减弱。
2.2 单因素实验优化工艺参数
2.2.1 反应温度对酯化反应酯化率的影响
在酸醇摩尔比1.5∶1、催化剂用量0.5%、反应时间5 h的条件下,分别选择反应温度为130、140、150、160、170、180℃,考察反应温度对酯化率的影响。结果见图5。
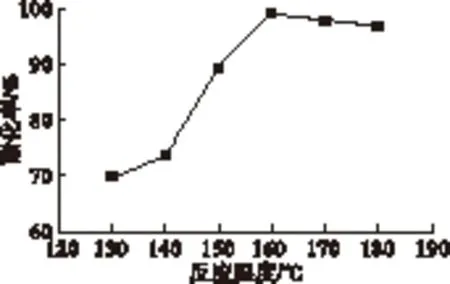
图5 反应温度对酯化率的影响
由图5可以看出,在160℃以下,随着反应温度的升高,酯化率明显增大,当反应温度到160℃时,酯化率达到最大值,为98.9%。当反应温度达到160℃以后,酯化率下降,主要是因为当反应温度升高至一定值时,反应的热动能不再是主导酯化反应速率的关键因素[13]。同时在160℃之后,由于温度过高会大大增加反应副产物产生的几率[15]。因此,确定该酯化反应的最佳反应温度为160℃。
2.2.2 反应时间对酯化反应酯化率的影响
在酸醇摩尔比1.5∶1、反应温度160℃、催化剂用量0.5%的条件下,分别选择反应时间为3、4、5、6、7、8 h,考察反应时间对酯化率的影响。结果见图6。

图6 反应时间对酯化率的影响
由图6可以看出,在反应的前6 h内,酯化率的增加幅度很大。当反应进行到6 h时,酯化率达到最大值,为99.8%。随后酯化率出现了下降的现象,这可能是由于反应达到了动态平衡,此时若正向反应产生的少量水未及时抽离,将会导致反应逆向进行,降低反应酯化率。因此,确定该酯化反应的最佳反应时间为6 h。
2.2.3 酸醇摩尔比对酯化反应酯化率的影响
在反应温度160℃、反应时间5 h、催化剂用量0.5%的条件下,分别选择酸醇摩尔比为1.0∶1、1.2∶1、1.4∶1、1.6∶1、1.8∶1、2.0∶1,考察酸醇摩尔比对酯化率的影响。结果见图7。

图7 酸醇摩尔比对酯化率的影响
由图7可以看出,当酸醇摩尔比在1.4∶1以下,随酸醇摩尔比的增大,酯化率明显增大,当酸醇摩尔比为1.6∶1时,酯化率为99.2%,但相比1.4∶1时的酯化率相差不大。因此,确定该酯化反应的最佳酸醇摩尔比为1.4∶1。
2.2.4 催化剂用量对酯化反应酯化率的影响
在研究催化剂用量对于酯化反应酯化率的影响时,发现并不是催化剂用量越大,酯化率越高。在反应温度160℃、酸醇摩尔比1.4∶1、反应时间5 h的条件下,分别选择催化剂用量为0.2%、0.4%、0.6%、0.8%、1.0%、1.2%,考察催化剂用量对酯化率的影响。结果见图8。

图8 催化剂用量对酯化率的影响
由图8可以看出,当催化剂用量为0.6%时,酯化率达到最大值,为99.2%,而催化剂用量过多或者过少,其酯化率都低于99.2%。这是因为催化剂只是加快了反应速率,并不是直接影响酯化率高低的决定性因素。因此,确定该酯化反应的最佳催化剂用量为0.6%。
2.3 催化剂活性的稳定性研究
为了考察催化剂在酯化过程中的稳定性,每次反应结束后将催化剂从产物中分离出来重新利用到下一批次。实验条件为:催化剂用量0.6%,酸醇摩尔比1.4∶1,反应温度160℃,反应时间6 h。在实验条件下,酯化率为99.3%。重复10次实验的催化剂相对活性如图9所示。
由图9可以看出,在负载型催化剂CuO-NHAP按实验条件反应6个批次以后,催化剂相对活性仍能保持85%以上,酯化率为86.9%,催化剂理论半衰期可达99.1 h,反映了负载型催化剂CuO-NHAP良好的稳定性。催化剂使用时相对活性降低可能是由于催化活性中心会被一些反应产物或者杂质吸附从而导致催化活性的下降,或者活性组分在重复使用和清洗过程中,脱附于载体表面。
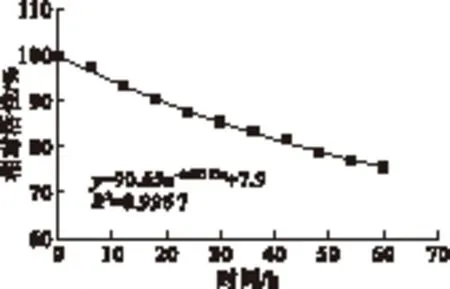
图9 CuO-NHAP催化剂重复利用时的稳定性
3 结 论
本实验主要开发了一种新型、高效的纳米羟基磷灰石负载氧化铜催化剂,并研究了此新型催化剂在植物甾醇酯合成工艺中的应用。研究结果表明,纳米羟基磷灰石(NHAP)经水蒸气扩孔、Cu(NO3)2浸渍、焙烧可有效制备氧化铜-纳米羟基磷灰石(CuO-NHAP)催化剂。此外,CuO-NHAP作为酯化反应的催化剂,实验得到最佳酯化反应条件为反应温度160℃、反应时间6 h、酸醇摩尔比1.4∶1、催化剂用量0.6%,在此条件下酯化率为99.3%,并且该催化剂具有较好的稳定性。由此可得该酯化反应所采用的反应体系具有反应时间短、酯化率高、催化剂可重复利用率高、与产物易分离等优点。
[1] TRAUTWEIN E A,DUCHATEAU G S M J E,LIN Y G,et al. Proposed mechanisms of cholesterol-lowering action of plant sterols[J]. Eur J Lipid Sci Technol,2003,105:171-185.
[2] 许青青,金文彬,苏宝根,等. 植物甾醇酯的化学合成及其分离研究进展[J]. 中国粮油学报,2014,29(3):120-128.
[3] 博迪克D C,莫伊尼G,雷德斯多夫D,等. 植物甾醇和植物甾烷醇衍生物:CN1256277A [P]. 2000-06-14.
[4] BERRY C J,BIERENBAUM M L. Anticholesterolemic edible oil:US6277431 [P]. 2001-08-21.
[5] KIM B H,AKOH C C. Modeling and optimization of lipase-catalyzed synthesis of phytosteryl esters of oleic acid by response surface methodology[J]. Food Chem,2007,102(1):336-342.
[6] ZHENG M M,DONG L,LU Y,et al. Immobilization ofCandidarugosalipase on magnetic poly (allyl glycidyl ether-co-ethylene glycol dimethacrylate) polymer microsphere for synthesis of phytosterol esters of unsaturated fatty acids[J]. J Mol Catal B Enzym,2012,74(1/2):16-23.
[7] ROBLES-MANUEL S,BARRAULT J,VALANGE S. Selective synthesis of phytosterol esters from natural sterols and fatty methyl esters over Mg-containing solid catalysts[J]. C R Chim,2011,14(7/8):656-662.
[8] YANG Y B,HE W S,JIA C S,et al. Efficient synthesis of phytosterol esters using the Lewis acidic ionic liquid[J]. J Mol Catal A Chem,2012,357:39-43.
[9] WEBER N,WEITKAMP P,MUKHERJEE K D. Fatty acid steryl,stanyl,and steroid esters by esterification and transesterification in vacuo usingCandidarugosalipase as catalyst [J]. J Agric Food Chem,2001,49(1):67-71.
[10] 李瑞,张晓鸣. 有机相脂肪酶催化合成共轭亚油酸β-谷甾醇酯的研究[J]. 中国油脂,2006,31(2):56-59.
[11] 陈茂彬. 植物甾醇酯的制备、生物活性及应用研究 [D]. 武汉:华中农业大学,2005.
[12] 王明霞.α-亚麻酸的纯化和改性研究 [D]. 北京:中国农业科学院,2007.
[13] CHARKRABORTY R,ROYCHOWDHURY D. Fish bone derived natural hydroxyapatite-supported copper acid catalyst:taguchi optimization of semibatch oleic acid esterification [J]. Chem Eng J,2013,215:491-499.
[14] 潘秋月,周晓红,孟祥河. 植物甾醇酯的绿色合成技术研究[J]. 中国粮油学报,2009,24(5):115-118.
[15] 张娟聪. 植物甾醇的改性研究[D]. 杭州:浙江工业大学,2009.
[16] 张斌. 负载型催化剂合成植物甾醇酯及其结晶纯化工艺的研究[D]. 杭州:浙江工业大学,2014.
Application of novel supported catalyst in synthesis process of phytosterol ester
PAN Danjie1, ZHANG Bin2, JIANG Xiaojie1, YE Qin2, MENG Xianghe2
(1.Hangzhou Grain and Oil Center Inspection Station, Hangzhou 310009, China;2.Ocean College, Zhejiang University of Technology, Hangzhou 310014, China)
A novel and high efficient copper oxide-nano hydroxyapatite (CuO-NHAP) catalyst was developed. The properties of supported catalyst(specific surface area, pore structure、mcro-morphology and crystal structure) were characterized and the process parameters of synthesis of plant sterol ester with plant sterol and fatty acid catalyzed by CuO-NHAP were optimized. The results showed that the CuO-NHAP catalyst was prepared effectively by pores-broading of nano-hydroxyapatite with vapour, impregnation with Cu(NO3)2and calcination. The optimal conditions of esterfication were obtained as follows:dosage of catalyst 0.6%, molar ratio of oleic acid to phytosterol 1.4∶1, reaction temperature 160℃ and reaction time 6 h. Under these conditions, the esterification rate was 99.3%. When the catalyst was reused for six times, its activity kept more than 85%.
sterol ester; catalyst; copper oxide-nano hydroxyapatite; reuse
2016-05-26;
2016-11-23
潘丹杰(1984),男,工程师,硕士研究生,研究方向为油脂分析检测(E-mail)1726471762@qq.com。
孟祥河,教授,博士生导师,博士(E-mail)mengxh@zjut.edu.cn。
TQ645;TQ426
A
1003-7969(2017)03-0059-05
