法舒地尔对高糖培养人腹膜间皮细胞RhoA/Rock1、ROS、GSH-Px及TGF-β1表达的影响
2017-05-09边爱淑杨丽娜马健飞
胡 晔 边爱淑 杨丽娜 樊 怡 马健飞
法舒地尔对高糖培养人腹膜间皮细胞RhoA/Rock1、ROS、GSH-Px及TGF-β1表达的影响
胡 晔 边爱淑 杨丽娜 樊 怡 马健飞
目的:探讨法舒地尔(FAS)对高糖培养的人腹膜间皮细胞(HMrSV)RhoA/Rock1、活性氧(ROS)、GSH-Px及转化生长因子β1(TGF-β1)表达的影响。 方法:将人腹膜间皮细胞株HMrSV分为对照组(葡萄糖浓度为0)、高糖组(葡萄糖浓度分别为1.5%、2.5%和4.25%)和FSA干预组(2.5%葡萄糖+FAS 12.5、25和50 μmol/L)。检测方法:Q-PCR法和Western印迹法检测RhoA和Rock1的表达;化学荧光法检测ROS的含量;ELISA法检测GSH-Px和TGF-β1的含量。 结果:与对照组相比,高糖组可呈浓度依赖方式上调RhoA、Rock1、ROS及TGF-β1的表达,下调GSH-Px的表达;与2.5%高塘组相比,FAS干预可明显下调RhoA、Rock1、ROS及TGF-β1的表达,上调GSH-Px的表达。 结论:FAS可能通过抑制Rho激酶活性抑制高糖培养的人腹膜间皮细胞发生氧化应激反应。
Rho/Rho激酶 氧化应激 腹膜透析 腹膜纤维化 法舒地尔
腹膜透析(PD)是终末期肾病患者肾脏替代治疗的方法之一。氧化应激是指机体或细胞内活性氧(ROS)过度产生和(或)抗氧化防御功能减弱,造成组织、细胞损伤的一种状态。研究表明,PD患者普遍存在氧化应激状态[1-2]。Rho被称为小G蛋白超家族并具有GTP酶活性,Rock属于丝氨酸/苏氨酸蛋白激酶,可与GTP-Rho相结合,是目前功能研究最为清楚的Rho下游靶效应分子[3]。Rho/Rock信号通路参与众多细胞功能,如细胞生长、黏附、迁移、聚集和增殖等;同时还参与调节体内多个生物环节,其中包括炎症,氧化应激及纤维化等[4]。转化生长因子β1(TGF-β1)被公认为是最主要的促纤维化因子。本实验通过观察高浓度葡萄糖对人腹膜间皮细胞(HMrSV)RhoA/Rock1、ROS、GSH-Px及TGF-β1表达的影响及法舒地尔(FAS)能否抑制高糖对HMrSV所产生的作用,为PD相关性腹膜纤维化的预防和治疗提供新的思路。
材料与方法
材料
实验细胞 HMrSV细胞株由法国巴黎TENON医院 Pierre RONCO教授建立;由中国医科大学附属一院徐惠绵教授及那迪医师馈赠。
主要试剂 改良型RPMI-1640培养基(美国Hyclone公司);无支原体胎牛血清(浙江天航生物科技有限公司);胰蛋白酶(美国Hyclone公司);PCR引物(大连宝生物合成);兔抗人RhoA多克隆抗体(英国abcam公司);兔抗人Rock1单克隆抗体(英国abcam公司);活性氧测试盒(南京建成生物工程研究所);谷胱甘肽过氧化物酶测试盒(南京建成生物工程研究所);TGF-β1 ELISA试剂盒(R&D)。
方法
HMrSV复苏与传代培养 将冻存细胞的冻存管直接浸入37℃温水中,并不时的摇动令其尽快融化,取出冻存管并吸出细胞悬液,加入已准备好的10 ml 1640培养液(含10%胎牛血清)中,4℃离心(800 r/min,5 min),得到细胞团,弃上清,继续用培养液重悬细胞,接种于培养瓶中,在CO2孵箱中培养24h后达到80%以上可传代,24h后再换液、传代或用于实验。
细胞分组 腹膜间皮细胞融合到80%以上进入实验,用1%胎牛血清培养基培养24h同步化,随机分以下各组:(1)对照组:只加入含10%胎牛血清(FBS1640)培养基作用24h;(2)不同葡萄糖浓度组:含10%FBS1640培养基中加入不同浓度的葡萄糖(1.5%,2.5%,4.25%)分别作用24h;(3)葡萄糖加FAS干预组:含10%FBS1640培养基中加入不同浓度FAS(12.5 μmol/L,25 μmol/L,50 μmol/L)分别预孵育2h,各加入2.5%葡萄糖再孵育24h。
Q-PCR 法检测RhoA,Rock1 的mRNA 表达 Trizol 法提取细胞总RNA,反转录合成cDNA。实时 定量PCR 引物序列: RhoA 上游5’-GACTCGGATTCGTTGCCTGA- 3’,下游3’-ATCCACCTCGATATCTGCCACA- 5’; Rock1 上游5’-GGACAGATGCGGGAGCTACA- 3’,下游3’-TGCTAGATCCAACTGAGTAGCAAGA- 5’;反应体系RhoA、Rock1及GADPH上下游引物各0.5 μl;SYBR Premix Ex TapII 6.25 μl;cDNA模板1.0 μl;去离子水4.25 μl;共12.5 μl。反应条件为:95℃ 30s预变性,95℃ 5s变性,60℃ 30s退火,共45个循环。ΔΔCt=(实验组目标基因-实验组内参)CT值-(对照组目标基因-对照组内参)CT值,mRNA的相对表达量=2-ΔΔCt×100%。
Western印迹法法检测RhoA,Rock1的蛋白表达 冰上裂解细胞,4℃,12 000 r/min离心10 min,留取上清用BCA法检测蛋白浓度。总蛋白上样量于10% SDS-PAGE电泳分离,电转移至PVDF膜上,以含5%脱脂奶粉的TBST封闭2h后,分别加入兔抗人RhoA抗体(1∶ 500),兔抗人Rock1抗体(1∶ 500),4℃过夜,洗膜,分别加入辣根过氧化物酶标记的山羊抗兔IgG(1∶ 2 000),山羊抗鼠IgG(1∶ 10 000),室温孵育2h,洗膜,ECL发光法显影,扫描仪成像,自动成像系统分析。
化学荧光法检测ROS 严格按照试剂盒说明书操作,加入DCFH-DA于培养基,37℃孵育细胞30 min后收集细胞,将收集好的细胞用PBS重悬,在荧光酶标仪上检测,读出光密度OD值,设定最佳激发波长500 nm,最佳发射波长525 nm,建立标准曲线换算出检测指标的真实含量。
ELISA法检测上清液GSH-Px及TGF-β1含量 严格按照试剂盒说明书操作,显色后用酶标仪读光密度OD值,建立标准曲线换算出检测指标的真实含量。
统计学分析 采用SPSS 19.0进行数据分析,计算资料以均数±标准差表示,组间比较采用单因素方差分析,P<0.05为差异统计学意义。
结 果
高糖对HMrSV RhoA及Rock1蛋白及mRNA表达的影响 与对照组相比,高糖组HMrSV RhoA及Rock1的蛋白及mRNA表达量显著增加,呈浓度依赖性,差异有统计学意义(图1)。
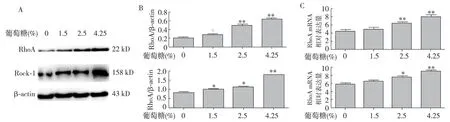
图1 不同浓度葡萄糖作用下HMrSV RhoA及Rock1的蛋白及mRNA表达情况HMrSV:人腹膜间皮细胞;RhoA:Rho蛋白A;Rock1:RhoA激酶1;mRNA:信使RNA;β-actin为内参;与0%组比较,*P<0.05;**P<0.01;A:Western印迹法;B:灰度定量分析法(对A图的半定量分析);C:Q-PCR法
FAS对高糖作用下HMrSV RhoA及Rock1蛋白及mRNA表达的影响 与2.5%高糖相比,FAS组HMrSV RhoA及Rock1的蛋白及mRNA表达量显著下降,且随着FAS浓度的增加,RhoA及Rock1的及mRNA表达量逐渐降低,差异具有统计学意义(图2)。
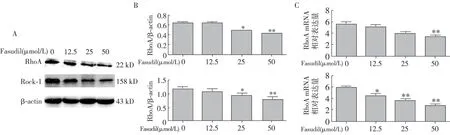
图2 FAS对高糖作用下HMrSV RhoA及Rock1的蛋白及mRNA表达情况FAS:法舒地尔;HMrSV:人腹膜间皮细胞;RhoA:Rho蛋白A;Rock1:RhoA激酶1;mRNA:信使RNA;β-actin为内参;与0 μnol/L组比较,*P<0.05;**P<0.01;A:Western印迹法;B:灰度定量分析法(对A图的半定量分析);C:Q-PCR法
高糖对HMrSV ROS、GSH-Px和TGF-β1蛋白表达的影响 与对照组相比,高糖组HMrSV ROS和TGF-β1的蛋白表达量显著增加,而GSH-Px的蛋白表达量显著减少,均呈浓度依赖性,差异具有统计学意义(表1)。
表1 葡萄糖作用下HMrSV ROS、GSH-Px和TGF-β1蛋白情况
HMrSV:人腹膜间皮细胞;ROS:活性氧;GSH-Px:谷胱甘肽过氧化物酶;TGF-β1:转化生长因子β1
FAS对高糖作用下HMrSV ROS、GSH-Px和TGF-β1蛋白表达的影响 与2.5%高糖相比,FAS组HMrSV ROS和TGF-β1的蛋白表达量显著下降,GSH-Px的蛋白表达量显著增加,呈FAS浓度依赖性(P<0.05),但在FAS的浓度为50 μmol/L时,GSH-Px的蛋白表达量未见增加(表2)。
表2 FAS对高糖作用下HMrSV ROS、GSH-Px和TGF-β1蛋白情况
HMrSV:人腹膜间皮细胞;ROS:活性氧;GSH-Px:谷胱甘肽过氧化物酶;TGF-β1:转化生长因子β1;FAS法舒地尔;HG:高糖
讨 论
PD是终末期肾病患者常用的替代疗法之一,非生理性腹膜透析液的慢性刺激和反复腹膜透析相关感染共同引起腹膜间皮细胞损伤是腹膜纤维化发生的始动因素[5]。研究表明,PD患者存在氧化应激状态,通过多种途径产生ROS,使氧化系统和抗氧化系统失衡,从而引起氧化应激反应,对腹膜间皮细胞造成损伤[1-2],最终导致腹膜纤维化的发生。因此,深入探讨腹膜氧化应激反应发生的机制,对于预防和延缓腹膜纤维化具有重大意义。
Rho/Rock信号通路广泛参与生物体内细胞增殖、迁移、凋亡、基因表达等行为。RhoA主要通过Rho/Rock信号通路调节肌动蛋白微丝骨架的聚合,进而影响细胞的极性和形态。FAS是目前在临床及实验中常用的一种Rock抑制剂,可调节细胞增殖、迁移黏附、骨架重排、胞质移动及炎症细胞运动等,在分子基因水平调节炎症、血栓形成、氧化及纤维化等相关的多种因子[6]。目前临床常用于改善缺血性脑血管疾病。但其作用远不仅限于此。有研究证实,高糖环境下腹膜间皮细胞的线粒体可产生大量ROS,导致氧化还原失衡,甚至出现细胞死亡[7-8]。Soliman等[9]研究发现,在糖尿病小鼠心肌细胞中,RhoA/Rock通路活化可激活PKCβ-2及ROS,从而破坏细胞骨架,损伤心肌细胞。还有实验表明Rho/Rock信号通路能激活Nox4(NADPH氧化酶-4)[10],通过产生O2-、H2O2等ROS产物,引起氧化应激。GSH-Px是机体内广泛存在的一种重要的催化H2O2分解的酶,可阻断脂质过氧化连锁反应,从而保护细胞免收氧化应激损伤。本研究发现高浓度葡萄糖可激活腹膜间皮细胞Rho/Rock信号通路,发生氧化应激反应,引起ROS蛋白表达上调,GSH-Px蛋白表达下调,同时FAS能显著下调ROS蛋白的表达,上调GSH-Px蛋白的表达,从而减轻氧化应激反应。
TGF-β1被公认为是最主要的促上皮细胞-间充质转分化(EMT)因子[11]。Washida等[12]的研究表明,Rho激酶参与激活多个阶段包括组织纤维化和血管生成的腹膜损伤,ROCK抑制剂可使组织纤维化区域及新生血管明显减少,使TGF-β、纤维连接蛋白及血管内皮生长因子(VEGF)显著降低[12-13]。近来研究发现结缔组织生长因子(CTGF)的过度表达和成肌纤维细胞的形成都依赖于RhoA信号转导[14]。国内也有研究发现,Rho/Rho激酶信号通路的激活在大鼠腹膜间皮细胞转分化中发挥重要作用。证实了分别用4.25%透析液建立PD大鼠模型以及用一定浓度的TGF-β 刺激腹膜间皮细胞,都会激活Rho/Rho激酶信号通路,随之使E-cadherin表达下降,α-SMA及Ⅰ型胶原表达增加[15-16]。而本研究也发现,葡萄糖可呈浓度依赖方式刺激腹膜间皮细胞上调TGF-β1蛋白的表达,FAS可显著下调TGF-β1蛋白的表达。
综上所述,本实验研究结果发现,高糖可激活人腹膜间皮细胞Rho/Rho激酶信号通路,发生氧化应激反应,上调促氧化因子ROS、下调抗氧化因子GSH-Px蛋白的表达,并上调纤维化标志性因子TGF-β1蛋白的表达,而FAS可抑制Rho/Rho激酶信号通路的激活,显著改善腹膜间皮细胞氧化应激状态,防止高糖对腹膜间皮细胞造成的损伤。因此,本实验表明,RhoA/Rock信号通路参与了人腹膜间皮细胞的氧化应激反应,抑制RhoA/Rock信号通路的激活可有效阻止腹膜间皮细胞氧化应激反应的发生,从而防止腹膜间皮细胞受到损伤,最终可防止及延缓腹膜纤维化的发生。但由于本实验只观察到Rock抑制剂可降低ROS的过表达,而ROS是否就是RhoA/Rock的下游效应分子尚无法证明,本实验也尚未证明氧化应激指标及纤维化指标的变化有无时间先后,因此,更有待于进一步深入研究。
1 Nascimento MM,Suliman ME,Silva M,et al.Effect of oral N-acetylcysteine treatment on plasma inflammatory and oxidative stress markers in peritoneal dialysis patients:a placebo-controlled study.Perit Dial Int,2010,30(3):336-342.
2 Kuo HT1,Lee JJ,Hsiao HH,et al.N-acetylcysteine prevents mitochondria from oxidative injury induced by conventional peritoneal dialysate in human peritoneal mesothelial cells.Am J Nephrol,2009,30(3):179-185.
3 Calabrese F,Baraldo S,Bazzan E,et al.IL-32,a novel proinflammatory cytokine in chronic obstructive pulmonary disease.Am J Respir Crit Care Med,2008,178(9):894-901.
4 Shimokawa H,Takeshita A.Rho-kinase is an important therapeutic target in cardiovascular medicine.Arterioscler Thromb Vasc Biol,2005,25(9):1767-1775.
5 Dobbie JW.Pathogenesis of peritoneal fibrosing syndromes (sclerosing peritonitis) in peritoneal dialysis.Perit Dial Int,1992,12(1):14-27.
6 Ishikawa Y,Nishikimi T,Akimoto K,et al.Long-term administration of rho-kinase inhibitor ameliorates renal damage in malignanthypertensive rats.Hypertension,2006,47(6):1075-83.
7 Raha S,Robinson BH.Mitochondria,oxygen free radicals,and apoptosis.Am J Med Genet,2001,106(1):62-70.
8 Green K,Brand MD,Murphy MP.Prevention of mitochondrial oxidative damage as a therapeutic strategy indiabetes.Diabetes,2004,53(Suppl 1):S110-118.
9 Soliman H,Gador A,Lu YH,et al.Diabetes-induced increased oxidative stress in cardiomyocytes is sustained by a positive feedback loop involving Rho kinase and PKCβ2.Am J Physiol Heart Circ Physiol,2012,303(8):H989-H1000.
10 Chen J,Li Q,Dong R,et al.The effect of the Ras homolog gene family (Rho),member A/Rho associated coiled-coil forming protein kinase pathway in atrial fibrosis of type 2 diabetes in rats.Exp Ther Med,2014,8(3):836-840.
11 Masszi A,Di Ciano C,Sirokmány G,et al.Central role for Rho in TGF-beta1-induced alpha-smooth muscle actin expression during epithelial-mesenchymal transition.Am J Physiol Renal Physiol,2003,284(5):F911-924.
12 Washida N,Wakino S,Tonozuka Y,et al.Rho-kinase inhibition ameliorates peritoneal fibrosis and angiogenesis in a rat model of peritoneal sclerosis.Nephrol Dial Transplant,2011,26(9):2770-2779.
13 Peng W,Zhou Q,Ao X,et al.Inhibition of Rho-kinase alleviates peritoneal fibrosis and angiogenesis in a rat model of peritoneal dialysis.Ren Fail,2013,35(7):958-966.
14 Watts KL,Cottrell E,Hoban PR, RhoA signaling modulates cyclin D1 expression in human lung fibroblasts; implications for idiopathic pulmonary fibrosis.Respir Res,2006,7:88.
15 彭卫生,周巧玲,唐荣,等.法舒地尔对腹膜透析大鼠腹膜间皮细胞转分化的影响.肾脏病与透析肾移植杂志,2013,22(2):134-139.
16 刘小贤,张浩,孙剑,等.TGF-β1对大鼠腹膜间皮细胞转分化的影响及其机制.中南大学学报,2010,35(2):159-164.
(本文编辑 加 则)
Effect of fasudil on RhoA/Rock1, ROS, GSH-Px and TGF-β1 expression of mesothelial cells with high glucose condition
HUYe,BIANAishu,YANGLina,FANYi,MAJianfei
DepartmentofNephrology,TheFirstAffiliatedHospitalofChinaMedicalUniversity,Shenyang110001,China
MAJianfei(E-mail:majiangfei@medmail.com)
Objective:To investigate the influence of fasudil on the expression of RhoA/Rock1, ROS, GSH-Px and TGF-β1 of human peritoneal mesothelioma cell line (HMrSV) cells incubated with high glucose. Methodology:HMrSV were divided into control group, high glucose group (the concentrations of glucose were 1.5%, 2.5% and 4.25%) and fasudil treatment group (glucose 2.5% + the concentrations of fasudil were 12.5, 25 and 50 μmol/L).The mRNA and protein expression levels of RhoA and Rock1 were detected with Q-PCR and Western blot, the expression of ROS was detected with chemical fluorescence, the protein content of GSH-Px and TGF-β1 in the supernatant were detected with ELISA. Results:Compared with the control group, glucose could increase the expression of RhoA, Rock1, ROS and TGF-β, and down-regulate the expression of GSH-Px in a concentration dependent manner (P<0.05). Fasudil could down-regulate the expression of RhoA, Rock1, ROS and TGF-β1, and increase the expression of GSH-Px (P<0.05). Conclusion:Fasudil can inhibit high glucose-induced oxidative stress response of HMrSV cells and it may produce effect through the inhibition of Rho kinase activity.
Rho/Rho kinase oxidative stress peritoneal dialysis peritoneal fibrosis fasudil
10.3969/cndt.j.issn.1006-298X.2017.02.009
国家自然科学基金(81370865)
中国医科大学附属第一医院肾内科(沈阳,110001)
马健飞(E-mail:majiangfei@medmail.com)
2016-09-09
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
