伴抗磷脂综合征狼疮性肾炎患者的临床特点及预后
2017-05-09刘正钊周敏林胡伟新章海涛
刘 洋 刘正钊 周敏林 杨 静 任 强 胡伟新 章海涛
伴抗磷脂综合征狼疮性肾炎患者的临床特点及预后
刘 洋 刘正钊 周敏林 杨 静 任 强 胡伟新 章海涛
目的:探讨伴抗磷脂综合征(APS)狼疮性肾炎(LN)患者的临床病理特点及肾脏远期预后。 方法:回顾性分析2002年至2014年期间在南京军区南京总医院肾脏科经肾活检确诊为LN且符合APS分类标准的汉族患者,并与同期不伴APS的LN患者比较,分析其临床表现、肾组织病理特点及肾脏远期预后差异。 结果:共收集53例合并APS的LN患者,随机选择106例不伴APS的LN患者,发现APS组患者在狼疮活动、血栓发生、心脏受累及抗凝药物的应用上明显高于对照组(P<0.05);而在LN病程、高血压、蛋白尿、血尿、血清白蛋白(Alb)、血清肌酐(SCr)、血红蛋白(Hb)、白细胞(WBC)、血小板(PLT)减少、自身抗体、补体水平及诱导方案的选择和治疗反应方面无明显差异。APS组患者血栓性微血管病所占比例更高。随访63.7个月两组肾脏存活率未见统计学差异。 结论:伴APS的LN患者疾病活动性更强、血栓事件和心脏受累更为常见,抗凝应用更为积极,但肾脏预后与不伴APS的患者未见明显统计学差异。
狼疮性肾炎 抗磷脂综合征 预后 血栓
抗磷脂综合征(APS)是以全身动静脉血栓形成、反复病态妊娠及血清抗磷脂抗体(APL)阳性为特点的非炎症性自身免疫病。可累及血液、神经、心肺等系统,肾损害多表现为肾动脉狭窄、肾静脉血栓、高血压甚至终末期肾病(ESRD)。文献报道欧洲人群中原发性APS发病率较高,来自欧洲13个国家的1 000例患者中原发性APS占53.1%,继发于系统性红斑狼疮(SLE)的APS占36.2%[1]。
狼疮性肾炎(LN)的远期预后与多种因素相关,杨静等分析了南京军区南京总医院肾脏科1 814例狼疮患者,显示性别、LN病程、平均动脉压、尿蛋白定量、血清肌酐(SCr)、血红蛋白(Hb)、补体水平及病理类型是ESRD的独立危险因素[2]。当合并APS时,LN患者的临床特点和预后需重新评估。国外研究发现APS是狼疮患者发生不可逆性器官损害和死亡的预测因素[3]。国内相关研究较少,且未见APS对SLE病死率及肾脏预后的影响[4]。本文回顾性分析了南京军区南京总医院肾脏科长期随访的伴APS的LN患者的临床、病理特点及肾脏预后,并与同期不伴APS的LN患者进行比较。
对象和方法
研究对象 收集2002年至2014年期间在南京军区南京总医院肾脏科经肾活检确诊为LN[5]且符合APS分类标准[6]的患者。对照组为同期肾活检确诊为LN不伴APS的患者,经SPSS统计软件以“选择个案——随机个案样本”的方式进行随机选择(图1)。所有患者均符合1997年美国风湿病学会(ACR)修订的SLE分类标准[7],具有肾脏受累的临床表现及实验室证据,经肾活检病理证实为LN。
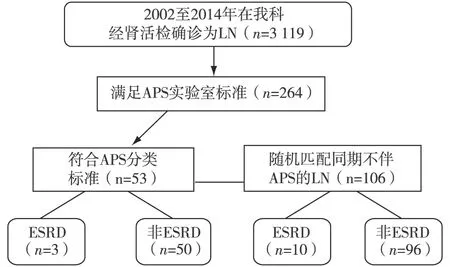
图1 患者纳入流程图LN:狼疮性肾炎;APS:抗磷脂综合征;ESRD:终末期肾病
临床指标 (1)基本资料:性别、年龄、LN病程、血压;(2)实验室检查:Hb、WBC、PLT、SCr、Alb、24h尿蛋白定量、尿沉渣红细胞计数、补体C3、C4、ANA、抗ds-DNA、抗Sm抗体;(3)心脏受累包括出现心律失常、心力衰竭的临床表现及彩色多普勒超声检查提示“心包积液、瓣膜反流、心脏舒张功能不全和(或)肺动脉高压”等病理情况;(4)血栓:除血栓临床症状外,均经影像学(CT/B超)证实有血栓存在和(或)肾组织活检病理证实肾小球毛细血管袢内血栓和(或)间质血管血栓存在;(5)据 2000年SLE疾病活动性指数[8]评定SLE-DAI分值;(6)抗凝药物包括华法林、低分子肝素、阿司匹林和(或)氯吡格雷;(7)诱导治疗包括环磷酰胺(CTX)、吗替麦考酚酯(MMF)、他克莫司(FK506)、多靶点(MT)方案(激素联合MMF、FK506)或其他(雷公藤多苷及单用激素诱导);(8)疗效判断包括完全缓解和部分缓解,前者指尿蛋白定量<0.4 g/24h、Alb≥35 g/L、SCr正常;后者指尿蛋白较基础值减少>50%且尿蛋白定量<3.5 g/24h、Alb≥30 g/L、SCr稳定(升高不超过基线的25%)。
肾脏病理 根据2003年国际肾脏病学会/肾脏病理学会(ISN/RPS)LN病理分型标准[5],结合光镜、电镜、免疫荧光染色对肾活检病理标本进行分型,观察有无肾小球内血栓、间质血管血栓及血栓性微血管病(TMA)表现,球性硬化、节段硬化及新月体比例,活动性病变评分(AI)、慢性化评分(CI)[9]。
检测方法 APL检测包括抗心磷脂抗体(IgG/IgM亚型)、抗β2糖蛋白Ⅰ抗体和狼疮抗凝物。采用酶联免疫吸附试验(ELISA)法检测血清抗心磷脂抗体和抗β2糖蛋白Ⅰ抗体;采用凝固法检测狼疮抗凝因子。
定义 主要终点为ESRD,次要终点为SCr倍增。ESRD定义为eGFR<15 ml/(min·1.73m2)或者肾脏替代治疗持续>3个月;肌酐倍增定义为随访期间出现SCr较基线升高1倍及以上。LN病程定义为LN 起病至接受肾活检的间隔时间;随访时间定义为肾活检日期与末次随访日期的时间间隔;高血压定义为需要服降压药,或未用降压药时收缩压≥140 mmHg和(或)舒张压≥90 mmHg。镜下血尿定义为尿沉渣红细胞≥10万/ml;血小板减少定义为 PLT<10×109/L;白细胞数减少定义为WBC<3.5×109/L。
APS诊断标准 临床标准:(1)血栓形成:经影像学/组织学证实1次以上动/静脉、小血管血栓。(2)病态妊娠:妊娠≥10周形态学正常的胎儿死亡≥1次;妊娠满34周前的新生儿早产≥1次;妊娠满10周前习惯性自发性流产≥3次。实验室标准:(1)狼疮抗凝因子阳性≥2次,间隔至少12周;(2)血清中检测到抗心磷脂抗体≥2次(lgG型>40 GPL;lgM型>40 MPL),间隔至少12周;(3)血清中检测到抗β2糖蛋白Ⅰ抗体≥2次(滴度>99的百分位数),间隔至少12周。满足至少1项临床标准和1项实验室标准,APS的诊断方成立[6]。
统计方法 采用SPSS19.0统计学软件进行统计分析。计量资料中正态分布者以“均数±标准差”表示,组间比较采用t检验;非正态分布者以“中位数(四分位间距)”表示,组间比较采用Man-Whitney Wilcoxon检验。计数资料以例数(百分率)表示,组间比较采用卡方检验或Fisher精确检验。以Graphpad Prism 5.0绘制生存曲线。采用单因素COX回归模型计算各个指标的风险比值(HR),将单因素分析有差异性的变量纳入多因素COX回归模型。P<0.05为差异有统计学意义。
结 果
LN伴APS患者的临床病理特征 本研究收集LN/APS患者53例,其中女性46例,男性7例。中位SCr 77.8 μmol/L,Hb 97 g/L,WBC、PLT减少率分别为17%、28.3%, ANA、抗ds-DNA、Sm抗体阳性率依次为96.2%、62.3%、30.2%。38例(71.7%)患者出现心脏受累,其中左室舒张功能减低23例,瓣膜病变20例,二尖瓣受累17例(瓣叶增厚、脱垂、钙化各1例,其余为瓣膜返流),三尖瓣、主动脉瓣受累分别有2例、10例,另有室间隔增厚3例,心包积液16例,心律失常3例(窦性心动过速2例,窦性心动过缓1例),合并肺动脉高压1例(50.3 mmHg)。35例(66%)患者经影像学或组织学检查证实血栓存在。病理类型以Ⅳ型(43.4%)和Ⅳ+Ⅴ型(24.5%)LN最为多见,肾小球毛细血管袢内血栓、间质血管血栓和血栓性微血管病(TMA)表现分别占3.8%、11.3%和9.4%。
两组患者基线资料特征比较 与对照组相比,APS组患者狼疮疾病活动性更高,血栓事件及心脏受累更为常见,抗凝药物应用更为积极(P<0.05);但在LN病程、高血压、蛋白尿、血尿、Alb、SCr、Hb、WBC或PLT减少、自身抗体、补体水平、诱导方案的选择和治疗反应方面未见明显差异(表1)。
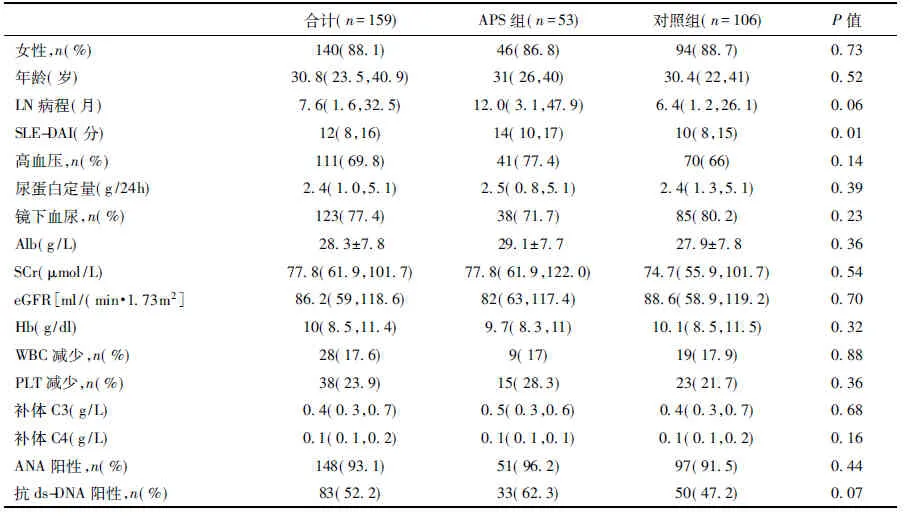
表1 两组患者的基线临床资料
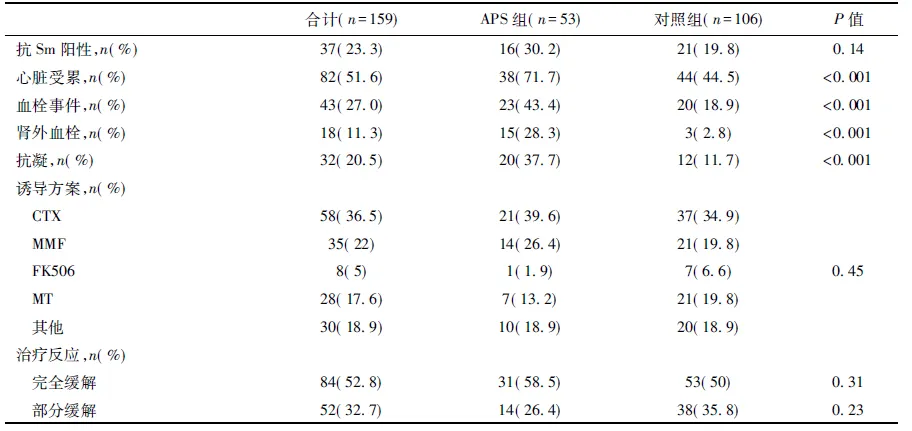
续表1
APS:抗磷脂综合征;LN:狼疮性肾炎;Alb:血清白蛋白;SCr:血清肌酐;eGFR:估算的肾小球滤过率;Hb:血红蛋白;PLT:血小板; ANA:抗核抗体;CTX:环磷酰胺;MMF:吗替麦考酚酯;FK506:他克莫司;MT:多靶点,激素联合MMF、FK506
病理特点比较 APS组患者间质血管血栓和TMA所占比例更高(11.3%vs3.8%和9.4%vs7.5%),肾小球毛细血管袢内血栓形成在两组之间的比较有统计学差异。但两组患者在球性硬化、节段硬化、新月体比例及AI、CI评分上无统计学差异(表2)。
LN/APS患者的肾脏预后 随访63.7(42.2,81.4)月, APS组患者有10例(18.9%)出现肌酐倍增,3例(5.7%)进展至ESRD,对照组有14例(13.2%)出现肌酐倍增,10例(9.4%)进展至ESRD;两组肾脏存活率未见统计学差异(图2)。
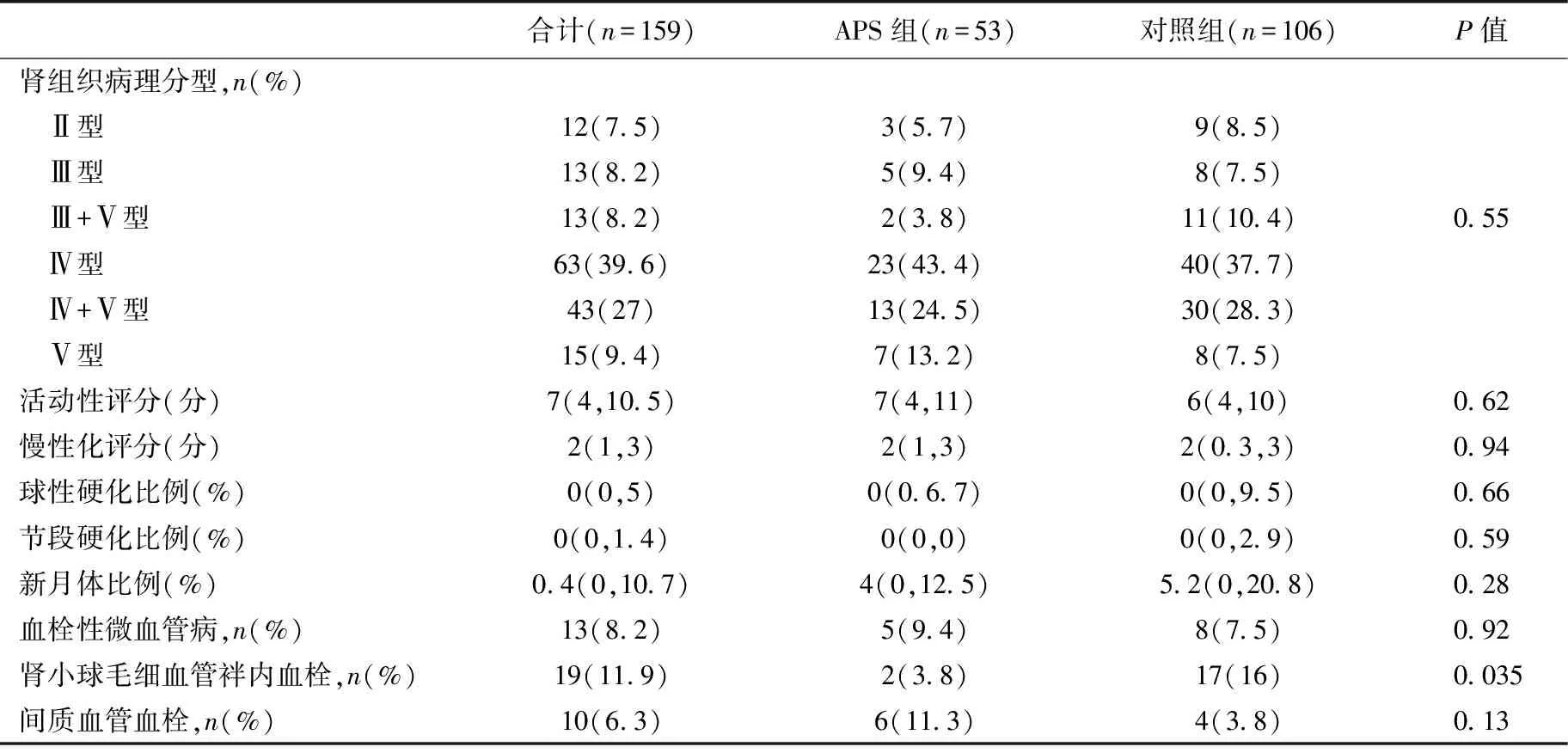
表2 两组患者的肾脏病理特点
APS:抗磷脂综合征
影响预后的多因素分析 选择APS组患者基线临床病理指标经单因素COX回归筛选,将单因素结果有统计学意义的指标(CI)和有临床意义的指标(SCr、血栓、抗凝)纳入多因素COX回归分析,结果显示CI是LN伴APS患者预后的独立危险因素(表3)。
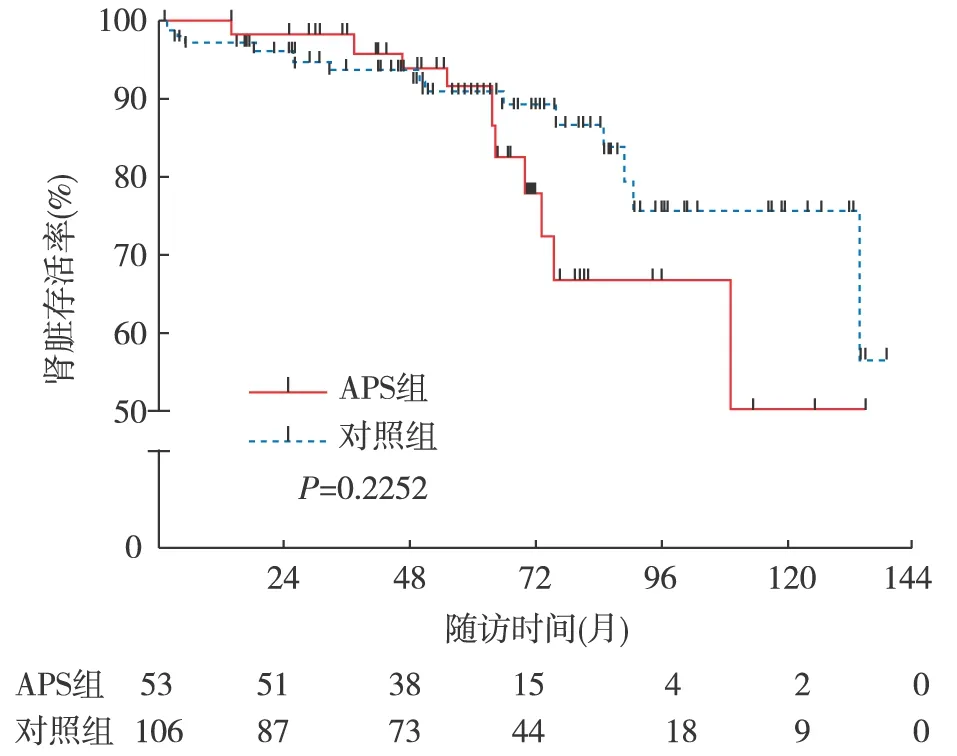
图2 伴抗磷脂综合征(APS)与不伴APS的狼疮性肾炎患者肾脏存活率比较
讨 论
SLE是一种可累及全身各系统的自身免疫性疾病,LN主要是由免疫复合物介导的肾小球肾炎。APS是一种非炎症性自身免疫病,肾脏易受累。二者在某种程度上具有共同的遗传背景[10],研究报道伴APL的狼疮患者在随访20年后将有约50%~70%进展至APS[11]。“Euro-Phospholipid”project在其随访期间发现入组时诊断为原发性APS的患者中有3例需被归为SLE相关性APS[12],提示我们加强狼疮患者长期随访及对APS认识的重要性。
本文回顾性分析了经肾活检证实为LN合并APS患者的临床病理特点,与对照组相比,APS组患者狼疮活动更明显,与国外研究结果一致[13]。
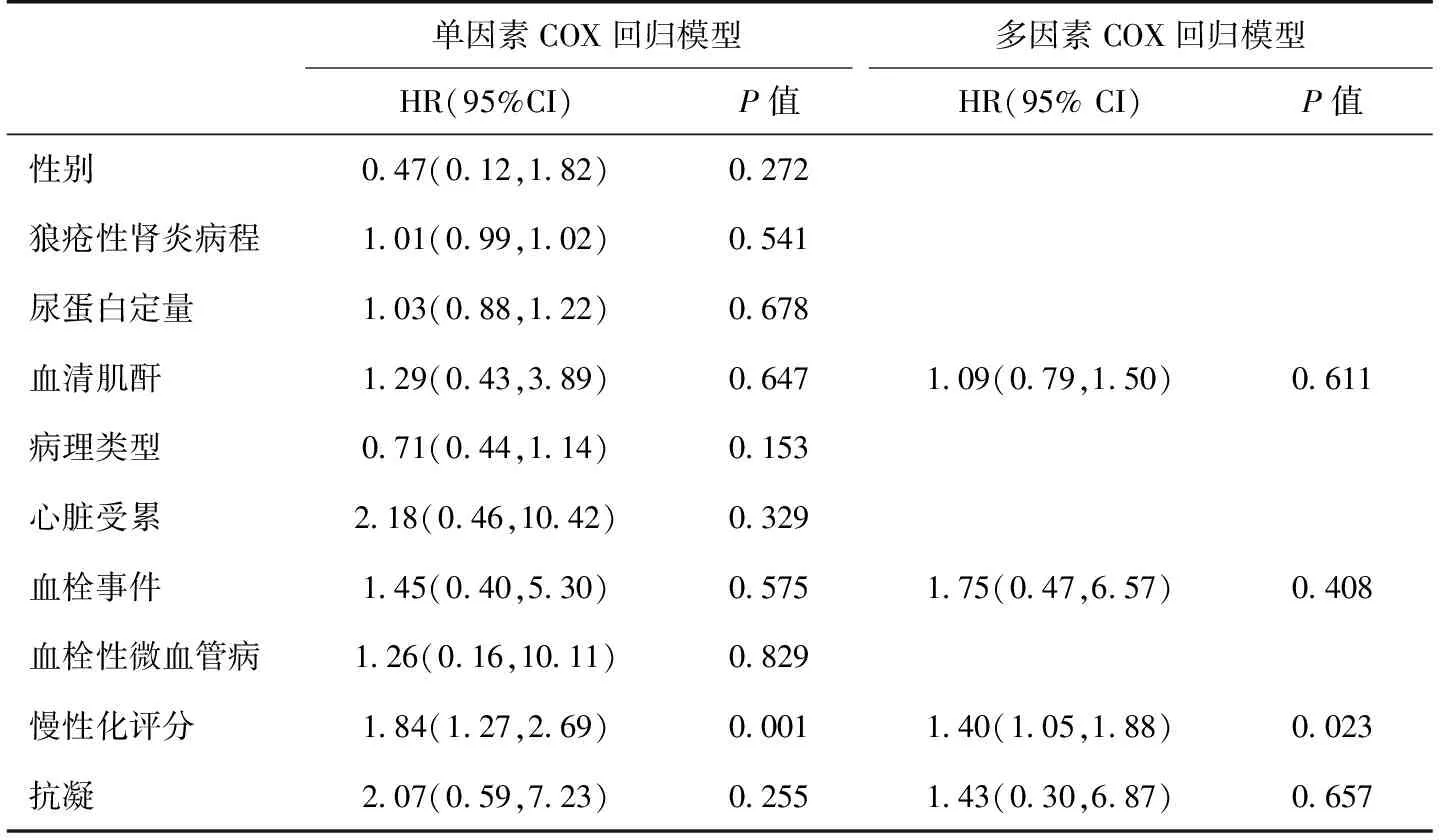
表3 影响抗磷脂综合征组患者肾脏预后的因素
SLE患者心脏受累率高、死亡率高,心脏损害是狼疮患者预后不良的主要原因之一[14];据报道APS患者>40%合并心脏受累[15],多表现为心瓣膜病变、心肌病、肺动脉高压、心功能不全。本研究中LN/APS患者心脏受累率达71.7%,以左室舒张功能减低和瓣膜病变常见,考虑与APL滴度以及相关因素参与炎性过程,激活补体,引起瓣膜增厚、僵化、返流相关。建议追踪患者的心脏瓣膜改变,及时发现心脏病变进展。
本研究发现合并APS的LN患者血栓发生率更高。APS组肾外血栓事件15例(28.3%),肾小球内血栓形成2例(3.8%),间质血管血栓6例(11.3%)。考虑与APS或中高滴度的APL存在,作用于相应血液成分及血管组织[16],损伤血管内壁,激活内外源性凝血途径,生成大量的凝血酶,促进血栓形成有关[17]。肾内微小血栓的出现可影响肾组织血流灌注,肾小球缺血和肾单位丢失,肾功能逐步恶化,造成各系统并发症。据报道合并微血栓的LN患者肾组织损伤更重、肾功能更差[18]。
早期抗凝可改善APL所致的凝血功能障碍,遏制肾功能恶化。本研究中伴APS的LN患者抗凝更为积极,但并未显示出它对肾脏预后的独立影响作用,考虑原因如下:(1)抗凝应用标准尚未统一,尽管推荐合并血栓者终生服用华法林预防复发,但也有因血白蛋白低需要预防性抗凝的情况;(2)抗凝强度尚未统一,仅有约25%的RCT研究患者存在动脉血栓事件[19],对于APS伴肾动脉血栓或复发性肾静脉血栓的患者其抗凝强度存在争议;(3)本次研究对象病情相对较轻,不具备普遍代表性。
虽然合并血栓的LN患者肾功能恶化更为明显,本文发现伴APS组患者血栓发生率明显高于对照组,但并未显示血栓是患者预后的独立危险因素。
关于伴APS狼疮患者预后情况的研究并不多见,尚未形成一致意见。本研究发现CI是LN伴APS患者预后的独立危险因素,提示我们要重视肾组织慢性化病变,及时采取必要措施改善肾脏预后[2]。本研究结果不够理想考虑影响因素如下:(1)病例数量有限;(2)纳入对象均行肾活检,相对于整体APS患者而言,患者病情相对较轻;(3)以心脏受累为例,此处变量定义为有心脏病变即为阳性,而LN或其他疾病也可有心脏受累,无法完全排除干扰因素。
本文存在一定的局限性,为单中心回顾性研究,纳入的病例均行肾活检,未选择重症、血栓严重、无条件接受肾活检的患者,病例数量有限,随访期间抗凝治疗监测不完善。
小结:本文回顾性分析了53例合并APS的LN患者临床病理特点,与不伴APS的LN相比,这类患者临床上疾病活动更加明显,心脏受累和血栓事件更常见,但两组肾脏远期预后无统计学差异。关于LN伴APS患者的抗凝治疗有待于进一步研究。
1 Cervera R,Piette JC,Font J,et al.Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1,000 patients.Arthritis and rheumatism,2002,46(4):1019-1027.
2 杨静,梁丹丹.狼疮性肾炎患者肾脏远期生存率及影响因素.肾脏病与透析肾移植杂志,2014,23(5):407-411.
3 Ruiz-Irastorza G,Egurbide MV,Ugalde J,et al.High impact of antiphospholipid syndrome on irreversible organ damage and survival of patients with systemic lupus erythematosus.Arch Intern Med,2004,164(1):77-82.
4 俞雯清,文煜冰,高瑞通,等.系统性红斑狼疮并发继发性抗磷脂综合征肾损害11例临床病理分析.中华肾脏病杂志,2010,26(12):875-879.
5 Weening JJ,D'Agati VD,Schwartz MM,et al.The classification of glomerulonephritis in systemic lupus erythematosus revisited.J Am Soc Nephrol,2004,15(2):241-250.
6 Miyakis S,Lockshin MD,Atsumi T,et al.International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS).J Thromb Haemost,2006,4(2):295-306.
7 Hochberg MC.Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus.Arthritis Rheum,1997,40(9):1725.
8 Gladman DD,Ibaez D,Urowitz MB.Systemic lupus erythematosus disease activity index 2000.The Journal of rheumatology,2002,29(2):288-291.
9 Austin HA 3rd,Muenz LR,Joyce KM,et al.Prognostic factors in lupus nephritis.Contribution of renal histologic data.The American journal of medicine,1983,75(3):382-391.
10 Horita T,Atsumi T,Yoshida N,et al.STAT4 single nucleotide polymorphism,rs7574865 G/T,as a risk for antiphospholipid syndrome.Ann Rheum Dis,2009,68(8):1366-1367.
11 Opatrny L,David M,Kahn SR,et al.Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a metaanalysis.J Rheumatol 2006,33(11):2214-2221.
12 Cervera R,Serrano R,Pons-Estel GJ,et al.Morbidity and mortality in the antiphospholipid syndrome during a 10-year period: a multicentre prospective study of 1000 patients.Ann Rheum Dis,2015,74(6):1011-1018.
13 Deák M,Bocskai M,Burcsár S,et al.Non-thromboembolic risk in systemic lupus erythematosus associated with antiphospholipid syndrome.Lupus,2014,23(9):913-918.
14 Bernatsky S,Boivin JF,Joseph L,et al.Mortality in systemic lupus erythematosus.Arthritis and rheumatism,2006,54(8):2550-2557.
15 Cervera R.Coronary and valvular syndromes and antiphospholipid antibodies.Thromb Res,2004,114(5-6):501-507.
16 Nzerue CM,Hewan-Lowe K,Pierangeli S,et al."Black swan in the kidney": renal involvement in the antiphospholipid antibody syndrome.Kidney Int,2002,62(3):733-744.
17 Roubey RA.Update on antiphospholipid antibodies.Curr Opin Rheumatol,2000,12(5):374-378.
18 Zheng H,Chen Y,Ao W,et al.Antiphospholipid antibody profiles in lupus nephritis with glomerular microthrombosis: a prospective study of 124 cases.Arthritis Res Ther,2009,11(3):R93.
19 Pons-Estel GJ,Cervera R.Renal involvement in antiphospholipid syndrome.Current rheumatology reports,2014,16(2):397.
(本文编辑 凡 心)
Clinical characteristics and outcome of lupus patients with antiphospholipid syndrome
LIUYang,LIUZhengzhao,ZHOUMinlin,YANGJing,RENQiang,HUWeixin,ZHANGHaitao
NationalClinicalResearchCenterofKidneyDiseases,JinlingHospital,NanjingUniversitySchoolofMedicine,Nanjing,210016,China
ZHANGHaitao(E-mail:htzhang163@163.com)
Objective:To explore the clinical and pathological characteristics as well as renal prognosis of lupus patients with secondary antiphospholipid syndrome. Methodology:Patients diagnosed as lupus nephritis (LN) by renal biopsy in our institute between 2002 and 2014 were retrospectively reviewed.They should conform to the classification criteria for antiphospholipid syndrome (APS) at the same time.Patients of lupus nephritis without antiphospholipid syndrome were chosen.The clinical,pathological characteristics as well as renal prognosis were analyzed between two groups. Results:53 LN patients accompanied APS and 106 LN without APS chose at random were enrolled in this study.By statistical analysis,patients in APS group were obviously higher in lupus disease activity,the incidence of heart involvement and thrombosis as well as choice of anticoagulants than patients in the control(P<0.05);while there were no significant differences in the course of disease,hypertension,urinary protein of 24 hours,hematuresis,serum albumin,serum creatinine,hemoglobin,leukopenia,thrombocytopenia,autoantibodies,complements,induction medications or treatment response.The rate of thrombotic microangiopathy in kidney tissues were higher in APS group.There were respectively 10 and 14 patients having double creatinine,3 and 10 patients progressing into end-stage renal disease(ESRD) after 63.7 months follow-up. Conclusion:LN patients with APS showed more serious disease activity,they were more inclined to have thrombosis,heart involvement.While no significant difference of renal outcome between the two groups were found by the existing data.
lupus nephritis antiphospholipid syndrome outcome thrombosis
10.3969/cndt.j.issn.1006-298X.2017.02.005
国家重点研发计划课题(2016YFC0904103);国家科技支撑计划课题(2015BAI12B02,2015BAI12B05)
南京大学医学院附属金陵医院(南京军区南京总医院)肾脏科 硕士研究生(刘 洋)国家肾脏疾病临床医学研究中心 全军肾脏病研究所(南京,210016)
章海涛(E-mail:htzhang163@163.com)
2016-11-25
ⓒ 2017年版权归《肾脏病与透析肾移植杂志》编辑部所有
