microRNA-192在晚期糖基化终产物诱导人腹膜间皮细胞上皮-间叶转化中的作用
2017-11-07邵维斌夏春英冯松涛
邵维斌, 路 萍, 夏春英, 李 忻, 荀 康, 冯松涛, 赵 倩
(江苏省镇江市第一人民医院 肾脏内科, 江苏 镇江, 212002)
microRNA-192在晚期糖基化终产物诱导人腹膜间皮细胞上皮-间叶转化中的作用
邵维斌, 路 萍, 夏春英, 李 忻, 荀 康, 冯松涛, 赵 倩
(江苏省镇江市第一人民医院 肾脏内科, 江苏 镇江, 212002)
目的探讨microRNA-192(miR-192)对晚期糖基化终产物(AGEs)诱导人腹膜间皮细胞上皮-间叶转化(EMT)的调控作用。方法人腹膜间皮细胞、转染miR-192抑制物后人腹膜间皮细胞和转染miR-192抑制物阴性对照的人腹膜间皮细胞在含AGEs的培养基培养72 h, 以M199培养基和含80 mM BSA的M199培养基为对照,然后运用实时荧光定量PCR法检测miR-192和mRNA的表达情况,运用蛋白质印迹法检测蛋白的表达情况。结果在AGEs刺激后,人腹膜间皮细胞miR-192、胶原蛋白I(CollagenI)mRNA、α-平滑肌肌动蛋白(α-SMA)mRNA和蛋白表达水平显著上升 (P<0.05),而E-钙黏蛋白(E-cadherin) mRNA和蛋白表达水平显著下降(P<0.05)。与转染miR-192抑制物阴性对照的人腹膜间皮细胞相比,转染miR-192抑制物的人腹膜间皮细胞miR-192、Collagen I mRNA、α-SMAmRNA和蛋白表达水平显著下降 (P<0.05),而E-cadherin mRNA和蛋白表达水平显著上升(P<0.05)。结论AGEs可能通过上调miR-192表达诱导人腹膜间皮细胞EMT。miR-192抑物可能通过下调miR-192表达阻止AGEs诱导人腹膜间皮细胞EMT。miR-192在AGEs诱导人腹膜间皮细胞EMT中起重要调控作用。
晚期糖基化终产物; 间皮细胞; 上皮-间叶转化; microRNA-192
随着腹膜透析的进行,腹膜会出现新生血管和纤维化等结构改变,引起腹膜功能衰竭[1-2]。透析液中高浓度葡萄糖、AGEs等可引起腹膜间皮细胞E-钙黏蛋白等表达下降, α-平滑肌肌动蛋白等表达上升,发生EMT[3-4], 腹膜间皮细胞EMT可能在腹膜发生新生血管形成和纤维化等结构改变的过程中起主导作用[4-5]。MicroRNA是一类非编码小RNA, 参与多种疾病调控。研究[6-7]发现, microRNA-192在糖尿病肾组织细胞转分化和纤维化过程中起重要调控作用。本研究探讨microRNA-192在AGEs诱导人腹膜间皮细胞EMT中的调控作用,现报告如下。
1 材料与方法
1.1 原代人腹膜间皮细胞的培养
人腹膜间皮细胞分离、培养及鉴定参照文献[8]的方法进行。
1.2 分组
① 对照组, M199培养基; ② AGEs, 含80 mM AGEs-BSA的M199培养基; ③ 牛血清白蛋白(BSA)组,含80 mM BSA的M199培养基。第3代人腹膜间皮细胞在上述各组培养基中培养72 h; ④ miR-192抑制物组,转染miR-192抑制物的腹膜间皮细胞,在含80 mM AGEs-BSA的M199培养基培养72 h; ⑤ miR-192抑制物对照组,转染阴性对照的人腹膜间皮细胞在含80 mM AGEs-BSA的M199培养基72 h。
1.3 实时荧光定量PCR法检测miRNA-192和
E-cadherin mRNA、α-SMA mRNA、Collagen
I mRNA的表达情况
细胞总RNA抽提按Trizol试剂盒的方法进行,转录按照cDNA逆转录试剂盒说明书进行,运用实时定量PCR试剂盒检测,按公式2-△△Ct求出基因表达量[9]。E-cadherin、-SMA、CollagenI、miRNA-192引物序列及相关条件见文献[7, 10]。
1.4 蛋白质印迹法检测E-cadherin、α-SMA蛋白
的表达[10]
人腹膜间皮细胞裂解蛋白经SDS-PAGE凝胶电泳后电转移至PVDF膜,用5%脱脂奶粉封闭2 h后,分别加入小鼠抗E-cadherin抗体(美国BD)、小鼠抗α-SMA抗体和小鼠抗β-actin抗体4 ℃过夜,洗膜后加辣根过氧化酶标记的人抗小鼠IgG抗体, 37 ℃1.5 h, 洗膜后加ECL试剂, X线自显影显示结果。
1.5 抑制物的合成与转染
miR-192抑制物,序列为5-GGCUGUCAAUUCAUAGGUCAG-3(购自上海吉玛生物公司),抑制阴性对照寡核苷酸,序列为5″-CAGUACUUUUGUGUAGUACAA-3(购自上海吉玛生物公司)。按照试剂说明书进行转染操作。
1.6 统计学方法
各组间资料比较用方差分析,两两比较用Student-Newman-Keals 检验(运用SAS软件进行统计分析)。P<0.05为差异有统计学意义。
2 结 果
2.1 AGEs对人腹膜间皮细胞microRNA-192、α-SMA、E-cadherin、和Collagen I mRNA表达的影响
实时定量PCR检测结果显示,与对照组及BSA组相比, AGEs刺激72 h后, microRNA-192、Collagen I和α-SMA mRNA的表达水平显著上升(P<0.05), 而E-cadherin mRNA表达水平显著下降(P<0.05)。见图1。

与对照组及BSA组相比,#P<0.05。图1 AGEs刺激后间皮细胞E⁃cadherin、α⁃SMA、CollagenImRNA和microRNA⁃192的相对表达情况
2.2 AGEs对人腹膜间皮细胞α-SMA、E-cadherin蛋白表达的影响
蛋白质印迹法结果显示,与对照组及BSA组相比, AGEs刺激72 h后, α-SMA蛋白表达水平显著增加(P<0.05), 而E-cadherin 蛋白表达水平显著下降(P<0.05)。见图2。
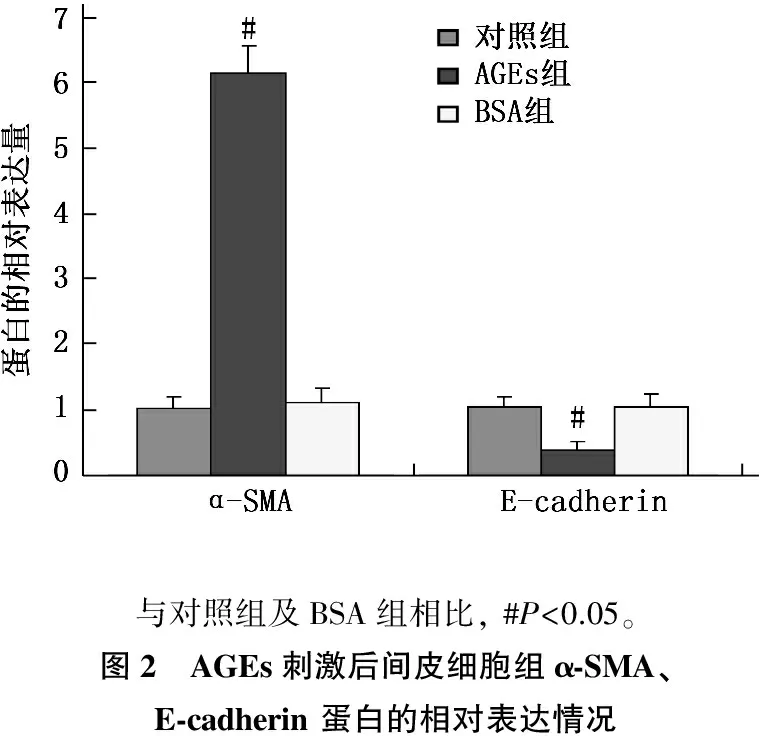
与对照组及BSA组相比,#P<0.05。图2 AGEs刺激后间皮细胞组α⁃SMA、E⁃cadherin蛋白的相对表达情况
2.3 microRNA-192抑制物对在AGEs刺激后人腹膜间皮细胞E-cadherin、α-SMA、CollagenI mRNA、microRNA-192表达的影响
实时定量PCR检测结果显示,与miR-192抑制物对照组相比, microRNA-192抑制物转染后人腹膜间皮细胞在AGEs刺激72 h后, microRNA-192、Collagen I mRNA、α-SMA表达水平显著下降(P<0.05),而E-cadherin mRNA表达水平显著上升(P<0.05)。见图3。
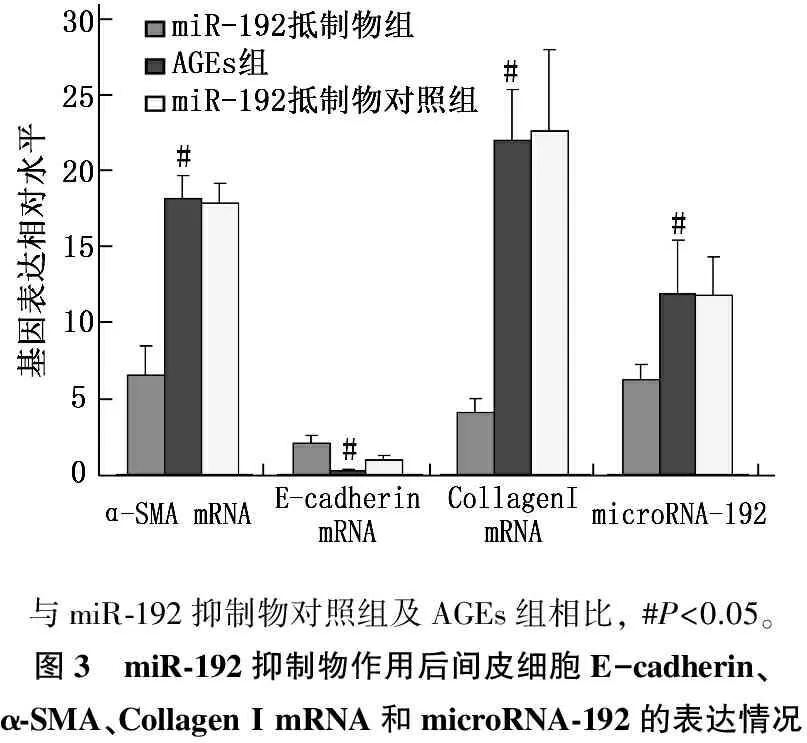
与miR⁃192抑制物对照组及AGEs组相比,#P<0.05。图3 miR⁃192抑制物作用后间皮细胞E-cadherin、α⁃SMA、CollagenImRNA和microRNA⁃192的表达情况
2.4 microRNA-192抑制物对在AGEs刺激后人
腹膜间皮细胞α-SMA、E-cadherin蛋白表达的影响
Western 印迹结果显示,与miR-192抑制物对照组相比, microRNA-192抑制物转染后人腹膜间皮细胞在AGEs刺激72 h后, α-SMA蛋白表达水平显著下降(P<0.05), 而E-cadherin 蛋白表达水平显著增加(P<0.05)。见图4。
3 讨 论
腹膜透析已成为终末期肾衰患者主要的治疗措施之一。目前,越来越多终末期肾衰患者首选腹膜透析疗法。随着腹膜透析进行,透析液中高浓度葡萄糖、AGEs、葡萄糖降解产物等可引起腹膜结构和功能改变,导致腹膜纤维化和功能衰竭,妨碍了腹膜透析的正常进行。
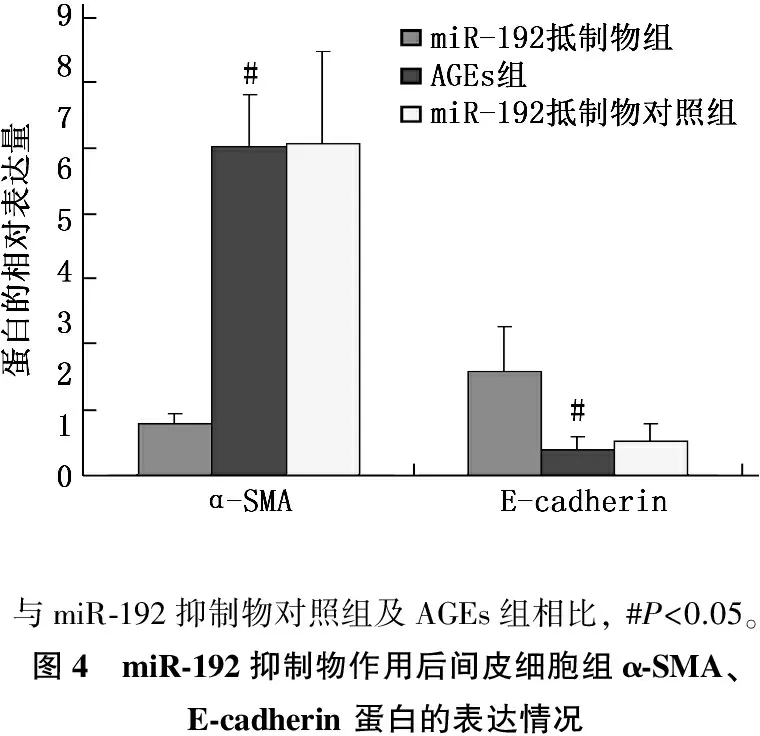
与miR⁃192抑制物对照组及AGEs组相比,#P<0.05。图4 miR⁃192抑制物作用后间皮细胞组α⁃SMA、E⁃cadherin蛋白的表达情况
长期腹膜透析患者腹膜出现表层间皮细胞消失、纤维化、透明样血管病变及大量新生血管形成等病理改变。腹膜明显新生血管形成和纤维化是引起腹膜功能衰竭的主要原因。作者先前的研究发现,高浓度葡萄糖或AGEs等能刺激腹膜间皮细胞转分化[10-11], 发生EMT的腹膜间皮细胞可能是腹膜透析患者腹膜组织中肌纤维母细胞的主要来源之一[4, 12]。这些转分化的腹膜间皮细胞能产生多种细胞因子如血管内皮生长因子、转化生长因子β等细胞因子具有促进血管内皮细胞增殖,刺激体内新血管形成、调节组织分化和参与纤维化等作用,腹膜间皮细胞EMT可能在腹膜新生血管形成和纤维化的过程中起关键作用。这些证据提示腹膜间皮细胞损伤在腹膜透析时腹膜结构和功能改变中起主导作用。因而研究AGEs损伤腹膜间皮细胞的机制对防治腹膜透析时腹膜结构改变和功能衰竭具有重要意义。
MicroRNA是一类内生的、长度约为20~24个核苷酸的功能性非编码小RNA,广泛参与生长发育、细胞分化、细胞凋亡、肿瘤发生等过程[13], 与多种疾病相关[14-16]。最近有研究发现, MicroRNA-192在糖尿病肾组织细胞转分化和纤维化过程中起重要调控作用,但MicroRNA-192对于AGEs引起腹膜间皮细胞EMT过程中是否同样具有调控作用,目前尚不清楚。
本研究发现, AGEs刺激后,人腹膜间皮细胞miR-192、Collagen I mRNA、α-SMA mRNA和α-SMA蛋白表达水平明显上升,而E-cadherin mRNA和E-cadherin蛋白表达水平显著下降,表明AGEs可能通过上调miR-192表达诱导人腹膜间皮细胞EMT。本研究还发现,转染miR-192抑制物的人腹膜间皮细胞经AGEs刺激后miR-192、Collagen I mRNA、α-SMA mRNA和α-SMA蛋白表达水平显著下降,而E-cadherin mRNA和E-cadherin蛋白表达水平显著上升,表明miR-192抑制物可能通过下调miR-192表达阻止AGEs诱导人腹膜间皮细胞EMT。因此miR-192可能在AGEs诱导人腹膜间皮细胞上皮-间叶转化中起重要调控作用。
[1] Mehrotra R, Devuyst O, Davies S J, et al. The Current State of Peritoneal Dialysis[J]. J Am Soc Nephrol, 2016, 27: 3238-3252.
[2] Devuyst O, Margetts P J, Topley N. The pathophysiology of the peritoneal membrane[J]. J Am Soc Nephrol, 2010, 21: 1077-1085.
[3] Vargha R, Endemann M, Kratochwill K. Ex vivo reversal of in vivo transdifferentiation in mesothelial cells grown from peritoneal dialysate effluents[J]. Nephrol Dial Transplant, 2006, 21: 2943-2947.
[4] Aroeira L S, Aguilera A, Sánchez-Tomero J A, et al. Epithelial to Mesenchymal Transition and Peritoneal Membrane Failure in Peritoneal Dialysis Patients: Pathologic Significance and Potential Therapeutic Interventions[J]. J Am Soc Nephrol, 2007, 18: 2004-2013.
[5] Yanez-Mo M, Lara-Pezzi E, Selgas R, et al. Peritoneal dialysis and epithelial-to-mesenchymal transition of mesothelial cells[J]. N Engl J Med, 2003, 348: 403-413.
[6] Putta S, Lanting L, Sun G, et al. Inhibiting microRNA-192 ameliorates renal fibrosis in diabetic nephropathy[J]. J Am Soc Nephrol, 2012, 23: 458-69.
[7] Krupa A, Jenkins R, Luo D D, et al. Loss of MicroRNA-192 promotes fibrogenesis in diabetic nephropathy[J]. J Am Soc Nephrol, 2010, 21: 438-47.
[8] 邵维斌, 钱家麒. 从网膜组织法培养人腹膜间皮细胞[J]. 肾脏病与透析肾移植杂志, 2001, 10: 92-94.
[9] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25: 402-408.
[10] 邵维斌, 荀康, 李忻, 等. 高浓度葡萄糖诱导大鼠腹膜间皮细胞上皮-间叶转化[J]. 实用临床医药杂志, 2010, 17: 4-7.
[11] 邵维斌, 彭淑娟, 夏春英, 等. 晚期糖基化终产物诱导大鼠腹膜间皮细胞上皮-间叶转化[J]. 实用临床医药杂志, 2011, 19: 6-9.
[12] Liu Y, Dong Z, Liu H, et al. Transition of mesothelial cell to fibroblast in peritoneal dialysis: EMT, stem cell or bystander[J]. Perit Dial Int, 2015, 35: 14-25.
[13] Adams B D, Parsons C, Walker L, et al. Targeting noncoding RNAs in disease[J]. J Clin Invest, 2017, 127: 761-771.
[14] Ameis D, Khoshgoo N, Iwasiow B M, et al. MicroRNAs in Lung Development and Disease[J]. Paediatr Respir Rev, 2017, 22: 38-43.
[15] Laffont B, Rayner K J. MicroRNAs in the Pathobiology and Therapy of Atherosclerosis[J]. Can J Cardiol, 2017, 33: 313-324.
[16] Oliveto S, Mancino M, Manfrini N, et al. Role of microRNAs in translation regulation and cancer[J]. World J Biol Chem, 2017, 8: 45-56.
TheroleofmicroRNA-192inprogressionofadvancedglycationendproducts-inducedepithelial-to-mesenchymaltransitionofhumanperitonealmesothelialcells
SHAOWeibin,LUPing,XIAChunying,LIXin,XUNKang,FENGSongtao,ZHAOQian
(DepartmentofNephrology,ZhenjiangFirstPeople′sHospital,Zhenjiang,Jiangsu, 212002)
ObjectiveTo investigate the role of microRNA-192 (miR-192) in the regulation of epithelial mesenchymal transition induced by advanced glycation end products (AGEs) in human peritoneal mesothelial cells.MethodsThe human peritoneal mesothelial cells, the human peritoneal mesothelial cells transfected by miR-192 inhibitor and the human peritoneal mesothelial cells transfected by miR-192 inhibitor negative control were cultured for 72 hours in culture medium containing AGEs (80mM); M199 medium and medium with M199 medium containing 80mM BSA as negative control, the expression of miR-192 and mRNA was detected by real-time quantitative PCR, and the expression of miR-192 and mRNA was detected by Western blotting.ResultsAGEs significantly upregulated the expression of miR-192, Collagen I mRNA, α-smooth muscle actin(α-SMA) mRNA and protein(P<0.05), while significantly downregulated the E-cadherin mRNA and protein expression(P<0.05). Compared with human peritoneal mesothelial cells transfected by miR-192 inhibitor, the expression of miR-192 and Collagen I mRNA and α-SMA mRNA and protein was decreased (P<0.05), while E-cadherin mRNA and protein expression was significantly increased (P<0.05).ConclusionAGEs may induce EMT of human peritoneal mesothelial cells by upregulation of miR-192 expression. MiR-192 inhibitor may prevent AGEs-inducing EMT of human peritoneal mesothelial cells by down-regulation of miR-192 expression, and may play an important regulatory role in EMT of human peritoneal mesothelial cells induced by AGEs.
peritoneal mesothelial cells; epithelial-to-mesenchymal transition; advanced glycation end products; microRNA-192
R 459.5
A
1672-2353(2017)19-095-04
10.7619/jcmp.201719027
2017-05-21
江苏省镇江市科技项目(SH2013051)
