癫痫幼鼠海马丝裂酶原蛋白活化激酶表达的特点及其对巨噬细胞炎性蛋白-α/趋化因子受体5表达的影响
2017-04-27王静茹朱晓波马宇陈少杰王一彪
王静茹,朱晓波,马宇,陈少杰,王一彪
癫痫幼鼠海马丝裂酶原蛋白活化激酶表达的特点及其对巨噬细胞炎性蛋白-α/趋化因子受体5表达的影响
王静茹,朱晓波,马宇,陈少杰,王一彪
目的 探讨癫痫幼鼠海马丝裂酶原蛋白活化激酶(MAPKs)表达的特点及其对巨噬细胞炎性蛋白-α(MIP-1α)/趋化因子受体5(CCR5)表达的影响。方法 应用立体定向技术对侧脑室内注射海人酸(KA),建立幼鼠惊厥模型。将出生21 d的Wistar幼鼠分为空白对照组、磷酸盐缓冲液(PBS)对照组及KA 4 h、8 h、16 h、24 h、3 d组,比较各组MAPKs表达的差异。另将出生21 d的幼鼠分为PBS+二甲亚砜(DMSO)组、KA+DMSO组、KA+PD98059(ERK1/2抑制剂)组和KA+SB203508(p38MAPK抑制剂)组,比较各组MIP-1α、CCR5表达的差异。采用Western Blot方法检测MAPKs蛋白水平及CCR5的表达。采用ELISA方法检测MIP-1α的表达。采用免疫组化染色方法检测各组大鼠海马P-ERK1/2、P-p38MAPKs等蛋白的表达。采用免疫荧光双标染色探讨P-ERK1/2和P-p38MAPK的胶质细胞来源。结果 与空白对照组比较,KA 4 h、8 h、16 h、24 h、3 d组P-ERK1/2水平明显增高;KA 8 h、16 h、24 h、3 d组P-P38MAPK水平明显增高(均P<0.05)。侧脑室注射KA后大鼠P-ERK1/2与P-P38MAPK表达主要分布在齿状回门区和锥体细胞层等神经元损伤明显的海马组织中。在侧脑室注射KA后,部分P-ERK1/2来源于活化的小胶质细胞及星形胶质细胞,而P-p38MAPK仅在小胶质细胞中出现免疫活性表达。与PBS+DMSO组比较,KA+DMSO组、KA+PD98059组和KA+SB203508组大鼠海马组织中MIP-1α、CCR5蛋白水平均明显增高,OX-42阳性细胞数明显增加(均P<0.05)。与KA+DMSO组比较,KA+PD98059组、KA+SB203508组大鼠海马组织中MIP-1α、CCR5蛋白水平均明显降低,OX-42阳性细胞数明显减少(均P<0.05)。结论 在幼鼠癫痫发生的早期阶段,MAPKs(ERK1/2、p38MAPK)可部分地调控MIP-1α/CCR5的表达。
幼鼠;癫痫发生;丝裂原活化蛋白激酶;巨噬细胞炎性蛋白-1α;趋化因子受体5
癫痫是人类神经系统最常见的疾病之一,成年后的癫痫发作或相关神经系统的认知功能等缺陷与婴幼儿期或儿童期的痫性发作有密切的关系。目前,已知癫痫形成过程包含了大量事件,如即刻早期基因的诱导、离子通道及其受体的改变、神经炎性反应、突触重塑及神经发生等。其中神经炎性反应事件在近几年来受到广泛关注。近年来,趋化因子作为多种神经疾患炎性反应的参与者受到广泛关注[1]。前期研究[2]表明,巨噬细胞炎性蛋白-α(MIP-1α)/趋化因子受体5(CCR5)生物轴在癫痫发生的早期阶段发挥重要的生物学功能,但是其表达调控机制尚不清晰。体外研究[3-4]表明,丝裂酶原蛋白活化激酶(MAPKs)信号通路分子可能在调控MIP-1α/CCR5的表达方面发挥重要作用。本研究旨在探讨侧脑室注射海人酸(KA)后幼鼠海马MAPKs的变化规律,及其对MIP-1α和CCR5表达的影响,为进一步的临床研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 幼年健康雄性wistar 大鼠(出生21 d),体质量(55±3)g,由山东大学动物实验中心提供。具体分组如下:实验1:侧脑室注射KA对幼鼠海马内MAPKs活性的影响。大鼠随机分为空白对照组、侧脑室注射磷酸盐缓冲液(PBS)后24 h组(PBS对照组)及侧脑室注射KA后4 h、8 h、16 h、24 h、3 d组(KA 4 h、8 h、16 h、24 h、3 d组),各实验组6~12只大鼠,分别用于Western Blot和/或免疫组化染色检测。实验2:MAPKs对于MIP-1α/CCR5表达的调控。大鼠随机分为PBS+二甲亚砜(DMSO)组、KA+DMSO组、KA+PD98059(ERK1/2抑制剂)组和KA+SB203508(p38MAPK抑制剂)组,每组18只大鼠。在预实验的基础上,分别选取0.5 mmol/L PD98059和1 mmol/L SB203580预处理KA大鼠。在KA(PBS)侧脑室注射后24 h处死所有大鼠,分别用于之后的Western Blot、免疫组化染色及ELISA。
1.1.2 主要试剂和仪器 兔抗P-ERK1/2和ERK1/2抗体、兔抗P-p38MAPK和p38MAPK抗体、兔抗P-CREB和CREB抗体(美国CST公司);兔抗P-JNK和JNK抗体、兔抗P-NF-κB/p65和NF-κB/p65抗体、兔抗P-IκBα和IκBα抗体、兔抗P-MAPKAPK-2和MAPKAPK-2抗体(美国bioworlde 公司);小鼠抗大鼠OX-42单克隆抗体(英国Serotec公司);小鼠抗大鼠ED-1、GFAP单克隆抗体(美国Abcam 公司);小鼠抗大鼠β-actin单克隆抗体(美国Santa Cruz 公司);生物素标记山羊抗小鼠或兔IgG、HRP标记山羊抗兔IgG、兔抗山羊IgG(北京中杉生物技术公司);AMCA标记的山羊抗兔IgG、FICT标记的山羊抗兔IgG、Texas Red 标记的山羊抗小鼠IgG(美国Vector Laboratories)。鼠脑立体定向仪(西安西北光电仪器厂);Leica CMl900恒冷切片机、ST5010型HE 自动染色机、封片机(德国Leica 公司);紫外分光光度计(上海光谱仪器有限公司);BL-420生物数据采集和分析系统(成都泰盟生物技术公司)。
1.2 方法
1.2.1 建立癫痫模型及侧脑室给药 参考大鼠大脑定位立体图谱及相关文献[5-6],侧脑室注射的穿刺坐标定位:前囟后0.6 mm,旁开1.2 mm,深度2.5 mm。将2 nmol KA(2 nmol/μl)以0.2 μl/min速度缓慢注入大鼠侧脑室,建立幼鼠惊厥模型[7]。与KA注射的坐标一致,取其对侧进行干预性药物注射,PD98059、SB203508或DMSO于PBS或KA注射前30 min侧脑室注射。
1.2.2 组织切片和标本的制备 水合氯醛(10%,400 mg/kg)腹腔麻醉、多聚甲醛(4%)主动脉灌注,解剖取脑组织。多聚甲醛固定,梯度酒精脱水、透明、包埋、切片,按照顺序每隔20张取6张为一组,每组取一张成一套,每套约8~10张,切片烤干备用。
1.2.3 Western Blot 称重海马组织,加入蛋白裂解液,研磨,离心,取上清,-80℃保存;溶解蛋白标准品,绘制标准曲线确定各样本蛋白浓度。样品SDS-PAGE凝胶电泳,转膜,一抗、二抗的封闭杂交、显影,数字凝胶成像分析系统进行扫描,以蛋白条带光密度值计算海马内MAPKs的磷酸化、非磷酸化蛋白水平及CCR5的表达。一抗P-ERK1/2、ERK1/2、P-p38MAPK、p38MAPK、P-JNK、JNK、P-MAPKAPK和MAPKAPK-2的稀释比例均为1∶100,CCR5的稀释比例为1∶250,β-actin的稀释比例为1∶5000;二抗为稀释比例为1∶5000的HRP标记兔抗山羊IgG或稀释比例为1∶5000~1∶15000的HRP标记山羊抗兔IgG。
1.2.4 ELISA 依据Western Blot 中海马组织蛋白提取及测定方法,完成各样本蛋白浓度测定;按照试剂盒说明配制相关工作液,按照既定步骤完成MIP-1α浓度监测。
1.2.5 酶标法免疫组化 切片复温、晾干,PBS液冲洗,3%过氧化氢处理,5%BSA/10%兔血清工作液封闭(室温孵育1h),先后滴加一抗(1∶100 P-ERK1/2、1∶100 P-p38MAPK或1∶100 OX-42)、二抗(生物素标记山羊抗小鼠或兔IgG)、三抗(辣根过氧化物酶标记的抗生物素)处理,冲洗,DAB显色、复染、脱水、封片,镜下观察。
1.2.6 免疫荧光双重标记技术 切片复温、晾干,0.1% Triton-X 100 PBS液漂洗3次,5%BSA/5%正常驴血清工作液封闭孵育1 h,用1∶100 P-ERK1/2或1∶100 P-p38MAPK,分别与1∶100 ED-1和1∶100 GFAP共同孵育(4℃过夜),二抗37℃避光1 h(1∶500 AMCA标记的山羊抗兔IgG和1∶500 Texas Red标记的山羊抗小鼠IgG),PBS冲洗,DAPI 染核,抗荧光淬灭剂封片,共聚焦显微镜下观察。
1.2.7 细胞计数分析 每个标本选取6张片, 200倍视野下采用双盲法对相应海马亚区进行计数分析。每张切片的每个海马区于2个不同视野下分别计数2次,然后取平均值;观察CA3和CA1区时,以锥体细胞层为中心计数。每张片随机选取6个视野,取其平均值,计数海马内OX-42的阳性细胞。在荧光显微镜下观察荧光标记的细胞。
2 结 果
2.1 各组大鼠海马组织中MAPKs蛋白水平的比较
见表1。与空白对照组比较,KA 4 h、8 h、16 h、24 h、3 d组P-ERK1/2水平明显增高;KA 8 h、16 h、24 h、3 d组P-P38MAPK水平明显增高(均P<0.05)。
2.2 KA组大鼠海马组织中P-ERK1/2表达的分布
见图1。KA 8 h组CA3区的锥体细胞层和门区可见少量棕黄色颗粒,体积偏大,成神经元状态,整个海马区(CA1锥体细胞层、颗粒细胞层除外)可见明显深染的阳性颗粒,体积较小。KA 24 h组CA3锥体细胞层和门区可见呈圆形或椭圆形的大量阳性染色颗粒,可能为胶质细胞。KA 3 d整个海马组织阳性染色颗粒明显减少,主要分布于CA3、CA1的椎体细胞层和海马门区,海马裂附近也见少许阳性颗粒。

表1 各组大鼠海马组织中MAPKs蛋白水平的比较(x±s)组别P/T-ERK1/2P/T-p38MAPKP/T-JNK空白对照组1.00±0.121.00±0.151.00±0.08KA4h组1.82±0.14*1.20±0.221.00±0.10KA8h组3.25±0.32*2.69±0.43*0.92±0.06KA16h组2.68±0.25*4.44±0.73*0.91±0.07KA24h组1.66±0.20*5.03±1.12*0.90±0.08KA3d组1.20±0.09*6.96±1.04*0.95±0.05PBS对照组0.86±0.090.81±0.120.92±0.08 注:与空白对照组比较*P<0.05
图1 KA组大鼠海马组织中P-ERK1/2表达的分布。KA8h:KA 8 h组;KA24h:KA 24 h组;KA3d:KA 3 d组;Hp:海马;Hilus:齿状回门区;CA3:海马CA3区;CA1:海马CA1区(高倍图片标尺50 μm,低倍图片标尺200 μm)
2.3 KA组大鼠海马组织中P-p38MAPK表达的分布 见图2。KA 8 h组可见少量染色浅的棕黄色颗粒,主要集中在海马裂及海马槽周围。KA 24 h组整个海马组织内可见染色较深的阳性颗粒,以神经元损伤明显的CA3区、齿状回门较为明显。KA 3 d组海马组织中见较多阳性染色颗粒,呈现显著表达,主要集中在CA1区锥体细胞层,可见较多深染颗粒。
2.4 KA组大鼠P-ERK1/2和P-p38MAPK胶质细胞来源的探究 见图3。免疫荧光双重标记结果显示,在GFAP标记的星形胶质细胞和ED-1标记的小胶质细胞内均可见P-ERK1/2阳性染色颗粒。与之相比,在GFAP标记的星形胶质细胞中未见P-P38MAPK阳性颗粒,而在ED-1标记的小胶质细胞可见明显阳性颗粒分布。
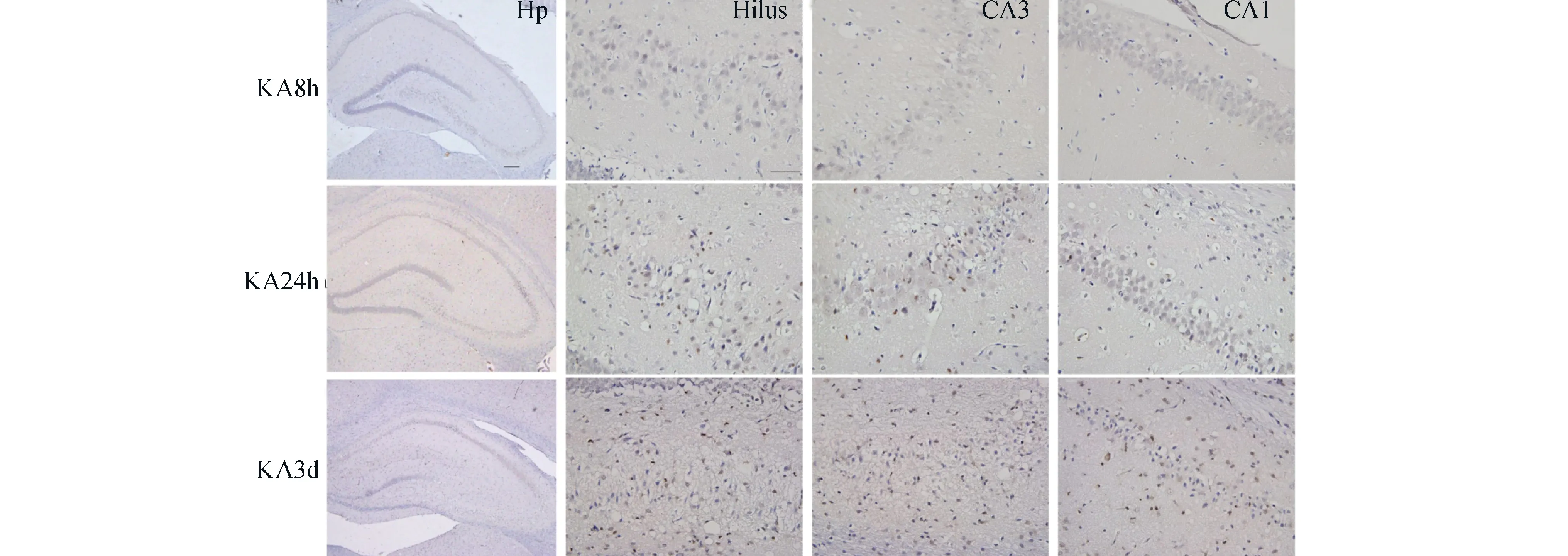
图2 KA组大鼠海马组织中P-p38MAPK表达的分布。KA8h:KA 8 h组;KA24h:KA 24 h组;KA3d:KA 3 d组;Hp:海马;Hilus:齿状回门区;CA3:海马CA3区;CA1:海马CA1区(高倍图片标尺50 μm,低倍图片标尺200 μm)
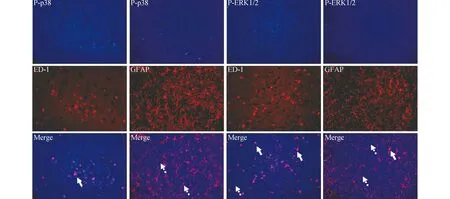
图3 免疫荧光双重标记检测P-p38MAPK 和P-ERK1/2 表达的胶质细胞来源。A 和B: P-p38MAPK(蓝光)分布于ED-1 标记的小胶质细胞(A 红光)而不能表达于GFAP 标记的星形胶质细胞(B 红光);C 和D:P-ERK1/2(蓝光)在小胶质细胞(C)和星形胶质细胞(D)均有表达(实线箭头指示共分布的细胞,虚线箭头指示非共分布细胞)
2.5 各组大鼠海马组织中MIP-1α、CCR5蛋白水平和OX-42阳性细胞数的比较 见表2。与PBS+DMSO组比较,KA+DMSO组、KA+PD98059组和KA+SB203508组大鼠海马组织中MIP-1α、CCR5蛋白水平均明显增高,OX-42阳性细胞数明显增加(均P<0.05)。与KA+DMSO组比较,KA+PD98059组、KA+SB203508组大鼠海马组织中MIP-1α、CCR5蛋白水平均明显降低,OX-42阳性细胞数明显减少(均P<0.05)。

表2 各组大鼠海马组织中MIP-1α、CCR5蛋白水平和OX-42阳性细胞数的比较(x±s)组别MIP-1α(pg/mg)CCR5(pg/mg)OX-42阳性细胞数(个)PBS+DMSO组0.60±0.201.00±0.1229±5KA+DMSO组151.60±41.00*4.80±0.32*68±10*KA+PD98059组81.30±26.50*△2.90±0.39*△52±12*△KA+SB203508组68.50±35.40*△2.13±0.30*△44±12*△ 注:与PBS+DMSO组比较*P<0.05;与KA+DMSO组比较△P<0.05
3 讨 论
MAPKs是细胞中的丝/苏氨酸蛋白激酶,广泛存在于真核细胞中,在将细胞外刺激信号转导至细胞及其核内、引起细胞生物学反应(如细胞增殖、分化、转化及凋亡)的过程中发挥着至关重要的作用。在缺氧、缺血、脑外伤及惊厥等神经病理条件下,MAPKs迅速被激活,调控多种细胞因子和炎性介质的表达分泌,使多种底物发生磷酸化反应,进一步调控基因的转录,从而发挥关键性作用[8]。
MAPKs主要包含3个经典的亚家族途径:ERK1/2(细胞外信号调节蛋白激酶)、P38MAPK(p38丝裂原活化蛋白激酶)和c-JNK(c-Jun 氨基末端激酶),能够在兴奋毒性脑损伤的病理过程中发挥关键作用。因此,本研究在探讨MAPKs与MIP-1α/CCR5轴的潜在联系之前,首先研究了MAPKs三个主要途径在海马组织中各自的表达特点。既往研究多集中在损伤早期、短暂的观察时间窗内,或者是惊厥模型中:Jeon 等[9]发现,在KA注射后,P-ERK1/2蛋白水平出现明显增高,尤其在3 h后持续保持在较高水平,相对应的P-p38MAPK和P-JNK在出现短暂升高后迅速下降至基础水平(KA后2 h左右)。脑损伤相对长时间的研究[10]发现,海马中P-p38MAPK的表达呈现双时相趋势。另有动物实验[11-12]表明,P-p38MAPK在缺血性脑损伤后能够即刻表达,在第二时相,即缺血后1~3 d,其分布多见于损伤区的小胶质细胞。这与本研究结果相一致,在建立惊厥模型后短时间内(8 h~3 d),海马损伤区内P-ERK1/2和P-p38MAPK的表达出现明显升高,但是P-JNK蛋白水平在KA注射后的表达未见明显差异,结合先前相关研究分析,可能与该实验选择的观察时间窗有关,尚需进一步分析。本研究结果显示,KA注射后P-ERK1/2和P-p38MAPK蛋白水平之间的变化趋势、显著表达时间及表达高峰等存在一定差异;且二者在齿状回门区和锥体细胞层等神经元损伤明显的海马组织中均呈现显著增高的表达,从而进一步提示MAPKs通路在癫痫形成(惊厥发生)过程中发挥着重要的生物调控作用。本研究中免疫荧光双标染色结果显示,部分P-ERK1/2在KA后24 h来源于活化的小胶质细胞及星形胶质细胞,而P-p38MAPK仅在小胶质细胞中出现免疫活性表达。结合前期研究[2]结果可以发现,P-ERK1/2、P-p38MAPK在很大程度上与MIP-1α、CCR5的免疫活性变化及分布相一致,从而进一步提示 MAPKs可能调控MIP-1α/CCR5诱导性表达。
事实上,多个体外研究结果[3-4,13]亦支持上述推测。有研究[3]发现,S100B和新型隐球菌免疫复合物能够分别参与调控MAPKs、NF-κB、AP-1和ERK1/2、NF-κB信号通路,从而诱导趋化因子MIP-1α的表达。人单核巨噬细胞系研究[4,13]已经证实,多种外源性刺激因素能够诱导MIP-1α等多种趋化因子及其受体表达,且ERK1/2、p38MAPK信号通路在其中发挥着重要的作用。本研究结果显示,侧脑室内ERK1/2、p38MAPK抑制剂的干预性治疗能够阻断相应的信号通路,从而进一步抑制KA 诱导的MIP-1α/CCR5的表达上调和活化小胶质细胞的聚集。到目前为止,这是第一个关于惊厥模型中MAPKs调控MIP-1α/CCR5生物轴表达的体内研究,而研究结果也暗示了MAPKs至少能够在一定程度上调控MIP-1α/CCR5轴的表达,从而在癫痫形成的病理过程中发挥重要作用。
[1]Johnson EA, Dao TL, Guignet MA, et al. Increased expression of the chemokines CXCL1 and MIP-1 alpha by resident brain cells precedes neutrophil infiltration in the brain following prolonged soman-induced status epilepticus in rats[J]. J Neuroinflamm,2011,8:41.
[2]Zhu XB, Wang YB, Chen O, et al. Characterization of the expression of macrophage inflammatory protein-1a (MIP-1a) and C-C chemokine receptor 5 (CCR5) after kainic acid-induced status epilepticus (SE) in juvenile rats[J]. Neuropathol Appl Neurobiol, 2012, 38: 602.
[3]Song X,Shapiro S,Goldman DL,et al.Fcgamma receptor I-and III-mediated macrophage inflammatory protein 1alpha induction in primary human and murine microglia[J].Infect Immun,2002,70:5177.
[4]Choe W, Volsky DJ, Potash MJ. Activation of NF-kappaB by R5 and X4 human immunodeficiency virus type 1 induces macrophage inflammatory protein 1alpha and tumor necrosis factor alpha in macrophages[J]. Virol, 2002, 76: 5274.
[5]Vezzani A, Michalkiewicz M, Michalkiewicz T, et al. Seizure susceptibility and epileptogenesis are decreased in transgenic rats overexpressing neuropeptide Y[J]. Neuroscience, 2002, 110: 237.
[6] Paxinos G, Watson C. The rat brain in stereotaxic coordinates[M]. 6th ed. New York, NY: Academic Press, 2007. 34~35.
[7]Sperk G.Kainic acid seizures in the rat[J].Prog Neurobiol,1994,42:1.
[8]Katoh-Semba R, Kaneko R, Kitajima S, et al. Activation of p38 mitogen-activated protein kinase is required for in vivo brain-derived neurotrophic factor production in the rat hippocampus[J]. Neuroscience, 2009, 163: 352.
[9]Jeon SH, Kim YS, Bae CD, et al. Activation of JNK and p38 in rat hippocampus after kainic acid induced seizure[J]. Experimental and Molecular Medicine, 2000, 32: 227.
[10]Yc G,Sanabria E,Funke MG,et al.Mitogen-activated protein kinase is increased in the limbic structures of the rat brain during the early stages of status epilepticus[J].Brain Res Bull,1998,47:223.
[11]Koistinaho M, Kettunen M, Goldsteins G, et al. Beta-amyloid precursor protein transgenic mice that harbor diffuse A beta deposits but do not form plaques show increased ischemic vulnerability:role of inflammation[J]. Proc Natl Acad Sci USA, 2002, 99: 1610.
[12]Tian DH, Litvak V, Lev S. Cerebral ischemia and seizures induce tyrosine phosphorylation of PYK2 in neurons and microglial cells[J]. Journal of Neuroscience, 2000, 20: 6478.
[13]Ko J, Yun CY, Lee JS, et al. p38 MAPK and ERK activation by 9-cis-retinoic acid induces chemokine receptors CCR1 and CCR2 expression in human monocytic THP-1 cells[J]. Experimental and Molecular Medicine, 2007, 39: 129.
Express characteristics of mitogen-actived protein kinases at hippocampus in immature rats with epilepsy and its influence on the expression of macrophage inflammatory protein-1α/chemokine receptor 5 axis
WANGJing-ru,ZHUXiao-bo,MAYu,etal.
DepartmentofPediatrics,theSecondHospitalofShandongUniversity,Jinan250033,China
Objective To investigate the express characteristics of mitogen-actived protein kinases (MAPKs) at hippocampus in immature rats with epilepsy and its influence on the expression of macrophage inflammatory protein-1α (MIP-1α)/chemokine receptor 5 (CCR5) axis.Methods Seizures were induced by intracerebroventricular injection of Kainic acid (KA) with stereotaxic apparatus. Wistar rats (bron 21 d) were randomly divided into blank control group, phosphate buffer (PBS) control group and KA 4 h, 8 h, 16 h, 24 h, 3 d groups. The differences of MAPKs in hippocampus among these groups were compared. Wistar rats (bron 21 d) were divided into PBS+dimethyl sulfoxide (DMSO) group, KA+DMSO group, KA+PD98059 (ERK1/2 inhibitor) group and KA+SB203508 (p38MAPK inhibitor) group. The effects of MAPKs on the expression of MIP-1α/CCR5 in hippocampus were detected. Western Blot was used to detect the level of MAPKs and CCR5 protein in each group. ELISA was used to quantify the MIP-1α protein in each group. Immunohistochemistry was performed to examine the expression of P-ERK1/2 and P-p38MAPK in each group. Results Compared with blank control group, the levels of P-ERK1/2 in KA 4 h, 8 h, 16 h, 24 h and 3 d groups were significantly increased, and the levels of P-P38MAPK in KA 8 h, 16 h, 24 h and 3 d groups were significantly increased (allP<0.05). After KA treatment, the experssion of P-ERK 1/2 and P-P38MAPK in rats were mainly distributed in the hilus of the dentate gyrus and the pyramidal cell layer,obviously damaged in hippocampus. After KA treatment, part of P-ERK1/2 was derived from activated microglia and astrocytes, while P-p38MAPK only showed the immunoreactivity in microglia. Compared with PBS+DMSO group, the levels of MIP-1, CCR5 and the number of OX-42 positive cells in hippocampus of KA+DMSO group, KA+PD98059 group and KA+SB203508 group were significantly increased (allP<0.05). Compared with KA+DMSO group, the levels of MIP-1, CCR5 and the number of OX-42 positive cells in hippocampus of KA+PD98059 group and KA+SB203508 group were significantly decreased (allP<0.05).Conclusion The MAPKs (ERK1/2 and p38MAPK) can partly regulate and control the expression of MIP-1α/CCR5 axis in the early stage of epileptogenesis.
immature rats;epileptogenesis;mitogen-actived protein kinases;macrophage inflammatory protein-1α;chemokine receptor 5
山东省医药卫生科技发展计划项目(2014WSO154)
250033济南,山东大学第二医院儿内科
王一彪
R742.1
A
1004-1648(2017)02-0124-06
2016-08-08
2016-09-02)
