丹参多酚酸对慢性束缚应激后小鼠认知功能障碍的改善作用及相关机制
2017-04-27张忠霞邱会卿孙美玉韩冰王铭维
张忠霞,邱会卿,孙美玉,韩冰,王铭维
丹参多酚酸对慢性束缚应激后小鼠认知功能障碍的改善作用及相关机制
张忠霞,邱会卿,孙美玉,韩冰,王铭维
目的 探讨丹参多酚酸对慢性束缚应激后小鼠认知功能障碍的改善作用及相关机制。方法 采用3个月龄健康雄性昆明小鼠,随机分为对照组、应激组和丹参多酚酸干预组(SA组),每组14只小鼠。对照组和应激组小鼠每日腹腔注射生理盐水,SA组小鼠每日腹腔注射丹参多酚酸注射液;应激组和SA组小鼠每日腹腔注射后,束缚制动8 h,连续14 d。采用新异物体识别试验(NORT)、Morris水迷宫试验检测小鼠学习记忆能力的改变。采用HE染色观察海马神经元形态的改变。分别采用免疫组化法和实时荧光定量PCR检测海马脑源性神经营养因子(BDNF)蛋白及mRNA的表达。 结果 应激组小鼠NORT试验识别期对新物体的探索时间及新异物体差异指数均明显低于对照组和SA组(均P<0.05)。应激组小鼠Morris水迷宫试验每日逃避潜伏期均明显长于对照组和SA组,第5 d探索平台次数明显少于对照组和SA组(均P<0.05)。HE染色结果显示,对照组小鼠海马神经元形态完整,未见明显变化;应激组小鼠海马神经元细胞体积缩小,部分神经元细胞呈泡状改变;SA组可见到核轻度不规则,细胞形态接近于对照组神经元。应激组小鼠BDNF蛋白阳性细胞数和mRNA相对表达量均明显少于对照组和SA组(均P<0.05)。结论 丹参多酚酸干预能明显预防慢性束缚应激引起的认知功能损伤,其可能机制是能够抑制慢性应激所致海马BDNF表达的下降。
慢性束缚应激;丹参多酚酸;认知功能障碍;脑源性神经营养因子
应激是机体在各种内外环境因素及社会、心理因素刺激时所出现的全身性非特异性适应反应,又称为应激反应[1]。长期慢性应激会导致认知功能的损伤,同时会引起神经内分泌系统和大脑蛋白的改变[2]。但是,应激影响认知的确切机制尚不清楚,临床也缺乏有效的预防和治疗药物。丹参多酚酸具有多种药理学作用,如抗炎、抗氧化、改善循环、清除自由基和神经保护等作用,不良反应少,具有良好的临床应用潜力[3-5]。但目前尚未见其用于改善应激后认知功能障碍的报道。本实验采用小鼠慢性束缚应激模型,观察小鼠认知功能的改变,并应用丹参多酚酸,观察其对小鼠认知功能的影响,并探讨其可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取3个月龄雄性、健康、清洁级昆明种小鼠42只,体质量(28±2)g,动物合格证号医动字第1303025号,购于河北医科大学实验动物中心,单位许可证号SCXK冀2008-1-003。
1.1.2 主要仪器与试剂 新异物体识别实验检测装置及ANY-maze图像追踪系统购于上海欣软信息科技有限公司,SLY-WMS Morris水迷宫及其分析系统购于安徽淮北正华生物仪器有限公司;正置荧光显微镜购于日本NIKON公司,石蜡切片、展片、烤片机均购于德国LEICA公司;兔抗小鼠脑源性神经营养因子(BDNF)抗体购于英国Abcam公司,SP兔来源免疫组化试剂盒及DAB显色剂均购于北京中杉金桥生物技术有限公司,RNA提取试剂盒购于成都福际生物技术有限公司,cDNA第一链合成试剂盒及荧光定量预混试剂购于天根生化科技有限公司,引物及碱基由生工生物工程上海股份有限公司合成,注射用丹参多酚酸为天津天士力之骄药业有限公司提供。
1.2 方法
1.2.1 动物分组及处理 所有动物于标准条件下饲养,室温(20±2)℃,湿度(50±5)%,所有动物在非应激期自由摄食和饮水。每12 h交替光照。实验动物在预适应1周后,随机分为3组,每组14只小鼠。(1)对照组:每日腹腔注射0.9%生理盐水,10 ml/kg,连续14 d;(2)应激组:每日腹腔注射0.9%生理盐水,10 ml/kg,然后给予8 h(9:00~17:00)束缚应激刺激,连续14 d;(3)丹参多酚酸干预组(SA组):每日腹腔注射配置浓度为6 mg/ml的丹参多酚酸溶液10 ml/kg,然后给予8 h(9:00~17:00)束缚应激刺激,连续14 d。束缚应激刺激方法:使用50 ml离心管,在离心管底壁前端、侧壁和瓶盖扎数个孔,保证空气通畅,使呼吸、排泄均不受限,而且不会感到疼痛。小鼠头部朝向离心管底部钻入,尾部盖上管盖,封闭后的离心管固定于水平地面上,使头部略高于尾部,以便尿液的排出。
1.2.2 新异物体识别试验(NORT) 束缚应激刺激结束后,采用NORT检测各组小鼠的认知功能。测试装置为长宽高均为50 cm的正方体不透明盒子,正上方有照明,以避免明暗光线的差异对动物探索行为造成干扰;用来辨识的物体A、B为红色等大长方体,C为粉色六边体,固定置于箱底。测试前首先将小鼠置于空盒内适应30 min。在熟悉期,于盒子的两侧放置物体A和B,将小鼠背对物体放置在物体A、B之间,观察并记录5 min内小鼠对每个物体的探索时间,之后将动物放回原来的鼠笼。间隔1 h后,进行识别期测试。将物体B更换为新物体C,记录小鼠在5 min内对物体A和新物体C的探索时间。每次测试结束,测试物体及测试箱都分别用75%乙醇进行擦拭,以消除气味对小鼠探索行为和探索物体时间产生的影响。采用探索新物体的时间和新异物体的差异指数(DR)作为学习记忆的检测指标。DR=探索新物体C的时间/(探索新物体C的时间+探索旧物体A的时间),探索时间越长,DR越大,说明学习记忆能力越好。
1.2.3 Morris水迷宫试验 Morris水迷宫由一直径1.2 m、高0.5 m的圆形水池和安装于正上方的自动摄像系统组成,水池被池壁上4个等距离点均分为4个象限。一直径0.14 m、高0.2 m的透明平台置于水下1.5~2 cm处,并保持固定。前4 d进行定位航行试验,每日将小鼠分别从水迷宫的4个象限面向池壁放入水中,记录其从入水到爬上平台的时间,即逃避潜伏期。每次的最大潜伏期设置为120 s,若在设置时间内未找到,则记为120 s。将4次的算术平均值记为当日的成绩。第5 d进行空间探索试验。将水下的平台撤掉,记录小鼠120 s内游过原平台位置的次数。
1.2.4 HE染色 行为学测试结束后,腹腔给予各组小鼠水合氯醛(0.3 ml/100 g)进行麻醉,4%体积分数的多聚甲醛灌注固定,脱水、透明、浸蜡、包埋,制作石蜡切片。切片脱蜡后经HE染色,梯度乙醇脱水,二甲苯透明处理后,用中性树胶封片。光镜下观察海马神经元形态的改变。
1.2.5 免疫组化染色及图像分析 取材和组织处理同1.2.4,石蜡切片经二甲苯和梯度乙醇进行脱蜡和水化处理,微波修复,加兔抗小鼠BDNF抗体(1∶100),进行常规免疫组织化学染色,DAB染色后,进行苏木素复染,最后经梯度乙醇脱水干燥,二甲苯透明,用中性树胶封片,采集图像并保存。以海马区神经元胞浆出现棕色颗粒为阳性反应,计数BDNF染色阳性的细胞。每只小鼠取5张切片,每张切片在高倍视野下计数海马区每个不重复视野阳性细胞数,得出5张切片的平均值为1只小鼠的细胞数。各组小鼠选择切片的部位相同。
1.2.6 实时荧光定量PCR 行为学测试结束后取材,在冰台上迅速剥离出新鲜海马组织,按试剂盒说明提取海马总RNA,进行RNA纯度和浓度鉴定。以提取的总RNA为模板,按试剂盒的说明反转录成cDNA。实时荧光定量PCR所用引物及碱基为:BDNF:F 5′-AGC TGA GCG TGT GTG ACA GT-3′,R 5′-ACC CAT GGG ATT ACA CTT GG-3′;GAPDH:F 5′-CCC CAA TGT ATC CGT TGTG-3′,R 5′-CTC AGT GTA GCC CAG GAT GC-3′。PCR反应体系(20 μl体系):2×SuperReal PreMix Plus 10 μl;正向引物(10 μM) 0.6 μl;反向引物(10 μM) 0.6 μl;cDNA模板1 μl;50×ROX Reference DyeΔ 0.4 μl;RNase-free ddH2O 7.4 μl。PCR反应程序:95℃ 15 min预变性→40个循环→95℃ 10 s变性→60℃ 32 s退火/延伸,采集荧光。实验数据根据目的基因和参考基因各自的Ct值,采用2-ΔΔCt法计算出各样品中目的基因的相对表达量。
2 结 果
2.1 各组小鼠认知功能的比较 见表1、表2。在NORT试验中,各组小鼠熟悉期探索时间差异均无统计学意义(均P>0.05);应激组小鼠识别期对物体C的探索时间及DR均明显低于对照组和SA组(均P<0.05)。在Morris水迷宫试验中,应激组小鼠每日逃避潜伏期均明显长于对照组和SA组,第5 d探索平台次数明显少于对照组和SA组(均P<0.05)。
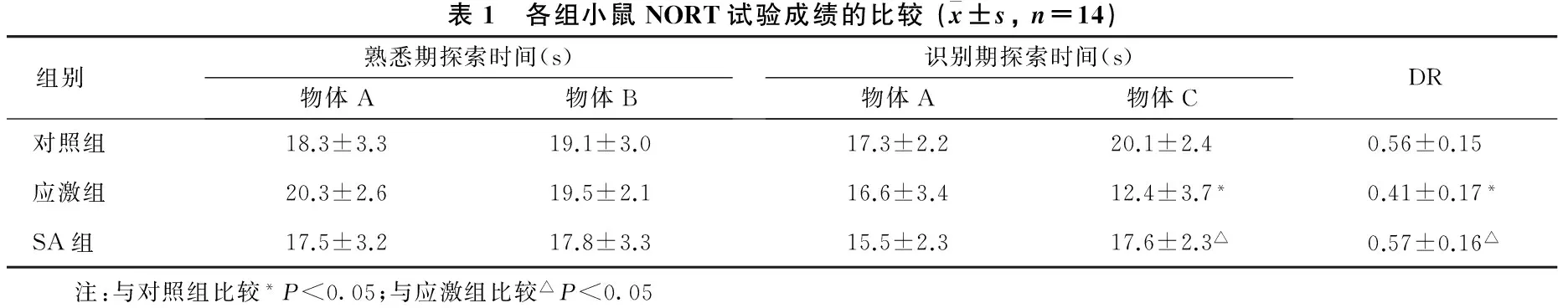
表1 各组小鼠NORT试验成绩的比较(x±s,n=14)组别熟悉期探索时间(s)物体A物体B识别期探索时间(s)物体A物体CDR对照组18.3±3.319.1±3.017.3±2.220.1±2.40.56±0.15应激组20.3±2.619.5±2.116.6±3.412.4±3.7*0.41±0.17*SA组17.5±3.217.8±3.315.5±2.317.6±2.3△0.57±0.16△ 注:与对照组比较*P<0.05;与应激组比较△P<0.05

表2 各组小鼠Morris水迷宫试验成绩的比较(x±s,n=14)组别第1d逃避潜伏期(s)第2d逃避潜伏期(s)第3d逃避潜伏期(s)第4d逃避潜伏期(s)第5d探索平台次数(次)对照组21.6±5.317.9±6.011.3±4.26.1±2.37.6±2.7应激组28.3±6.4*24.5±7.1*17.6±5.4*13.8±3.7*4.4±2.4*SA组23.5±7.2△19.5±5.8△13.5±5.3△9.6±3.3△6.7±1.8△ 注:与对照组比较*P<0.05;与应激组比较△P<0.05
2.2 各组小鼠海马神经元形态的比较 见图1。HE染色结果显示,对照组小鼠海马区细胞排列整齐有序,细胞核呈圆形或椭圆形,形态完整,核染色质均匀未见明显变化;应激组小鼠海马神经元细胞体积缩小,部分神经元细胞呈泡状改变;SA组可见到核轻度不规则,细胞形态接近于对照组神经元。
2.3 各组小鼠海马BDNF蛋白表达的比较 见图2、表3。应激组小鼠BDNF蛋白阳性细胞数明显少于对照组和SA组(均P<0.05)。
2.4 各组小鼠海马BDNF mRNA表达的比较 见表3。应激组小鼠BDNF mRNA相对表达量明显少于对照组和SA组(均P<0.05)。
图1 各组小鼠海马神经元HE染色。A:对照组; B:应激组; C:SA组(×400) 图2 各组小鼠海马BDNF蛋白免疫组化染色。A:对照组; B:应激组; C:SA组(×400 )
3 讨 论
丹参多酚酸是由中药丹参的水溶性酚酸类化合物制成的冻干粉针剂,具有抗凝、抗炎、抗氧化、清除自由基、抑制内皮素释放等作用[3-5]。目前的报道[6-7]主要集中于临床,对抑制冠心病患者血小板的聚集和活化、抗脑缺血损伤具有显著作用。而其对慢性应激所致的认知损伤是否具有干预作用,其作用机制如何,尚未见报道。
目前被广泛认可的应激模型包括慢性不可预知性温和应激模型、交流箱模型、慢性束缚应激模型等[8]。已有研究[9]证实,慢性束缚应激与人类心身疾病的过程具有相似性,不仅能够引起心理病理改变,而且可对记忆产生影响。同时考虑到前两种应激模式的刺激强度过大[10],故本实验应用慢性束缚应激模型进行实验。Morris水迷宫是检测动物空间学习记忆的经典试验,NORT试验可有效地检测再认记忆,其理论依据是啮齿类动物对于新异物体具有选择偏爱性,二者考查的认知功能均与海马区密切相关[11]。
本实验结果显示,应激组在定位航行试验中找到平台的逃避潜伏期显著增长,在撤掉平台的空间探索试验中穿越原平台所在位置的次数明显减少,在NORT识别期对于新物体的识别程度明显降低,说明慢性束缚应激损伤了小鼠的空间学习和情景再认记忆。而SA组的各项学习成绩比单纯应激组小鼠均有了显著改善,说明丹参多酚酸可以明显改善上述认知损伤。
长期应激会损伤鼠的海马部位。Sapolsky等[12-13]报告慢性应激可以导致海马锥体神经元缺失及认知功能的下降。BDNF作为脑组织中含量最丰富的神经营养因子,广泛分布于皮质、海马、下丘脑等部位,对于神经的发生、存活及增殖有重要的作用,并可增强突触联系,影响神经元的可塑性和神经递质的合成[14]。已有研究[12,15]报道,BDNF能够增强正常人的记忆能力以及长时程增强(LTP),阻断酪氨酸激酶B受体(TrkB,BDNF受体)或者应用BDNF抗体能够抑制海马脑片的LTP[15]。本实验结果显示,慢性束缚应激模型小鼠海马神经元发生损伤,海马区BDNF mRNA和蛋白的表达均降低,这与Aleisa等[16]和Gersner等[17]的研究一致。而提前给予丹参多酚酸后,海马神经元形态未受到显著影响,BDNF在基因与蛋白水平的表达未出现显著下降,说明丹参多酚酸能够预防慢性应激后海马神经元的损伤,可以有效阻止BDNF的下调,从而发挥改善认知的功能,这些将为丹参多酚酸用于临床治疗认知功能障碍提供理论依据;而丹参多酚酸是如何上调BDNF的表达的,有待于进一步实验研究。
[1]Miller MW, Sadeh N. Traumatic stress,oxidative stress and post-traumatic stress disorder:neurodegeneration and the accelerated-aging hypothesis[J]. Mol Psychiatry, 2014, 19: 1156.
[2]Croft W, Dobson KL, Bellamy TC. Plasticity of Neuron-Glial transmission: equipping Glia for Long-Term integration of network activity[J]. Neural Plast, 2015, 8: 765.
[3]Ho JH, Hong CY. Salvianolic acids: small compounds with multiple mechanisms for cardiovascular protection[J]. J Biomed Sci, 2011, 18: 30.
[4]Guan L, Zhang YL, Li ZY, et al. Salvianolic acids attenuate rat hippocampal injury after acute CO poisoning by improving blood flow properties[J]. Biomed Res Int, 2015, 2015: 526483.
[5]Orgah JO, Zhang M, Orgah EA, et al. Effective dose of the combination of salvianolic acids and tanshinones against inflammatory injury in human umbilical vein endothelial cells injured by thrombin [J]. Chin J Integr Med, 2015. doi:10.1007/s11655-014-1956-6.
[6]Fan HY, Fu FH, Yang MY, et al. Antiplatelet and antithrombotic activities of salvianolic acid A[J]. Thromb Res, 2010, 126: e17.
[7]Zhu HB, Zou LB, Tian JW, et al. SMND-309, a novel derivative of salvianolic acid B, protects rat brains ischemia and reperfusion injury by targeting the JAK2/STAT3 pathway[J]. Eur J Pharmacol, 2013, 714: 23.
[8]Hill MN, Hellemans KG, Verma P, et al. Neurobiology of chronic mild stress:parallels to major depression[J]. Neurosci Biobehav Rev, 2012, 36: 2085.
[9]Sadeghi M, Radahmadi M, Reisi P. Effects of repeated treatment with cholecystokinin sulfated octapeptide on passive avoidance memory under chronic restraint stress in male rats[J]. Adv Biomed Res, 2015, 4: 150.
[10]Shansky RM, Rubinow K, Brennan A, et al. The effects of sex and hormonal status on restraint-stress-induced working memory impairment[J]. Behav Brain Funet, 2006, 2: 8.
[11]Lyon L, Saksida LM, Bussey TJ. Spontaneous object recognition and its relevance to schizophrenia: a review of findings from pharmacological, genetic, lesion and developmental rodent models[J]. Psychopharmacology (Berl), 2012, 220: 647.
[12]Sapolsky RM. A mechanism for glucocorticoid toxicity in the hippocampus:increased neuronal vulnerability to metabolic insults[J]. Neurosci, 1985, 5: 1228.
[13]Sapolsky RM, Krey LC, Mcewen BS. The neuroendocrinology of stress and aging:the glucocorticoid cascade hypothesis[J]. Endocr Rev, 1986, 7: 284.
[14]Murua VS, Gomez RA, Andrea ME, et al. Shuttle-box deficits induced by chronic vairable stress:reversal by imipramine administration[J]. Pharmacol Biochem Behav, 1991, 38: 125.
[15]Figurov A, Pozzo-Miller LD, Olafsson P, et al. Regulation of synaptic responses to high-frequency stimulation and LTP by neurotrophins in the hippocampus[J]. Nature, 1996, 381: 706.
[16]Aleisa AM, Alzoubi KH, Gerges NZ, et al. Chronic psychosocial stress-induced impairment of hippocampal LTP: Possible role of BDNF[J]. Neurobiol Dis, 2006, 22: 453.
[17]Gersner R, Toth E, Isserles M, et al. Site-speci c antidepressant effects of repeated subconvulsive electrical stimulation:potential role of brain-derived neurotrophic factor[J]. Biol Psychiatry, 2010, 67: 125.
Improving effect of salvianolic acids on cognitive dysfunction caused by chronic restrain stress and its mechanism in mice
ZHANGZhong-xia,QiuHui-qing,SUNMei-yu,etal.
DepartmentofNeurology,theFirstHospitalofHebeiMedicalUniversity,BrainAgingandCognitiveNeuroscienceLaboratoryofHebeiProvince,Shijiazhuang050031,China
Objective To investigate the improving effect of salvianolic acids on cognitive dysfunction caused by chronic restraint stress and its mechanism in mice. Methods Healthy male Kunming mouse of 3-month aged were randomly divided into control group, stress group and salvianolic acids treating group (SA group), with 14 mouse in each group. Daily intraperitoneal injection of saline were given to the control group and stress group, while salvianolic acids were given to the SA group. Stress group and SA group were restrained for 8 h after injection every day for 14 d continually. Changes of learning and memory ability were tested by novel-object recognition task (NORT) and Morris water maze test. The hippocampal neuronal damage was observed by the HE staining. Protein and its mRNA expression of brain derived neurotrophic factor (BDNF) were detected by immunohistochemistry and real-time fluorescence quantitative PCR respectively. Results The exploring time for the novel object and the difference index in NORT recognition unit of stress group were significantly lower than the control group and SA group (allP<0.05). Daily escape latency in Morris water maze test of stress group were significantly longer than control group and SA group, while the exploring time for platform was significantly less than control group and SA group (allP<0.05). HE staining showed that the hippocampal neurons morphology of control group was complet, and there was no obvious changes. The volum of hippocampal neurons was reduced, and part of them had vesicular changes in stress group. Slightly irregular of cell nuclear could be seen in SA group, close to the neurons of control group. The number of BDNF positive cells and relative expression of mRNA in stress group were significantly less than those in control group and SA group (allP<0.05). Conclusions Salvonolic acids can significantly improve cognitive dysfunction caused by chronic restraint stress. Its possible mechanism is that it can inhibit the decrease of BDNF expression in hippocampus cauced by chronic stress.
chronic restraint stress;salvonolic acids;cognitive dysfunction;brain derived neurotrophic factor
国家重点基础研究发展计划(973计划)项目(2010CB535005);河北省医学科学研究重点课题计划(20160202)
050031 石家庄,河北医科大学第一医院神经内科,河北省脑老化与认知神经科学实验室
王铭维
R749.1
A
1004-1648(2017)02-0111-05
2016-08-10
2016-09-02)
