不同解冻方式对鲣鱼鱼肉蛋白及组胺变化的影响
2017-04-26李天翔包海蓉王锡昌郭全友韩秋煜张青
李天翔,包海蓉*,王锡昌,郭全友,韩秋煜,张青
1(上海海洋大学食品学院,上海,201306)2(东海水产研究所,上海,200090)
不同解冻方式对鲣鱼鱼肉蛋白及组胺变化的影响
李天翔1,包海蓉1*,王锡昌1,郭全友2,韩秋煜1,张青1
1(上海海洋大学食品学院,上海,201306)2(东海水产研究所,上海,200090)
以冷冻鲣鱼为研究对象,探究不同解冻方式(自然空气解冻、静水解冻、流水解冻、冷藏库解冻)对其高铁肌红蛋白(metmyoglobin, metMb)、可溶性肌原纤维蛋白(soluble myofibrillar proteins, SMP)、可溶性肌浆蛋白(soluble sarcoplasmic proteins, SSP)、Ca2+-ATPase活性、活性巯基(reactive sulfhydryl, A-SH)及组胺含量的影响,并结合解冻汁液流失率、色泽、质构评价。结果表明,解冻汁液流失率和咀嚼性与肌原纤维蛋白变化指标(SMP含量、Ca2+-ATPase活性、A-SH含量)之间,Ca2+-ATPase活性与A-SH含量之间分别极显著相关(P<0.01)。相比其他3种解冻方式,冷藏库解冻显著(P<0.05)的抑制组胺的生成及氧合肌红蛋白的氧化,保持色泽。此外,冷藏库解冻较好地保持了肌原纤维蛋白的结构和功能特性,汁液流失率最低,质构较好。因此,冷藏库解冻适合作为鲣鱼罐头生产的解冻方式。
鲣鱼;解冻方式;蛋白;组胺
鲣鱼属低值金枪鱼,是加工金枪鱼罐头的主要鱼种[1]。鲣鱼肉富含蛋白质(26.14%)[2]。鲣鱼罐头的加工工艺主要包括原料处理、腌制、预热处理、装罐杀菌。原料主要来自远洋捕捞调拨的冷冻鲣鱼,冷冻鲣鱼的解冻是鲣鱼罐头加工的第一环节。目前企业常用的解冻方式主要包括自然空气解冻、静水解冻、流水解冻、冷藏库解冻。实际生产中,冷藏库可以由连接冷冻库与车间之间的过道间实现,冷藏库不安装制冷装置可由冷冻原料解冻吸收热量,反复利用的冷藏库库温保持不变。蛋白和组胺是鲣鱼罐头加工生产中对品质影响较大的物质,但关于鲣鱼罐头原料解冻前后蛋白和组胺变化方面的研究鲜有报道。鱼体冷冻后形成的大小冰晶会对细胞结构造成破坏,并释放出酶等内容物,解冻时鱼体逐渐回温,会加速蛋白变性[3]。TOKUR等[4]报道虹鳟鱼在解冻过程中鱼肉蛋白因聚集或交联而变性,导致溶解性显著降低,且不同方式解冻后蛋白溶解性不同。鱼肉蛋白的变化直接影响着鱼肉的质构、色泽、营养、风味[5]。童玲等[6]报道鲣鱼肌肉中组氨酸的含量高达7.89%,有利于组胺的大量生成。加工鱼柳的组胺主要在解冻阶段产生[7],组胺的积聚或摄入过量可导致过敏反应如头痛、血压变化,甚至可能威胁生命[8]。我国鱼类罐头卫生标准(GB 14939—2005)规定,罐头鱼肉组胺含量不得超过100 mg/100 g。本实验探究不同解冻方式(自然空气解冻、静水解冻、流水解冻、冷藏库解冻)对鱼肉蛋白变化(高铁肌红蛋白含量、可溶性蛋白含量、Ca2+-ATPase活性、活性巯基含量)及组胺含量的影响,并进行解冻汁液流失率、色泽、质构测定,旨在为鲣鱼的加工提供参考。
1 材料与方法
1.1 材料与仪器
鲣鱼由浙江黄罐食品股份有限公司提供;KCl、曲拉通、顺丁烯二酸、NaCl、NaH2PO4、Na2HPO4、三氯乙酸、浓H2SO4、钼酸铵、FeSO4、CaCl2、浓HCl、尿素、十二烷基硫酸钠、乙二胺四乙酸、2-硝基苯甲酸、高氯酸、NaHCO3、CH3COONH4、丹磺酰氯(98%)(分析纯);甲醇、乙腈(色谱纯),国药(上海)提供。
TES-1384输入温度记录器(0.1 ℃),上海中炫电子有限公司;LRH-100CL型低温培养箱,上海一恒科学仪器有限公司;DC-30恒温水浴锅,赛默飞世尔科技有限公司;D-130电动匀浆机,Wiggens有限公司;VORTEX21K冷冻离心机,拓赫机电科技(上海)公司;TA.XT.Plus 质构仪,英国SMS公司;CR-400型色差计,Konica Minolta;LC-20A岛津液相色谱仪,岛津国际贸易(上海)有限公司。
1.2 实验方法
1.2.1 解冻处理
实验所用-20℃冰箱冷藏鲣鱼,体长(33±2) cm、体重(0.75±0.05) kg;从冰箱取出后用PE自封袋(30 cm×42 cm)排空气密封,采用以下4种解冻方式解冻。
自然空气解冻:空气温度(15±1)℃;静水解冻:水温(15±1)℃;流水解冻:水温(15±1)℃,流速80 mL/s;冷藏库解冻:冷藏库温度4 ℃。
1.2.2 温度测定
因难以用温度计探头测定鱼体中心温度,所以本实验采取先解冻1h后打开PE自封袋,再将温度计探头插入到鱼体中心进行温度测量,同时排出PE自封袋内空气,密封后继续解冻,各种解冻方法均解冻至鱼体中心0 ℃[9],为避免去内脏、去皮、清洗过程及取样间的差异对指标测定的影响,所以解冻完成后直接切取鲣鱼背部肉测定各项指标。
1.2.3 汁液流失率测定
取-20 ℃冷冻鲣鱼,鱼体表面用吸水纸擦拭干净后称重m1,后用不同解冻方式解冻完成后,去除PE自封袋用吸水纸擦拭鱼体表面干净后称重m2。汁液流失率可由下式计算得出:

(1)
1.2.4 高铁肌红蛋白(metmyoglobin, metMb)测定
参照福田裕[10]的方法。取5 g鱼肉,加去离子水5 mL均质,离心10 min(5 000 r/min,4 ℃),保留上清液,调pH(1 mol/L HCl)6.0,NaOH调pH 6.8~7.0,离心弃沉淀,稀释3倍,滤膜过滤λ540,λ503测定吸光度值。metMb含量Y(%)可由下式计算得出:
A540/A503=-5×10-7Y3+2×10-4Y2-0.037 7Y+2.856 8
(2)
1.2.5 可溶性肌原纤维蛋白(soluble myofibrillar proteins, SMP)、Ca2+-ATPase活性、活性巯基(reactive sulfhydryl, A-SH)含量的测定
SMP测定:参照缪函霖[11]的方法,采用双缩脲法测定SMP量。Ca2+-ATPase活性测定:参照BENJAKUL等[12]方法。A-SH测定,参照YONGSAWATDIGUL等[13]方法。
1.2.6 可溶性肌浆蛋白(soluble sarcoplasmic proteins, SSP)的测定
参照NIU[14]的方法。取5 g鱼肉加10倍体积25 mmol/L NaH2PO4/Na2HPO4缓冲液(pH 7.2)均质,振荡(250 r/min,4 ℃,12 h),冷冻高速离心机(5 000 r/min,4 ℃,20 min),上清液即为SSP。采用双缩脲法测定SSP量。
1.2.7 质构和色泽测定
参照缪函霖的文献[15]。
1.2.8 组胺含量的测定
参照行标SN/T 2209—2008的高效液相色谱法。
1.2.9 数据处理
实验数据用SPSS 22.0软件进行分析,Origin 8.5软件作图。
2 结果与分析
2.1 解冻时间及组胺含量的测定结果与分析
由表1可知,4种解冻方式达到解冻终点的时间分别为8.90、5.00、2.75和18.40 h。可知解冻速率,流水为静水的1.82倍,自然空气的3.24倍,冷藏库的6.69倍。不同方式解冻速率的差别是由解冻介质传热性能,流动性以及温度差导致的。因为传热性能水比空气好,传热速率快,因此解冻时间静水比自然空气减少约一半。流动的水可以加强热量的交换,可以持续的将热热量传递给冷冻的鲣鱼,流水解冻所需时间相比静水解冻减少约一半。4 ℃冷藏库解冻较其他3种方式相比温度差小,因而所需解冻时间最长。
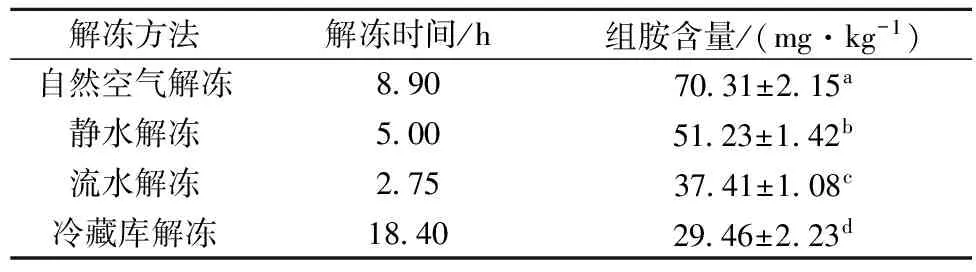
表1 解冻方式对解冻时间及组胺含量的影响
注:字母不同表示相互之间存在显著差异(P<0.05)。下同。
组胺是产组胺菌使组氨酸脱羧基形成,其含量可以从微生物分解的角度反映鱼肉的新鲜度。谢超等[16]报道温度与时间、pH值、盐度及供氧量等因素影响组胺产生。刘书臣等[17]报道大目金枪鱼贮藏4 ℃下5 d组胺有少量增加,15 ℃下组胺迅速增加,可见温度对组胺产生影响显著,且低温抑制组胺的产生,组胺随时间延长积累。从表1可以看出4种方式对应的组胺含量为冷藏库(29.46)<流水(37.41)<静水(51.23)<自然空气(70.31),且冷藏库解冻组胺含量显著(P<0.05)低于其他3组。这可能由于嗜热产组胺菌4 ℃下生长抑制,15 ℃下生长迅速。
2.2 解冻汁液流失率的测定结果与分析
鱼体冷冻后生成的大小冰晶会对肌原纤维产生一定的破坏,解冻会加速蛋白质的变性和降解,使蛋白质的水合作用降低,肌肉的持水性下降,造成汁液流失[9]。不同方式解冻鲣鱼的汁液流失率如图1所示。
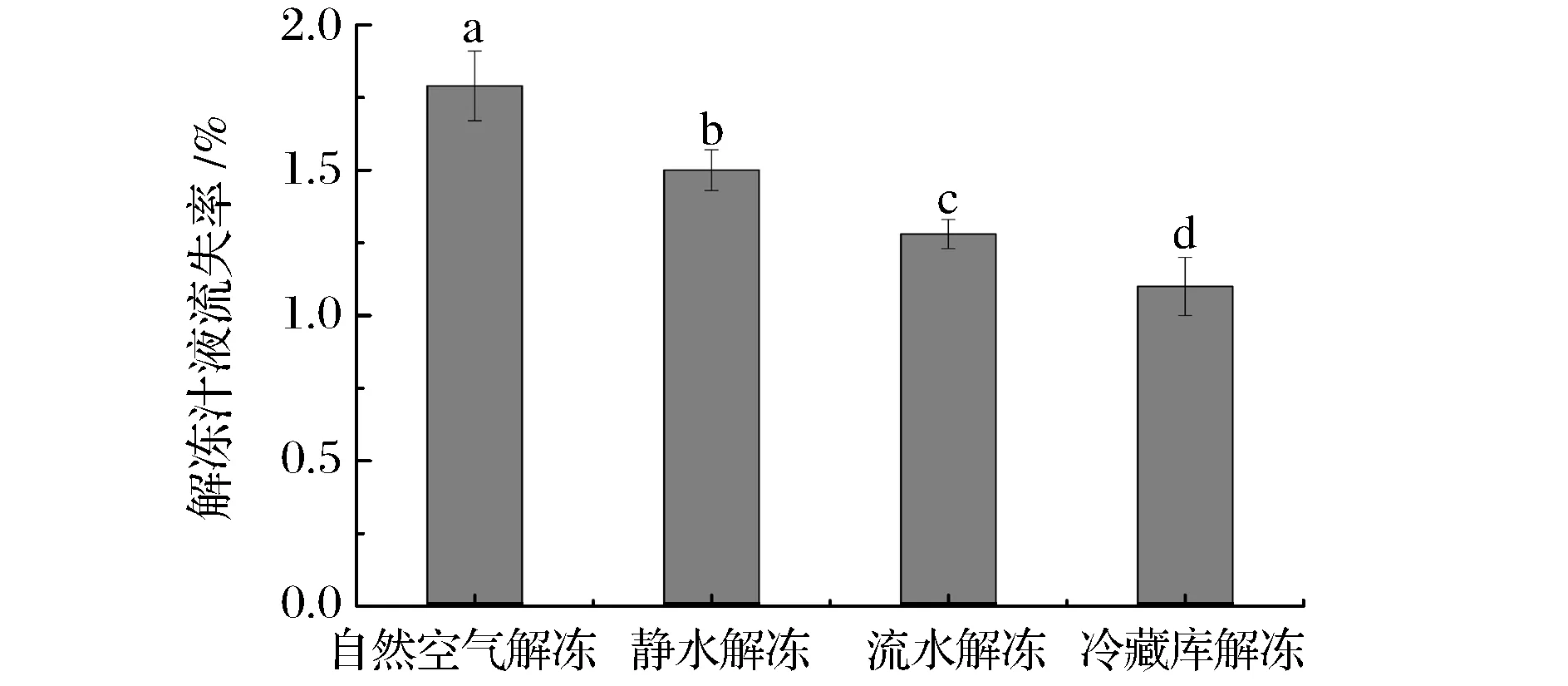
图1 解冻方式对解冻汁液流失率的影响Fig.1 Effect of different thawing methods on thawing loss rate注:字母不同表示有显著差异(P<0.05)。下同。
由图1可知,4种方式中,自然空气和静水解冻汁液流失率最高(1.79%和1.50%),这可能是因为较高温度长时间解冻加速蛋白质的变性和降解而使蛋白质的水合作用降低,持水性下降,汁液大量流失。冷藏库解冻汁液流失率最低(1.10%),且显著(P<0.05)低于其他3组。WANG等[18]也发现冷藏库解冻能够显著降低秋刀鱼解冻汁液流失率。这可能是因为冷藏库解冻温度较低且解冻过程温和,抑制了腐败微生物的滋长和减弱了生化反应,从而减少了蛋白质的变性和降解,能够很好的吸收回渗水,故汁液流失率最低。
2.3 高铁肌红蛋白含量、色泽的测定结果与分析
金枪鱼肉含大量肌红蛋白(Mb)。鱼肉因氧合肌红蛋白(MbO2)呈现鲜红色,其氧化产物metMb使鱼肉呈不良棕红色[19]。HUNT等[20]报道metMb产生取决于一些外界条件如温度、时间、氧气量等。不同方式解冻后鲣鱼鱼肉a*值和metMb含量如图2所示。
由图2可知,4种方式对应的metMb含量为自然空气(27.50%)>静水(22.31%)>流水(21.20%)>冷藏库(18.04%),与a*值具有一定的负相关,其中冷藏库metMb含量显著(P<0.05)低于其他3组。实验发现,冷藏库较其他3种方式温度低,有效的抑制肌红蛋白的氧化,维持色泽。尚艳丽等[19]学者也得出了低温慢时解冻能够有效的保持黄鳍金枪鱼的色泽。

图2 解冻方式对高铁肌红蛋白含量及色泽的影响Fig.2 Effect of different thawing methods on metMb content and a*
2.4 质构的测定结果与分析
从表2可知,不同方式解冻对质构特性影响不同,整体而言,硬度、弹性、内聚性和咀嚼性变化趋势基本一致;较弹性、内聚性和咀嚼性,硬度受解冻方式影响最为明显。硬度表示使鱼肉发生一定形变所需的力。冷藏库硬度(125.22 g)显著(P<0.05)高于其他3组,自然空气解冻硬度最低(112.41 g)。郭恒等[21]学者也得出了低温冷藏库解冻能有效地保持鲐鱼的硬度。弹性表示鱼肉去除外力后,形变恢复程度。4种方式对应的弹性无显著差异(P>0.05),刘欢等[9]也得到了类似的结果。内聚性的变化与硬度基本类似。咀嚼性是综合评价鱼肉质地的指标,由鱼肉硬度、弹性和内聚性综合决定。从表2可见,咀嚼性的变化与硬度、内聚性基本类似为冷藏库解冻最好(62.13),自然空气最差(54.30)。XIONG等[22]报道冻结和解冻过程的质构特性的下降与蛋白质变性有关。不同方式解冻质构的差异,主要与由微生物的生长和生化反应造成的解冻后鱼肉蛋白理化性质及鲜度变化有关[23]。冷藏库低温缓慢解冻质构最好,与余力等[24]的研究结果一致,可能是因为冷藏库解冻后蛋白变性和降解少,肌肉持水性好,汁液流失少,肌原纤维间结合紧密,具有较高的鲜度。
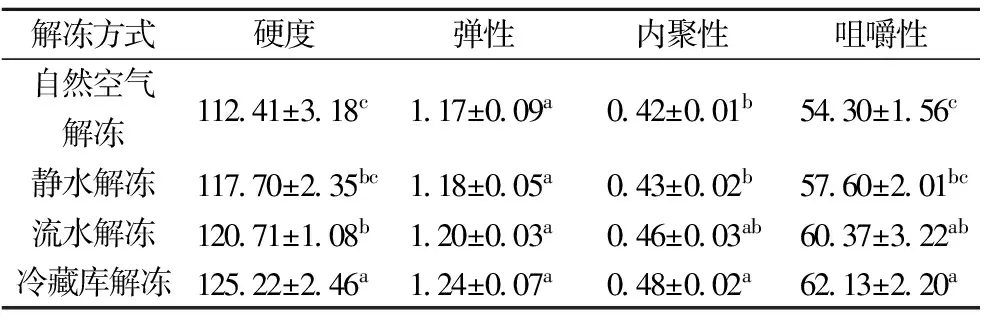
表2 解冻方式对质构的影响
2.5 可溶性蛋白含量的测定结果与分析
肌原纤维蛋白(结构蛋白)、肌浆蛋白分别占鱼类肌肉蛋白的50%~70%和20%~50%。由图3可见,不同方式解冻对SMP含量有不同影响,4种方式对应的SMP含量为冷藏库(54.14)>流水(52.67)>静水(50.76)>自然空气(47.51),而SSP含量稳定在43.42~43.68 mg/g之间。相比于SSP,SMP含量的变化可以从一定程度反映蛋白变性的情况。WANG等[18]研究的解冻方式对秋刀鱼也有类似的报道。MEGTA等[25]报道蛋白质溶解度下降是由于蛋白质变性暴露出疏水基团,凝聚沉淀。这一结果可能由于冷藏库解冻鱼肉肌原纤维蛋白结构和性质破坏较小,减少了SMP含量的降低,SMP含量变化与解冻汁液流失率和质构分析基本一致。
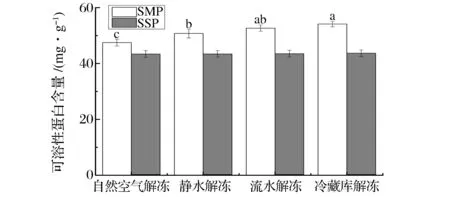
图3 解冻方式对可溶性蛋白含量的影响Fig.3 Effect of different thawing methods on SMP, SSP
2.6 Ca2+-ATPase活性、A-SH含量的测定结果与分析
肌原纤维蛋白可以在Ca2+存在的条件下催化ATP降解因此又称为Ca2+-ATPase。其活性的变化可以反映肌原纤维蛋白质发生变性的程度从而反映鱼肉的新鲜度。由图4可知4种方式对应的Ca2+-ATPase活性为冷藏库(0.19)>流水(0.17)>静水(0.14)>自然空气(0.11),其中冷藏库Ca2+-ATPase活性显著(P<0.05)高于其他3组。这一结果与XIU等[26]研究解冻方式对猪肉Ca2+-ATPase的影响得出高温解冻较低温解冻Ca2+-ATPase活性下降显著一致。目前关于Ca2+-ATPase活性下降的解释有很多如HATANO等[27]认为Ca2+-ATPase活性下降与肌原纤维蛋白的水解有关;JIANG等[28]认为巯基交联,引起蛋白构象改变,导致分子聚合使Ca2+-ATPase活性下降。从图4可以看出,A-SH含量的变化
与Ca2+-ATPase活性基本类似。巯基是蛋白头部具反应活性的功能基团,其氧化可使蛋白分子聚合,其变化可以反映蛋白变性聚合情况。这一结果与刘会省等[29]研究解冻方式对虾时的结果相反,这可能是由于本实验鲣鱼解冻采用排空气密封减少了氧气接触的机会,同时低温或短时解冻可以降低巯基的氧化。实验结果表明,冷藏库解冻肌原纤维蛋白结构和性质保持较好,与SMP含量变化分析、解冻汁液流失率和质构分析基本一致。
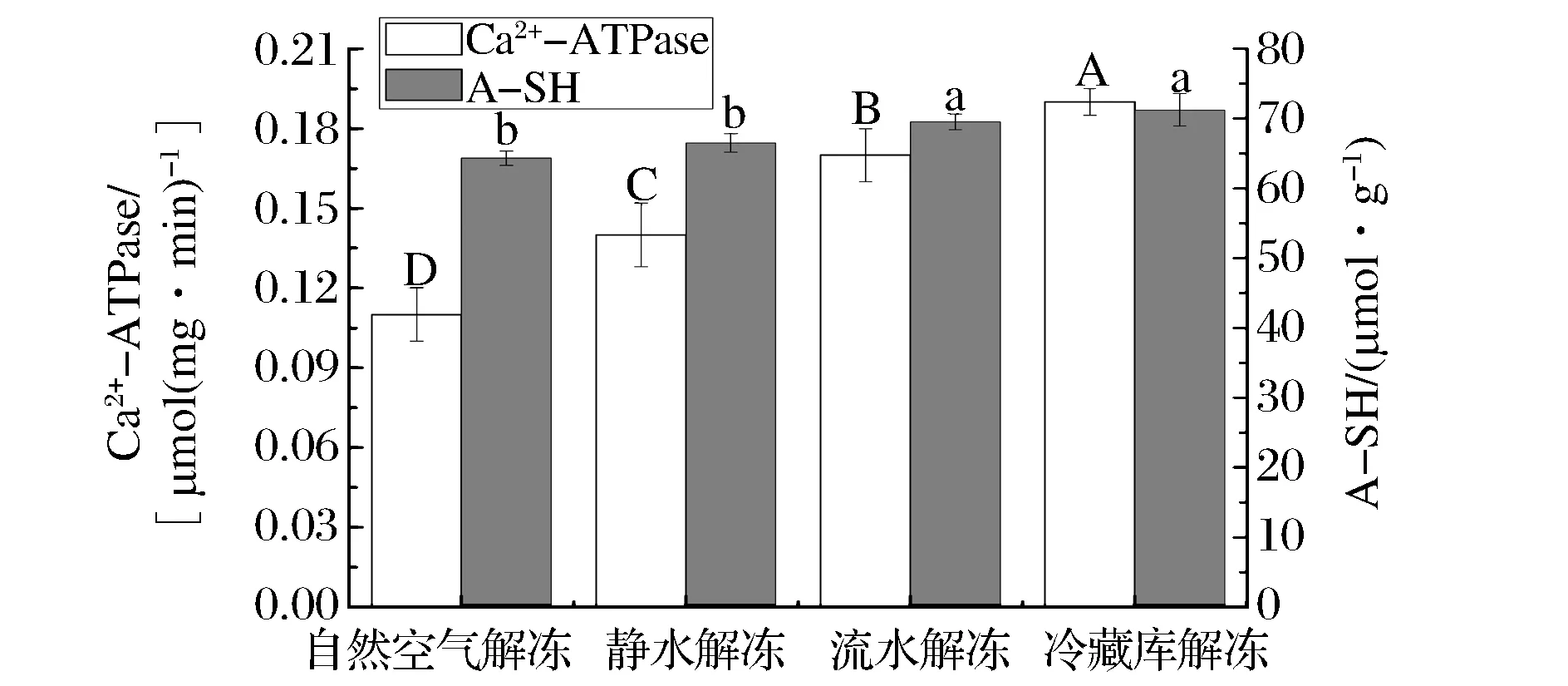
图4 解冻方式对Ca2+-ATPase活性及A-SH含量的影响Fig.4 Effect of different thawing methods on Ca2+-ATPase and A-SH
2.7 不同指标之间的相关性分析
从表3可知,硬度与Ca2+-ATPase活性极显著相关(P<0.01),解冻汁液流失率和咀嚼性与SMP含量、Ca2+-ATPase活性、A-SH含量极显著相关(P<0.01),这些相关性与XIU等[26]在研究不同解冻方式对猪肉时的结果类似,他们发现剪切力(剪切法测的质构指标)与Ca2+-ATPase和K-ATPase活性极显著相关。Ca2+-ATPase活性与SMP含量和A-SH含量极显著相关(P<0.01)。解冻汁液流失率、硬度和咀嚼性之间极显著相关(P<0.01)。不同方式解冻影响微生物的生长和生化反应,使鱼肉蛋白质变性、氧化交联和降解,导致SMP含量下降和汁液流失、产生有害物质组胺,使鲜度、质构下降。
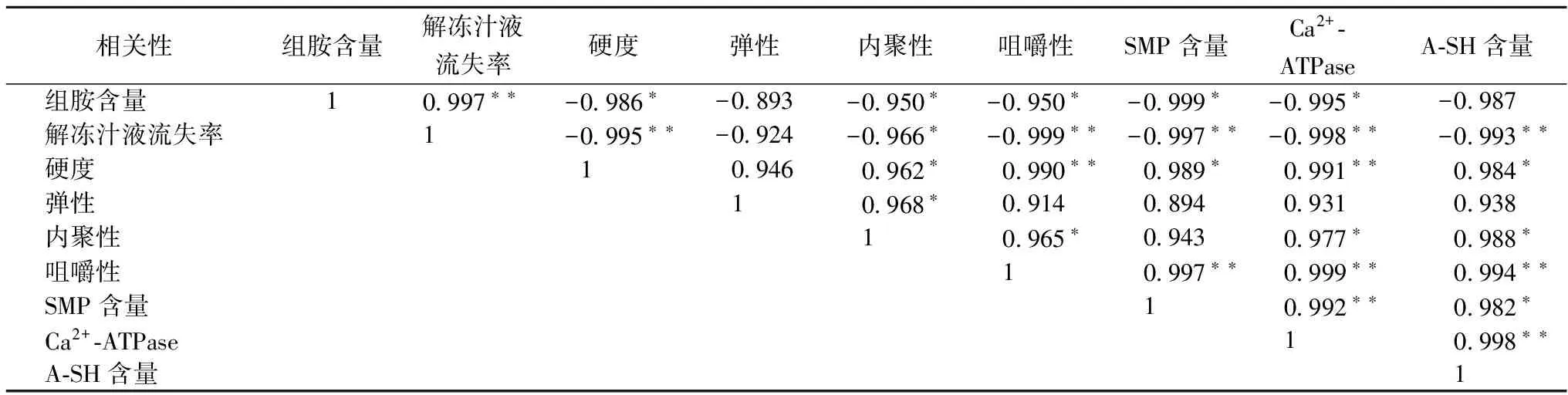
表3 组胺含量、解冻汁液流失率、质构及肌原纤维蛋白变化指标的相关性分析
注:*显著相关(P<0.05) ;**极显著相关(P<0.01)。
3 结论
本实验探究自然空气解冻、静水解冻、流水解冻、冷藏库解冻条件下鲣鱼鱼肉蛋白及组胺变化,结合解冻汁液流失率、色泽、质构的评价。结果表明:不同解冻方式对鲣鱼解冻品质有不同影响。自然空气和静水解冻品质较差,冷藏库解冻解冻时间较长,但抑制了微生物的滋长和生化反应减少了蛋白的变性与降解,从而解冻汁液流失率最低和较好的保持了质构特性,且硬度、色泽以及组胺控制显著(P<0.05)。流水解冻较大地缩短了解冻时间,品质稍差于冷藏库解冻,且需要较大的投入。因此,从品质保持角度考虑,冷藏库解冻适合作为鲣鱼罐头生产的解冻方式。
[1] 陈娜,尹晨玲,赵小惠,等.鲣鱼毛油脱胶技术的研究[J].肉类研究,2014,39(9):179-184.
[2] 孙丽.金枪鱼肉在蒸煮过程中品质特性变化的研究[D].无锡:江南大学,2009.
[3] HE Q,ZHU L,SHEN Y,et al.Evaluation of the effects of frozen storage on the microstructure of tilapia (Perciformes:Cichlidae) through fractal dimension method[J].LWT-Food Science and Technology,2015,64(2):1 283-1 288.
[4] TOKUR B,KANDEMR S.The effects of different thawing methods on protein quality of frozen fish[J].Fish science and technology,2014,30(2):23-30.
[5] GODIKSEN H,MORZEL M,HYLDIG G,et al.Contribution of cathepsins B, L and D to muscle protein profiles correlated with texture in rainbow trout (Oncorhynchus mykiss)[J].Food Chemistry,2009,113(4):889-896.
[6] 童玲,金毅,徐坤华,等.3种鲣鱼背部肌肉营养成分分析及评价[J].南方水产科学,2014,10(5):59-67.
[7] 段振华,王素华.金枪鱼的加工利用技术研究进展[J].肉类研究,2013,27(8):35-38.
[8] 赖小玲,何志权,陈华絮,等.几种海产品储藏期间组胺含量及其品质的变化[J].肉类研究,2007,28(1):333-336.
[9] 刘欢,陈雪,宋立玲,等.不同解冻方式对鲐鱼鲜度及品质的影响[J].食品科学,2016,37(10):259-265.
[10] 福田裕.冷冻金枪鱼的质量评价法[R].上海:21世纪水产品加工利用新技术国际,2007
[11] 缪函霖,包海蓉,赵路漫.金枪鱼肉冷藏过程中理化特性的变化[J].江苏农业科学,2013,41(8):248-251.
[12] MORRISSEY M T,BENJAKUL S,AN H J,SEYMOUR T A.Physicochemical changes in pacific whiting muscle proteins during iced storage[J].Journal of Food Science,1997,62(4):729-733.
[13] YONGSAWATDIIGUL J,PARK J W.Thermal denaturation and aggregation of threadfin bream actomyosin[J].Food Chemistry,2003,83(3): 409-416.
[14] NIU Li-hong,RASCO B,HUANG Yi-qun,et al.Relationship of changes in quality attributes and protein solubility of ground beef under pasteurization conditions[J].LWT-Food Science and Technology,2015,61(1):19-24.
[15] 缪函霖,王锡昌,包海蓉,等.不同新鲜度金枪鱼肉蒸煮品质的研究[J].食品工业科技,2014,35(13):80-85.
[16] 谢超,王阳光,邓尚贵.水产品中组胺产生机制及影响因素研究概述[J].肉类研究,2009(4):74-77.
[17] 刘书臣,廖明涛,赵巧灵,等.不同贮藏温度下大目金枪鱼鲜度及组胺变化[J].食品与发酵工业,2013,39(5):213-218
[18] WANG Feng-yu,CAO Rong,ZHANG Ling,et al.Effect of thawing methods on quality of Coloabis saira[J].Journal of Food Safety and Quality,2015,6(11):4 584-4 590.
[19] 尚艳丽,杨金生,夏松养.不同解冻方式对金枪鱼色泽的影响研究[J].食品科技,2012,35(1):72-75.
[20] HUNT M C,SORHEIM O,SLIDE E.Color and heat denaturation of myoglobin forms in ground beef[J].Food Chemistry and Toxicology,1999,64(5):847-885.
[21] 郭恒,钱怡,李颖杰,等.解冻温度对冷冻鲐鱼品质、质构及超微结构的影响[J].中国食品学报,2014,14(12):49-56.
[22] XIONG Y L.Antioxidations in muscle foods[M].New York:John Wiley and Sons,Inc, 2000:85-111.
[23] 继家笙,杨运华.水产品工业手册 [M].北京:北京轻工业出版社,1991.
[24] 余力,贺稚非.不同解冻方式对伊拉克兔肉品质特性的影响[J].食品科学,2015,36(14):258-264.
[25] MEHTA N K,ELAVARASAN K,REDDY A M,et al.Effect of ice storage on functional properties of protein from a few species of fresh water fish(India major carps) with special emphasis on gel forming ability[J].Food Science and Technology,2014,51:655-663.
[26] XIU Fang-xia,BAO Hua-kong,JING Liu,et al.Influence of different thawing methods on physicochemical changes and protein oxidation of porcline longissimus muscle [J].LWT-Food Science and Technology,2012,46(1):280-286.
[27] HATANO S.Effect of freezing and storage on the enzyme activities[J]. Refrigeration(Japanese), 1968,43: 14-16
[28] JIANG S T,HWANG D C,CHEN C S.Effect of storage temperature on the formation of disulfides and denaturation of milk fish actomyosin[J]. Food Science, 1988, 53(5):1 333-1 335.
[29] 刘会省,迟海,杨宪时.3解冻方式对船上冻结南极磷虾品质变化的影响[J].食品与发酵工业,2014,40(2):51-54.
Effect of different thawing methods on muscle proteins and histamine variation of skipjack tuna
LI Tian-xiang1,BAO Hai-rong1*,WANG Xi-chang1,GUO Quan-you2, HAN Qiu-yu1,ZHANG Qing1
1(College of Food Science and Technology, Shanghai Ocean University,Shanghai 201306, China) 2(East China Sea Fisheries Research Institute, Shanghai 200090, China)
The effect of different thawing methods(natural room temperature, static water, running water, and 4℃) on metmyoglobin (metMb), soluble myofibrillar proteins(SMP), soluble sarcoplasmic proteins(SSP), Ca2+-ATPase activity, active sulfhydryl(A-SH) and histamine content of skipjack tuna. Meanwhile, evaluations of thawing loss rate, color and texture were performed. The results indicated that thawing loss rate and chewiness with SMP content, Ca2+-ATPase activity, A-SH content; Ca2+-ATPase activity with A-SH content were highly correlation(P<0.01). 4℃ thawing method remained the best color, inhibited metMb and histamine content significantly(P<0.05), presented a better structure and functional property of myofibrillar protein, and remained a lower thawing loss rate and a better texture. Overall, the better thawing method is 4℃.
skipjack tuna; thawing methods; protein; histamine
10.13995/j.cnki.11-1802/ts.201703032
硕士研究生(包海蓉副教授为通讯作者,E-mail:hrbao@shou.edu.cn)。
国家高技术研究发展计划“863”计划(2012AA092302)
2016-06-30,改回日期:2016-07-27
