耐镉乳酸菌对重金属镉的吸附机制
2017-04-26邵鑫孙凯熊婧余翀吴希阳
邵鑫,孙凯,熊婧,余翀,吴希阳
(暨南大学 理工学院,食品科学与工程系,广东 广州,510632)
耐镉乳酸菌对重金属镉的吸附机制
邵鑫,孙凯,熊婧,余翀,吴希阳*
(暨南大学 理工学院,食品科学与工程系,广东 广州,510632)

乳酸菌;镉耐受性;吸附机制
在所有重金属污染问题中,镉因其生物毒性大、移动性强成为最受关注的对象之一[1]。而通过食物摄入是镉进入人体的最主要渠道(90%)[2-4]。当镉被人体吸收后,自然排泄是一个非常缓慢的过程,因此,使用解毒剂驱排体内蓄积的镉是预防及治疗镉中毒的优选措施[5]。但这些药物治疗方法单一,副作用多、安全性差、价格昂贵、疗程较长。螯合物还会结合除镉之外的其他金属,甚至体内的一些必需微量元素,若长时间服用会影响机体健康[6-7]。
由于农产品/食品重金属镉污染问题日趋严重,寻找能够移除食品及人体中的重金属镉的方法已然迫在眉睫。虽然已发现了许多能够吸附重金属镉的微生物,但它们通常是环境工业微生物或条件致病菌,无法应用于食品行业[8]。
乳酸菌具有吸附重金属镉的能力,不仅能够在环境中对镉进行吸附,且在肠道内也能够发挥吸附作用[9-13]。环境和肠道微生态在长期的低剂量镉的压力下,可能会产生对镉的耐受性,因此通过筛选能够分离出耐镉乳酸菌成为潜在的镉吸附剂和解毒剂。而乳酸菌作为食品安全级别的益生菌,在食品中应用广泛,使用食品安全级的乳酸菌作为重金属镉吸附剂添加到含镉食品中移除食品中的镉;或作为膳食补充剂摄入体内,通过粪便将重金属排出体外,防止镉在体内进行积累是新的研究思路[14]。
现有的研究报道局限于乳酸菌对镉的吸附力研究,缺乏对细菌细胞本身机理的了解。本研究结合红外光谱、扫描电镜方法,从细胞的微观结构及形态变化对乳酸菌吸附重金属镉的机理进行了探索。
1 实验材料
1.1 实验菌株
研究采用的乳酸杆菌菌株如表1所示,为本实验室收藏的标准菌株,其中的干酪乳杆菌(LAB-111)分离自益力多乳酸菌饮品。
1.2 培养基及相关试剂
MRS培养基(250 g)、MRS肉汤(250 g),北京陆桥技术有限责任公司;戊二醛(500 mL)、无水乙醇(500 mL)、醋酸异戊酯(500 mL)、多聚甲醛(500 mL)、Cd(NO3)2·4 H2O(分析纯),天津市大茂化学试剂厂。
1.3 仪器与设备
真空冷冻干燥机(FD-1-50),北京博医康实验仪器有限公司;傅里叶变换红外吸收光谱仪(EQUINOX55),德国Bruker公司;扫描电子显微镜(XL-30ESEM)、透射电子显微镜(TECNAI-10),荷兰飞利浦公司;火焰原子分光光度计(AA-7000),日本岛津公司。
2 实验方法
2.1 镉储备液的配制
称取27.44 g Cd(NO3)2·4 H2O溶于100 mL无菌蒸馏水中,配制成100 g/L的母液,经0.45 μm滤膜过滤后,储存于4 ℃冰箱中。
2.2 实验菌株的最低抑菌浓度(MIC)测定
将表1中17株实验室保藏的标准乳酸杆菌接种于MRS平板中,于37 ℃二氧化碳培养箱中培养48 h,挑取单菌落悬浮于1 mL灭菌纯水中,取1环划线于不同Cd2+浓度的平板上培养48~72 h后观察生长情况并记录各菌株的MIC。
2.3 目标菌体收集及吸附
将表1中LAB-5、LAB-9、LAB-28、LAB-53四株对镉具有高耐受性的乳酸杆菌(MIC≥4.0 g/L)的实验菌株和1株在镉耐受性实验中MIC最低(10 mg/L)的乳酸菌LAB-54接种于MRS培养基上,置于37 ℃二氧化碳培养箱中培养48 h,挑取单菌落接种于MRS肉汤中,37 ℃培养24 h后,2 795 g离心10 min收集菌体,用灭菌纯水洗涤3次,悬浮成100 g/L(湿重)的菌悬液。
取100 g/L的镉储备液用无菌水配制成浓度为100 mg/L的Cd2+水溶液,加入100 g/L的菌悬液,使菌体终浓度为5 g/L,置于37 ℃摇床培养120 min。于2 795 g离心10 min使吸附后的菌体沉淀,用无菌水洗涤3次,转入已称重的EP管中,80 ℃烘箱干燥至恒重,测干重。上清液用0.45 μm滤膜过滤,存于4 ℃冰箱中待测。共设3批平行实验。
取100 g/L的镉储备液用无菌水配制成浓度为0、25、300 mg/L的Cd2+水溶液,分别加入LAB-5和LAB-54 100 g/L的菌悬液,使菌体终浓度为5 g/L,置于37 ℃摇床培养120 min。4 024.8 g离心10 min使吸附后的菌体沉淀,用纯水洗涤3次后再次离心使菌体沉淀。
2.4 标准曲线的制作
取镉标准溶液(100 ppm)配制成浓度为0、0.5、1、1.5、2、2.5 ppm的标准溶液,注入火焰原子化器中测其吸光度值,以标准曲线工作液的浓度为横坐标,相应的吸光度值为纵坐标,绘制标准曲线并求出吸光度值与浓度关系的一元线性回归方程。
2.5 仪器工作参数设定及样品的测定
火焰原子吸收分光光度计测定条件如下:波长228.8 nm,狭缝0.15~0.2 nm,灯电流6~7 mA,空气流量5 L/min,背景校正为氚灯。
于测定标准曲线工作液相同的实验条件下,吸取吸附后的上清液样品注入火焰原子化器,测其吸光度值。代入标准系列的一元线性回归方程中求样品中镉的浓度,平行测定2次。若测定结果超出标准曲线范围,用1%硝酸溶液稀释至范围内后再行测定。按公式(1)计算镉的生物吸附率[15]:
(1)
其中,Qr,吸附率,%;Co,金属离子初始浓度,mg/L;Ce,吸附后重金属离子最终浓度,mg/L;m,菌株的干重,g;V,溶液总体积,L。
2.6 红外光谱及扫描电镜分析
将吸附后的菌体沉淀在-80 ℃冷冻过夜后,冷冻干燥至恒重,取干燥菌粉于玛瑙研钵中与溴化钾以1∶50的质量比在红外灯下研磨混匀后压片,成形后置于傅里叶变换红外吸收光谱仪的检测台上,对镉结合的细胞进行红外光谱分析。
以2.5%戊二醛悬浮吸附后的菌体沉淀,于4℃冰箱中固定过夜,4 024.8 g离心5 min,去上清;用0.1 mol/L,pH 7.2的PBS清洗菌体3次,每次10 min;用30%、50%、70%、90%的乙醇梯度脱水各10 min,再用无水乙醇(100%)脱水2次,每次10 min,然后用醋酸异戊酯悬浮菌体2次,每次8 min;将菌悬液在盖玻片上滴样,待醋酸异戊酯挥发后,将盖玻片置于临界点干燥机的样品槽内进行干燥处理;将干燥好的样品粘贴在铜台上,用离子镀膜机在样品表面喷镀1层金属导电膜,然后将样品置于扫描电镜样品观察室中,选用3 kV加速电压对菌体的表面微观特征进行观察。
3 结果与讨论
3.1 MIC测定结果
对17株乳酸杆菌进行MIC测定的结果显示,共有4株菌MIC≥4.0 g/L(23.50%),11株菌(64.70%)的MIC低于2.0 g/L,其中LAB-54的MIC最低为10 mg/L,另外2株菌的MIC在2.0~2.5 g/L,如表1所示。
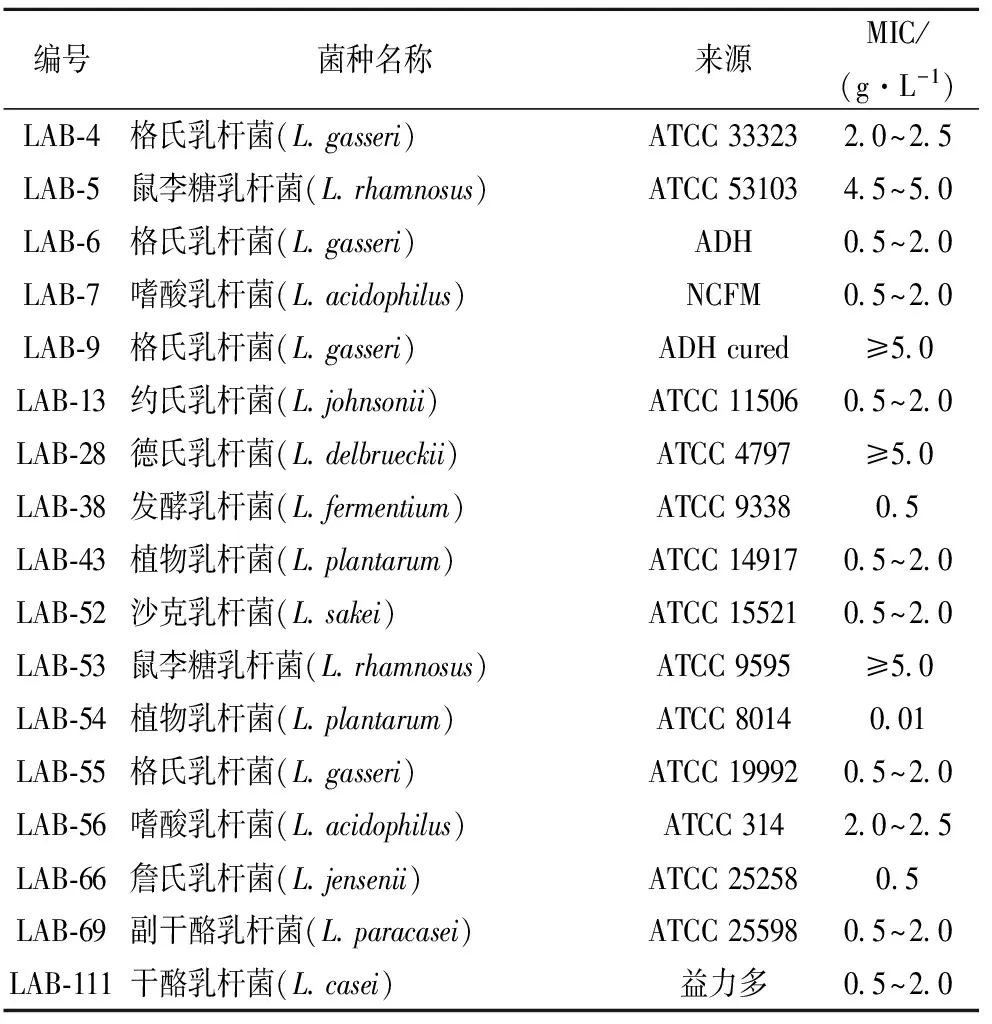
表1 实验菌株的耐镉MIC实验
3.2 标准曲线的制作
镉标准溶液的浓度分别为0、0.05、0.1、0.15、0.2、0.25 mg/L,以Cd2+浓度为横坐标,吸光度值为纵坐标,绘制的标准曲线回归方程为:y=1.003 7x+0.007 2,拟合度R2=0.999 2。
3.3 不同乳酸菌对镉的吸附率
本研究通过原子吸收分光光度法测定经乳酸菌在含Cd2+溶液中进行生物吸附后的Cd2+含量,可知细菌胞内或胞外吸附后溶液中的重金属含量的改变,从而测定出不同的菌株对镉的吸附性能。
图1显示了4株对镉具有高耐受性能以及1株对镉具有低耐受性能的乳酸菌在Cd2+浓度为100 mg/L的溶液中对Cd2+的吸附率。
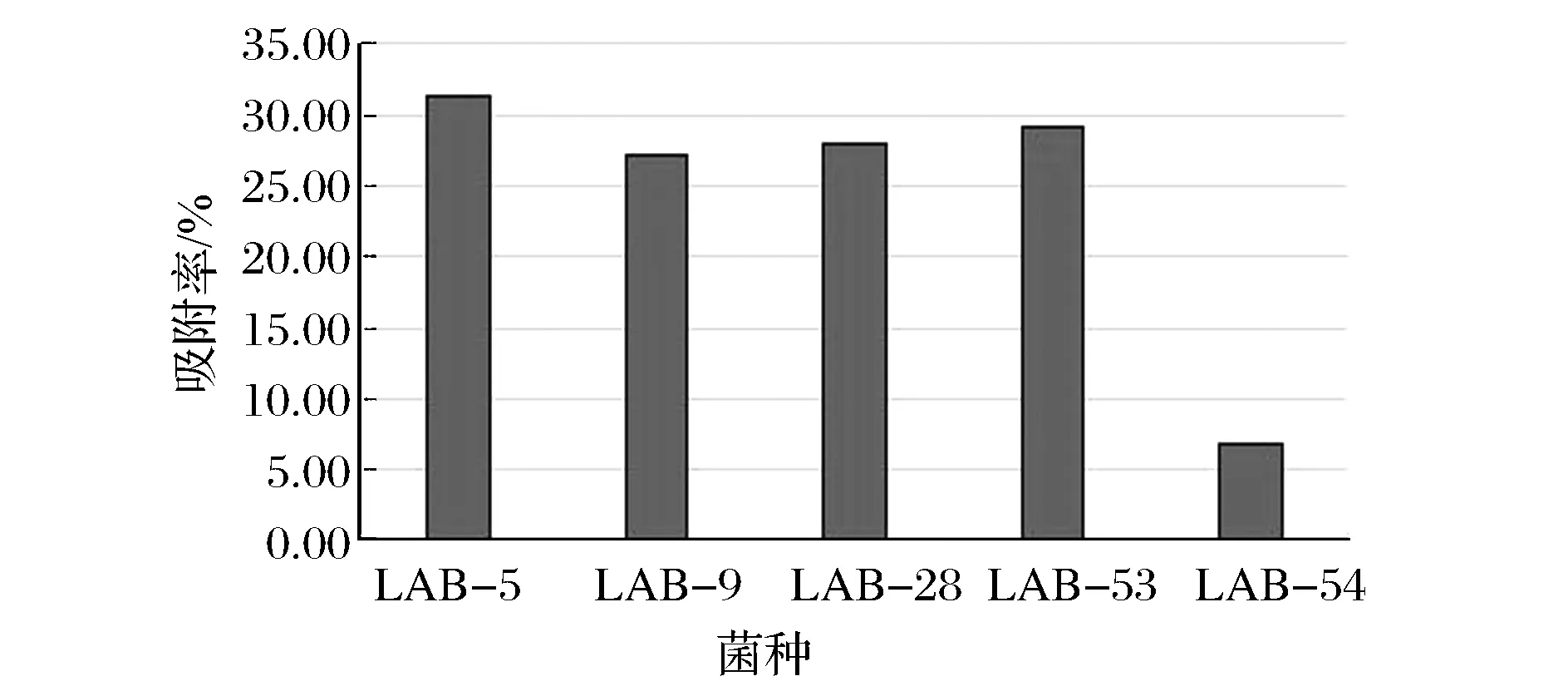
图1 耐镉乳酸菌的镉吸附率Fig.1 Cd removal efficiency of Cd-resistant LAB strains
可以看出,4株高耐受乳酸菌具有一定的Cd2+吸附能力,而LAB-54作为低耐受对照菌株的吸附率最低(6.80%),LAB-9、LAB-28、LAB-53 3株菌的吸附率分别为:27.20%、28.00%、29.10%。LAB-5的吸附率最高, 达到了31.40%。ZHAI等在筛选高吸附性能的菌株时将筛选标准定为当吸附率高于18% 则认为该菌株具有高吸附性能[16]。若以此为依据,则本研究所筛选的4株乳酸菌皆被认为是高吸附菌株。
3.4 红外光谱

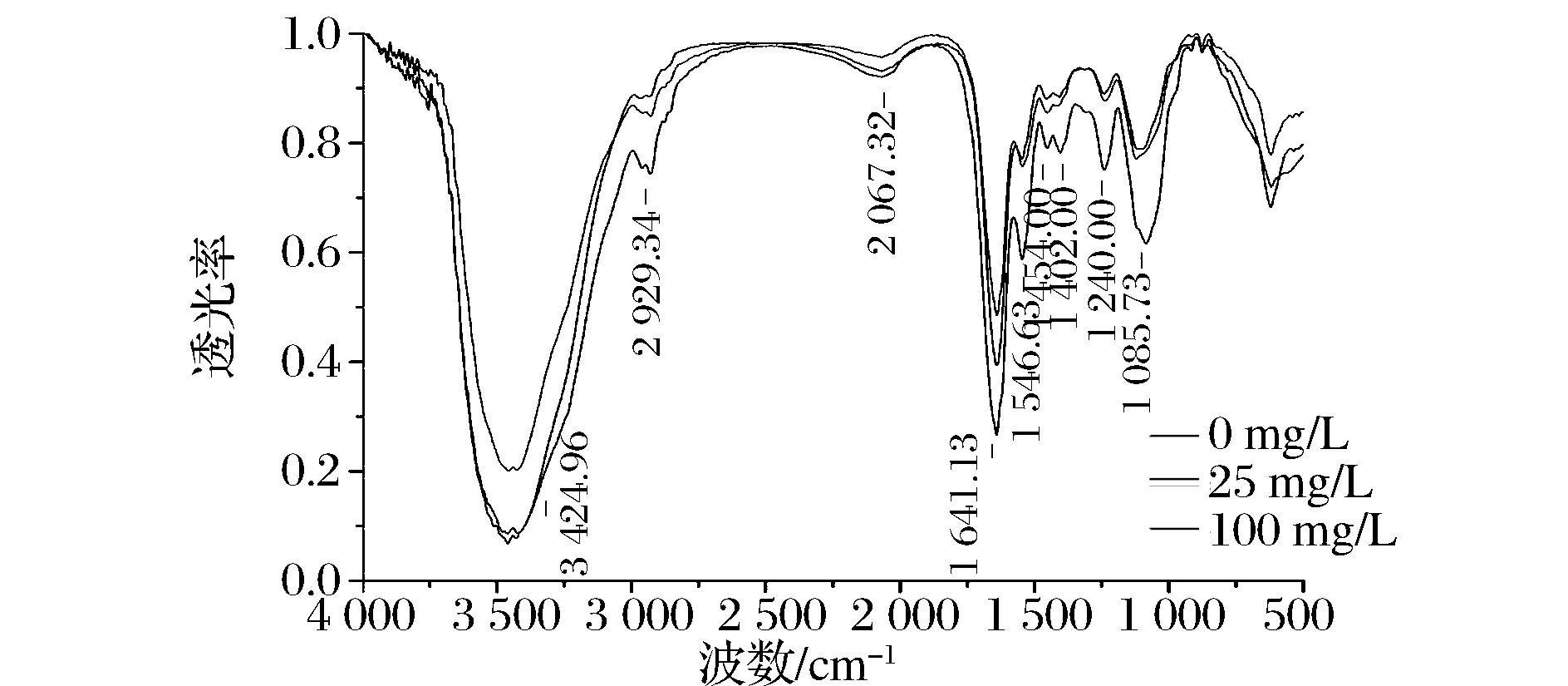
图2 在3种Cd2+浓度(0、25、300 mg/L)下LAB-5的FTIR图Fig.2 FTIR photographs of LAB-5 biomass under three different Cd2+ concentrations (0, 25, 300 mg/L)
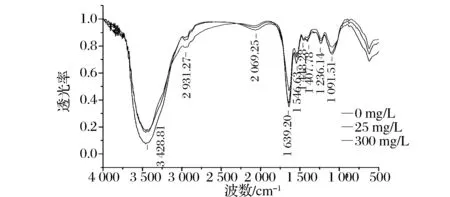
图3 在3种Cd2+浓度(0、25、300 mg/L)下LAB-54的FTIR图Fig.3 FTIR photographs of LAB-54 biomass under three different Cd2+ concentrations (0, 25, 300 mg/L)
吸附前后主要吸收峰的变化量如表2所示,以吸附前为对照,若吸附后为负值,则该吸收峰向低波数移动,代表红移,若吸附后为正值,则该吸收峰向高波数移动,代表蓝移。

表2 吸附重金属镉前后细胞主要吸收峰的变化

LAB-54的镉耐受能力非常弱,MIC为10 mg/L,选取该菌目的是作为对照组观察低耐受菌株与镉的结合机制。在25 mg/L的Cd2+处理后,只有原位于3 428.81 cm-1和2 931.27 cm-1的峰位置发生偏移,强度明显减弱,其他位置的吸收峰变化均不明显,推测此时Cd2+与细胞结合位点主要在细胞壁的脂肪酸上。在300 mg/L的Cd2+处理后,各吸收峰均出现了不同程度的强度减弱,说明该菌与羟基、羧基、磷酸基、酰胺基、烃基官能团共同作用。

3.5 扫描电镜分析
扫描电镜能从不同角度对样品的表面微观形态观察,对在空白对照(0 mg/L)、低浓度(25 mg/L)和高浓度(300 mg/L)的Cd2+进行吸附后的2株乳酸菌进行扫描,以细胞的变化来分析镉对细胞的影响,并推测作用机制。
图4为LAB-5在3种不同Cd2+浓度处理后的细胞形态。LAB-5为革兰氏阳性长杆菌,吸附前(图4-A)细胞形态完整无缺,表面光滑饱满,细胞与细胞之间似乎黏连着一层光滑的外膜。在25 mg/L的Cd2+吸附后(图4-B)的细胞明显出现变形、扭曲、凹陷、皱褶,表面变得粗糙,细胞之间覆盖着的光滑外膜消失,胞外还黏连着一些丝状物质。在300 mg/L的Cd2+吸附后(图4-C)的细胞损伤更为严重,明显观察到细胞壁穿孔现象,表面粗糙不堪,有些细胞的胞内物质完全流失,呈扁平状的空壳塌陷在盖玻片上,丝状黏连物明显增多。结合红外光谱(图2)来看,在低浓度下,细胞已开始大规模坏死,推测Cd2+同时与细胞壁上的S层蛋白、多聚糖、胞内分泌的多糖、酰胺、蛋白质结合。在高浓度下,细胞坏死加重,推测是由于Cd2+浓度过高,胞内外渗透压差异巨大,更多高毒性的镉进入了细胞内部,胞内物质迅速并且大量地从孔中溢出,使镉的吸附量从低浓度的7 mg/g增加到21 mg/g(干重)。
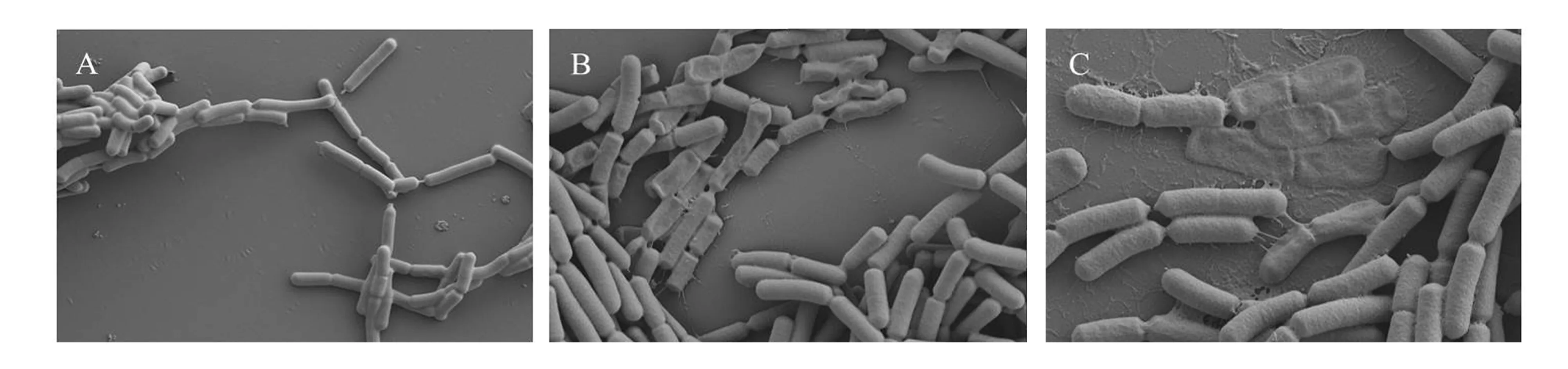
图4 在3种Cd2+浓度下LAB-5的SEM图(A-0、B-25 mg/L、C-300 mg/L)Fig.4 SEM photographs of LAB-5 biomass under three different Cd2+ concentrations (A-0, B-25, C-300 mg/L)
图5为LAB-54在3种不同Cd2+浓度处理后的细胞形态。LAB-54为革兰氏阳性短杆菌,由于该菌的MIC只有10 mg/L,因此其在25和300 mg/L的Cd2+都无法生长,推测是Cd2+的毒性导致细胞死亡。该菌未对其吸附性能进行探讨,但由于其MIC非常低,失活菌体对镉的吸附能力应较强。吸附前(图5-A)细胞为存活状态,完整无缺,表面饱满。在25 mg/L的Cd2+吸附后(图5-B)的细胞壁形态完全改变,表面粗糙,内陷、破裂、穿孔的程度十分严重,胞外附着许多细小颗粒。在300 mg/L的Cd2+吸附后(5C)的细胞胞内物质完全流失,呈扁平状的空壳塌陷在盖玻片上,有些细胞堆积在一起完全变形,甚至无法观察到细胞原来的形态。

图5 在3种Cd2+浓度下LAB-54的SEM图(A-0、B-25 mg/L、C-300 mg/L)Fig.5 SEM photographs of LAB-54 biomass under three different Cd2+ concentrations (A-0, B-25 mg/L, C-300 mg/L)
对以上2株菌进行扫描电镜分析,可以初步推测:LAB-5在低浓度下细胞几乎无死亡,此时为胞外吸附,在高浓度下细胞坏死较多,表明Cd2+已通过胞内运输进入细胞内部,胞外吸附和胞内扩散共同作用;LAB-54则在低浓度下可能同时存在2种机制共同作用。因此,乳酸菌与镉的作用机制包括胞外吸附及胞内扩散,而高耐受细菌可能存在一些耐受机制能够阻止Cd2+进入胞内,或将已进入胞内的Cd2+排出。
4 结论

[1] 张宝悦,王激清,刘社平,等.重金属镉污染对蔬菜的影响及防治对策[J].长江蔬菜,2006(3):34-36.
[2] United Nations Environment Programme.Draft final review of scientific information on cadmium[R].UNEP,2008.
[3] VAHTER M,BERGLUND M,LIND B,et al.Personal monitoring of lead and cadmium exposure-a Swedish study with special reference to methodological aspects[J]. Scandinavian Journal of Work,Environment and Health,1991,17(1):65-74.
[4] OLSSON I M,BENSRYD I,LUNDH T,et al.Cadmium in blood and urine——impact of sex,age,dietary intake,iron status,and former smoking-association of renal effects[J].Environmental Health Perspectives,2002,110(12):1 185-1 190.
[5] LICHTFOUSE E,SCHWARZBAUER J,ROBERT D.Environmental chemistry for a sustainable world[M]//Pollutant diseases, remediation and recycling:Vol 2.Springer,2013:388.
[6] EYBL V,KOTYZOVA D,KOUTENSKY J.Comparative study of natural antioxidants-curcumin, resveratrol and melatonin-in cadmium induced oxidative damage in mice[J].Toxicology,2006,225:150-156.
[7] BLUDOVSKA M,KOTYZOVA D,KOUTENSKY J,et al.The influence of alpha-lipoic acid on the toxicity of cadmium[J].General Physiology and Biophysics,1999,18:28-32.
[8] MRVCIC J,STANZER D,SOLIC E,et al. Interaction of lactic acid bacteria with metal ions:opportunities for improving food safety and quality[J].World Journal of Microbiology and Biotechnology,2012,28(9):2 771-2 782.
[9] HALTTAUNEN T,COLLADO M C,ELNEZAMI H,et al.Combining strains of lactic acid bacteria may reduce their toxin and heavy metal removal efficiency from aqueous solution[J].Letters in Applied Microbiology,2008,46(2):160-165.
[10] HALTTAUNEN T, SALMINEN S,TAHOVONEN R.Rapid removal of lead and cadmium from water by specific lactic acid bacteria[J]. International Journal of Food Microbiology,2007,114(1):30-35.
[11] TEEMU H,SEPPO S,JUSSI M,et al.Reversible surface binding of cadmium and lead by lactic acid and bifidobacteria[J]. International Journal of Food Microbiology,2008,125(2):170-175.
[12] TOPCU A,BULAT T.Removal of cadmium and lead from aqueous solution byEnterococcusfaeciumstrains[J].Journal of Food Science,2010,75(1):13-17.
[13] BHAKTA J N,MUNEKAGE Y,OHNISHI K,et al.Isolation and identification of cadmium-and lead-resistant lactic acid bacteria for application as metal removing probiotic[J].International Journal of Environmental Science and Technology,2012,9(3):433-440.
[14] BHAKTA J N,OHNISHI K,MUNEKAGE Y,et al.Characterization of lactic acid bacteria-based probiotics as potential heavy metal sorbents[J].Journal of Applied Microbiology,2012,112(6):1 193-1 206.
[15] KINOSHITA H,SOHMA Y,OHTAKE F,et al.Biosorption of heavy metals by lactic acid bacteria and identification of mercury binding protein[J].Resource Microbiology,2013,164(7):701-709.
[16] ZHAI Q,YIN R,YU L,et al.Screening of lactic acid bacteria with potential protective effects against cadmium toxicity[J]. Food Control,2015,54:23-30.
[17] GERBINO E,MOBILI P,TYMCZYSZYN E,et al.FTIR spectroscopy structural analysis of the interaction between Lactobacillus kefir S-layers and metal ions[J].Journal of Molecular Structure,2011,987(1-3):186-192.
[18] CHAKRAVARTY R,BANERJEE P C.Mechanism of cadmium binding on the cell wall of an acidophilic bacterium[J].Bioresoure Technolology,2012,108:176-183.
The cadmium removal mechanism of lactobacillus strains
SHAO Xin, SUN Kai, XIONG Jing, YU Chong, WU Xi-Yang*
(Department of Food Science & Engineering,Jinan University, Guangzhou 510632, China)

lactic acid bacteria (LAB); cadmium (Cd) resistance; removal mechanism
10.13995/j.cnki.11-1802/ts.201703009
硕士研究生(吴希阳教授为通讯作者,E-mail:kentwu@hotmail.com)。
广东省科技计划项目(2015A030401042);广东省自然科学基金项目(S2012010008479)
2016-05-12,改回日期:2016-11-02
