茵陈水提物对牛血清白蛋白诱导的肝损伤大鼠的保护作用研究
2017-04-26吴军,尚瑞
吴 军,尚 瑞
·实验性肝炎·
茵陈水提物对牛血清白蛋白诱导的肝损伤大鼠的保护作用研究
吴 军,尚 瑞
目的 研究茵陈水提物对牛血清白蛋白所致肝纤维化大鼠的保护作用。方法将90只SD大鼠随机平均分为正常组、模型组、秋水仙碱组、大剂量(200 mg·kg-1)、中等剂量(100 mg·kg-1)和小剂量(50 mg·kg-1)茵陈水提物处理组。在造模成功后除对照组和模型组外,给予药物灌胃。在末次给药后取各组大鼠血清和肝组织,检测血清Ⅲ型前胶原(PC-Ⅲ)、Ⅳ型胶原(Ⅳ-C)、层粘连蛋白(LN)和透明质酸酶(HA)及肝组织羟脯氨酸含量,观察肝组织病理学变化。结果大剂量药物处理组动物血清ALT、AST、PC-Ⅲ、Ⅳ-C胶原、LN、HA及肝组织羟脯氨酸含量分别为(103.78±19.83)IU/L、(246.53±36.67)IU/L、(30.34±2.52)ng/ml、(29.54±2.65)ng/ml、(45.34±1.45)ng/ml、(232.51±23.66)ng/ml及(0.85±0.22)μg/mg,中剂量组分别为(124.59±24.41)IU/L、(277.23±36.45)IU/L、(34.57±2.34)ng/ml、(34.90±2.45)ng/ml、(52.13±2.34)ng/ml、(283.14±23.75)ng/ml及(0.96±0.26)μg/mg,均明显低于模型组【分别为(161.24±26.23)IU/L、(382.45±39.45)IU/L、(41.78±3.12)ng/ml、(42.34±3.25)ng/ml、(65.14±3.81)ng/ml、(383.53±39.35)ng/ml及(1.43±0.17)μg/mg,P均<0.05】;大和中剂量组ALB水平分别为(35.66±2.85)g/L和(35.78±2.64)g/L,均明显高于模型组【(31.32±2.15)g/L,P均<0.05】;大和中剂量组重度纤维化发生率均为13.3%,均明显低于模型组的93.3%(P均<0.05);肝组织病理学检查显示,与模型组比,大和中剂量组大鼠肝细胞水肿、变性和坏死情况均显著减轻。结论茵陈水提物具有一定的抗肝纤维化作用,值得进行深入研究。
肝纤维化;茵陈;牛血清白蛋白;免疫性肝损伤;大鼠
保肝作用是茵陈水提物最重要的活性之一[1~6],其对黄疸型肝炎等具有显著的治疗疗效[7,8]。我们采用牛血清白蛋白(BSA)诱导大鼠肝损伤,观察了茵陈水提物的抗肝纤维化作用,旨在为茵陈水提物的抗肝纤维化研究提供一定的理论依据。
1 材料与方法
1.1 仪器、药物和试剂 AN-7型全自动生化分析仪(美国安捷伦公司);OP-721型和OP-752c型紫外分光光度计(常州第一分析仪器厂);L-530型多管架自动离心机(上海市第一仪器有限公司);DF-9型立式压力蒸汽灭菌器(沈阳市医疗设备厂);JG-01型电热恒温培养箱(上海市第一仪器有限公司)。菊科蒿属植物茵陈购于河北省安国市安国中药材交易中心,经中国药科大学中药学院王文教授鉴定。茵陈水提取物由中国药科大学中药学院生药教研室制备,取药材粉末,加入10倍药材当量的纯净水,于100℃煮沸3次,合并各次提取液,减压蒸馏,配制成1.2 g/ml的水提浸膏。BSA(罗氏制药出品,由上海源聚生物科技有限公司分装,批号:09023124);秋水仙碱(武汉人福制药股份有限公司,批号:2014021321);福氏不完全佐剂和检测肝组织羟脯氨酸试剂盒(美国Sigma公司,批号分别为98030821和98120690);检测Ⅲ型前胶原、Ⅳ型胶原、层粘连蛋白(LN)和透明质酸酶(HA)所需放免试剂盒(武汉博士德有限公司,批号分别为2014120 934、2014112432、2014120133和2015010289)。
1.2 免疫性肝纤维化大鼠模型的建立 90只雄性SD大鼠,体质量为(120±10)g,购于江苏省疾控中心实验动物中心,由中国药科大学中药学院药理学教研室饲养。将SD大鼠随机分为正常组、模型组、秋水仙碱组、茵陈水提物大、中和小剂量组,每组15只。采用文献介绍的方法[9],在除正常组外的大鼠,取溶有BSA的生理盐水(9 g/L)与等量福氏不完全佐剂相互混匀,制备造模用乳悬液,取0.5 ml,给予大鼠皮下注射,第1次与第2次注射时间间隔为14 d,以后间隔7 d,共注射5次。在第5次注射后7 d,给予BSA 0.2 mg/0.5 ml尾静脉注射,2次/w,以后给予0.4 mg/0.5 ml尾静脉注射,2次/w,共计注射15次。造模组大鼠造模时间为35 d。在大鼠造模成功后,分别给予秋水仙碱0.1 mg·kg-1、茵陈水提取物200 mg·kg-1、100 mg·kg-1和50 mg·kg-1灌胃,1次/d,干预80 d;在正常组和模型组,则给予大鼠同等量生理盐水灌胃。在最后一次给药3 h后,采用乙醚麻醉大鼠,经腹主动脉取血,制备血清。采血完成后,处死大鼠并取肝组织20 mg,置于福尔马林溶液中固定,采用HE染色,行组织病理学检查。根据文献[10],将肝组织肝纤维化程度分为5期:Ⅳ期即肝组织全小叶纤维结缔组织弥漫性增生,同时伴有假小叶形成;Ⅲ期即纤维结缔组织主要出现于大鼠肝小叶中央静脉周围;Ⅱ期即纤维结缔组织增生情况不超过小叶面积的2/3;Ⅰ期即纤维结缔组织仅存在于大鼠肝脏汇管区;0期即大鼠肝组织无纤维化。其中Ⅳ期和Ⅲ期肝纤维化病变为重度肝纤维化。
1.3 检测 采用试剂盒分别检测肝组织羟脯氨酸含量和血清PC-Ⅲ、Ⅳ-C胶原、LN和HA水平;常规检测血清生化指标。
1.4 统计学处理 应用SPSS 22.0软件对数据进行统计学处理,计量资料以±s表示,组间差异采用LSD法进行比较,计数资料采用x2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠血清肝功能指标比较 与模型组比,秋水仙碱组、大、中剂量药物组大鼠血清ALT和AST水平均显著降低(P<0.05),而ALB和TP水平则均有显著升高(P<0.05);小剂量组大鼠上述指标与模型组比,则无显著性相差(P>0.05,表1)。
2.2 各组大鼠血清肝纤维化相关指标的比较 与正常组比,模型组大鼠血清PC-Ⅲ、Ⅳ-C胶原、HA和LN均显著升高;与模型组比,秋水仙碱组、大剂量和中剂量组大鼠血清上述指标均明显降低(P<0.05),而小剂量组与模型组比,无显著性相差(P>0.05,表2)。
2.3 各组大鼠肝组织羟脯氨酸含量比较 正常组、秋水仙碱组、大剂量和中剂量茵陈水提物组大鼠肝组织羟脯氨酸含量分别为(0.73±0.15)μg/mg、(0.79±0.20)μg/mg、(0.85±0.22)μg/mg和(0.96± 0.26)μg/mg,均明显低于模型组 [(1.43±0.17)μg/mg,P<0.05];小剂量茵陈水提物组大鼠肝组织羟脯氨酸含量为(1.34±0.33)μg/mg,与模型组比无显著性相差(P>0.05)。
2.4 各组大鼠肝组织病理学表现 模型组和小剂量药物组大鼠肝组织主要呈Ⅲ~Ⅳ级纤维化,且多伴肝细胞脂肪变性及灶性坏死;秋水仙碱组、大剂量和中剂量组肝组织主要呈0~Ⅱ级纤维增生,其重度纤维化发生率均显著低于模型组(P<0.05,表3、图1)。
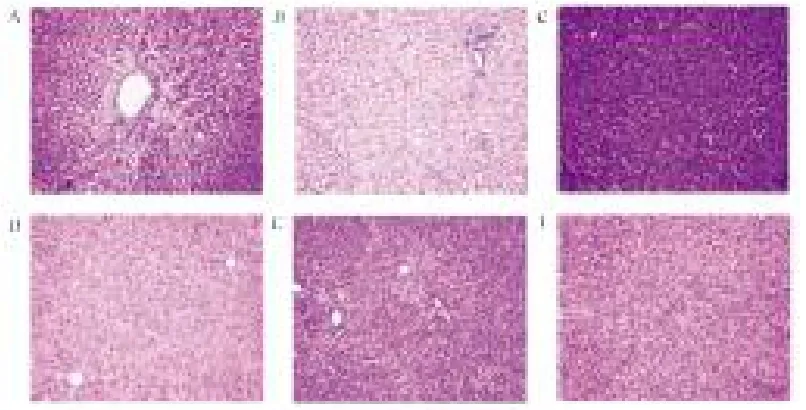
图1 各组大鼠肝组织病理学表现(HE,400×)
表1 各组大鼠血清肝功能指标(±s)比较
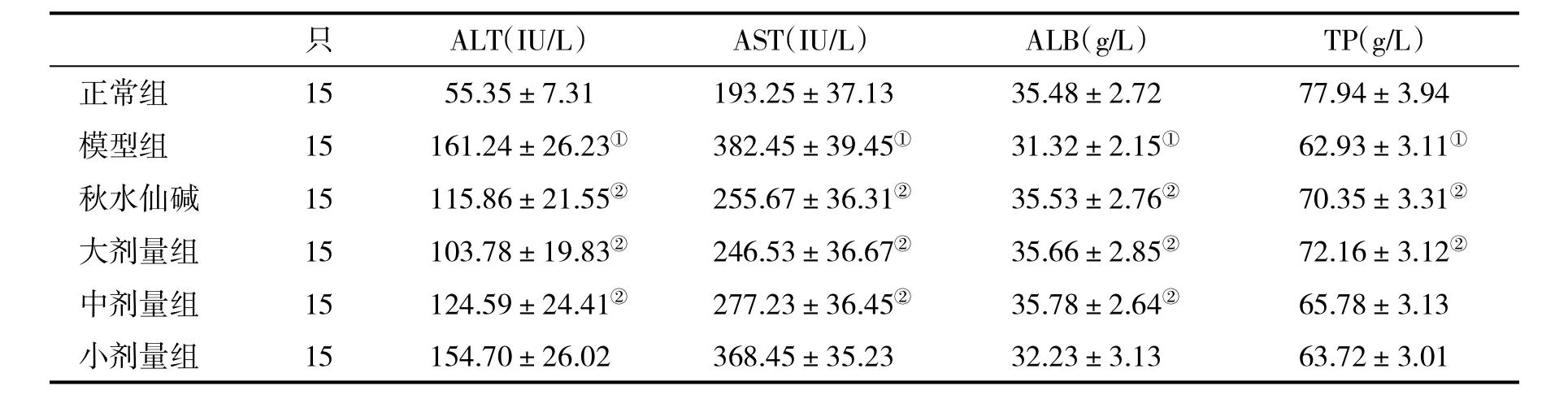
表1 各组大鼠血清肝功能指标(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只 ALT(IU/L) AST(IU/L) ALB(g/L) TP(g/L)正常组 15 55.35±7.31 193.25±37.13 35.48±2.72 77.94±3.94模型组 15 161.24±26.23① 382.45±39.45① 31.32±2.15① 62.93±3.11①秋水仙碱 15 115.86±21.55② 255.67±36.31② 35.53±2.76② 70.35±3.31②大剂量组 15 103.78±19.83② 246.53±36.67② 35.66±2.85② 72.16±3.12②中剂量组 15 124.59±24.41② 277.23±36.45② 35.78±2.64② 65.78±3.13小剂量组 15 154.70±26.02 368.45±35.23 32.23±3.13 63.72±3.01
表2 各组大鼠血清肝纤维化指标(±s)比较
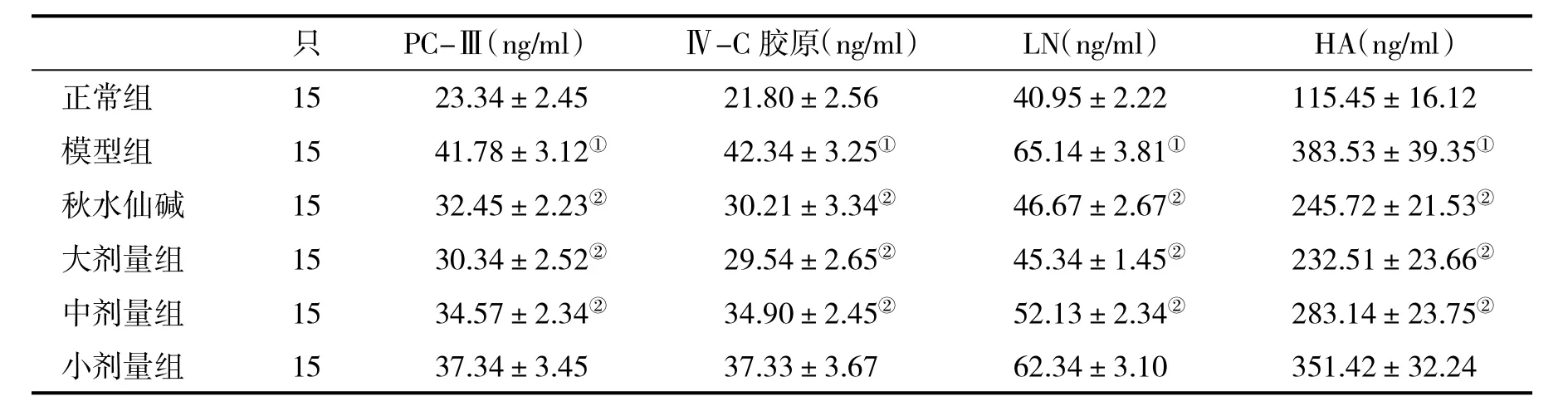
表2 各组大鼠血清肝纤维化指标(±s)比较
与正常组比,①P<0.05;与模型组比,②P<0.05
只 PC-Ⅲ(ng/ml) Ⅳ-C胶原(ng/ml) LN(ng/ml) HA(ng/ml)正常组 15 23.34±2.45 21.80±2.56 40.95±2.22 115.45±16.12模型组 15 41.78±3.12① 42.34±3.25① 65.14±3.81① 383.53±39.35①秋水仙碱 15 32.45±2.23② 30.21±3.34② 46.67±2.67② 245.72±21.53②大剂量组 15 30.34±2.52② 29.54±2.65② 45.34±1.45② 232.51±23.66②中剂量组 15 34.57±2.34② 34.90±2.45② 52.13±2.34② 283.14±23.75②小剂量组 15 37.34±3.45 37.33±3.67 62.34±3.10 351.42±32.24
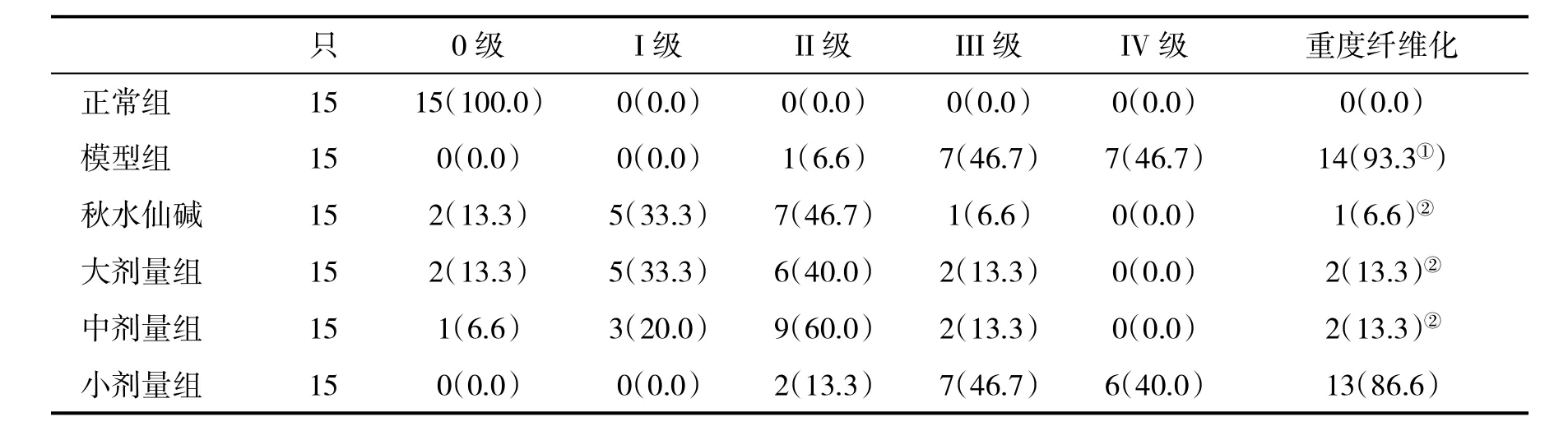
表3 各组大鼠肝组织纤维化分期(%)比较
3 讨论
现代药学研究证实,茵陈水提取物可有效改善胆汁的郁结,加速胆汁的正常排泄,还可能增加胆汁中胆红素、固体物及胆酸的排出量[11~14]。此外,该药物中香豆素等主要活性成分还可有效保护肝细胞膜,防止正常肝脏细胞坏死,改善肝脏微循环,促进肝细胞再生,同时还能够通过葡萄糖醛酸酶的抑制活性来增强肝脏的解毒功能,最终起到保护肝脏的作用[15-16]。
尽管茵陈的药理活性已研究得十分广泛且深入,但国内关于其治疗BSA所致大鼠肝纤维化的研究却较少[17~20]。本研究通过检测肝纤维化大鼠血清ALB、TP、ALT和AST等肝功能指标的变化情况来判断大鼠的肝损伤情况。检测PC-Ⅲ、Ⅳ-C胶原、LN和HA等肝纤维化血清学指标来判断茵陈水提取物对于肝纤维化大鼠的治疗作用,发现与模型组比,大中剂量的茵陈水提物处理大鼠血清ALB、TP、ALT和AST、PC-Ⅲ、Ⅳ-C胶原、LN、HA及肝组织羟脯氨酸水平均出现明显改善(P<0.05)。病理学观察结果显示,模型组大鼠肝组织多呈Ⅲ~Ⅳ期纤维化,且伴肝细胞脂肪变性及灶性坏死,而大剂量和中剂量药物组肝组织主要呈0~Ⅱ级纤维增生,其重度纤维化的发生率均显著低于模型组。上述结果提示,茵陈水提物能够有效改善肝纤维化大鼠的肝脏损伤,对于疾病的缓解具有重要的意义。
尽管本研究得到了较为客观的结果,但是仍存在检测指标较少、具体的治疗机制尚不明确等诸多问题。后续研究还需通过扩大检测指标范围,深入探讨茵陈的具体作用机制。茵陈水提取物对BSA所致的大鼠肝纤维化具有较好的治疗作用,值得进行深入研究。
[1]Ahmad A,Ahmad R.Understanding the mechanism of hepatic fibrosis and potential therapeutic approaches.Saudi J Gastroenterol,2012,18(3):155-167.
[2]Ashley B,Zachary G.Hepatitis B-associated fibrosis and fibrosis/cirrhosis regression with nucleoside and nucleotide analogs. Expert Rev Gastroenterol Hepatol,2012,6(2):187-198.
[3]Jun DW,Tak WY,Bae SH,et al.Recent trends in the treatment of chronic hepatitis C.Kor J Hepatol,2012,18(1):22-28.
[4]Sajid M,Khan MR,Shah NA,et al.Proficiencies of artemisia scoparia against CCl4 induced DNA damages and renal toxicity in rat.BMC Complement Altern Med,2016,16(1):149.
[5]田代华.实用中药辞典.北京:人民卫生出版社,2002:1279.
[6]Khan MA,Khan H,Tariq SA,etal.In vitroattenuation of thermal-induced protein denaturation by aerial parts of Artemisiascoparia.JEvid Based ComplementAltern Med. 2015,20(1):9-12.
[7]Cho JY,Park KH,Hwang do Y,et al.Antihypertensive effects of artemisia scoparia waldst in spontaneously hypertensive rats and identification of angiotensin I converting enzymeinhibitors. Molecules,2015,20(11):19789-19804.
[8]Richard AJ,Fuller S,Fedorcenco V,et al.Artemisia scoparia enhances adipocyte development and endocrine function in vitro and enhances insulin action in vivo.PLoS One,2014,9(6):e98897.
[9]朱启贵,方步武,竺稽能.牛血清白蛋白致免疫性肝纤维化动物模型的研究.中西医结合肝病杂志,1992,2:20.
[10]Puche JE,Saiman Y,Friedman SL.Hepatic stellate cells and liver fibrosis.Compr Physiol,2013,3:1473-1492.
[11]Ergelen R,A kyuz U,Aydin Y,et al.Measurements of serum procollagen-III peptide and M30 do not improve the diagnostic accuracy of transient elastography for the detection of hepatic fibrosis in patients with nonalcoholic fatty liverdisease.Eur J Gastroenterol Hepatol,2015,27:667-671.
[12]Mak KM,Chen LL,Lee TF.Codistribution of collagen type IV and laminin in liver fibrosis of elderly cadavers:immunohistochemical marker of perisinusoidal basement membrane formation. Anat Rec(Hoboken),2013,296:953-964.
[13]Wang ZQ,Zhang XH,Yu Y,et al.Artemisia scoparia extract attenuates non-alcoholic fatty liverdisease in diet-induced obesity mice by enhancing hepatic insulin and AMPK signaling independently ofFGF21 pathway.Metabolism.,2013,62(9):1239-1249.
[14]Habib M,Waheed I.Evaluation of anti-nociceptive,anti-inflammatory and antipyretic activities of Artemisia scopariahydromethanolic extract.J Ethnopharmacol.2013,145(1):18-24.
[15]Choi E,Park H,Lee J,et al.Anticancer,antiobesity,and anti-inflammatory activity of Artemisia species in vitro.J Tradit Chin Med,2013,33(1):92-97.
[16]Sharopov FS,Setzer WN.The essential oil of Artemisia scoparia from tajikistan is dominated by phenyldiacetylenes.Nat Prod Commun,2011,6(1):119-122.
[17]Takami T,Terai SJ,Sakaida I.Current state and future prospects for our liver regeneration therapy using autologous bone marrow cells for decompensated liver cirrhosis patients.J Pharmacol Sci,2011,115(3):274-278.
[18]Mathurin P,O’Grady J,Carithers RL,et al.Corticosteroids improve short-term survival in patients with severe alcoholic hepatitis:meta-analysis of individual patient data.Gut,2011,60(2):255-260.
[19]Kim KA,Jeong SH.The diagnosis and treatment of primary biliary cirrhosis.Kor J Hepatol,2011,17(3):173-179.
[20]王美玲,陆伦根.肝纤维化治疗研究进展.实用肝脏病杂志,2013,16(4):369-371.
(收稿:2016-08-04)
(本文编辑:陈从新)
Protective effects of YinChen water extract in rats with bovine serum albumin-induced hepatic fibrosis
Wu Jun,Shang Rui.Department of Gastroenterology,Affiliated People’sHospital,Hubei Medical College,Shiyan 442000,Hubei Province,China
ObjectiveTo study the therapeutic effect of YinChen water extracts in rats with bovine serum albumin-induced liverfibrosis.Methods 90 SD ratswere randomly divided into normalcontrol,model,colchicines,and large(200 mg·kg-1),middle(100 mg·kg-1)and low(50 mg·kg-1)dose of YinChen water extracts intervened groups.The medicine and herbal medicine were intragastricly administered after the model had been successfully established.Serum PC III,IV-C collagen,LN,HA and hepatic hydroxyproline content were detected. The liver histopathological changes were also observed.Results The levels of serum ALT,AST,PC-Ⅲ,Ⅳ-C,LN,HA and liver tissue hydroxyproline content were(103.78±19.83)IU/L,(246.53±36.67)IU/L,(30.34±2.52)ng/ml,(29.54±2.65)ng/ml,(45.34±1.45)ng/ml,(232.51±23.66)ng/ml and(0.85±0.22)μg/mg in the large dose YinChen water extracts group,and they were(124.59±24.41)IU/L,(277.23±36.45)IU/L,(34.57±2.34)ng/ml,(34.90±2.45)ng/mL,(52.13±2.34)ng/ml,(283.14±23.75)ng/ml and(0.96±0.26)μg/mg in the middle dose group,much lower than in the model group[(161.24±26.23)IU/L,(382.45±39.45)IU/L,(41.78±3.12)ng/ml,(42.34±3.25)ng/ml,(65.14±3.81)ng/ml,(383.53±39.35)ng/ml and(1.43±0.17)μg/mg,P<0.05];serum levels of albumin in large and middle groups were(35.66±2.85)g/L and(35.78±2.64)g/L,significantly higher than in the model group[(31.32± 2.15)g/L,P<0.05];Pathological examination showed that hepatic cells edema,degeneration and necrosis in colchicines,large and middle dose of YinChen water extract groups appeared significantly improved as compared with in the model group.Conclusion The YinChen waterextracts has a certain therapeuticeffect on liver fibrosis,and it is worth to be further studied.
Liver fibrosis;Herbal medicine;Bovine serum albumin;Immunological liver injuries;Rats
10.3969/j.issn.1672-5069.2017.01.014
442000湖北省十堰市 湖北医药学院附属人民医院消化内科
吴军,男,33岁,医学硕士,主治医师。主要从事消化系统肿瘤基础与临床研究。E-mail:jun189356@sina.com
尚瑞,E-mail:pupuchuchun@163.com
