老年自身免疫性肝炎患者临床检验特点分析
2017-04-26刘露露王炳元
刘露露,乔 宽,王炳元
·自身免疫性肝炎·
老年自身免疫性肝炎患者临床检验特点分析
刘露露,乔 宽,王炳元
目的 探讨老年自身免疫性肝炎(AIH)患者临床检验特点。方法回顾性分析2005年1月~2015年12月期间收治的133例AIH患者的临床资料,年龄<60岁者85例,≥60岁者48例。统计分析两组患者临床资料、生化指标和免疫学指标等差异。结果21.3%老年组和20.0%非老年组合并干燥综合征,合并自身免疫性甲状腺炎分别为8.3%和10.6%,合并类风湿性关节炎分别为10.4%和4.7%(P<0.05);老年患者血清ALT、AST和ALP呈低水平升高,GGT明显升高,γ-球蛋白和IgG均超过最高上限;老年组和非老年组抗核抗体阳性率分别为80.5%和77.0%,AMA分别为51.7%和55.9%,SSA阳性率分别为23.3%和15.2%,ENA分别为8.3%和7.7%(P>0.05),非老年组DsDNA阳性率为6.3%,两组均未检出SLA/LP、LC-1和LKM;老年组红细胞MCV和MCH明显高于非老年组(P<0.05),血Cr、Urea和胱抑素C(Cys-c)也显著高于非老年组(P<0.01);老年组β-球蛋白显著低于非老年组,差异有统计学意义(P<0.01)。结论老年AIH患者在合并肝外自身免疫性疾病、血生化指标、自身抗体、γ-球蛋白和IgG水平等方面与非老年组类似,但老年患者红细胞MCV和MCH明显增大,提示可能合并自身免疫性胃炎,Cys-C升高提示老年AIH患者可能合并肾脏免疫性损伤,β-球蛋白增高提示易发生肝内胆汁淤积,DsDNA仅见于非老年患者,提示中青年患者易合并多器官自身免疫病。
自身免疫性肝炎;老年人;自身抗体;肾脏功能;β-球蛋白
自身免疫性肝炎(Autoimmune hepatitis,AIH)经治疗可有效缓解病情,预后良好,关键是早期发现和及时有效的治疗。临床流行病学研究表明,除10~30岁为其发病高峰外,50~70岁也是AIH的多发年龄,但对于这两个年龄段患者诊断和治疗是否有所不同,还需要研究。绝大部分老年患者未能进行肝活检,老年人往往存在多重疾病,皮质激素和免疫抑制剂的应用是否能使老年患者获益,也需要明确。本研究分析了老年AIH患者临床检验特点,以期为早期诊断和治疗提供帮助。
1 资料与方法
1.1 研究对象 回顾性分析2005年1月~2015年12月期间收治于中国医科大学附属第一医院的133例AIH患者的临床资料,男20例,女113例;年龄13~83岁,平均年龄(55.20±12.91)岁。年龄<60岁(非老年组)者85例,≥60岁(老年组)者48例。AIH诊断主要根据国际AIH工作组(IAIHG)2008年提出的简化评分系统[1],包括自身抗体(ANA、SMA、抗LKM-1、SLA)、IgG、组织学表现及有无肝炎病毒感染4项指标。对评分≥6,可能为AIH;对评分≥7,确诊为AIH。对于具有复杂表现患者的诊断则根据1999年IAIHG制定的诊断标准[2],在治疗前总评分超过15分者确诊为AIH,10~15分者为疑诊AIH;治疗后超过17分者确诊为AIH,12~17分者为疑诊AIH。
1.2 实验室指标 常规进行血常规、血液生化和免疫学检查。内容包括:(1)血细胞计数;(2)肝脏功能检测;(3)肾脏功能;(4)血清免疫球蛋白和蛋白电泳;(5)自身抗体检测,包括抗核抗体(ANA)、抗平滑肌抗体(SMA)、抗线粒体抗体(AMA)、抗线粒体抗体M2(AMA-M2)、可溶性肝抗原 /肝胰抗原抗体(SLA/LP)、抗肝细胞溶质抗原I型抗体(LC-1)、抗肝肾微粒体抗体(LKM)、抗核提取物抗体(ENA)、抗双链DNA抗体(DsDNA)、抗SSA抗体(SSA)、抗SSB抗体(SSB)等;(6)所有患者均未进行肝组织学检查。
1.3 统计分析 应用SPSS 20.0软件进行统计分析。对符合正态分布的计量资料以±s表示,采用t检验,对偏态分布的计量资料以M(IQR)表示,采用秩和检验。对计数资料采用x2检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料和合并其他疾病情况 两组中女性均明显多于男性,组间性别构成和合并其他疾病情况无统计学差异(表1)。
表1 两组一般资料和合并其他疾病(%,±s)情况比较

表1 两组一般资料和合并其他疾病(%,±s)情况比较
非老年 老年 统计值 P例数 85(63.9) 48(36.1)年龄(岁) 48.1±9.9 67.8±6.1 t=-14.11 0.00男/女 12/73(16.4)8/40(20.0)x2=0.16 0.69干燥综合征 17(20.0) 15(31.2) x2=2.13 0.15甲状腺炎 9(10.6) 4(8.3) x2=0.01 0.91类风湿性关节炎 4(4.7) 5(10.4) x2=0.81 0.37药物性肝损伤 7(8.2) 3(6.2) x2=0.01 0.94病毒性肝炎 1(1.2) 0(0.0) x2=0.00 1.00
2.2 临床检验结果 两组患者WBC、RBC、HGB、PLT均在参考值范围内,组间差异无统计学意义(P>0.05);老年组MCV和MCH显著高于非老年组,差异具有统计学意义(P<0.01,表2);两组血ALT、AST、GGT、ALP、DBIL、TBA水平无统计学差异(P>0.05,表3);老年组血Cr和Urea水平明显高于非老年组,差异具有统计学意义(P<0.01),胱抑素C(Cys-C)显著高于非老年组,差异具有统计学意义(P<0.01,表4)。
表2 两组患者血细胞指标【±s或M(IQR)】的比较
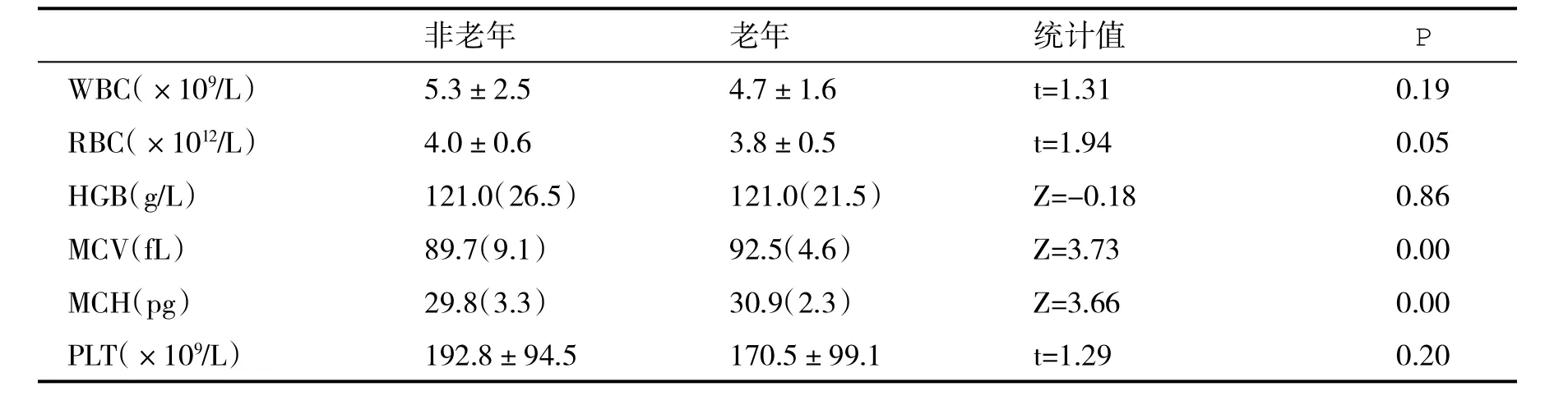
表2 两组患者血细胞指标【±s或M(IQR)】的比较
非老年 老年 统计值 P WBC(×109/L) 5.3±2.5 4.7±1.6 t=1.31 0.19 RBC(×1012/L) 4.0±0.6 3.8±0.5 t=1.94 0.05 HGB(g/L) 121.0(26.5) 121.0(21.5) Z=-0.18 0.86 MCV(fL) 89.7(9.1) 92.5(4.6) Z=3.73 0.00 MCH(pg) 29.8(3.3) 30.9(2.3) Z=3.66 0.00 PLT(×109/L) 192.8±94.5 170.5±99.1 t=1.29 0.20
表3 两组血生化指标【M(IQR)或(±s)】的比较

表3 两组血生化指标【M(IQR)或(±s)】的比较
非老年 老年 统计值 P ALT(U/L) 56.0(42.4,116.0) 43.5(32.4,58.3) Z=-1.81 0.07 AST(U/L) 71.0(53.0,111.0) 55.5(39.0,59.5) Z=-1.62 0.10 GGT(U/L) 165.0(145.5,245.0) 187.0(156.7,241.3) Z=-0.23 0.82 ALP(U/L) 164.0(132.3,203.0) 159.0(132.4,168.5) Z=-0.50 0.61 CHE(U/L) 6256.7±2521.9 5771.6±2076.7 t=1.18 0.18 TBIL(μmol/L) 17.0(13.4,48.9) 16.05(14.3,18.2) Z=-0.59 0.56 DBIL(μmol/L) 26.3(17.6,85.0) 14.3(12.3,78.6) Z=-0.23 0.82 TBA(μmol/L) 19.5(15.4,64.5) 16.5(13.5,48.5) Z=-1.05 0.30 ALB(g/L) 34.9±6.2 34.1±6.0 t=0.69 0.49 TP(g/L) 67.1±8.1 68.1±9.0 t=-0.65 0.52 PA(mg/dL) 14.8±8.6 14.9±7.3 t=-0.06 0.95

表4 两组肾脏功能指标【M(IQR)】的比较
2.3 两组血清蛋白电泳和免疫球蛋白水平比较 两组白蛋白和免疫球蛋白水平差异无统计学意义(P>0.05,表5)。
2.4 常见自身抗体检测情况 两组自身抗体阳性率无显著性相差(P>0.05,表6)。
表5 两组血清蛋白电泳分类和免疫球蛋白水平(±s)的比较
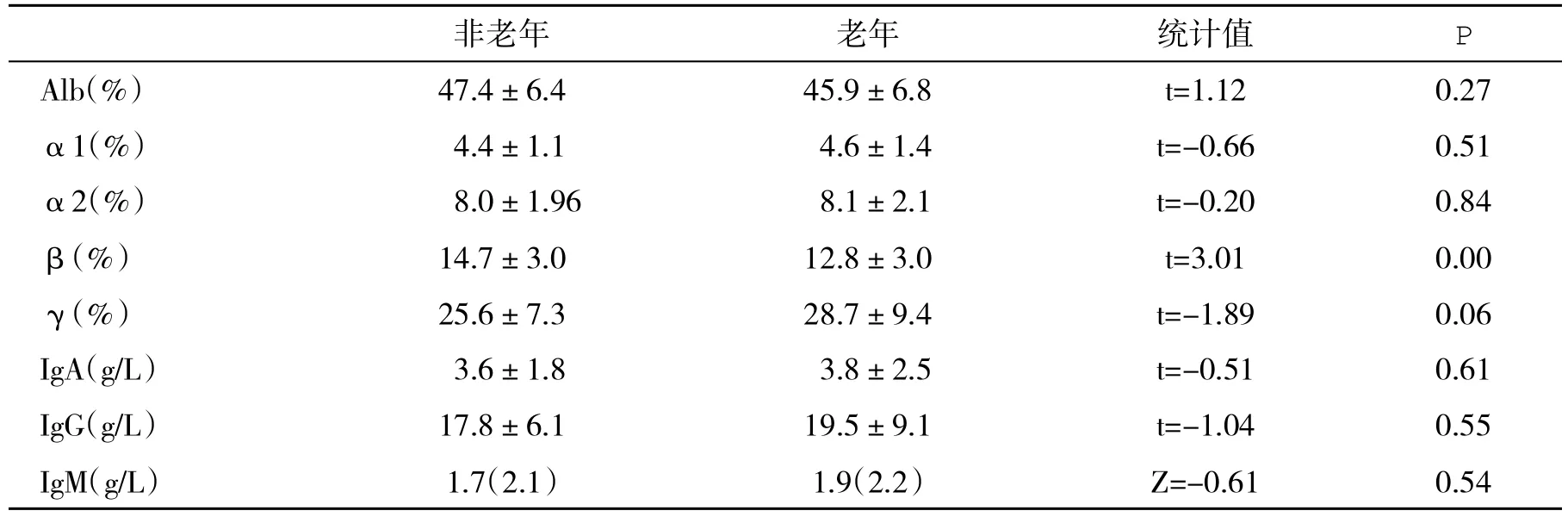
表5 两组血清蛋白电泳分类和免疫球蛋白水平(±s)的比较
参考值:白蛋白 53.5%~70.0%;α1球蛋白0.6%~5.0%;α2球蛋白 3.0%~12.5%;β球蛋白 6.0%~16.3%;γ球蛋白 9.4%~20.0%
非老年 老年 统计值 P Alb(%) 47.4±6.4 45.9±6.8 t=1.12 0.27 α1(%) 4.4±1.1 4.6±1.4 t=-0.66 0.51 α2(%) 8.0±1.96 8.1±2.1 t=-0.20 0.84 β(%) 14.7±3.0 12.8±3.0 t=3.01 0.00 γ(%) 25.6±7.3 28.7±9.4 t=-1.89 0.06 IgA(g/L) 3.6±1.8 3.8±2.5 t=-0.51 0.61 IgG(g/L) 17.8±6.1 19.5±9.1 t=-1.04 0.55 IgM(g/L) 1.7(2.1) 1.9(2.2) Z=-0.61 0.54
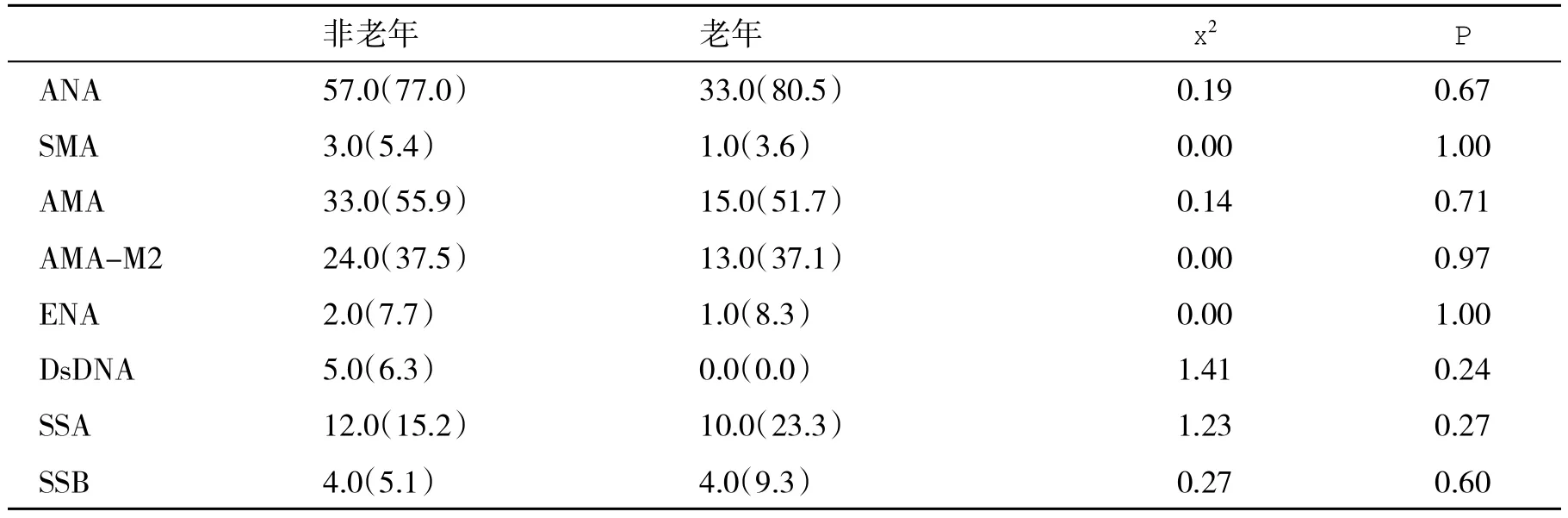
表6 两组自身抗体阳性率(%)的比较
3 讨论
由于老年人往往伴发多种疾病或处于亚健康状态,患者及家属对穿刺的恐惧,主动动员患者行肝穿刺的医生和愿意配合穿刺的患者越来越少。随着老龄化,老年人免疫性疾病已经成为临床常见病,多重疾病和多重用药等又很容易出现肝功能损伤,甚至出现药物诱发的自身免疫性肝炎,导致疾病诊断的复杂化[3]。这种现状促使我们从复杂的临床表现和实验室检查中找出对诊断和鉴别诊断有意义的关键指标,准确地做出诊断,精准治疗,防止疾病进展和恶化。本研究进行了初步尝试。
本次纳入临床确诊的AIH患者133例,以女性(82.3%)和中老年人居多,与文献报道一致[4],但≥60岁的患者(36.1%)超过Czaja et al[5]20%的报道。其原因不清,可能与本院疑难杂症患者比较集中,肝脏损害病程较长,合并干燥综合征、类风湿性关节炎和自身免疫性甲状腺炎分别为 31.25%、10.42%和8.33%。由于并发疾病的掩盖,以及临床医生对本病的认识不足,导致诊断较晚,患者就诊时症状亦不典型。关于合并其他自身免疫性疾病的发生,国内也有更高的报道,如老年组和非老年组分别为 36.36%和23.59%[6]。当然,合并其他自身免疫性疾病越多,AIH诊断的可能性就越大。
老年AIH往往表现为进行性和难以预料的乏力或懒散,腹水、肝硬化或进展性肝纤维化,也有许多患者很少或根本没有症状[7]。因此,根据临床症状进行诊断,往往延误诊断时机,而且可能导致病情进入终末期肝硬化,失去治疗的机会。所以,有研究者认为,症状及实验室检查有明显异常者不一定需要行肝活检[8]。重视分析临床检验的特点,需要找到诊断的契机,成为老年AIH诊断的关键。
临床上,AIH是以转氨酶升高、高γ-球蛋白血症、循环中出现自身抗体和肝组织穿入现象、玫瑰花环形成、界面性肝炎为特征[9]。AIH本身就是一种免疫性炎症,但可能是一种低度炎症,因为反应炎症的重要指标C反应蛋白(CRP)一般在正常上限制的3倍左右,所以在AIH的生化检查中,往往有转氨酶的升高伴或不伴有胆红素和碱性磷酸酶的升高[10]。本研究中,绝大部分患者存在ALT的升高,甚至高达1495 U/l,但多为200 U/l以内,老年患者普遍低于中青年患者。研究肝脏老化的特征可见,非病理状态下的常规肝脏酶学检查未显示出明显的年龄相关性升高,ALT甚至随年龄升高而降低[11]。肝脏酶学异常升高对AIH的诊断具有重要的意义。老年人存在免疫衰老、自身免疫反应弱、肝脏损害较轻,肝脏酶学的高低不能真实地反映AIH组织学上的严重程度[12]。所以,要注意肝脏酶学不升高或低水平持续增高,也可能是老年AIH的特征。
高γ-球蛋白血症是AIH的特征性表现。本组病例均有γ-球蛋白升高,成为诊断AIH重要的线索。正常血清蛋白电泳中β-球蛋白含量为6.7%~15.6%。本组病例存在β-球蛋白偏高趋势,而且非老年组AIH患者明显高于老年组AIH患者。尽管β-球蛋白升高的机制仍然不清,一般认为可能反映胆汁淤积性肝脏病变。事实上,非老年组AIH患者直接胆红素、总胆汁酸等明显高于老年组。有关β-球蛋白在AIH发病机制中的作用,仍需要继续研究。血清IgG升高也是提示AIH的重要线索,特别是约85%无症状AIH患者血清IgG升高[10]。老年患者血清IgG比非老年组患者有更高的趋势。免疫球蛋白作为AIH的特征性免疫改变之一,还可以监测疾病的炎症活动程度和对治疗的反应。
同样,循环中出现的自身抗体不仅决定AIH的诊断,也是AIH分型的依据,还是判断治疗效果的重要标志。老年AIH可导致体内出现多种自身抗体[13]。本组数据显示,ANA阳性率最高,可达78.30%,并且老年组阳性率高达80%,稍高于非老年组的77%。两组LC-1、LKM、SLA/LP的检测例数较少,分别为15、33、16例,结果均为阴性,故未能对AIH类型进一步分析。本组AIH患者AMA阳性率为54.5%,AMA-M2阳性率为37.4%,与国内杨晋辉等[6]的报道类似,说明AIH/PBC重叠综合征的存在。
本研究还提醒临床医生重视肾脏损伤和MCV增大的问题。尽管肌酐和尿素氮都在正常范围,但老年组有明显增高的趋势,两组间有显著的统计学差异。Cys-C在老年组明显异常增高。肾脏是一个重要的免疫攻击器官,AIH也常与肾脏的自身免疫性疾病(如系统性红斑狼疮)并存[14],增龄也是肾脏功能减退的主要原因。AIH是否同时殃及肾脏的结构和功能,尚需要进一步探讨。长期的疾病折磨,AIH患者常出现MCV增大,尤其是高龄者,是由于营养不良造成的大细胞性贫血,还是因为自身抗体攻击胃黏膜而导致自身免疫性胃炎,目前尚不得而知,也成为今后研究的课题之一。曾有研究认为,一个与自身免疫多腺体综合征 1型发育相关基因(APS-1)的突变,与AIH、PSC、PBC、慢性萎缩性胃炎、I型糖尿病等有关[15]。
老年人AIH的临床特点包括,缺乏特异性临床表现,合并更多的其他自身免疫性疾病,肝活检受到更多的限制,确诊时间更晚。本研究结果提示,老年人出现转氨酶异常时要考虑是否合并AIH的可能,在排除病毒性及药物性肝损害以及不饮酒等因素外,同时出现血清IgG升高,和/或γ-球蛋白升高,和/或自身抗体阳性时,可作为AIH诊断的依据,这些指标越多对诊断的帮助越大,有助于早期诊断,从而获得良好的治疗结局。如果出现β-球蛋白升高,提示有胆汁淤积的可能,但还需要临床继续观察。继续探讨的课题还包括AIH与肾脏的关系和AIH与自身免疫性胃炎的关系等。
[1]Hennes EM,Zeniya M,Czaja AJ,et al.Simplified criteria for the diagnosis of autoimmune hepatitis.Hepatology,2008,48(1):169-176.
[2]Alvarez F,Berg PA,Bianchi FB,et al.International Autoimmune Hepatitis Group Report:review ofcriteria for diagnosis of autoimmune hepatitis.J Hepatol,1999,31(5):929-938.
[3] 陈慧,郑娉娉,王炳元.药物诱发自身免疫性肝炎的研究进展.传染病信息,2011,24(5):313-318.
[4]Manns MP,Lohse AW,Vergani D.Autoimmune hepatitis-Update 2015.J Hepatol,2015,62(Suppl 1):S100-111.
[5]Czaja AJ.Adoptive cell transfer in autoimmune hepatitis.Expert Rev Gastroenterol Hepatol,2015,9(6):821-836.
[6]唐映梅,包维民,杨晋辉,等.老年自身免疫性肝炎的临床及病理特点.中国老年学杂志,2011,31(18):3469-3471.
[7]刘露露,王炳元.老年自身免疫性肝炎研究进展.实用肝脏病杂志,2015,18(6):578-580.
[8]Bjornsson E,Talwalkar J,Treeprasertsuk S,et al.Patients with typical laboratory features of autoimmune hepatitis rarely need a liver biopsy for diagnosis.Clin Gastroenterol Hepatol,2011,9:57-63.
[9]Mieli-Vergani G,Vergani D.Autoimmune liver disease:news and perspectives.Transl Med UniSa,2011,1:195-212.
[10]Kapila N,HigaJT,LonghiMS,etal.AutoimmuneHepatitis:Clinical review with insights into the purinergic mechanism of disease.J Clin Transl Hepatol,2013,1(2):79-86.
[11]王炳元.重视增龄的肝脏衰老.实用肝脏病杂志,2015,18(6):571-572.
[12]WangQX,JiangX,LiangM,etal.EASL clinicalpractice guidelines(2015):autoimmune hepatitis.J Clin hepatol,2015,31(12):2000-2019.
[13]Czaja AJ.Performance parameters of the conventional serological markers for autoimmune hepatitis. Dig Dis Sci,2011,56:545-554.
[14]Onder FO,Yürekli OT,Ozta E,et al.Features of systemic lupus erythematosus in patients with autoimmune hepatitis. Rheumatol Int,2013,33(6):1581-1585.
[15]Vogel A,Liermann H,Harms A,et al.Autoimmune regulator AIRE:evidence for genetic differences between autoimmune hepatitis and hepatitis as part of the autoimmune polyglandular syndrome type 1.Hepatology,2001,33(5):1047-1052.
(收稿:2016-08-18)
(本文编辑:陈从新)
Clinical examination characteristics of elderly patients with autoimmune hepatitis
Liu Lulu,Qiao Kuan,Wang Bingyuan.DepartmentofElderly Gastroenterology,FirstAffiliated Hospital,China MedicalUniversity,Shengyang 110001,Liaoning Province,China
Wang Bingyuan,E-mail:wangby0908@163.com
ObjectiveTo explore the clinical characteristics of elderly patients with autoimmune hepatitis(AIH).Methods 133 patients with AIH in our hospital between Jan.2005 and Dec.2015 were selected in this study.The age was 13 to 83 years-old with mean age of(55.20±12.91)years old,and the male were 20 and female were 113 cases;Patients younger than 60 years old(non-elderly group)were 85 cases,and elderly group older than 60 were 48 cases.Statistically analysis was applied to compare the clinical manifestations,biochemical indicators,immunological indexes in the two groups.Results Women were significantly more than men in patients with AIH in this study,and the coexistence of Sjogren's syndrome in non-elderly group was 20.0%,and 31.3%in the elderly group,autoimmune thyroiditis were 10.6%and 8.3%,and rheumatoid arthritis were 4.7%and 10.4%in the two groups;serum ALT,AST and ALP levelsincreased ata low levels,serum GGT levelsincreased significantly,and blood γ-globulin and IgG increased at a maximum limit of normal references;the positive rates of ANA were 80.5%in elderly group and 77.0%in non-elderly group,the AMA were 51.7%and 55.9%,the SSA were 23.3%and 15.2%,the ENA were 8.3%and 7.7%,and the DsDNA was only positive in non-elderly group(6.3%),and the SLA/LP,LC-1 and LKM did not check out in the two groups;MCV and average of MCH in the elderly group were obviously higher than those in the non-elderly group (P<0.05);serum Cr,urea and Cys-C levels in the elderly group was significantly higher than in the non-elderlygroup,and the differences between the two groups was statistically significant(P< 0.01);serum β-globulin in the non-elderly group was much higher than in the elderlygroup(P<0.01). Conclusion The elderly AIH patients is similar to the non-elderly group in clinicalmanifestations,complicated by extrahepatic incidence of autoimmunediseases,liver biochemistry,autoantibodies,γ-globulin and IgG levels;But the MCV and MCH in the elderly group are significantly larger,suggesting that the elderly patients may be deteriorated by autoimmune gastritis;the rise of serum Cys-C in elderly patients suggests that they may be with kidney damage and serum β-globulin levels increase at a low levels in the non-elderly patients,hinting that they are prone to intrahepatic cholestasis;DsDNA is restricted to the non-elderly patients,implying that they are easy to have multiple autoimmune organ diseases.
Autoimmune hepatitis;Elderly;Auto antibodies;Renal function;β-globulin
10.3969/j.issn.1672-5069.2017.01.013
110001沈阳市 中国医科大学附属第一医院老年消化内分泌科
刘露露,女,27岁,硕士研究生。主要从事胃肠病和慢性肝病防治研究。现工作单位为湖北省襄阳市中心医院(湖北文理学院附属医院)消化内科。E-mail:liululuxy2016@163.com
王炳元,E-mail:wangby0908@163.com
