高效猪毛角蛋白降解菌株的分离与鉴定
2017-04-26尹红梅
雷 平,刘 标,尹红梅
(湖南省微生物研究院,湖南 长沙 410009)
高效猪毛角蛋白降解菌株的分离与鉴定
雷 平,刘 标,尹红梅
(湖南省微生物研究院,湖南 长沙 410009)
为了筛选能高效降解猪毛角蛋白的微生物,从长期堆放废弃猪毛的土壤中取样,采用以猪毛粉为唯一碳氮源的培养基分离角蛋白降解菌,并对其产角蛋白酶条件进行了研究。通过驯化培养后,筛选到5株能够降解猪毛角蛋白的菌株,其中菌株E-2降解效果最佳。将E-2接种到以猪毛为唯一碳氮源的培养基中培养5 d后,猪毛降解率达58.6%,发酵液中角蛋白酶活为46.6 U·mL-1。结合形态学观察、生理生化特征及ITS序列分析,鉴定该菌株为解脂耶氏酵母(Yarrowialipolytica)。E-2产酶影响条件实验结果表明,培养108 h后酶活性最高,产角蛋白酶最适条件为pH值6.0~7.0,温度35~40 ℃,猪毛粉添加量15 g·L-1。E-2能降解猪毛、鸡毛、羊毛,但降解活性及产酶活性均不同。该菌株的分离筛选为微生物降解猪毛角蛋白提供了新的菌种资源,至今未见解脂耶氏酵母在降解毛发角蛋白方面的相关报道。
猪毛角蛋白;角蛋白降解菌;解脂耶氏酵母
随着生猪规模化养殖的发展,如何无害化处理病死猪是所有养殖场必须面对和解决的问题[1]。根据中国农业部2013年颁布的《病死动物无害化处理技术规范》,中国病死动物无害化处理技术主要包括4类,即焚烧法、化制法、掩埋法和发酵法,其中,发酵法是指将动物尸体与稻糠、木屑等辅料混合,加入特定的微生物,发酵动物尸体,最后将病死动物变为有机肥的过程。国内外研究表明,堆肥发酵法可以较好地分解畜禽尸体,且堆肥过程中产生的高温能有效杀死其中的病原微生物,是一种低成本的死畜禽(因重大动物疫病和人畜共患病死亡的动物尸体除外)处理方法,目前已经在国内外得到了较多的研究与应用[2-7]。
目前,畜禽尸体堆肥使用的菌剂对堆体中猪毛的降解效果不佳,导致堆肥产品中猪毛含量高,不但影响肥料的品质,而且会污染环境。猪毛的主要成分是角蛋白,含量达95%以上,它是一种结构蛋白,性质非常稳定,不容易被一般的蛋白酶水解[8]。近年来,利用微生物降解羽毛角蛋白的研究报道较多,已分离出能降解羽毛角蛋白的微生物包括细菌[9-10]、真菌[11-12]和放线菌[13]等,而专门针对猪毛角蛋白降解的研究较少报道。因此,本实验拟从长期堆积废弃猪毛的周边土壤中取样,分离能高效降解猪毛角蛋白的微生物菌株,旨在为猪毛的降解提供微生物资源,促进堆肥法在处理畜禽死体方面的应用。
1 材料与方法
1.1 材料
1.1.1 土样
土壤采集自长沙市某生猪屠宰场长期堆积废弃猪毛处。
1.1.2 角蛋白材料
猪毛及猪毛粉:收集生猪屠宰场废弃的猪毛,用蒸馏水洗净,60 ℃烘箱中烘干至恒质量。将烘干猪毛粉碎后过60目筛即制成猪毛粉。
鸡毛、羊毛:收集屠宰场周围废弃的鸡毛、羊毛,用蒸馏水洗净,烤箱烘干至恒质量。
1.1.3 培养基
驯化培养基:猪毛粉10.0 g·L-1,K2HPO41.0 g·L-1,KH2PO40.5 g·L-1,NaCl 0.5 g·L-1,pH 7.0。
筛选培养基:在驯化培养基的基础上添加2%的琼脂粉。
降解培养基:猪毛粉10.0 g·L-1(或猪毛10.0 g·L-1),K2HPO41.0 g·L-1,KH2PO40.5 g·L-1,NaCl 0.5 g·L-1,pH 7.0。
牛肉膏蛋白胨培养基:牛肉膏3.0 g·L-1,蛋白胨10.0 g·L-1,NaCl 5.0 g·L-1,pH 7.0。
PDA培养基:马铃薯200 g·L-1,葡萄糖20 g·L-1,琼脂 15 g·L-1,自然pH,115 ℃高温灭菌30 min。
以上培养基除PDA外,其余均121 ℃高温灭菌20 min。
1.2 方法
1.2.1 猪毛角蛋白降解菌的分离及初筛
称取10.0 g土样加入到内含90 mL无菌0.9% NaCl的锥形瓶中,充分混匀,静置30 min。取5 mL上清液加入到含有100 mL驯化培养基的锥形瓶中,30 ℃、180 r·min-1培养96 h。取驯化后的菌液10倍梯度稀释后,涂布在含有猪毛粉的筛选培养基平板上,筛选生长良好的单菌落,牛肉膏蛋白胨试管斜面保存待用。
1.2.2 猪毛角蛋白降解率测定
采用失重法测定猪毛的降解率。将1.2.1节中初筛获得的5株菌株分别接种至牛肉膏蛋白胨培养基中,30 ℃、180 r·min-1培养24 h制成种子液。将各种子液以2%接种量分别接种到含猪毛的降解培养基中,30 ℃、180 r·min-1培养,观察猪毛的降解状况。培养5 d后,将培养液利用滤纸过滤,收集残渣至干燥箱内烘干至恒质量,称量,计算菌株对猪毛的降解率。
猪毛降解率=(猪毛干质量-残留猪毛干质量)/猪毛干质量×100%。
1.2.3 菌株角蛋白酶活性的测定
将初筛获得的5株菌株接种到牛肉膏蛋白胨培养基中制成种子液,将各种子液以2%接种量分别接种到含猪毛的降解培养基中,30 ℃、180 r·min-1培养5 d后测定培养液中角蛋白酶活性。角蛋白酶活性的测定参照王继勇等[14]方法进行。
1.2.4 高效猪毛角蛋白降解菌E-2的菌种鉴定
从形态学、生理生化特征和ITS序列方面对筛选的猪毛角蛋白降解率最高的菌株E-2进行菌种鉴定。菌株生理生化特征的检测参照《微生物学实验教程》(第2版)中相关方法进行[15]。
采用生工生物工程(上海)股份有限公司生产的酵母菌基因组DNA快速抽提试剂盒提取菌株E-2基因组DNA,用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行ITS序列扩增。PCR反应体系:10×PCR Buffer 5.0 μL,dNTP(25 mmol·L-1)4.0 μL,引物(10 μmol·L-1)各2.0 μL,Taq酶(5 U·μL-1)0.5 μL,DNA模板2 μL,补ddH2O至50 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,51 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,4 ℃终止反应。将PCR产物经1.0%琼脂糖凝胶电泳检测后,利用胶回收试剂盒纯化,交由生工生物工程(上海)股份有限公司测序。
测得的序列通过NCBI比对分析,利用Mega 5.0软件中N-J法构建ITS序列系统发育树,用bootstrap进行检验,重复1 000次,确定该菌的分类地位。
1.2.5 菌株E-2产角蛋白酶曲线
接种菌株E-2到PDA培养基中,30 ℃、180 r·min-1培养24 h制成种子液。将种子液以2%接种量接种到含猪毛粉的降解培养基中,30 ℃、180 r·min-1培养,分别在12、24、36、48、60、72、84、96、108、120、132、144 h测定发酵液中活菌数和上清液的角蛋白酶活性。
1.2.6 环境因素对E-2产角蛋白酶的影响
以降解培养基为基础培养基,猪毛粉含量10 g·L-1,pH 7.0,温度30 ℃,转速180 r·min-1,接种量2%,培养时间108 h为初始培养条件,研究不同环境因素对E-2角蛋白酶活性的影响。条件如下:(1)培养基初始pH为5.0、6.0、7.0、8.0、9.0;(2)温度为25、30、35、40、45、50 ℃;(3)培养基中猪毛粉添加量为5、10、15、20、25、30 g·L-1;(4)培养基中分别添加猪毛粉、鸡毛粉、羊毛粉,添加量均为10 g·L-1。
1.3 数据分析
试验数据利用软件SPSS 18.0和Microsoft Excel 2003进行统计分析和作图。试验结果以平均值±标准差表示,数据间差异显著性比较采用One-way ANOVA方法进行分析。
2 结果与分析
2.1 菌株分离筛选
经过驯化后,共分离获得5株在以猪毛粉为唯一碳氮源的筛选培养基上生长良好的菌株,分别编号为E-1、E-2、E-3、E-4、E-5。将5株菌株接种至牛肉膏蛋白胨平板培养,通过菌落形态及显微形态观察,初步判定菌株E-2为酵母菌,其他菌株为细菌。将初筛获得的5株菌株接种到含猪毛的降解培养基中培养5 d后,各菌株对猪毛均有不同程度的降解,其中,接种E-2的锥形瓶中猪毛大部分已降解,培养液变浑浊,而未接菌的对照组猪毛基本没有变化(图1)。5株初筛获得的猪毛角蛋白降解菌的猪毛降解率及发酵上清液中的角蛋白酶活性见表1。结果显示,培养5 d后,菌株E-2发酵上清液角蛋白酶活为46.6 U·mL-1,对培养基中猪毛的降解率可达58.6%,显著高于其他4株菌株(P<0.05)。因此,选取菌株E-2作进一步的研究。

A, 对照Control; B, E-2图1 菌株E-2发酵5 d降解猪毛的效果Fig.1 The pig hair degradation effect by E-2 after 5 days fermentation
表1 不同菌株分解猪毛角蛋白的能力
Table 1 The degradation ability of different strains to pig hair keratin (n=3)
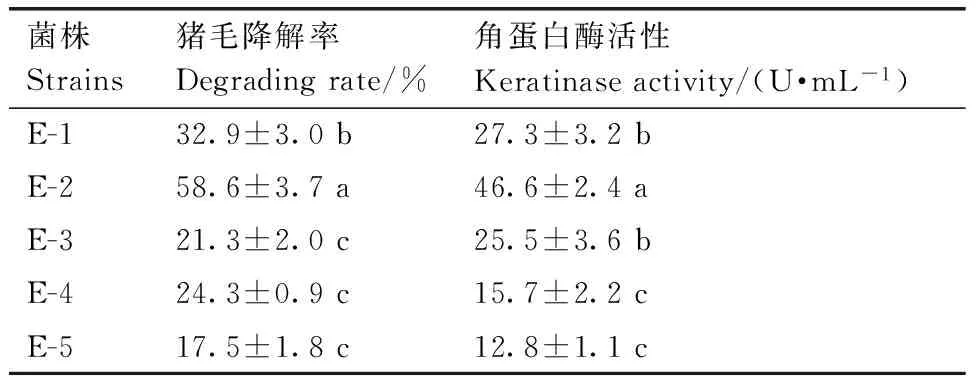
菌株Strains猪毛降解率Degradingrate/%角蛋白酶活性Keratinaseactivity/(U·mL-1)E-132.9±3.0b27.3±3.2bE-258.6±3.7a46.6±2.4aE-321.3±2.0c25.5±3.6bE-424.3±0.9c15.7±2.2cE-517.5±1.8c12.8±1.1c
同列数据后无相同小写字母表示差异显著(P<0.05)。表2同。
Data marked without the same lowercase letter in each column indicated significant differences atP<0.05. The same as table 2.
2.2 E-2菌种鉴定
2.2.1 菌株形态及生理生化特征
将菌株E-2接种在PDA平板上,30 ℃培养72 h后,可以观察到菌落呈乳白色,圆形,表面光滑,边缘整齐。在显微镜下,大部分细胞呈椭圆形(图2)。生化实验结果表明,菌株E-2的葡萄糖发酵、蔗糖发酵、麦芽糖发酵、木糖发酵、石蕊牛奶实验均为阳性,明胶液化、尿素分解、1%醋酸生长实验均为阴性。
2.2.2 PCR扩增结果
以E-2基因组DNA为模板,引物ITS1、ITS4扩增产物的测序结果显示,E-2 ITS序列长度为693 bp。在NCBI中进行Blast分析,结果表明,菌株E-2与解脂耶氏酵母(Yarrowialipolytica)的同源性最高,达98%。根据同源性比对结果,利用Mega 5.0软件构建ITS序列系统发育树,如图3所示。结合形态学观察、生理生化特征和ITS序列分析的结果,初步将菌株E-2鉴定为解脂耶氏酵母(Yarrowialipolytica)。

图2 菌株E-2的细胞形态Fig.2 Cellular morphology of strain E-2 cells
2.3 高效降解菌E-2产角蛋白酶曲线
图4显示,菌株E-2在以猪毛粉为唯一碳氮源的培养基中生长速度较慢,在60~96 h处于对数生长期,96~108 h处于稳定期,108 h后开始进入衰亡期。菌株产酶曲线表明,在0~60 h产角蛋白酶较少,进入对数期后酶活性逐渐增大,108 h时达到酶活性最大,菌株进入衰亡期后,角蛋白酶活性趋于降低,但幅度较小。
2.4 环境因素对E-2产角蛋白酶的影响
2.4.1 初始pH及培养温度对菌株E-2产角蛋白酶的影响
温度和pH均是影响微生物生长繁殖和代谢的重要因素,因此,本研究考察了不同培养温度和初始pH对菌株E-2产角蛋白酶的影响。结果显示,培养温度为25~35 ℃时,随着温度的升高,发酵液中角蛋白酶活性逐渐增大;温度为35~40 ℃时,酶活性达到最大值;随着温度的继续升高,菌株E-2的角蛋白酶活性显著降低(P<0.05)(图5)。培养基的初始pH也对E-2产角蛋白酶影响较大,如图6所示,当初始pH值为5.0时,角蛋白酶活性较低;pH值为6.0~7.0时,酶活性达到最大;进一步增大pH值,角蛋白酶活性趋于下降。
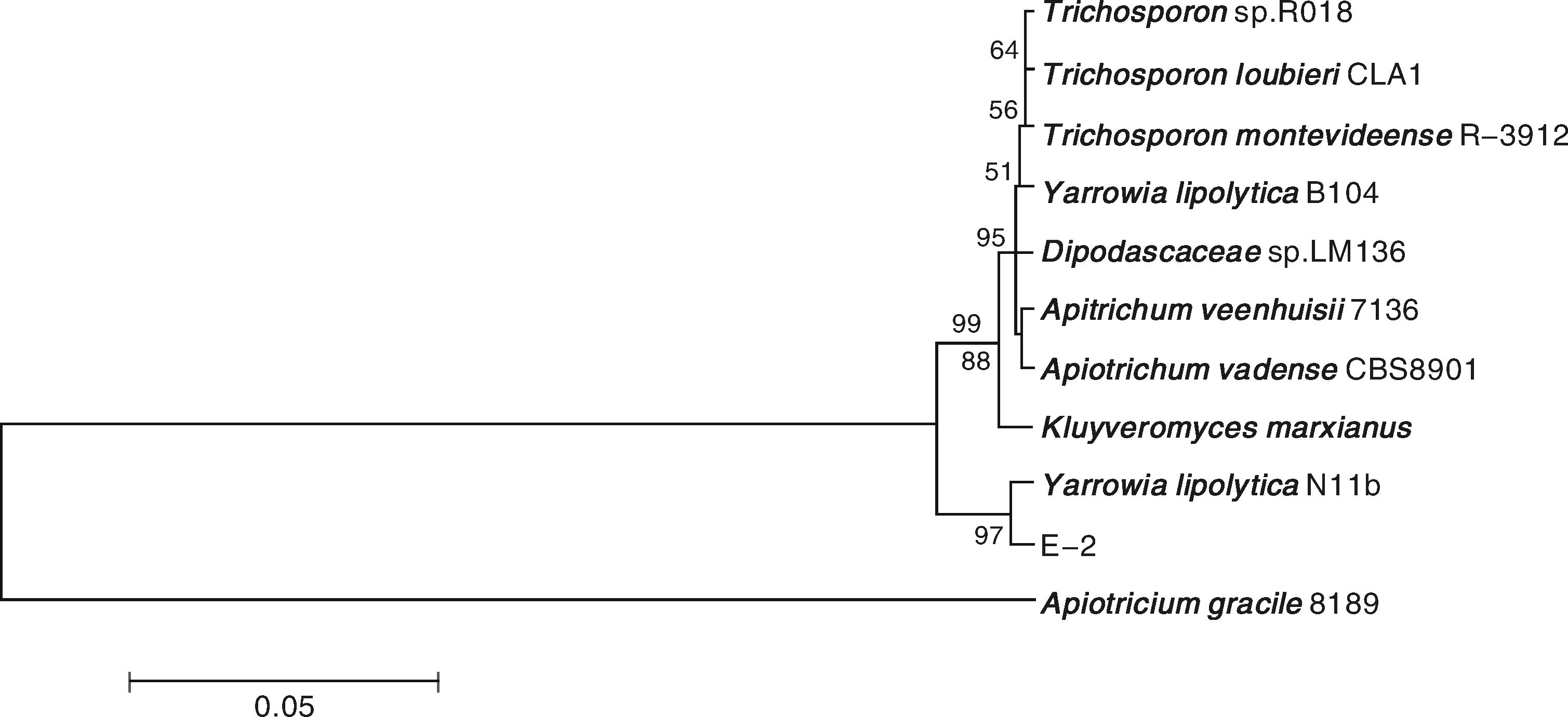
图3 基于菌株E-2 ITS序列的系统发育树Fig.3 Phylogenetic tree based on ITS sequences of strain E-2
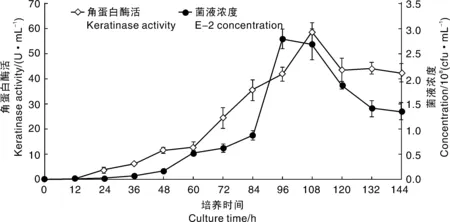
图4 菌株E-2角蛋白酶活性-时间曲线图Fig.4 Keratinase activity-time curve of strain E-2
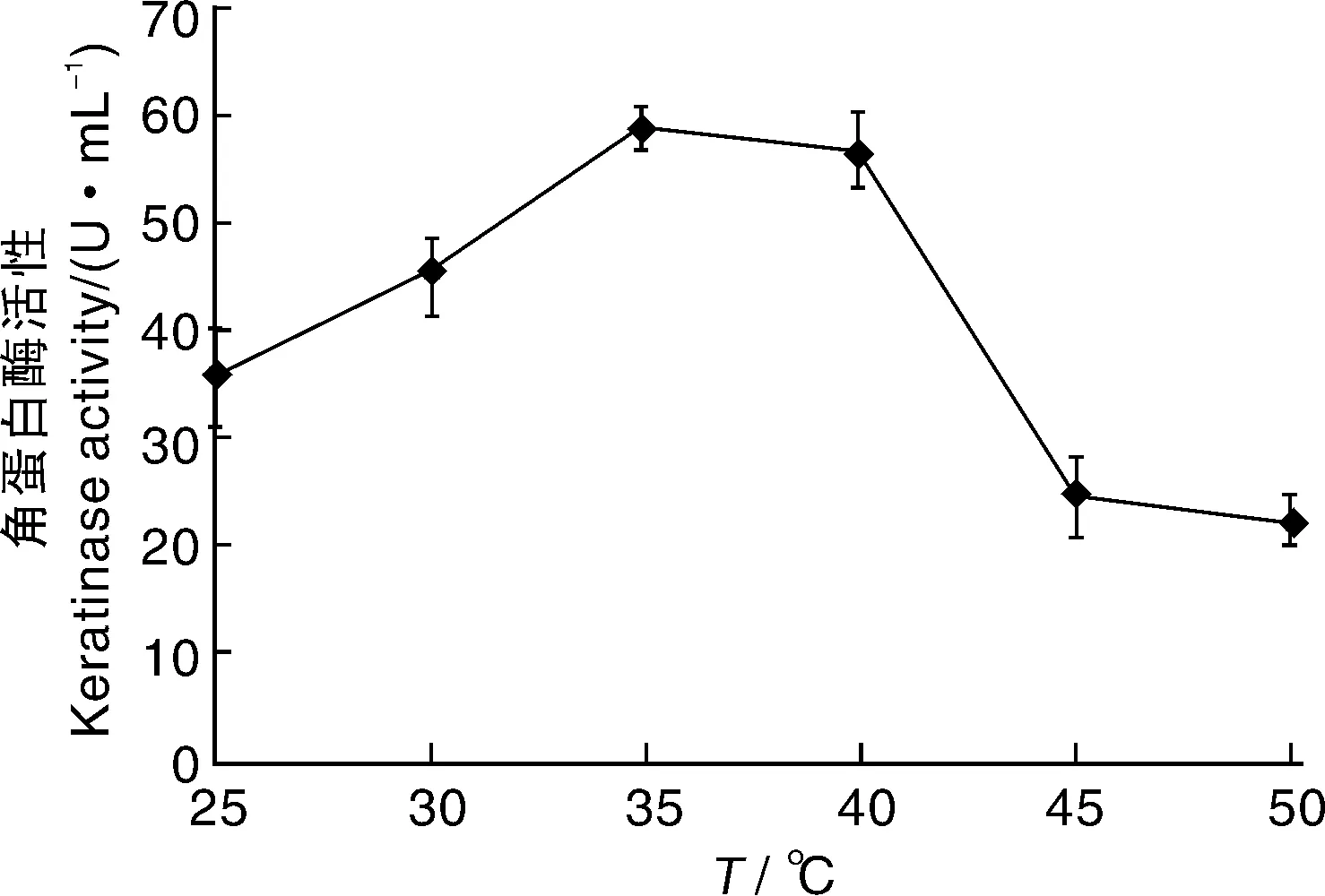
图5 温度对菌株E-2角蛋白酶活性的影响Fig.5 Effect of temperature on the keratinase activity of strain E-2

图6 培养基初始pH对菌株E-2角蛋白酶活性的影响Fig.6 Effect of initial pH on the keratinase activity of strain E-2
2.4.2 培养基中猪毛粉添加量对E-2产角蛋白酶的影响
大多数角蛋白酶为诱导型酶,需要外在的角蛋白类物质作为诱导物,例如毛发、角蛋白粉等[16]。因此,本研究考察了不同猪毛粉添加量对菌株E-2产角蛋白酶的影响。结果表明:随着猪毛粉含量的增加,角蛋白酶活性逐渐增大;当猪毛粉含量达到15 g·L-1时,酶活性达到最大值(59.9 U·mL-1);继续增加猪毛粉含量,酶活性无显著变化(图7)。2.4.3 菌株E-2降解不同角蛋白底物能力的比较蛋白底物的诱导下均能产生角蛋白酶,从而降解不同的毛发角蛋白。其中,菌株E-2在等量鸡毛诱导下,发酵液中角蛋白酶活性最高,对鸡毛的降解程度也最高(P<0.05)。
表2结果表明,菌株在猪毛、鸡毛、羊毛等角
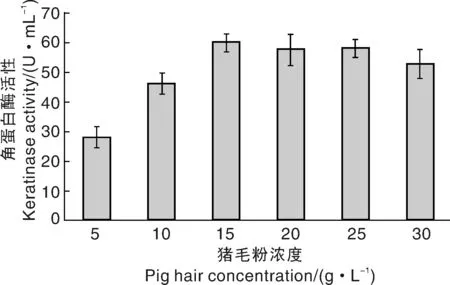
图7 猪毛粉添加量对菌株E-2角蛋白酶活性的影响Fig.7 Effect of pig hair concentration on the keratinase activity of strain E-2
表2 E-2对不同角蛋白底物的降解能力
Table 2 Degradation ability of strain E-2 to different keratins
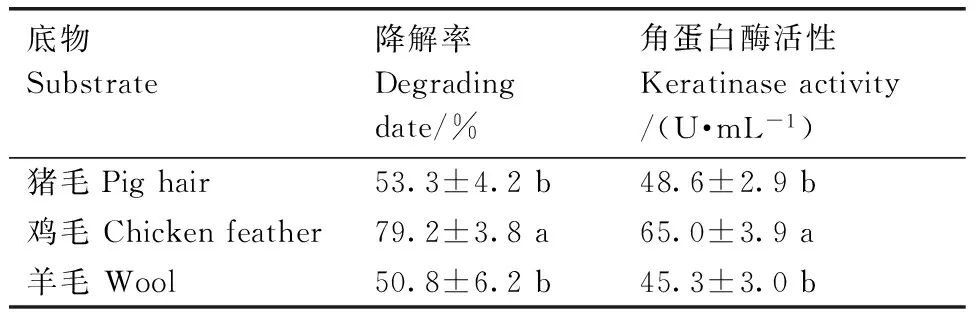
底物Substrate降解率Degradingdate/%角蛋白酶活性Keratinaseactivity/(U·mL-1)猪毛Pighair53.3±4.2b48.6±2.9b鸡毛Chickenfeather79.2±3.8a65.0±3.9a羊毛Wool50.8±6.2b45.3±3.0b
3 结论与讨论
从长期堆放废弃猪毛的土壤中取样,通过驯化筛选到5株能够降解猪毛角蛋白的菌株,其中菌株E-2的降解效果最佳。接种菌株E-2到以猪毛为唯一碳氮源的培养基中,培养5 d后,猪毛降解率达58.6%,发酵液中角蛋白酶活为46.6 U·mL-1。通过形态学观察、生理生化特征及ITS序列分析,将该菌鉴定为解脂耶氏酵母(Yarrowialipolytica)。菌株E-2在猪毛粉降解培养基中培养108 h后角蛋白酶活性最大,最佳产酶条件为:培养基初始pH值6.0~7.0,温度35~40 ℃,猪毛粉添加量为15 g·L-1。以猪毛、鸡毛、羊毛作为发酵底物时,均能诱导菌株E-2产生角蛋白酶,但以鸡毛为底物的培养液中角蛋白酶活性显著高于猪毛和羊毛。
猪毛、羽毛等畜禽毛发的主要成分是角蛋白,而角蛋白中含有高强度的二硫键[17],不容易被降解。在畜禽死体堆肥中,猪毛等畜禽毛发得不到充分降解,不但浪费了大量的蛋白质资源,而且会污染环境。近年来,利用能够分泌角蛋白酶的微生物降解动物毛发角蛋白作为一种经济环保的方法引起了研究者们的关注。真菌是最早被报道能够降解角蛋白的微生物,但多数为致病菌,影响了它们在实际中的应用[10]。本研究从长期堆放猪毛的土壤中分离筛选到的菌株E-2能够高效降解猪毛角蛋白,在以往研究中,由于解脂耶氏酵母可利用烷烃类和疏水性物质,如油脂、聚甲基化和氯化的烷烃,且对不良环境抵抗力强、对环境安全,常被用于有机废弃物的治理[18],未见有将解脂耶氏酵母用于降解毛发角蛋白的报道。因此,本研究筛选到的菌株E-2丰富了降解毛发角蛋白的微生物资源库,在废弃角蛋白的开发利用方面具有潜在的应用前景。
黄林等[17]研究结果表明,弗氏链霉菌S-221菌株能够降解羽毛角蛋白,将角蛋白降解率、角蛋白酶活性及菌体生长量之间进行直线回归统计分析,发现羽毛角蛋白的降解依赖于菌株角蛋白酶活性的大小,而酶活性大小依赖于菌体生长量的大小。本研究中菌株E-2角蛋白酶活性-时间曲线结果表明(图4),发酵液酶活性的大小与菌体的生长量成正相关,与黄林等[17]研究结果相类似。
黄林等[17]在发酵培养基中分别添加猪毛、鸭毛和鸡毛,发现菌株S-221均能产生角蛋白酶,但酶活性大小有显著差异,其中,以鸡毛为底物的培养基中酶活性最高。本研究中,菌株E-2在鸡毛粉的诱导下,角蛋白酶活性最高,对鸡毛的降解率显著高于猪毛和羊毛。推测可能是由于不同毛发中角蛋白的结构不同,诱导产生的角蛋白酶在底物特异性、反应活性等方面有差异[19-20],具体原因有待进一步研究。
培养基的初始pH、培养温度、猪毛粉的添加量等环境因素均会影响菌株的角蛋白酶活性。因此,对于该菌株的最佳产酶发酵条件、酶学性质、降解角蛋白的机理等也有待进一步研究,以深入挖掘该菌在降解角蛋白方面的潜能。
[1] 周开锋. 几种病死猪生物降解技术应用实效分析[J]. 猪业科学, 2013 (10): 46-49. ZHOU K F. Analysis of several technologies of biological degradation of case fatality pigs [J].SwineIndustryScience, 2013 (10): 46-49. (in Chinese)
[2] KALBASI A, MUKHTAR S, HAWKINS S E, et al. Carcass composting for management of farm mortalities: a review [J].CompostScienceandUtilization, 2005, 13(3): 180-193.
[3] BERGE A C, GLANVILLE T D, MILLNER P D, et al. Methods and microbial risks associated with composting of animal carcasses in the United States [J].JournaloftheAmericanVeterinaryMedicalAssociation, 2009, 234(1): 47-56.
[4] GWYTHER C L, WILLIAMS A P, GOLYSHIN P N, et al. The environmental and biosecurity characteristics of livestock carcass disposal methods: A review [J].WasteManagement, 2011, 31(4): 767-778.
[5] EAMENS G J, DORAHY C J, MUIRHEAD L, et al. Bacterial survival studies to assess the efficacy of static pile composting and above ground burial for disposal of bovine carcases [J].JournalofAppliedMicrobiology, 2011, 110(6): 1402-1413.
[6] 陈腾飞, 吴志明, 刘阳利, 等. 热辅快速生物发酵分解工艺无害化处理病死猪尸体效果评估[J]. 动物医学进展, 2015, 36(5): 81-85. CHEN T F, WU Z M, LIU Y L, et al. Evaluation of effect on harmless treatment of dead pig carcass by process of rapid biological fermention decomposition [J].ProgressinVeterinaryMedicine, 2015, 36(5): 81-85. (in Chinese with English abstract)
[7] 陶秀萍, 董红敏. 畜禽尸体堆肥无害化处理技术现状[J]. 现代畜牧兽医, 2014 (7): 25-29. TAO X P, DONG H M. Livestock and poultry carcass composting: A review [J].ModernJournalofAnimalHusbandryandVeterinaryMedicine, 2014 (7): 25-29.(in Chinese with English abstract)
[8] 罗海波, 柴玉叶, 兰云军. 利用制革废弃猪毛提取角蛋白[J]. 精细化工, 2013, 30(7): 744-747, 760. LUO H B, CHAI Y Y, LAN Y J. Preparation of keratin from discarded pig hair in the tanning process [J].FineChemicals, 2013, 30(7): 744-747, 760. (in Chinese with English abstract)
[9] 何熙璞, 周礼玮, 刘婕,等. 一株羽毛角蛋白降解菌的分离鉴定及特性研究[J]. 环境科学与技术, 2014, 37(7): 49-54. HE X P,ZHOU L W,LIU J, et al. Isolation, identification and characteristics of a feather-degrading strain [J].EnvironmentalScienceandTechnology, 2014, 37(7): 49-54. (in Chinese with English abstract)
[10] 周童娜, 杨文翰, 赵江婷, 等. 一株家禽羽毛角蛋白降解菌的分离与鉴定[J]. 家畜生态学报, 2015, 36(11): 37-41, 51. ZHOU T N, YANG W H, ZHAO J T, et al. Isolation, identification and characteristics of one strain of new feather-degrading bacteria [J].ActaEcologiaeAnimalisDomastici, 2015, 36(11): 37-41, 51. (in Chinese with English abstract)
[11] 朱晓飞, 张玲, 赵平芝, 等. 链霉菌B221的角蛋白降解机制初探[J]. 中国农学通报, 2007, 23(6): 18-22. ZHU X F, ZHANG L, ZHAO P Z, et al. Mechanism of keratin degradation byStreptomycetesp. B221 [J].ChineseAgriculturalScienceBulletin, 2007, 23(6): 18-22. (in Chinese with English abstract)
[12] 王秋影, 廖美德, 王刘庆, 等. 淡紫拟青霉角蛋白酶特性初步研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(11): 192-196. WANG Q Y,LIAO M D,WANG L Q,et al. Properties of keratinase fromPaecilomyceslilacinus[J].JournalofNorthwestAgricultureandForestryUniversity(NaturalScienceEdition), 2012, 40(11): 192-196. (in Chinese with English abstract)
[13] BRESSOLLIER P L F, URDACI M, VERNEUIL B. Purification and characterization of a keratinolytic serine proteinase fromStreptomycesalbidoflavus[J].AppliedandEnvironmentalMicrobiology, 1999, 65(6): 2570-2576.
[14] 王继勇, 何敏, 陈聪, 等. 羽毛降解菌的筛选及其产酶特性[J]. 武汉大学学报(自然科学学版), 2015, 61(2): 183-186. WANG J Y, HE M, CHEN C, et al. Isolation and characterictics of enzyme production of feather-degrading bacteria [J].JournalofWuhanUniversity(NaturalScienceEdition), 2015, 61(2): 183-186. (in Chinese with English abstract)
[15] 赵斌, 何绍江. 微生物学实验[M]. 北京: 科学出版社, 2002: 148-149.
[16] 谢菲, 李从虎, 郑佳, 等. 角蛋白酶生产菌株的分离筛选与鉴定[J]. 微生物学报, 2010, 50(4): 537-541. XIE F, LI C H, ZHENG J, et al. Screening and identification of a newBacillusstrain producing kerarinase [J].ActaMicrobiologicaSinica, 2010, 50(4): 537-541. (in Chinese with English abstract)
[17] 黄林, 熊智强, 蔡华静, 等. 链霉菌降解角蛋白的生化机制研究[J]. 微生物学通报, 2006, 33(4): 36-42. HUANG L, XIONG Z Q, CAI H J, et al. Study on the biochemical mechanism of degrading keratins byStreptomycesfradiae[J].MicrobiologyChina, 2006, 33(4): 36-42. (in Chinese with English abstract)
[18] 吴兰, 罗玉萍, 万金保, 等. 解脂耶氏酵母菌处理含油废水的研究[J]. 环境科学研究, 2006, 19(5): 122-125. WU L, LUO Y P, WANG J B, et al. Use ofYarrowialipolyticafor the treatment of oil waste water [J].ResearchofEnvironmentalScience, 2006, 19(5): 122-125. (in Chinese with English abstract)
[19] POOPATHI S, THIRUGNANASAMBANTHAM K, MANI C, et al. Purification and characterization of keratinase from feather degrading bacterium useful for mosquito control-A new report [J].TropicalBiomedicine, 2014, 31(1): 97-109.
[20] ZAGHLOUL T I, EMBABY A M, ELMAHDY A R. Key determinants affecting sheep wool biodegradation directed by a keratinase-producingBacillussubtilis, recombinant strain [J].Biodegradation, 2011, 22(1): 111-128.
(责任编辑 侯春晓)
Isolation and identification of a pig hair keratin-degrading strain
LEI Ping, LIU Biao, YIN Hongmei
(HunanMicrobiologyInstitute,Changsha410009,China)
To screening the microorganisms with high pig-hair keratin-degrading capacity, the strains were isolated from environment soil collected from the pig hair waste site by adopting the culture medium taking keratin as sole carbon and nitrogen source and the optimal environmental factors for keratinase activity were investigated. In this study, five strains with pig hair degrading ability were obtained by the method of enrichment and domenstication, while the strain E-2 showed the highest capatity of degrading pig hair keratin. The degrading rate of pig hair keratin was up to 58.6% after 5 days fermentation and the keratinase activty reached 46.6 U·mL-1.The strain E-2 was identified asYarrowialipolyticabased on morphology, physiological characteristics and ITS sequence analysis. Experimental results of environmental factors showed that the optimum cultivation conditions for keratinase activity was pH 6.0-7.0,temperature 35-40 ℃,pig hair content 15 g·L-1and culture time 108 h. E-2 could degrade pig hairs, chicken feathers and wools, while the degrading activtiy and keratinase acticity varied with different keratin substrates. Up to date, little is known about the pig hair keratin degrading byYarrowialipolytica, thus, we provided a new efficient keratin-degarding strain to utilize pig hair.
pig hair keratin; keratin degrading strain;Yarrowialipolytica
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.19
2016-11-22
湖南省科技重点研发计划(2016NK2208);湖南省生猪产业技术体系生猪产业规模养殖与环境控制岗位项目
雷 平(1965—),男,湖南常德人,硕士,助理研究员,从事农业微生物的基础与应用研究。E-mail: 280795307@qq.com
S828;X713
A
1004-1524(2017)04-0644-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 644-650
雷平, 刘标, 尹红梅. 高效猪毛角蛋白降解菌株的分离与鉴定[J]. 浙江农业学报, 2017, 29(4): 644-650.
