黄瓜花叶病毒基因沉默载体的效率和稳定性分析
2017-04-26向志丹张震霄杜志游
向志丹,张震霄,李 超,杜志游
(浙江理工大学 生命科学学院,浙江 杭州 310018)
黄瓜花叶病毒基因沉默载体的效率和稳定性分析
向志丹,张震霄,李 超,杜志游*
(浙江理工大学 生命科学学院,浙江 杭州 310018)
病毒诱导的基因沉默(virus-induced gene silencing, VIGS)已被广泛应用于植物基因的功能研究。试验以八氢番茄红素脱氢酶(phytoene desaturase, PDS)作为指示基因,在本生烟体内分析黄瓜花叶病毒(Cucumbermosaicvirus, CMV)作为VIGS载体对植物内源PDS mRNA的沉默效率。采用分子克隆的方法,将Fny-CMV 2b ORF替换为不同长度的PDS序列,并分析了其在本生烟植物上诱导的PDS沉默效率。结果表明,该重组病毒能诱导上部系统叶的光漂白表型,且沉默效率与插入片段长度呈一定的正相关性,但在顶端新生叶中均不引起明显的光漂白现象,过长的片段插入(≥518 nt)影响病毒基因组的遗传稳定性,导致插入片段的部分缺失。CMV作为 VIGS载体,最适合的插入片段约为350 nt。
病毒诱导的基因沉默;黄瓜花叶病毒;2b;八氢番茄红素脱氢酶
病毒诱导的基因沉默 (virus induced gene silencing, VIGS)是一种分子遗传学技术,即利用病毒作为一个外源基因片段的载体,通过病毒复制和寄主RNA沉默机制产生外源片段的siRNA,进而通过siRNA途径沉默靶标mRNA。由于该技术具有周期短和操作简便等优点,已被广泛地应用于植物的基因功能研究。到目前为止,已有众多VIGS载体的报道。其中,应用最为广泛的VIGS载体为烟草脆裂病毒(Tobaccorattlevirus, TRV)[1]。
黄瓜花叶病毒(Cucumbermosaicvirus, CMV)是属于雀麦花叶病毒科(Bromoviridae)黄瓜花叶病毒属(Cucumovirus)的典型成员。CMV可侵染包括茄科、十字花科、豆科及葫芦科等重要经济作物在内的1 000多种植物[2]。CMV基因组由3条正义单链RNA(RNA1-3)组成。RNA1和RNA2可直接作为模板翻译合成1a和2a(RdRp)蛋白,负责病毒的复制;此外,RNA2还通过其亚基因组RNA4A编码产生约12~15 ku的2b蛋白。2b ORF 5’端与2a ORF的3’端有240个碱基的重叠。2b蛋白是一种多功能蛋白,包括病毒致病因子和RNA沉默的抑制子。RNA3编码3a蛋白(即移动蛋白,MP)和外壳蛋白(CP),负责病毒的细胞间移动、长距离移动和病毒粒子的包装[2-3]。
CMV的VIGS载体能有效地诱导本生烟和玉米植物内源mRNA的沉默[4-6],但是报道的CMV载体均保留了2b蛋白的N端约80个氨基酸序列,内含RNA沉默抑制子活性的功能域。因此,保留的2b序列有可能会影响病毒诱导的基因沉默。为此,本试验利用一段八氢番茄红素脱氢酶(phytoene desaturase, PDS)cDNA完全替换Fny-CMV株系的2b ORF,在本生烟体内分析该CMV重组体对植物内源PDS mRNA的沉默效率;在此基础上,进一步分析PDS插入片段的长度与CMV诱导沉默效率的关系,以及插入片段的遗传稳定性,从而明确CMV VIGS载体的最适插入片段长度。
1 材料与方法
1.1 试剂
AMV逆转录酶、RNA酶抑制剂、高保真PyrobestTMDNA 聚合酶、限制性内切酶均购于TaKaRa公司。T4 DNA连接酶购于NEB公司。RiboMax体外转录试剂盒、m7GpppG Cap类似物和Klenow大片段均购于Promega公司。其他试剂购于上海生工。
1.2 植物及其生长
本生烟(Nicotianabenthamiana)幼苗于22~28 ℃、16 h光周期的植物培养室中培养。
1.3 质粒及其构建
CMV株系Fny基因组RNA1-3的侵染性克隆pF109、pF209和pF309由Dr. Peter Palukaitis提供[7]。2b缺失质粒pF209Δ2b由本实验室构建[8]。根据前期报道的方法,构建pF209Δ2b-PDS353重组质粒。扩增片段Ⅰ和片段Ⅲ的PCR引物以及方法完全参照前期描述的方法[8]。片段Ⅱ为PDS序列,利用引物NbPDS1437F和NbPDS1879R (表1),以本生烟的mRNA作为模板,通过常规RT-PCR扩增获得353 bp大小的DNA片段。然后,通过重叠PCR,将片段Ⅰ、Ⅱ和Ⅲ混合作为PCR模板,进行PCR扩增。扩增产物经HindⅢ和PstⅠ酶切,克隆至pF209质粒,产生pF209Δ2b-PDS353重组质粒。值的一提的是,我们在PDS片段的上下游分别引入ApaⅠ和MluⅠ克隆位点,便于后续PDS片段的克隆。
为了构建含有不同长度的PDS片段的重组质粒,我们利用不同的上游引物与NbPDS1879R组合,PCR扩增获得104、219、518、750和1 030 bp的PDS DNA片段。经ApaI和MluI酶切,克隆至预先经ApaI/MluI酶切的pF209Δ2b-PDS353质粒,构建产生重组质粒PDS104、PDS219、PDS518、PDS750和PDS1030。所有重组质粒都经测序确定。
表1 用于构建质粒PDS重组质粒的引物序列
Table 1 List of primers used for constructing PDS recombinant plasmids

引物名称Primername引物序列Primersequence(5’-3’)质粒plasmidsNbPDS760FGGGCCCAGAACTAGGGATTGATGATCPDS1030NbPDS1040FGGGCCCAGGGTGACAGATGAGGPDS750NbPDS1272FGGGCCCAGCTGAATGAGGATGGPDS518NbPDS1437FCCAACAAACAGCGAAAGAATTATTGATA-AGGGCCCTGGGAGTTCCTGTGATAAATGTCPDS353NbPDS1571FGGGCCCCAATCAGTCTATGTTGGAPDS219NbPDS1686FGGGCCCTTTCGGCAGATCAGAGPDS104NbPDS1879RAGATGCGGAAGGGGAGGTTTCAACGCGTCCGACAGGGTTCACAACCT—
1.4 体外转录和病毒接种
pF109、pF309、pF209及其突变体和PDS重组体经PstI酶切线性化,然后利用RiboMax体外转录试剂盒合成相应的RNA。将CMV的三条基因组以1∶1∶1的比例混合,摩擦接种至5~6叶期的本生烟。
1.5 病毒RNA的杂交检测
根据Trizol试剂的使用操作说明,提取叶组织总RNA。总RNA经nanodrop定量和1×TBE琼脂糖电泳的质量检测。总RNA的琼脂糖-甲醛变性电泳、转膜以及Northern杂交检测参考文献报道的方法[8]。
1.6 PDS mRNA的相对定量
利用Trizol试剂提取CMV重组病毒侵染的本生烟光漂白叶组织的总RNA,然后参考先前描述的方法进行实时荧光定量PCR检测[9]分析PDS mRNA的相对水平。EF1α作为内参基因,引物序列详见文献[9]。PDS 特异的上下游引物分别为NbPDS405F: 5’-CCACGACCCGAAGATTGAC-3’和 NbPDS511R: 5’-TAACGCCGCCTCCAAATAG-3’。
2 结果与分析
2.1 CMV沉默载体的构建和沉默效率的测定
CMV 2b蛋白是一个有效的RNA沉默抑制子,其抑制活性位于其N端61氨基酸[10],且该蛋白在多数植物上对病毒的复制和移动是非必需的[3],因此,我们将Fny-CMV的2b ORF替换为353 bp的PDS片段,构建了pF209Δ2b-PDS353重组质粒(图1-A)。通过体外转录,将其与Fny-CMV RNA1和RNA3的体外转录产物混合接种本生烟,产生重组病毒Fny-CMVΔ2b-PDS353;同时,以接种2b基因缺失的突变体Fny-CMVΔ2b作为对照。在整个病毒症状观察期间,对照病毒Fny-CMVΔ2b仅引起轻微的花叶症状。然而,接种后7 d,Fny-CMVΔ2b-PDS353侵染引起上部系统叶出现明显的沿脉褪绿;接种后25 d,以上系统叶则发展为大面积的光漂白表型(白色箭头所示,图1-B)。然而,顶部新生叶仅呈现局部有限的光漂白现象(灰色箭头所示,图1-B)。以上结果表明,在病毒侵染的早中期,Fny-CMVΔ2b-PDS353侵染能有效地诱导上部系统叶中PDS mRNA的沉默,然而,沉默效率在新生叶中受到明显的抑制。
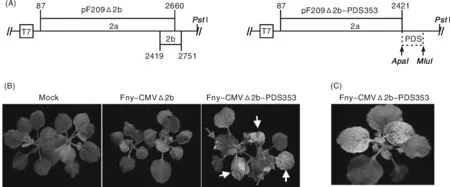
A, pF209与pF209Δ2b-PDS353的侵染性克隆示意图;B, 本生烟接种病毒或缓冲液后(mock)的表型,接种25 d后拍照;C, pF209Δ2b-PDS353转接3代后引起的本生烟表型,转接14 d后拍照A, Diagram of infectious constructs pFny209 and its mutant pF209Δ2b-PDS353; B, Phenotype of N. benthamiana plants inoculated with virus or inoculation buffer (mock). The photos were taken at 25 dpi; C, Phenotype of N. benthamiana plant with infection of pF209Δ2b-PDS353 after three passages. The photo was taken at 14 dpi图1 CMV诱导的PDS沉默Fig.1 PDS silencing induced by CMV
为了分析Fny-CMVΔ2b-PDS353重组病毒的遗传稳定性,对该病毒进行了3次转接本生烟。第三次转接后14 d,接种植物的系统叶同样表现明显的光漂白表型(图1-C)。然后,通过RT-PCR和测序分析,结果表明,插入PDS序列没有出现任何片段缺失和突变(数据未显示),这说明该重组病毒在植物体内能稳定遗传,而且新生叶中减弱的沉默效率不是由于PDS插入片段的不稳定性导致。
2.2 PDS插入片段的大小对CMV诱导沉默效率的影响
为了分析不同插入片段对CMV诱导沉默效率的影响,我们将2b ORF系列替换为不同长度的PDS片段:104 bp(PDS104)、219 bp(PDS219)、353 bp(PDS353,即Fny-CMVΔ2b-PDS353)、518 bp(PDS518)、750 bp(PDS750)和1030 bp(PDS1030)(图2-A)。将以上重组质粒的体外转录产物分别与RNA1和RNA3混合接种本生烟。接种后14 d,以上重组病毒在上部系统叶中引起差异的光漂白效果。PDS104几乎不引起光漂白现象,叶片轻微出现少量的褪绿表型。PDS219则出现大面积褪绿,但光漂白现象不明显。PDS518表现与PDS353相近的光漂白程度,而PDS750和PDS1030二者表现最为严重的光漂白表型。然而,在顶部的新生叶上,PDS518引起的光漂白最为明显,而PDS750和PDS1030则与PDS104和PDS219相似,没有引起明显的PDS沉默表型(图2-B)。
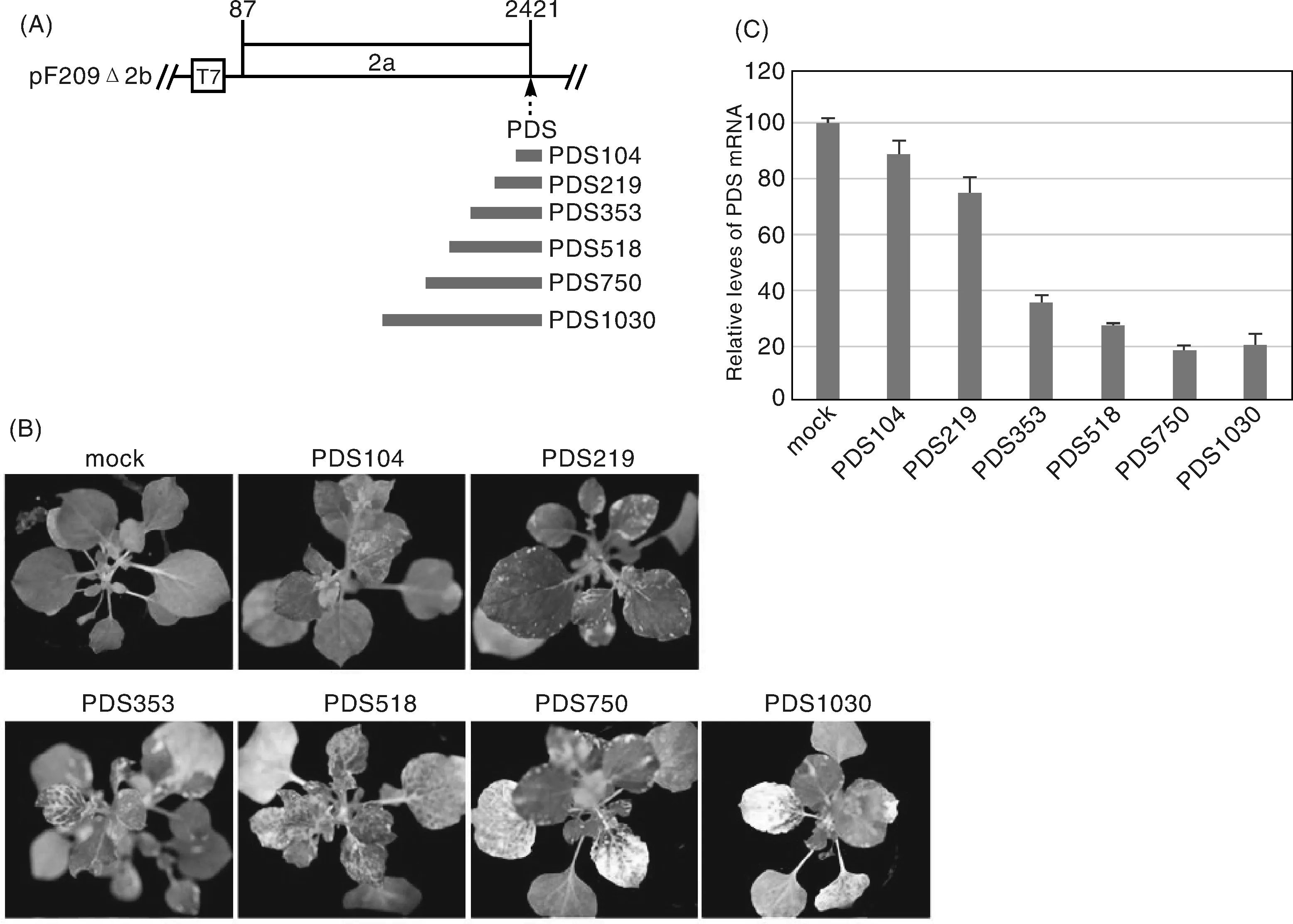
A, pF209Δ2b携带不同长度的PDS插入片段的示意图;B, 重组病毒在本生烟植物上引起的光漂白表型,接种后25 d拍照;C, 实时定量PCR分析重组病毒引起的PDS mRNA的下调,PDS mRNA 提取自下部呈现光漂白的叶片(非顶叶)A, Diagram of pF209Δ2b harboring PDS inserts in different sizes. B, Photobleaching phenotype on N. benthamiana plants with infection of the recombinant viruses. Photos were taken at 25 dpi. C, Analysis of down-regulation of PDS mRNA by the recombinant viruses using real-time PCR. PDS mRNA was extracted from the leaf tissues showing photobleaching, rather than the top leaves图2 不同长度的PDS插入对CMV诱导PDS沉默效率的影响Fig.2 Effect of PDS insertion in different sizes on CMV-induced PDS silencing
利用荧光定量PCR方法,对上述表现光漂白表型的上部系统叶(非顶部叶片)中的PDS mRNA水平进行相对定量,结果如图2-C所示。PDS104与PDS219侵染分别只降低了11%和25%;PDS353侵染则显著降低了PDS mRNA水平,降低效率为65%。与mock相比,PDS518、PDS750和PDS1030分别降低了73%、82%和80%。以上结果说明,CMV诱导的PDS沉默效率与PDS插入片段的大小呈一定的相关性。
2.3 重组病毒的遗传稳定性分析
为分析以上重组病毒的遗传稳定性,对重组病毒进行了3次转接。转接后第14天,通过Northern杂交对系统叶中的病毒子代RNA进行检测。结果显示(图3-A),在转接的植物中均检测到病毒RNA条带,且各重组病毒间基因组含量没有显著区别。但是,我们注意到PDS1030、PDS750和PDS518三者的基因组RNA2迁移速率比PDS353快,这与理论大小不相符,说明前三者的RNA2很可能发生PDS片段的缺失。为此,通过RT-PCR和测序分析,我们发现,PDS353、PDS219和PDS104病毒的PDS插入片段没有发生缺失和突变,但是,PDS1030、PDS750和PDS518在插入片段的5’端分别缺失813、542和332 nt(图3-B)。这些结果说明,CMV作为沉默载体,最适插入片段为350 nt左右。
3 讨论
到目前为止,已有多达40个植物病毒的VIGS载体报道[11],这说明许多病毒都具有诱导基因沉默的能力。但是,不同病毒的沉默效率可能存在着差异性。Ratcliff等[1]发现:相比于马铃薯X病毒(Potatovirusx, PVX)、烟草花叶病毒(Tobaccomosaicvirus, TMV)和番茄金花叶病毒(Tomatogoldenmosaicvirus, TGMV),TRV具有明显的沉默效率优势:表现为更高的沉默程度和更久的持续时间。PVX不能有效地诱导顶部新生叶的PDS沉默,但是TRV则能有效地诱导沉默,这方面的差异很可能与二者病毒能否侵染植物顶端分生组织有关[1]。TRV由于其编码的RNA沉默抑制子16k,使得该病毒能有效地侵染植物的顶端分生组织[12],但是PVX则不能[1]。
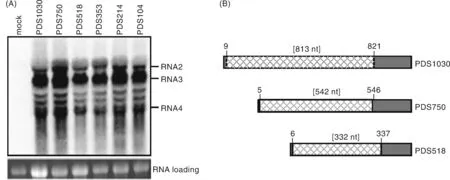
A, RNA 杂交分析病毒子代RNA的积累,总RNA 提取自病毒转接3代后第14天的系统叶;B, CMV病毒中PDS插入片段的缺失示意图,网格方形代表PDS序列的缺失部分,括号中数字代表缺失的碱基数目,其他数字表示缺失片段在原插入片段中的位置,灰色代表在病毒基因组中保留的序列部分A, Analysis of viral progeny RNAs by RNA blotting. Total RNA was extracted from the upper systemic leaves at 14 dpi after 3 passages; B, Diagrams of PDS deletion from the PDS inserts in CMV. Rectangles with grids indicate deletion from the inserted PDS fragments. The numbers in brackets indicate deletion size. Other numbers represent the positions of deletion fragment in the original inserts. Gray rectangles indicate the sequence remained in the viral genomes after passages图3 CMV重组病毒的遗传稳定性分析Fig.3 Analysis of genetic stabilities of CMV recombinants
CMV 2b蛋白是该病毒侵染植物的顶端分生组织所必需的[13]。我们所测试的CMV沉默载体由于完全缺失2b基因,从而使得CMV重组病毒丧失了侵染本生烟顶端分生组织的能力,这合理地解释了该CMV沉默载体无法有效地沉默顶端新生叶组织中PDS的现象。另外一种可能是2b蛋白的缺失,使得病毒无法克服寄主的抗病毒RNA沉默,导致病毒积累显著降低[9,14],从而影响了PDS siRNA在体内的丰度。当在特定CMV株系的基因组中保留2b N端约80个氨基酸(包含RNA抑制子的活性结构域),在其后插入靶标的部分序列,能有效地抑制本生烟和玉米植物体内相应内源基因的RNA沉默[4,6]。由此可见,选择特定CMV 2b蛋白,并保留其抑制子的功能结构域,对CMV 诱导植物内源的基因沉默是有利的。
Burch-Smith等[15]报道300~500 bp 插入片段的沉默效果最佳。然而,我们发现,插入片段的长度与CMV诱导的沉默效率呈现一定的相关性,353 nt和518 nt的插入片段均能有效地诱导沉默,但是,750 nt片段的插入达到最高的沉默效率(图2)。尽管长片段的插入增强了沉默效率,但是,插入片段大于518 nt则降低了病毒的遗传稳定性,出现插入片段的丢失(图3)。外源片段丢失的现象也在侵染玉米的CMV沉默载体中发生[6]。片段的缺失很可能是由于长片段的插入影响了病毒基因组的病毒粒子组装和长距离运输。基于沉默的效率和稳定性,CMV载体的理想插入片段在350 nt左右。
[1] RATCLIFF F, MARTIN-HERNANDEZ A M, BAULCOMBE D C. Technical advance. Tobacco rattle virus as a vector for analysis of gene function by silencing [J].PlantJournal, 2001, 25(2): 237-245.
[2] PALUKAITIS P, GARCIA-ARENAL F. Cucumoviruses [J].AdvancesinVirusResearch, 2003, 62: 241-323.
[3] JACQUEMOND M. Cucumber mosaic virus [J].AdvancesinVirusResearch, 2012, 84: 439-504.
[4] 程晓东,施伟,杜志游,等. 基于黄瓜花叶病毒(CMV)基因沉默载体的构建 [J]. 农业生物技术学报,2015, 23(12): 1550-1558. CHENG X D, SHI W, DU Z Y, et al. Construction of virus-induced gene silencing vector based onCucumbermosaicvirus(CMV) [J].JournalofAgriculturalBiotechnology, 2015, 23(12): 1550-1558. (in Chinese with English abstract)
[5] OTAGAKI S, ARAI M, TAKAHASHI A, et al. Rapid induction of transcriptional and post-transcriptional gene silencing using-a novel Cucumber mosaic virus vector [J].PlantBiotechnologyJournal, 2006, 23(3): 259-265.
[6] WANG R, YANG X, WANG N, et al. An efficient virus-induced gene silencing vector for maize functional genomics research [J].PlantJournal, 2016, 86(1): 102-115.
[7] RIZZO T M, PALUKAITIS P. Construction of full-length cDNA clones of cucumber mosaic virus RNAs 1, 2 and 3: generation of infectious RNA transcripts [J].MolecularGeneralGenetics, 1990, 222(2): 249-256.
[8] DU Z Y, CHEN F F, LIAO Q S, et al. 2b ORFs encoded by subgroup IB strains of cucumber mosaic virus induce differential virulence on Nicotiana species [J].JournalGeneralVirology, 2007, 88(9): 2596-2604.
[9] DU Z Y, CHEN A Z, CHEN W H, et al. Nuclear-cytoplasmic partitioning of the Cucumber mosaic virus 2b protein determines the balance between its roles as a virulence determinant and RNA silencing suppressor [J].JournalVirology, 2014, 88(10):5228-5241.
[10] DUAN C G, FANG Y Y, ZHOU B J, et al. Suppression of Arabidopsis ARGONAUTE1-mediated slicing, transgene-induced RNA silencing, and DNA methylation by distinct domains of the Cucumber mosaic virus 2b protein [J].PlantCell, 2012, 24(1): 259-274.
[11] RAMANNA H, DING X S, NELSON R S. Rationale for developing new virus vectors to analyze gene function in grasses through virus-induced gene silencing [J].MethodsinMolecularBiology, 2013, 975: 15-32.
[12] MARTIN-HERNANDEZ A M, BAULCOMBE D C. Tobacco rattle virus 16-kilodalton protein encodes a suppressor of RNA silencing that allows transient viral entry in meristems [J].JournalofVirology, 2008, 82(8): 4064-4071.
[13] SUNPAPAO A, NAKAI T, DONG F, et al. The 2b protein of cucumber mosaic virus is essential for viral infection of the shoot apical meristem and for efficient invasion of leaf primordia in infected tobacco plants [J].JournalofGeneralVirology, 2009, 90(12): 3015-3021.
[14] DIAZ-PENDO J A, Li F, Li W X, et al. Suppression of antiviral silencing by cucumber mosaic virus 2b protein in Arabidopsis is associated with drastically reduced accumulation of three classes of viral small interfering RNAs [J].PlantCell, 2007, 19(6): 2053-2063.
[15] BURCH-SMITH T M, ANDERSON J C, MARTIN G B, et al. Applications and advantages of virus-induced gene silencing for gene function studies in plants [J].PlantJournal, 2004, 39(5): 734-746.
(责任编辑 张 韵)
Investigation of efficiency and stability ofCucumbermosaicvirus-based gene silencing vector
XIANG Zhidan, ZHANG Zhenxiao, LI Chao, DU Zhiyou*
(CollegeofLifeSciences,ZhejiangSci-TechUniversity,Hangzhou310018,China)
Virus-induced gene silencing (VIGS) has been widely used for analysis of plant gene function. In this work, using phytoene desaturase (PDS) as an indicator, efficiency ofCucumbermosaicvirus(CMV) as a VIGS vector was investigated to silence PDS mRNA inNicotianabenthamiana. Recombinant viruses were generated by replacing the 2b ORF with a set of PDS fragments, and tested inN.benthamianaplants. Results showed that these recombinants induced photobleaching phenotype in the upper systemic leaves and silencing efficiency was correlated with the length of the PDS inserts in some extents, but they did not cause obvious photobleaching phenotype in the newly top leaves and oversized inserts (≥518 nt) reduced genetic stability of viral genome, leading to partial deletion of the inserts. Thus, the optimal insert is about 350 nt in length for CMV-based VIGS vector.
virus-induced gene silencing;Cucumbermosaicvirus; 2b; phytoene desaturase
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.16
2016-11-30
国家自然科学基金(31470007)
向志丹(1992—),女,湖北宜昌人,硕士研究生,从事分子植物病毒学研究。E-mail: wjgqzwwl@qq.com
*通信作者,杜志游,E-mail: duzy@zstu.edu.cn
Q933
A
1004-1524(2017)04-0625-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 625-630
向志丹,张震霄,李超,等. 黄瓜花叶病毒基因沉默载体的效率和稳定性分析[J].浙江农业学报,2017,29(4): 625-630.
