一株真菌的发酵液对番茄抗盐的促进作用及菌株初步鉴定
2017-04-26刘国丽
刘国丽,龚 娜,陈 珣,王 娜
(1.辽宁省农业科学院 微生物工程中心,辽宁 沈阳 110161; 2.辽宁省农业科学院 植物营养与环境资源研究所,辽宁 沈阳 110161)
一株真菌的发酵液对番茄抗盐的促进作用及菌株初步鉴定
刘国丽1,龚 娜1,陈 珣1,王 娜2,*
(1.辽宁省农业科学院 微生物工程中心,辽宁 沈阳 110161; 2.辽宁省农业科学院 植物营养与环境资源研究所,辽宁 沈阳 110161)
为筛选获得能提高番茄耐盐性的真菌发酵液,试验采用真菌的发酵液处理75 mmol·L-1Ca(NO3)2胁迫下的番茄种子,通过测定种子发芽率、发芽势,选择对种子发芽有促进作用的菌株发酵液,研究其对Ca(NO3)2处理下番茄幼苗根干质量、苗干质量等农艺性状指标及植株内源激素等的影响,结果显示,其中部分菌株发酵液能不同程度地提高番茄种子发芽率和发芽势,并能提高根干质量、苗干质量;结合种子发芽指标及幼苗干质量和内源激素含量来看,其中菌株DL12发酵液处理综合效果最好,种子发芽率、发芽势、株高、根干质量、苗干质量较对照分别提升了29%、200%、17.6%、26.8%、18.9%。DL12处理后叶片中IAA含量是对照组的49.6倍。采用真菌通用引物ITS1和ITS2扩增菌株DL12 18S rDNA序列,并与GenBank已知序列比对后,结果显示,菌株DL12与Schizophyllumcommune相似度达到99%,推测菌株DL12是Schizophyllum属真菌。
番茄;抗盐;真菌;发酵液
近年来,我国设施番茄栽培发展迅速,已成为农民增收的重要途径之一。然而,由于设施栽培是封闭栽培方式,缺少自然雨水淋洗,高温、高湿且通气不良,设施农田土壤又长期处于高集约化、高复种指数、高肥料施用量的生产状态,生态环境和生产状态综合导致了土壤次生盐渍化、养分失调、土壤酸化等诸多问题,其中以土壤次生盐渍化问题最为突出[1]。并且随着种植年限的增加,设施土壤次生盐渍化现象非常普遍,在连续栽培蔬菜 3 年以上的日光温室和塑料大棚中,土壤可溶性盐表积现象比较明显,土壤可溶性盐积累严重[2]。盐渍化导致的盐害通常表现为生理干旱,引起蔬菜生长发育不良,植株抗病性下降,病虫害加重等后果,此外盐渍化导致的盐胁迫影响作物对养分的吸收,引起植物根细胞吸收土壤水分困难或是脱水[3],严重影响蔬菜的产量和品质,造成蔬菜生长受阻,产量降低,因此土壤盐渍化是蔬菜栽培的重要限制因子,严重制约着设施蔬菜栽培的进一步发展。
番茄是我国主要的设施蔬菜作物之一,在农业生产中有重要经济价值,易受土壤盐渍化影响。因此探索研究解决土壤盐渍化,缓解番茄盐害的方法,对于提高设施园艺生产效率具有重要的理论意义和实践价值。而通过生物途径使植物充分适应盐渍环境,以提高植物在盐渍土壤上的生产力极具发展潜力[4-5]。
本试验以番茄品种L402为材料,分析比较了不同外源真菌发酵液对盐胁迫下番茄种子发芽情况、幼苗生长的影响,探讨不同外源真菌发酵液对番茄盐胁迫的缓解作用,筛选获得缓解番茄盐害的菌种,以期找到提高番茄耐盐性的有效途径,为提高番茄在盐渍化上的生产力提供科学依据和理论基础。
1 材料与方法
1.1 试验材料
1.1.1 番茄品种
供试番茄品种为L402。
1.1.2 供试菌株及发酵液的配制
从辽宁不同盐碱环境区的土壤和植株中自行分离出真菌菌株27株。无菌操作条件下将供试菌株分别接种于PDA培养基中,28 ℃,200 r·min-1培养5 d,离心取上清,并调节发酵液浓度为干质量1 mg·mL-1,备用。
1.2 试验方法
1.2.1 试验设计
发芽试验:选取大小一致、饱满的番茄种子在2% (m/V)次氯酸钠溶液中浸泡15 min,进行消毒,然后用去离子水将种子清洗干净,进行发酵液拌种处理,对照用同等体积水替代处理,晾干后,置于9 cm直径培养皿中,里面铺两层滤纸,加入10 mL 75 mmol·L-1Ca(NO3)2,然后在25 ℃的恒温培养箱内催芽,每个平皿20粒番茄种子,定期补充水分,每天观察统计种子发芽数,共统计14 d。
盆栽试验:盆栽试验于塑料花盆中进行,每盆种一穴,每穴单株种植。当长至3叶1心时,用不同的发酵液喷淋番茄幼苗的叶片并至根部,共喷 30 mL 1 mg·mL-1发酵液,开始进行发酵液处理,对照组喷淋同等体积水。7 d后,每3 d每穴浇30 mL 75 mmol·L-1Ca(NO3)2,开始盐胁迫处理,共浇10次,每个处理3个平行。盐处理结束后取样,测定番茄植株生物量、内源激素等指标。
1.2.2 指标测定方法
发芽势及发芽率按下列公式:发芽率=总发芽的种子数/种子总数×100%;发芽势=前3 d发芽的种子数/种子总数×100%。
植株生物量的测定:首先,将番茄植株从花盆中连根取出,用去离子水小心冲洗,并保持根系的完整。按地上部和地下部分开,置于鼓风干燥箱中105 ℃下杀青 30 min,于80 ℃下烘干至恒质量,称得干质量。
内源激素提取与检测[6-7]:采集盆栽试验后的番茄幼苗叶片,提取内源激素样品,并用0.22 μm孔径的有机滤膜过滤,弃去初滤液,续滤液作为样品溶液。检测条件:运行缓冲液75 mmol·L-1硼砂缓冲液(pH 9.0);检测波长205 nm;分离电压20 kV。
1.2.3 菌株ITS序列扩增与测序
将筛选到的菌株接种至PDA液体培养基中,28 ℃摇床150 r·min-1培养36 h,采用真菌DNA 试剂盒提取菌株总DNA,菌株DNA提取后,经0.8%琼脂糖凝胶电泳检测DNA的完整性,并通过微量核酸定量仪检测其浓度。采用真菌通用引物ITS1和ITS2扩增18S rDNA 的ITS区域,PCR扩增产物送至上海生物工程技术服务有限公司测序。将测得的序列与GenBank已知序列进行BLAST比对(http://blast.ncbi.nlm.nih.gov/Blast.cgi),并利用MEGA 4.1进行系统发育树构建。
1.3 数据处理
试验数据采用Microsoft Excel软件系统分析。
2 结果与分析
2. 1 真菌发酵液对番茄种子发芽率及发芽势的影响
由表1可以看出,75 mmol·L-1Ca(NO3)2胁迫下,L402种子发芽率受到了明显的抑制,发芽速度很慢。不同真菌发酵液处理后番茄种子发芽率和发芽势表现差异很大,相对于对照组,部分菌株抑制了种子的发芽率和发芽势,而DWJ2、DL2、DL12等显著促进了种子的萌发。其中DL12处理组番茄种子发芽率和发芽势分别比对照组高29%和200%。
2.2 真菌发酵液对番茄植株株高和生物量影响
综合考虑真菌发酵液对发芽率和发芽势的影响,以发芽势或发芽率不小于对照作为筛选标准,挑选效果好的DL2、DL3等13种真菌发酵液进行盆栽试验。
从表2中可以看出,采用各真菌发酵液进行喷淋处理后,对植株株高、干质量影响各不相同,部分对种子发芽有促进作用的菌株也能促进幼苗的生长,说明在一定程度上缓解了Ca(NO3)2对番茄幼苗的伤害。其中DL2、DL12、DL15、DWJ2、DWR3对番茄植株的株高和生物量积累作用较大,显著高于对照。
2.3 DL12发酵液处理对番茄幼苗内源激素的影响
表1 真菌发酵液对番茄种子发芽率及发芽势的影响
Table 1 Effects of fungus fermentation liquid on germination rate and germination potential of tomato seeds
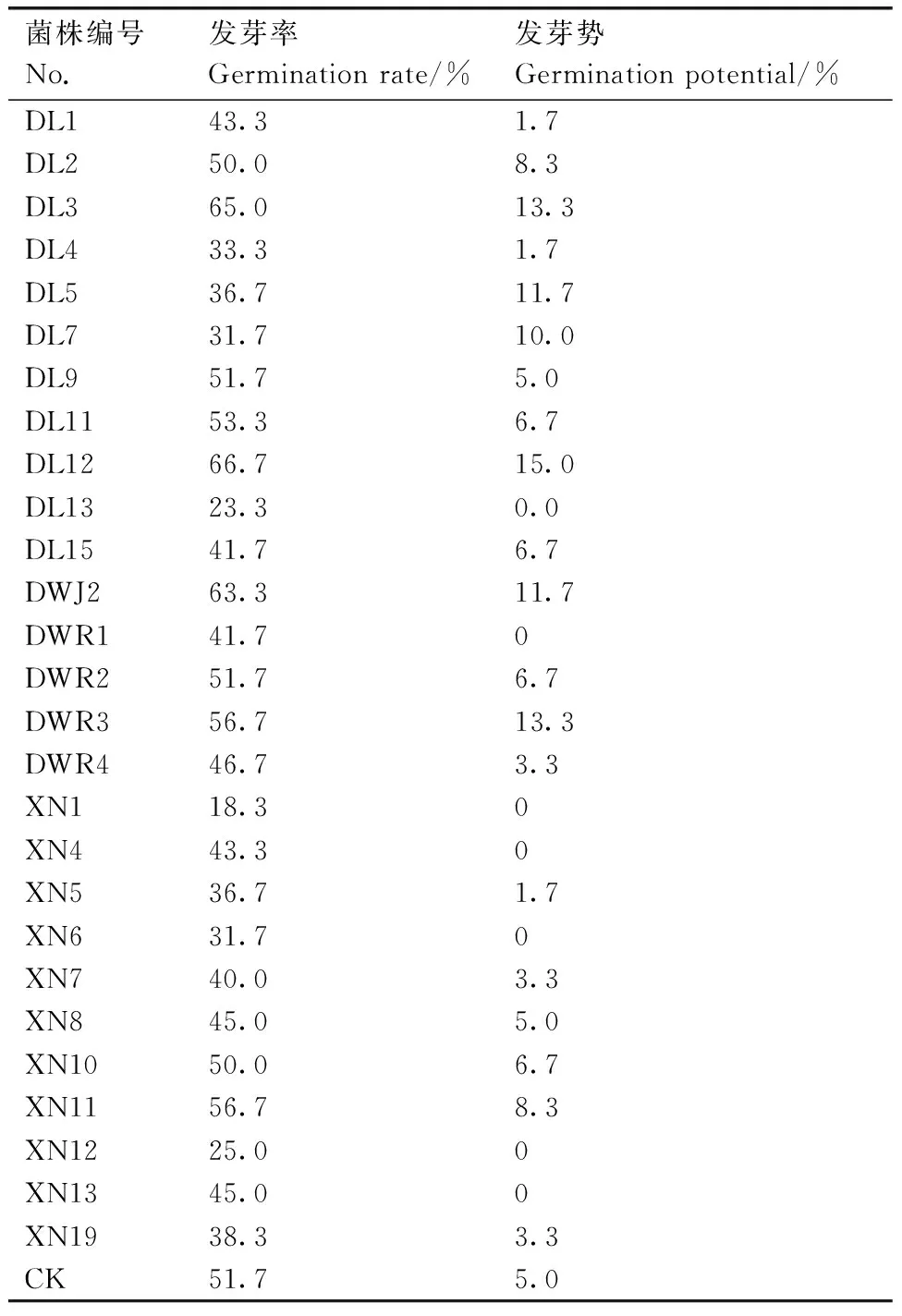
菌株编号No.发芽率Germinationrate/%发芽势Germinationpotential/%DL143.31.7DL250.08.3DL365.013.3DL433.31.7DL536.711.7DL731.710.0DL951.75.0DL1153.36.7DL1266.715.0DL1323.30.0DL1541.76.7DWJ263.311.7DWR141.70DWR251.76.7DWR356.713.3DWR446.73.3XN118.30XN443.30XN536.71.7XN631.70XN740.03.3XN845.05.0XN1050.06.7XN1156.78.3XN1225.00XN1345.00XN1938.33.3CK51.75.0
表2 真菌发酵液喷淋对番茄植株株高和生物量的影响
Table 2 Effects of fungus fermentation liquid on plant height, root dry weight and seedling dry weight of tomato

菌株编号No.株高Plantheight/cm根干质量Rootdryweight/g苗干质量Seedlingdryweight/gDL217.17cd0.457bc2.097cdDL314.40a0.359a1.627aDL515.83abc0.383a1.857abcDL714.43a0.390a1.700abDL914.57ab0.413ab1.697abDL1116.07bc0.407ab1.833abcDL1218.23d0.511cd2.197dDL1518.03d0.483cd2.260dDWJ218.06d0.541d2.220dDWR216.16bc0.390a1.807abcDWR318.13d0.490cd1.973bcdXN1016.00bc0.420ab1.767abXN1115.57ab0.392a1.880abcCK15.50ab0.403ab1.847abc
表中同列数据后无相同小写字母的表示差异显著(P<0.05)。
Values within a column followed by different lowercase letters indicate the significant difference (P<0.05).
植物激素通常作用于植物激素受体,通过信号转导引发下游基因表达和相应的生理生化反应,进而影响根、茎、叶、花、果实等器官的形态建成[8]。生长素(IAA)和脱落酸(ABA)是植物的内源激素,可促进或抑制与种子萌发有关酶类的活性从而调节代谢进程,进而促进或抑制种子的萌发和早期生长。通过检测DL2、DL12、DL15、DWJ2、DWR3发酵液对番茄植株内源激素含量的影响,结果见表3和图1,DL12、DL15、DWJ2均检测到IAA,同等条件下未检测到ABA。只有DL2检测到ABA含量0.431 μg·mL-1。DWR3未检测到ABA和IAA。DL12发酵液处理后有效提高了叶片中IAA的浓度,为14.473 μg·mL-1,而对照组检测结果仅为0.290 μg·mL-1,DL12发酵液处理番茄叶片IAA含量是对照组的49.9倍。
表3 真菌发酵液对番茄叶片内源激素含量的影响
Table 3 Effect of fermentation liquid on endogenous hormones content in tomato leaves
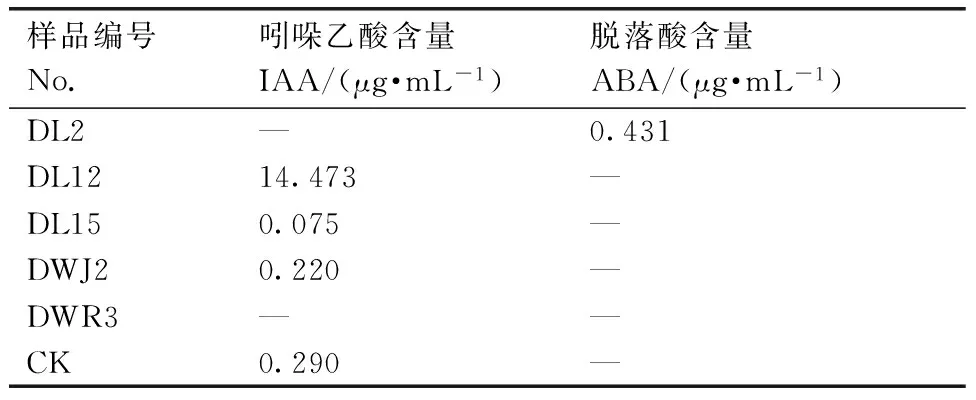
样品编号No.吲哚乙酸含量IAA/(μg·mL-1)脱落酸含量ABA/(μg·mL-1)DL2—0.431DL1214.473—DL150.075—DWJ20.220—DWR3——CK0.290—
“—”表示未检测到。
“—”stands for no detection.

a、b、c依次为标准品、DL12处理、CK组叶片图谱a, Standard sample; b, HPCE chromatograms of IAA in tomato leaves treated by fermentation liquid of DL12; c, CK图1 番茄叶片中IAA毛细管电泳图谱Fig.1 The HPCE chromatograms of IAA in tomato leaves
2.4 菌株ITS rDNA序列分析
利用ITS1和ITS2 rDNA特异引物对菌株进行PCR扩增得到的目的DNA片段,利用Blast软件与GenBank的序列进行同源性比较(图2),结果显示菌株DL12与Schizophyllumcommune相似度达到99%,初步推测DL12为Schizophyllum属真菌。
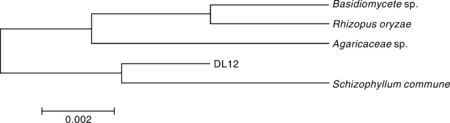
图2 菌株DL12基于ITS rDNA 序列同源性构建的系统发育树Fig.2 Phylogenetic tree of strain DL12 and other reference species
3 结论与讨论
通过比较筛选不同来源的真菌发酵液对番茄发芽及生物量等指标的作用,获得一株对Ca(NO3)2胁迫下番茄发芽和生长有促进作用的菌株DL12,DL12发酵液处理后能提高Ca(NO3)2胁迫下番茄种子发芽率、发芽势,较对照分别提升了29%、200%;株高、根干质量、苗干质量较对照分别提升了17.6%、26.8%、18.9%。内源激素检测表明,DL12能明显提高幼苗的内源激素IAA含量。
目前我国耕地面积不断减少,土地盐碱化不断恶化,通过生物途径使植物充分适应盐渍环境,增强植株对盐碱的耐受范围,以提高植物在盐渍土壤上的生产力极具发展潜力,可为盐渍化土地的利用提供新的途径。近年来,关于盐胁迫下促生菌的报道越来越多,涉及很多属种,包括细菌、真菌等[9-15]。但关于Schizophyllum属菌株与植物促生抗逆的报道较少,仅李莎[16]报道了分离得到的一株Schizophyllum属TTS-5菌株,不仅对立枯丝核菌有拮抗作用,接种至油松幼苗后,油松苗成活率、生长状况及根系活力均高于对照。本试验结果表明,DL12发酵液处理可以提高番茄种子在Ca(NO3)2胁迫下的萌发,喷淋处理后,可以促进幼苗的生长,显著影响番茄植株的内源激素含量,缓解盐胁迫对番茄幼苗的毒害作用,从而增强番茄对盐胁迫的抗性。本试验为提高设施蔬菜在盐渍化土地上的抗性提供了新的思路和方法。
[1] 顾京晏,顾卫,张化,等.我国设施农业土壤次生盐渍化生物改良措施研究进展[J].北京师范大学学报(自然科学版),2016,52(1):70-75. GU J Y, GU W, ZHANG H, et al. Biological measures for soil improvement of facility agriculture in China[J].JournalofBeijingNormalUniversity(NatureScience), 2016,52(1):70-75.(in Chinese with English abstract)
[2] 王学征.设施环境盐胁迫对番茄生长发育及膜系统影响的研究[D].哈尔滨:东北农业大学,2004. WANG X Z. Studies on effects of salt stress on growth and development and membranes system of tomato in protected farm[D].Harbin: Northeast Agricultural University. 2004. (in Chinese with English abstract)
[3] PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants: a review.[J].EcotoxicologyandEnvironmentalSafety, 2005, 60(3):324.
[4] 顾金凤.微生物菌肥对盐渍化土壤的改良研究[D].扬州:扬州大学,2013. GU J F. Effects of microbiological fertilizer on salinized soil [D].Yangzhou: Yangzhou University, 2013. (in Chinese with English abstract)
[5] 黄红艳.次生盐渍化土壤的微生物多样性及微生物改良效应研究[D].上海:上海交通大学,2012. HUANG H Y. Soil microbial diversity in secondary salinization soils and it’s microbial remidation [D]. Shanghai: Shanghai Jiao Tong University, 2012. (in Chinese with English abstract)
[6] 马晓颖, 贾东贝, 李冰宇,等. 利用高效毛细管电泳测定真菌代谢产物吲哚乙酸含量[J].江苏农业科学, 2011, 39(3):439-441. MA X Y, JIA D B, LI B Y, et al. Content determination of IAA in metabolic of fungi using high-performance capillary electrophoresis [J].JiangsuAgriculturalSciences, 2011, 39(3):439-441. (in Chinese with English abstract)
[7] 陶龙兴.内源IAA对亚种间杂交稻籽粒灌浆的信息效应[D].北京:中国农业科学院,2003. TAO L X. Signaling effects of endogenous IAA on grain filling of subspecies hybrid rice[D]. Beijing: Chinese Academy of Agricultural Sciences, 2003. (in Chinese with English abstract)
[8] 尹培培, 包日双, 戴佳锟,等. 植物激素对植物器官发生影响的研究进展[J].江西农业学报,2012,24(6):37-41. YIN P P, BAO R S, DAI J K, et al. Research advance in impact of phytohormone on plant organogenesis[J].ActaAgriculturaeJiangxi, 2012, 24(6):37-41. (in Chinese with English abstract)
[9] 辛树权,王贵,高扬.植物生长促生菌对盐胁迫下水稻种子萌发及幼苗生长的影响[J]. 湖北农业科学,2012,51(3):490-496. XIN S Q, WANG G, GAO Y. Effects of plant growth-promoting rhizobacteria (PGPR) on the rice germination and seedling development under salt stress [J].HubeiAgriculturalSciences, 2012, 51(3):490-496. (in Chinese with English abstract)
[10] 郑元元, 岳海涛, 石在强, 等.盐胁迫下解盐促生细菌Rs-5和Rs-198促进棉花种子发芽的机理探讨[J].中国农业科学,2008,41(5):1326-1332. ZHENG Y Y,YUE H T, SHI Z Q, et al. Physiochemical characters and ability to promote cotton germination of bacteria strains Rs-5 and Rs-198 under salt stress [J].ScientiaAgriculturaSinica, 2008, 41(5):1326-1332. (in Chinese with English abstract)
[11] 罗欢. 芽孢杆菌对植物的促生和耐盐作用及其相关机制的研究[D]. 南京:南京农业大学, 2013. LUO H. Study of growth promoting and salt tolerance ofBacillusspp. on plant and the research of underlying mechanisms[D].Nanjing: Nanjing Agricultural University,2013. (in Chinese with English abstract)
[12] 吉云秀,黄晓东.植物促生菌对燕麦初生苗盐分胁迫下的促生效应[J].大连海事大学学报, 2007,33(2):86-89. JI Y X, HUANG X D. Effects of plant growth-promoting rhizobacteria on the growth of oat seedlings under salt stress[J].JournalofDalianMaritimeUniversity, 2007, 33(2):86-89. (in Chinese with English abstract)
[13] 马晓敏,张红娟,顾沐宇,等. 促生菌的分离鉴定及其对柳枝稷种子在盐胁迫下的萌发促进作用[J].家畜生态学报,2015, 36(6):46-52. MA X M, ZHANG H J, GU M Y, et al. Isolation and identification of plant growth-promoting Rhizobacteria(PGPR) and its promoting effect on switchgrass seed under NaCl salt stress[J].ActaEcologiaeAnimalisDomastici, 2015, 36(6):46-52. (in Chinese with English abstract)
[14] 王斌. 丛枝菌根真菌提高加工番茄抗盐和抗旱效能及其机理研究[D].石河子:石河子大学,2013. WANG B. Arbuscular mycorrhizal fungi improve salt and drought resistance to processing tomato and study of their mechanisms [D]. Shihezi: Shihezi University, 2013. (in Chinese with English abstract)
[15] 李娇. 碱蓬内生菌对Na2CO3胁迫下水稻幼苗生长的缓解作用[D].沈阳:沈阳师范大学,2014. LI J. Effect of endophyte infection alleviate growth damage of rice seedlings under Na2CO3stress [D]. Shenyang: Shenyang Normal University, 2014. (in Chinese with English abstract)
[16] 李莎.外生菌根真菌和荧光假单胞菌对油松生长和抗病性的影响[D].杨凌:西北农林科技大学,2011. LI S. Effects of ectomycorrhiza fungi andPseudomonasfluorescenstoPinustabulaeformisgrowth and disease resistance[D]. Yangling: Northwest A&F University, 2011. (in Chinese with English abstract)
(责任编辑 张 韵)
Promotion effect of fungus DL12 fermentation liquid on salt-resistance ability of tomato and primary identification of strain
LIU Guoli1, GONG Na1, CHEN Xun1, WANG Na2,*
(1.CenterofMicrobialEngineering,LiaoningAcademyofAgriculturalSciences,Shenyang110161,China;2.InstituteofPlantNutrientsandEnvironmentalResources,LiaoningAcademyofAgriculturalSciences,Shenyang110161,China)
In order to screen fungi that could improve the salt-resistance ability ofLycopersiconesculentum, firstly, the fermentation liquid of different fungi were used to treat the seeds ofLycopersiconesculentumunder 75 mmol·L-1Ca(NO3)2stress. Then the seedlings were sprayed by fermentation liquid of different fungi which had good effects on germination of seeds through evaluation of germination rate and germination potential. The plant height and biomass of seedlings after treatment were recorded. Effect of fermentation liquid from strains DL2, DL12, DL15, DWJ2, DWR3 on endogenous hormones content of seedlings were also measured through HPCE chromatograms. Results showed that several fungi strains could partially improve germination rate and germination potential of seeds, and increase the dry weight. DL12 had the best effects among all the fungi. The germination rate, germination potential of seeds, plant height, root dry weight, and seedling dry weight were increased by 29%, 200%, 17.6%, 26.8%, 18.9%, respectively, compared with the control group. The IAA content was 49.6 times of the control group. The fungus general primers ITS1 and ITS2 were used to amplify 18S rDNA sequences of strain DL12, and alignment with the known sequences from GenBank was carried out, results showed that the similarity between strain DL12 andSchizophyllumcommunewas 99%. It was concluded that DL12 may belong toSchizophyllumsp.
tomato; salt-resistance; fungus; fermentation liquid
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.13
2016-12-21
辽宁省自然科学基金项目(2014027026);辽宁省科学事业公益研究基金项目(2015002006)
刘国丽(1986—),女,山东菏泽人,硕士,助理实习员,从事植物内生菌方向研究。E-mail: liugl12@163.com
*通信作者,王娜,E-mail: wnsxh1999@126.com
S182
A
1004-1524(2017)04-0605-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 605-610
刘国丽,龚娜,陈珣,等. 一株真菌的发酵液对番茄抗盐的促进作用及菌株初步鉴定[J].浙江农业学报,2017,29(4): 605-610.
