纤维素分解菌的分离筛选及其对秸秆的分解特性
2017-04-26邱秀文周桂香王慧娟杨丽丽
邱秀文,周桂香,3,*,王慧娟,杨丽丽
(1.九江学院 鄱阳湖生态经济研究中心,江西 九江 332005; 2.九江市流域管理与生态保护重点实验室(九江学院), 江西 九江 332005; 3.土壤与农业可持续发展国家重点实验室/中国科学院 南京土壤研究所,江苏 南京 210008; 4.九江学院 化学与环境工程学院,江西 九江 332005)
纤维素分解菌的分离筛选及其对秸秆的分解特性
邱秀文1,2,周桂香1,2,3,*,王慧娟4,杨丽丽4
(1.九江学院 鄱阳湖生态经济研究中心,江西 九江 332005; 2.九江市流域管理与生态保护重点实验室(九江学院), 江西 九江 332005; 3.土壤与农业可持续发展国家重点实验室/中国科学院 南京土壤研究所,江苏 南京 210008; 4.九江学院 化学与环境工程学院,江西 九江 332005)
从秸秆还田土壤中分离纯化出1株高效纤维素分解菌JJU-A,经形态观察和ITS分子序列分析,鉴定该菌为白耙齿菌(Irpexlacteus)。将JJU-A接种至玉米秸秆培养30、60、90 d后测定秸秆化学组成及官能团变化。结果表明,JJU-A菌对玉米秸秆中纤维素、半纤维素及可溶性糖的分解利用率远高于木质素,其中,纤维素、半纤维素和可溶性糖的降解率分别达53.60%、58.89%和76.03%,而木质素的降解率仅为28.61%。采用傅里叶红外光谱法(FTIR)分析秸秆中主要化学官能团的变化。由光谱数据分析可知,随着降解的进行,秸秆样品在1 046、1 245、1 335、1 603、2 900和3 383 cm-1吸收峰信号强度明显降低,秸秆中C=C、C=O、—CH3、—CH的含量逐渐降低,暗示纤维素、半纤维素、糖类及脂肪族化合物被大量分解。以上结果说明,白耙齿菌JJU-A可以有效提高秸秆的降解效率,加快秸秆资源化利用。
红外光谱;降解过程;玉米秸秆;纤维素
我国每年产生的农作物秸秆近9亿t,其中玉米秸秆2.2亿t[1]。农作物秸秆是自然界蕴藏最丰富的有机资源,可作为农业生产中的肥料来源[2-4]。秸秆还田是绿色生态农业的重要措施,能有效增加土壤有机质含量,提升土壤地力,对于维持农田肥力和减少化肥施用具有积极作用[5-7]。同时,秸秆还田是农田生态系统碳循环的重要组成部分,秸秆的利用方式影响着农田生态系统土壤碳储量[8]。秸秆降解研究已成为当前土壤学和地球化学等领域的热点之一。
秸秆中的主要有机成分包括木质素、可溶性糖、纤维素、半纤维素及脂类等[9]。土壤微生物是秸秆降解的主要驱动者,在降解过程中发挥了重要作用[10-11]。有研究表明,纤维素分解菌对农田秸秆降解过程及降解速率有直接影响[12-13]。在自然状态下,秸秆中纤维素类物质的降解率不高,如何利用纤维素分解菌加速其降解过程成为当前亟待解决的问题。本研究从长期玉米秸秆还田的土壤中筛选出1株高效纤维素降解真菌,对其进行形态学及分子生物学鉴定,并对其降解秸秆的效果进行研究,以期为提高玉米秸秆利用率提供优质的菌株资源。
1 材料与方法
1.1 试验材料
土壤样品采集于中国科学院封丘农业生态试验站,采集的土壤样品置于4 ℃冰箱条件下保存,备用。
以夏玉米秸秆为底物。秸秆采自中国科学院封丘农业生态试验站,秸秆采样时间为2015年10月。试验前将秸秆用蒸馏水清洗3次,于80 ℃条件下烘干至质量恒定,剪成1~2 cm小段备用。
富集培养基: KCl 0.5 g、NaNO30.5 g、Fe2(SO4)3·7H2O(先配成1%的母液,然后再取1 mL)、K2HPO41.0 g、MgSO4·7H2O 0.5 g、蒸馏水1 000 mL。
筛选培养基:羧甲基纤维素钠(CMC-Na) 15.0 g、CaCl20.5 g、MgS04·7H20 0.5 mg、CoCl2·6H2O 3.7 mg、KH2PO41.0 g、尿素0.5 g、琼脂20 g、(NH4)2SO40.5 g、MnSO4·H2O 2.5 mg、ZnSO4·7H2O 3.6 mg、FeSO4·7H2O 7.5 g、蒸馏水1 000 mL。
鉴别培养基(CMC-刚果红培养基):琼脂20 g、CMC-Na 20 g、MnSO4·7H2O 0.5 g、NaCl 0.5 g、KH2PO41.0 g、刚果红0.4 g、(NH4)2SO42.0 g、蒸馏水1 000 mL。
秸秆固体培养基:将玉米秸秆自然风干,剪成长度1~2 cm的小段,按250 g·L-1的比例加入MS盐溶液,灭菌备用。
以上培养基均在121 ℃灭菌20 min 后使用。
1.2 试验方法
1.2.1 菌株的分离筛选
将采集的土壤样品混合均匀后,称取10 g土壤样品加入到装有90 mL无菌水的锥形瓶中,制成悬浮液,静置5 min,量取2 mL上清液至装有18 mL液体富集培养基的试管中,将滤纸条(长6 cm,宽1 cm)也放入试管,使其稍浸入培养基液面,置于28 ℃的培养箱中富集培养,连续富集3次后,采用羧甲基纤维素钠平板法和刚果红染色法[14]筛选具有纤维素分解能力的菌株。
1.2.2 菌株鉴定
将获得的菌株培养7 d,制片,在显微镜(400×)下观察并拍照,观察纤维素分解菌菌落及菌体形态特征,参照《微生物分类学》[15]对菌株作进一步鉴定,参照芦光新等[16]对菌株进行分子鉴定。
1.2.3 秸秆分解研究
将纤维素分解菌分别接种到牛肉膏培养基中, 在170 r·min-1、37 ℃条件下培养2 d后离心(5 000 r·min-1、4 ℃),利用PBS溶液清洗菌体多次,最后用PBS溶液调整菌体D600值至1.0。按照20 g·L-1的接种量将菌株分别接种到秸秆培养基中,28 ℃条件下培养,并注意保持固体培养基的含水率,分别在试验1、2、3个月进行采样。参照Ververis 等[17]测定秸秆样品纤维素、半纤维素、木质素含量。
1.2.4 秸秆红外光谱分析
将玉米秸秆样品置于65 ℃烘箱中烘干至质量恒定,用KBr压片法在傅里叶变换红外光谱仪上测定。
2 结果与分析
2.1 纤维素分解菌的形态
分离到的菌株的形态如图1所示。菌落以中间接种的原菌落为中心向外蔓延,呈圆形生长。菌株整体为白色,部分呈现浅紫色,呈蓬松状,湿润,光泽性好,靠外部的菌丝较为浓密,菌丝较长,分生孢子呈圆形或椭圆形,无气味。命名为JJU-A。
2.2 纤维素分解菌的分子生物学鉴定
以JJU-A菌株基因组DNA为模板,利用真菌ITS通用引物(ITS-1,ITS-4)进行PCR扩增,测序后,将获得的ITS序列与GenBank中的核酸数据库序列进行Blast分析,采用Clustal软件进行多重序列比对。选取相似序列构建系统进化树(图2)。结果显示,JJU-A菌株与IrpexlacteusKUC9124(JX290578.1)同源性最高。通过对该菌生长状况及形态的观察,结合分子鉴定,确定该菌为白耙齿菌(Irpexlacteus)。
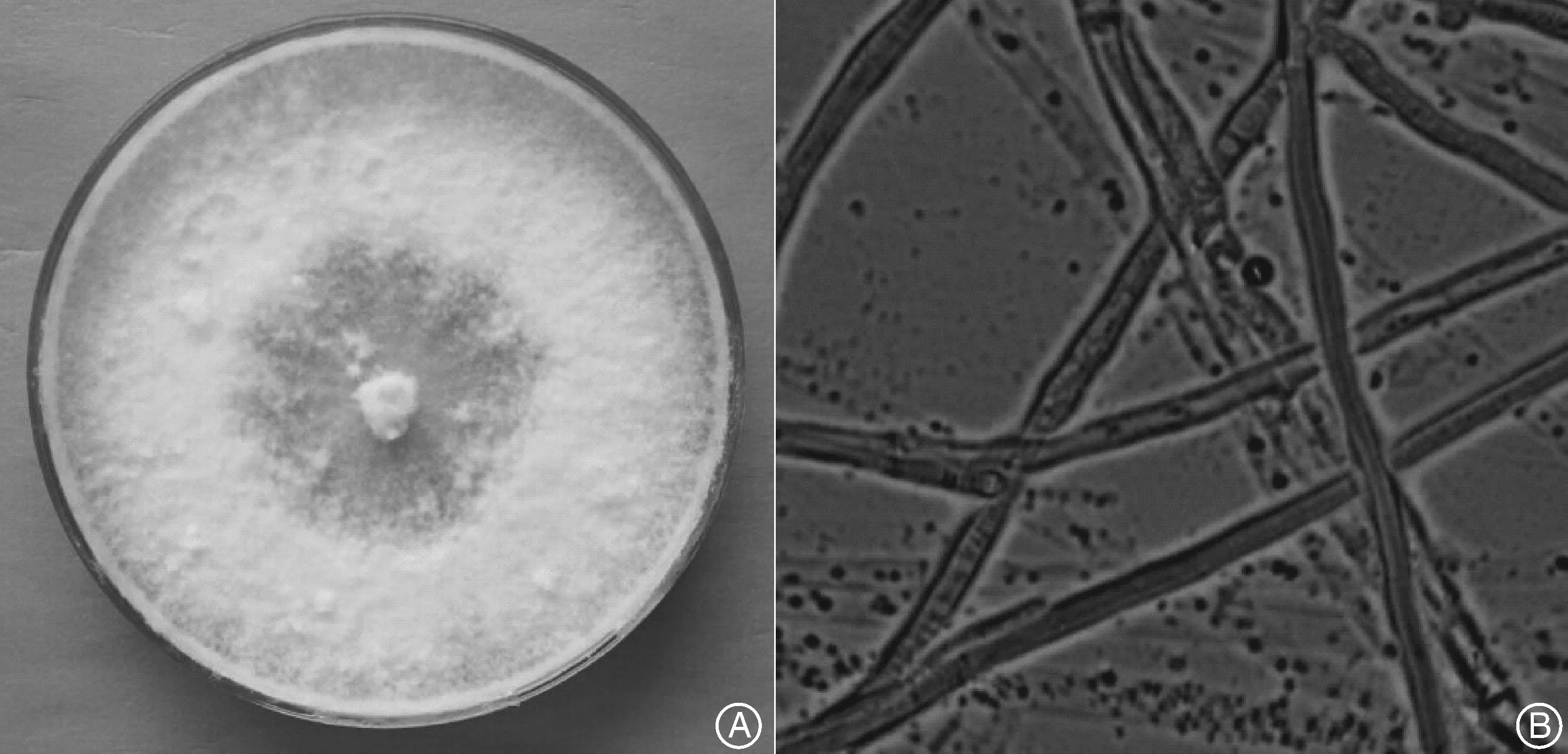
A,菌株的菌落特征;B,菌株放大400倍的显微照片A, Colony morphology;B, Microphotograph, ×400图1 菌株形态特征Fig.1 Morphology characteristic of strain JJU-A
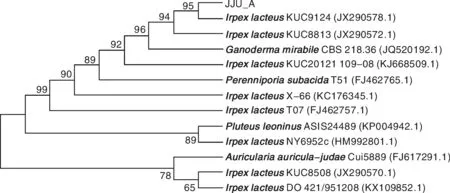
图2 菌株JJU-A的系统发育树Fig.2 Phylogenetic tree of strain JJU-A
2.3 纤维素分解菌的生长曲线
由图3可知,白耙齿菌JJU-A在接种1 d后即进入生长期,生长速率较快,菌落直径随时间增加直线上升,直至菌落直径达到最大值9 cm。7 d后,菌体生长达到稳定期,菌体直径基本保持在9 cm。
2.4 JJU-A的秸秆降解特性
2.4.1 秸秆降解率
将分离获得的纤维素分解菌JJU-A接种到玉米秸秆培养基上,进行秸秆降解试验。如图4所示,接种白耙齿菌JJU-A后,秸秆降解率从接种开始至30 d呈快速上升趋势,降解率达到30%,此后,秸秆降解率增加幅度相对减小,试验90 d后玉米秸秆降解率为45%。

图3 纤维素分解菌生长曲线Fig.3 Growth curve of strain JJU-A
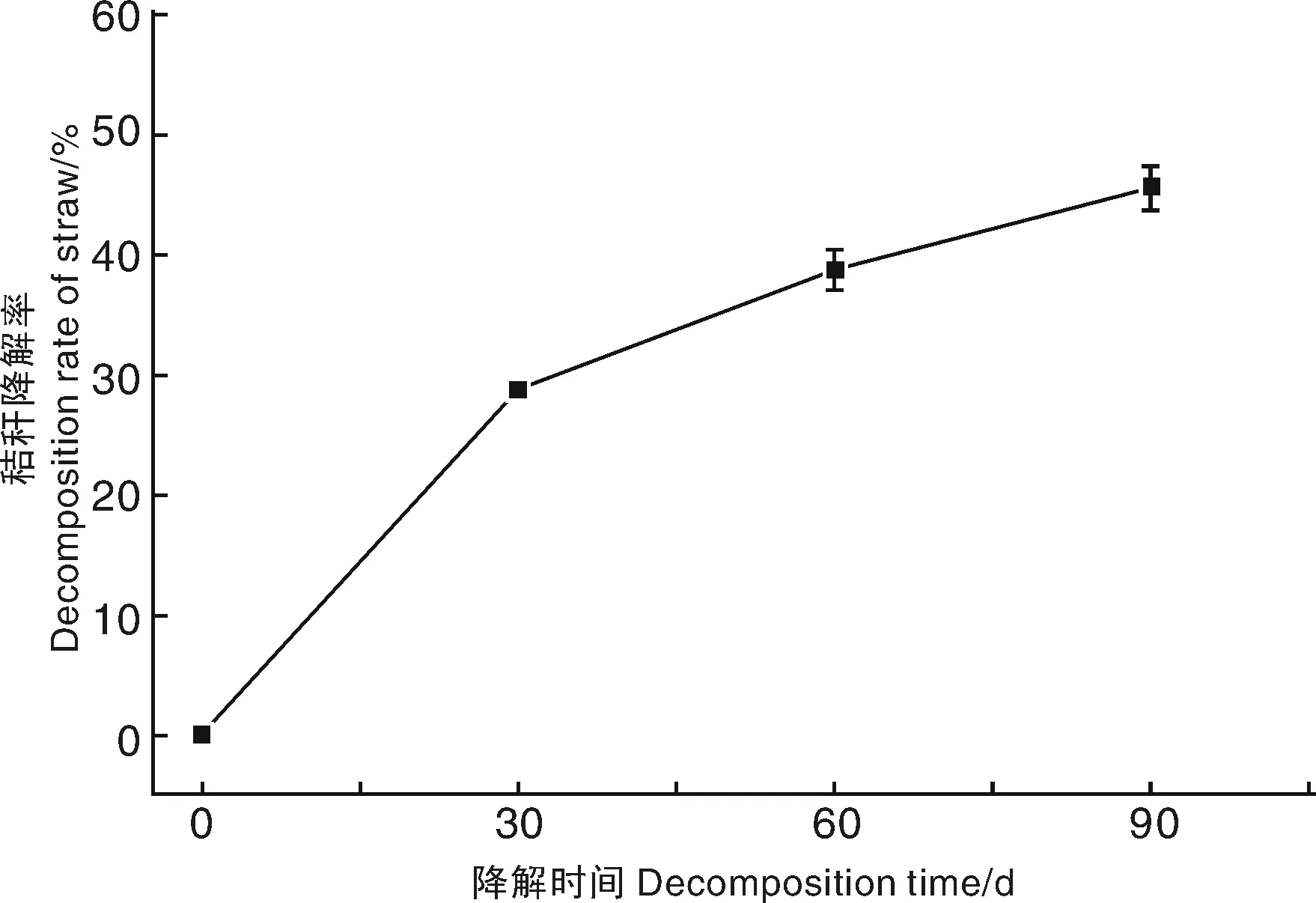
图4 玉米秸秆降解率动态变化Fig.4 Dynamic change of decomposition rate of maize straw
2.4.2 秸秆纤维素类及糖类物质含量变化
在接种白耙齿菌JJU-A 30 d后,玉米秸秆中纤维素降解率达到31.48%,随后纤维素含量缓慢降低,纤维素含量从30 d时的28.66%下降到13.28%,降解率超过50%(图5)。
在整个降解过程中,自接种白耙齿菌JJU-A后,半纤维素的百分含量随着降解时间的延长大幅降低:接种30 d后,半纤维素含量为34.66%;降解60 d后,半纤维素含量降至27.41%;至90 d,半纤维素含量降低至14.23%,此时半纤维素降解率达到58.89%(图6)。
木质素是秸秆中难降解的成分,所以玉米秸秆中木质素的相对百分含量在整个试验期间变化不大。玉米秸秆在接种白耙齿菌JJU-A培养30 d后,秸秆中木质素的含量从11.97%降为9.73%,之后JJU-A对木质素的降解效果减弱,至90 d,玉米秸秆中木质素含量降至8.51%,降解率为28.61%(图7)。
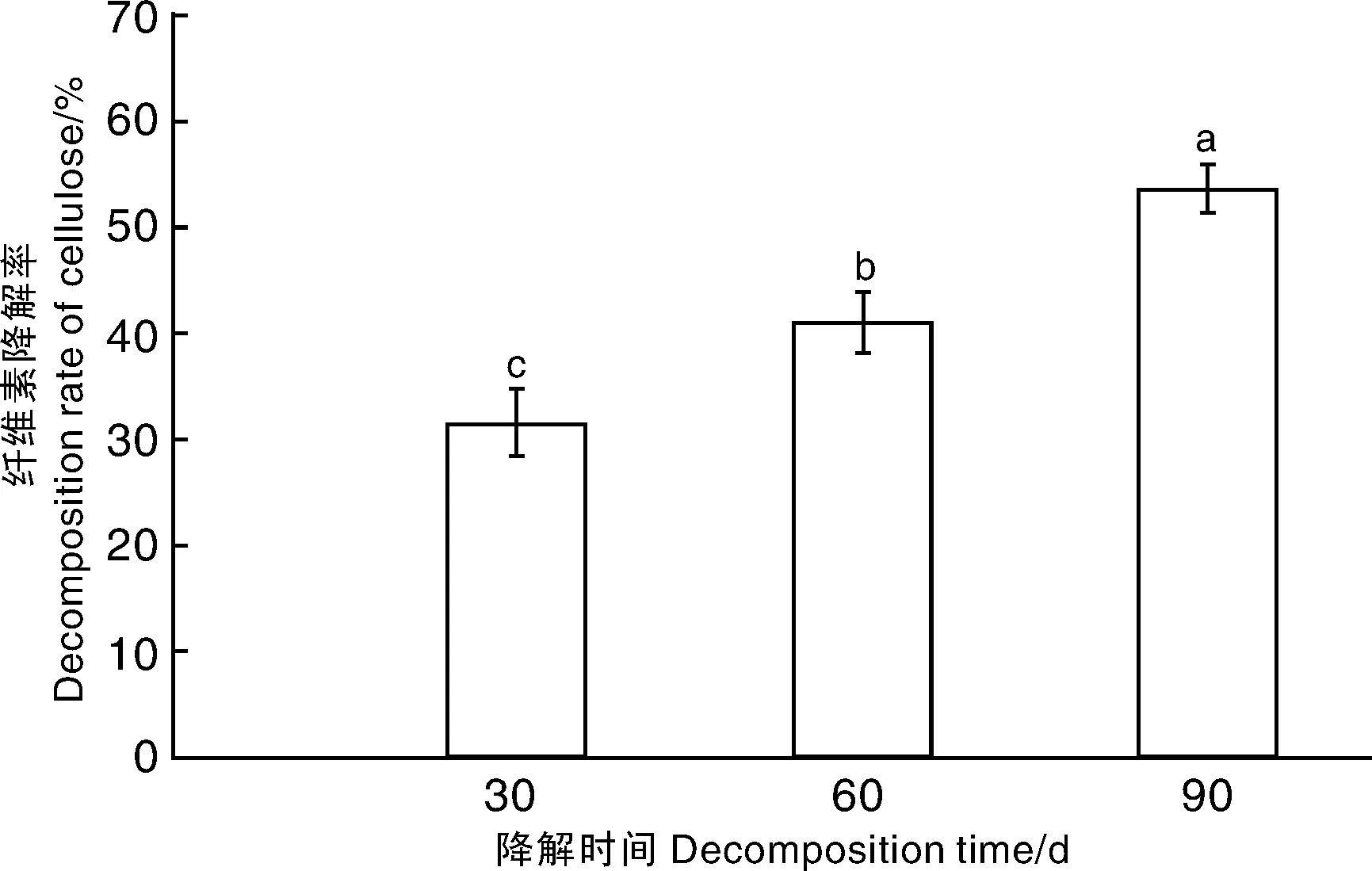
图5 玉米秸秆纤维素含量变化Fig.5 Dynamic change of decomposition rate of cellulose
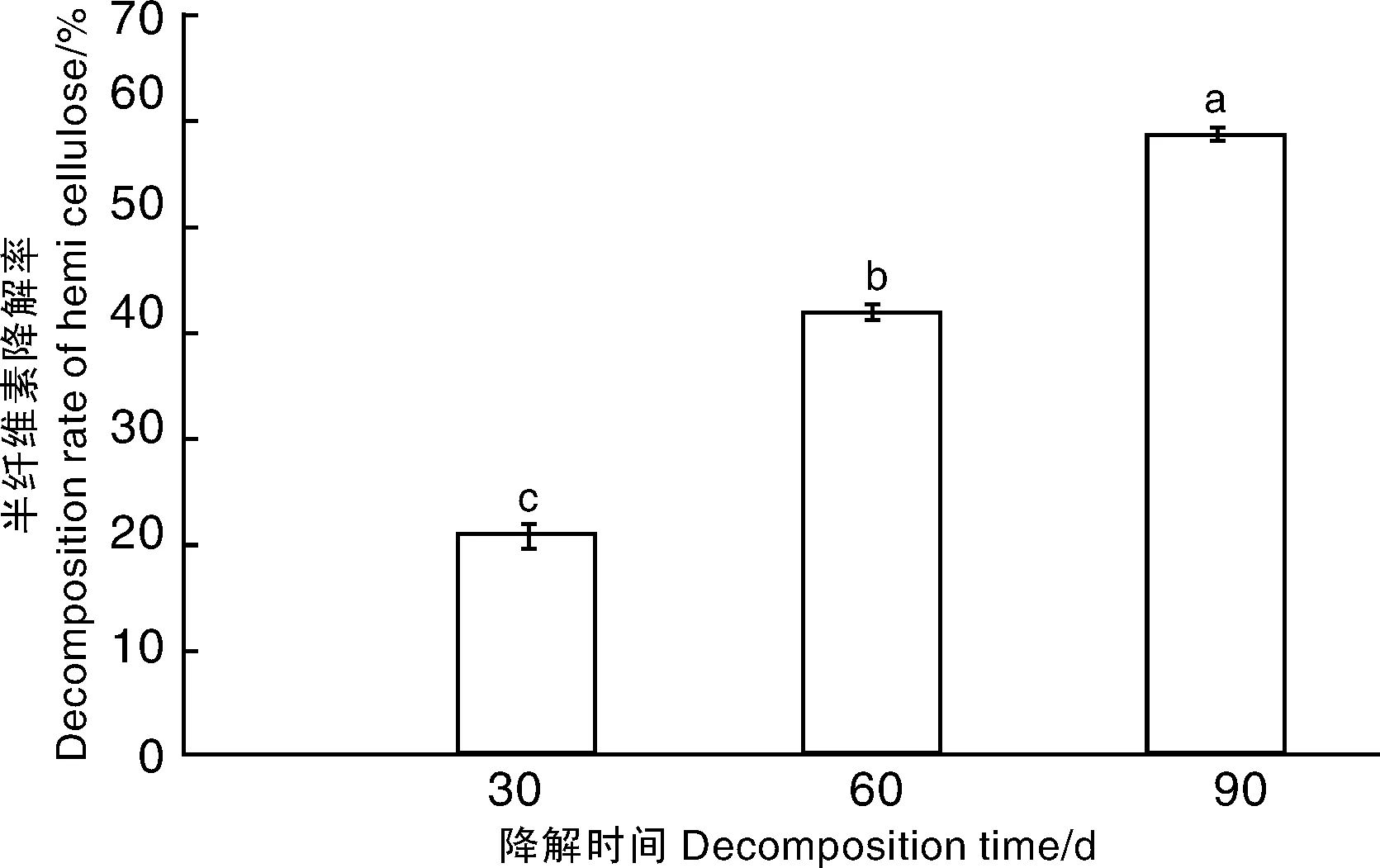
图6 玉米秸秆半纤维素含量变化Fig.6 Dynamic change of decomposition rate of hemicellulose
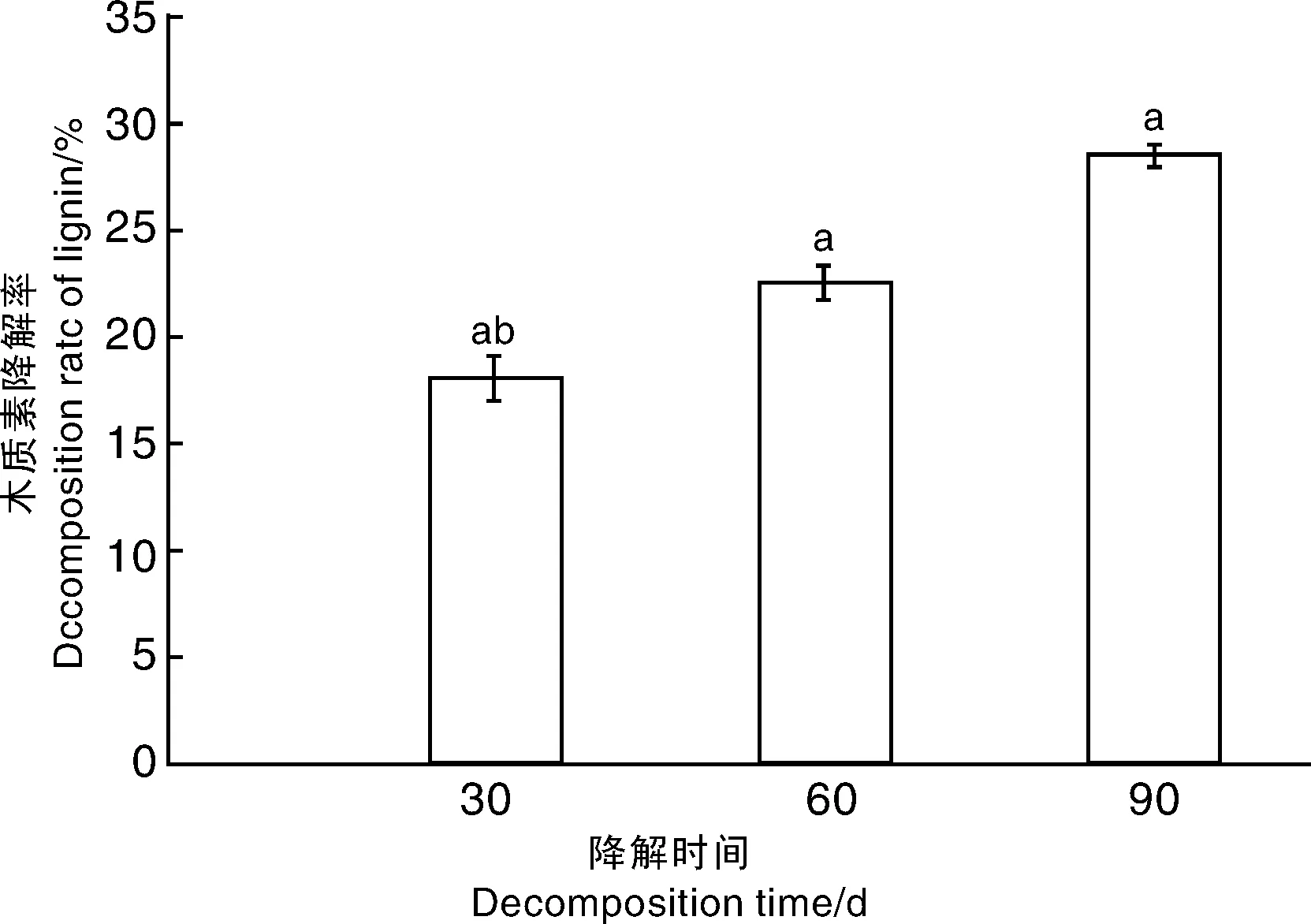
图7 玉米秸秆木质素含量变化Fig.7 Dynamic change of decomposition rate of lignin
如图8所示,玉米秸秆在接种白耙齿菌JJU-A培养30 d后,秸秆中可溶性糖的降解率接近60%。可以看出,在降解前期,白耙齿菌JJU-A对可溶性糖的分解利用远高于其对纤维素、半纤维素和木质素的分解,这说明JJU-A在接种后可充分利用玉米秸秆中的可溶性糖作为能源物质迅速繁殖。这有利于其在短时间内繁殖出足够的菌数以启动其对纤维素类等难分解物质的降解。
2.4.3 秸秆红外光谱分析
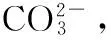

图8 玉米秸秆可溶性糖含量变化Fig.8 Dynamic change of decomposition rate of soluble saccharide
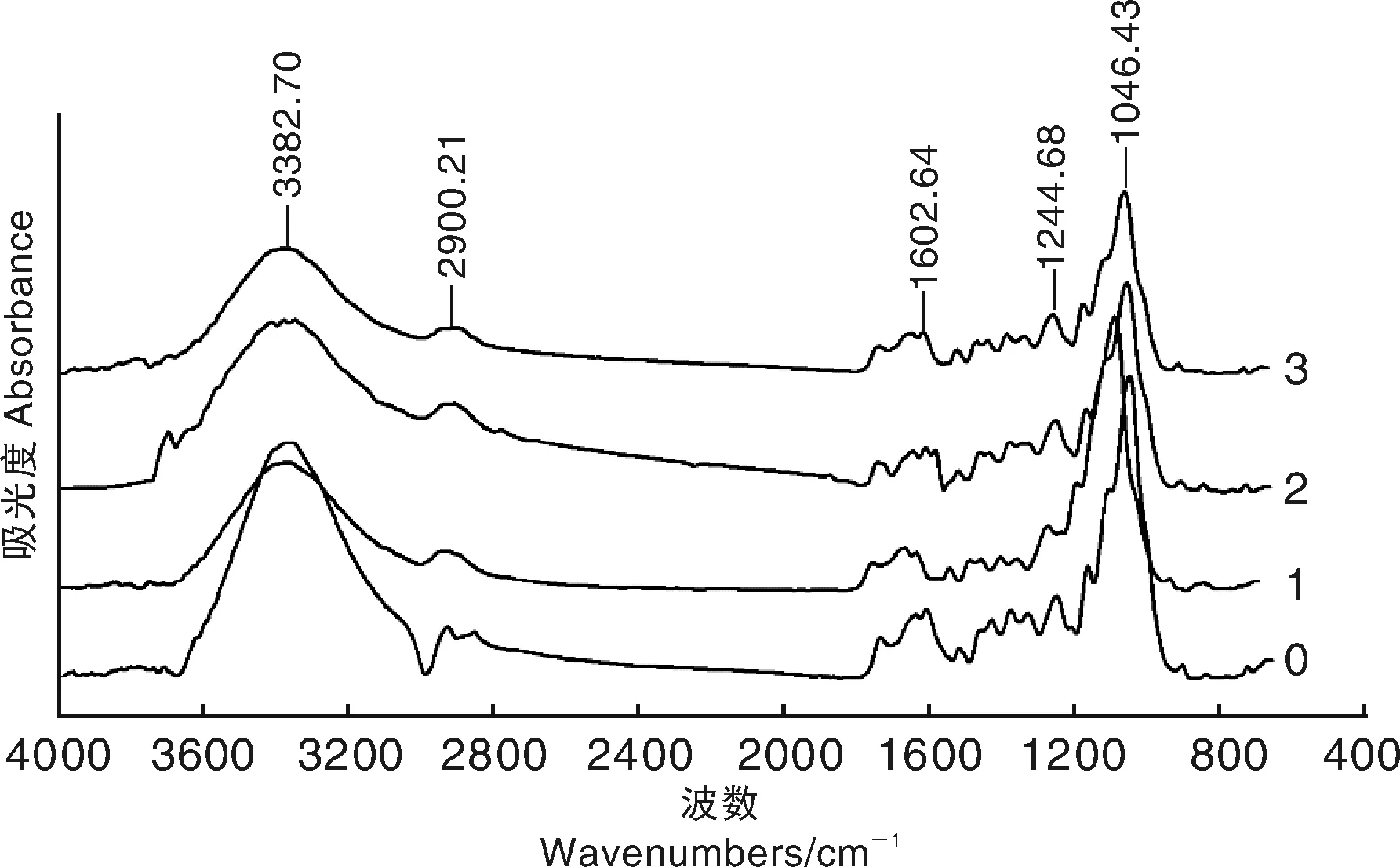
0,降解前;1,降解30 d;2,降解60 d;3,降解90 d0, Before decomposition; 1, 30 d after decomposition; 2, 60 d after decomposition; 3, 90 d after decomposition图9 玉米秸秆红外光谱图Fig.9 FTIR spectrogram of maize straw degraded by strain JJU-A
3 讨论
本研究从秸秆还田土壤中分离筛选出1株高效纤维素分解菌,命名为JJU-A,经形态学鉴定和ITS分子序列分析,确定该菌株为白耙齿菌(Irpexlacteus)。通过常规化学法分别测定玉米秸秆中纤维素、半纤维素、木质素和可溶性糖的含量,接种白耙齿菌JJU-A(IrpexlacteusJJU-A)降解30 d后,玉米秸秆中纤维素、半纤维素及可溶性糖的降解率远高于木质素,其中纤维素、半纤维素和可溶性糖的降解率分别达53.60%、58.89%和76.03%,而木质素的降解率为28.61%。
目前,有关微生物在秸秆或凋落物降解方面的研究较多。刘海静等[18]采用减重法测定秸秆降解率,结果表明,从接种开始至两个月,接种粪产碱菌DG75B(Alcaligenesfaecalis)、蜡状芽孢杆菌 LYZ22(Bacilluscereus)的秸秆降解率分别为31.12%、24.42%。本研究结果显示,当接种白耙齿菌JJU-A 60 d时,秸秆降解率达38.75%,降解效果更优。张伟等[19]采用常规质量分析法测定了白耙齿菌(Irpexlaxteus)对沈阳地区20种常用园林树木枝条的降解能力,结果表明,在降解90 d时,榆叶梅、稠李和桑树等的降解率均在50%左右,与本研究结果极为相近。
在本试验条件下,秸秆中纤维素、半纤维素和木质素的降解率最高分别可达53.60%、58.89%和28.61%,相比纤维素、半纤维素的降解率,木质素的降解率偏低,这是因为木质素结构复杂,难以被降解。以往人们研究降解秸秆木质纤维素的微生物多数局限于单个菌株的纯培养,但在自然界中,木质纤维素是在多种菌类的共同作用下被分解,从而进入地球碳素循环。牛俊玲等[20]研究了高效纤维素分解菌复合系对稻草秸秆的降解,结果表明,发酵12 d后,秸秆中可溶性糖的降解率达到72.91%,而本研究中玉米秸秆降解30 d后可溶性糖降解率仅为55.68%。因此,本课题下一步将开展联合菌降解秸秆中纤维素、半纤维素和木质素的研究。
[1] 左旭, 王红彦, 王亚静, 等. 中国玉米秸秆资源量估算及其自然适宜性评价[J]. 中国农业资源与区划, 2015, 36(6):5-10. ZUO X, WANG H Y, WANG Y J, et al. Estimation and suitability evaluation of corn straw resources in China[J].ChineseJournalofAgriculturalResourcesandRegionalPlanning, 2015, 36(6): 5-10. (in Chinese with English abstract)
[2] 王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7):870-875. WANG H Y, FAN B Q. Screening of three straw-cellulose degrading microorganism[J].ActaMicrobiologicaSinica, 2010, 50(7): 870-875. (in Chinese with English abstract)
[3] 陈燕, 周孙全, 郑奇士, 等. 常温纤维素降解菌的分离与鉴定[J]. 上海交通大学学报(医学版), 2010, 30(8):1018-1020. CHEN Y, ZHOU S Q, ZHENG Q S, et al. Isolation and identification of cellulose-degrading bacteria under room temperature[J].JournalofShanghaiJiaotongUniversity(MedicalScience), 2010, 30(8): 1018-1020. (in Chinese with English abstract)
[4] 刘定辉, 蒲波, 陈尚洪, 等. 秸秆还田循环利用对土壤碳库的影响研究[J]. 西南农业学报, 2008, 21(5):1316-1319. LIU D H, PU B, CHEN S H, et al. Effect of crop straw returning to paddy soil on soil carbon pool in Sichuan basin[J].SouthwestChinaJournalofAgriculturalSciences, 2008, 21(5): 1316-1319. (in Chinese with English abstract)
[5] 潘剑玲, 代万安, 尚占环, 等. 秸秆还田对土壤有机质和氮素有效性影响及机制研究进展[J]. 中国生态农业学报, 2013, 21(5):526-535. PU J L, DAI W A, SHANG Z H, et al. Review of research progress on the influence and mechanism of field straw residue incorporation on soil organic matter and nitrogen availability[J].ChineseJournalofEco-Agriculture, 2013, 21(5): 526-535. (in Chinese with English abstract)
[6] FEI L U, WANG X, HAN B, et al. Soil carbon sequestrations by nitrogen fertilizer application, straw return and no-tillage in China’s cropland[J].GlobalChangeBiology, 2009, 15(2):281-305.
[7] LORETTA T, ANNA N, GIANNI G, et al. Can mineral and organic fertilization help sequestrate carbon dioxide in cropland[J].EuropeanJournalofAgronomy, 2008, 29(1):13-20.
[8] 朱鸿杰, 闫晓明, 何成芳, 等. 秸秆还田条件下农田系统碳循环研究进展[J]. 生态环境学报, 2014(2):344-351. ZHU H J, YAN X M, HE C F, et al. Effect of returning straw on soil carbon cycle in cropland ecosystem[J].EcologyandEnvironmentSciences, 2014 (2): 344-351. (in Chinese with English abstract)
[9] NOWAK J, NOWAK D, CHEVALLIER P, et al. Analysis of composite structure and primordial wood remains in petrified wood[J].AppliedSpectroscopy, 2007, 61(8): 889-895.
[10] SMITH J L, PAUL E A, BOLLAG J M, et al. The significance of soil microbial biomass estimations[M]. New York; Marcel Dekker, 1990: 357-398.
[11] 章家恩, 刘文高. 微生物资源的开发利用与农业可持续发展[J]. 生态环境学报, 2001, 10(2):154-157. ZHANG J E, LIU W G. Utilization of microbes resources and sustainable development of agriculture[J].SoilandEnvironmentalSciences, 2001, 10(2): 154-157.
[12] BURNS R G. Enzyme activity in oil: some theoretical and practical consider-actions[M]// BURNS R G. Soil enzymes. London, UK: Academic Press, 1978: 295-340.
[13] KIRK T K. Degradation of lignin[M]// GIBSON D T. Microbial degradation of organic compounds. New York: Marcel Dekker, 1984: 399-437.
[14] 江国忠. 高产纤维素酶枯草芽孢杆菌的筛选、应用及其产酶条件研究[D]. 南昌: 南昌大学, 2010. JIANG G Z. Screening, application and conditions of enzyme production research of bacillus subtilis strains with high -cellulase yield[D]. Nanchang: Nanchang University, 2010. (in Chinese with English abstract)
[15] 张纪中. 微生物分类学[M]. 上海: 复旦大学出版社, 1990: 368-425.
[16] 芦光新, 陈秀蓉, 杨成德, 等. 一株纤维素分解菌的鉴定及对两种草坪草凋落物分解活性的研究[J]. 草业学报, 2011, 20(6):170-179. LU G X, CHEN X R, YANG C D, et al. Identification of cellulose decomposing fungi strain F1 and decomposition activity to two kinds of lawn grass litter[J].ActaPrataculturaeSinica, 2011, 20(6): 170-179. (in Chinese with English abstract)
[17] VERVERIS C, GEORGHIOU K, DANIELIDIS D, et al. Cellulose, hemicelluloses, lignin and ash content of some organic materials and their suitability for use as paper pulp supplements[J].BioresourceTechnology, 2007, 98(2):296-301.
[18] 刘海静, 任萍. 无机营养元素对小麦秸秆降解菌降解效果的影响[J]. 中国农学通报, 2013, 29(6):30-37. LIU H J, REN P. Effects of inorganic elements on wheat straw degradation by biodegradation strains[J].ChineseAgriculturalScienceBulletin, 2013, 29(6): 30-37. (in Chinese with English abstract)
[19] 张伟, 高国平, 程瑞春, 等. 白耙齿菌(Irpexlacteus)对园林树木枝条降解能力测定[J]. 沈阳农业大学学报, 2009, 40(5): 571-574. ZHANG W, GAO G P, CHENG R C, et al. Degradation abilities ofIrpexlacteusto garden tree branches[J].JournalofShenyangAgriculturalUniversity, 2009, 40(5): 571-574. (in Chinese with English abstract)
[20] 牛俊玲, 崔宗均, 李国学, 等. 高效纤维素分解菌复合系的筛选构建及其对秸秆的分解特性[J]. 农业环境科学学报, 2005, 24(4):795-799. NIU J L, CUI Z J, LI G X, et al. Selection and construction of composting consortia for degrading lignocellulose efficiently and its capability of straw degradation[J].JournalofAgro-EnvironmentScience, 2005, 24(4): 795-799. (in Chinese with English abstract)
(责任编辑 高 峻)
Isolation and scrcening of cellulose degrading bacterium and its decomposition characteristics of straw
QIU Xiuwen1,2, ZHOU guixiang1,2,3,*, WANG Huijuan4, YANG Lili4
(1.PoyangLakeEco-economyResearchCenter,JiujiangUniversity,Jiujiang332005,China; 2.JiujiangKeyLaboratoryofBasinManagementandEcologicalProtection,JiujiangUniversity,Jiujiang332005,China; 3.StateKeyLaboratoryofSoilandSustainableAgriculture/InstituteofSoilScience,ChineseAcademyofSciences,Nanjing210008,China; 4.SchoolofChemistryandEnvironmentalEngineering,JiujiangUniversity,Jiujiang332005,China)
A cellulose-decomposing strain, named JJU-A, was isolated from straw turnover soil. According to morphological observation, biochemical testing and rDNA-ITS gene sequence, the strain JJU-A was identified asIrpexlacteus. A 3-month experiment was carried out with JJU-A inoculated on maize straw, and the decomposition rate and the function groups of the maize straw were determined after 30, 60 and 90 d. It was shown that the decomposition rate of cellulose, hemicelluloses and soluble saccharide was higher than that of lignin, as the decomposition rates of cellulose, hemicelluloses, soluble saccharide and lignin were 53.60% 58.89% 76.03% and 28.61%, respectively. Fourier infrared spectroscopy (FTIR) was used to detect the changes of function groups of maize straw. The relative absorption intensity of 1 046, 1 245, 1 335, 1 603, 2 900 and 3 383 cm-1decreased obviously, and the percentage of C=C, C=O, —CH3, —CH decreased during the decomposition process, indicating that cellulose, hemicelluloses, saccharide and aliphatic compounds were degraded largely. In conclusion, the addition ofIrpexlaxteusJJU-A on maize straw could improve the degradation efficiency of straw and realize the resource utilization of straw.
infrared spectroscopy; decomposition process; maize straw; cellulose
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.18
2016-12-20
国家自然科学基金项目(41661068);江西省自然科学基金项目(20161BAB214150,20161BAB214152);土壤与农业可持续发展国家重点实验室开放课题(Y20160010)
邱秀文(1984—),男,江西赣州人,博士,讲师,主要从事环境微生物研究。E-mail: 334260049@qq.com
*通信作者,周桂香,E-mail: zgx20053227@163.com
S154
A
1004-1524(2017)04-0637-07
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 637-643
邱秀文,周桂香,王慧娟,等. 纤维素分解菌的分离筛选及其对秸秆的分解特性[J]. 浙江农业学报,2017,29(4): 637-643.
