伪狂犬病毒gE、gI和US9三基因缺失株的构建
2017-04-26郭万柱黄剑波姜子义许思遥邓益超毛汐语吕雯婷徐志文
樊 毅,李 碧 ,郭万柱,李 萍,黄剑波,杨 凡,姜子义,赵 军,许思遥, 邓益超,殷 玥,毛汐语,吕雯婷,徐志文,2,朱 玲,2,*
(1.四川农业大学 动物医学院,四川 温江 611130; 2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 温江 611130)
伪狂犬病毒gE、gI和US9三基因缺失株的构建
樊 毅1,李 碧1,郭万柱1,李 萍1,黄剑波1,杨 凡1,姜子义1,赵 军1,许思遥1, 邓益超1,殷 玥1,毛汐语1,吕雯婷1,徐志文1,2,朱 玲1,2,*
(1.四川农业大学 动物医学院,四川 温江 611130; 2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 温江 611130)
伪狂犬病毒(pseudorabies virus,PRV)是一种疱疹病毒,在自然界具有极广泛的宿主类群,是中国养猪业发展主要威胁之一。为了研究病毒的神经传导机制,实验采用Lipofectamine®3 000转染试剂,将PP63质粒与伪狂犬病毒Fa株基因组DNA共转染BHK-21细胞,空斑筛选得到gI/gE/US9重组缺失病毒,并命名为SA215-T。采用PCR、基因测序、Western Blot、电镜检查和生长曲线测定等方法检测重组病毒PRV-SA215-T。研究结果显示,Western Blot未发现gE基因的表达,SA215-T株的电镜形态与野毒株无明显差异,SA215-T株与亲本毒株Fa株在细胞中的生长曲线差异不明显且均达到了较高的病毒滴度。
伪狂犬;gE/gI/US9;重组病毒;基因缺失
伪狂犬病毒(pseudorabies virus,PRV),为疱疹病毒科,α疱疹病毒亚科,水痘病毒属,猪疱疹病毒Ⅰ型病毒(suid hepervirusⅠ,SHV-Ⅰ)[1-2],具备α亚型疱疹病毒典型的粒子结构[3-4]。本试验所用伪狂犬毒株属于闽A株(Fa株)伪狂犬病毒,为福建省农科院畜牧兽医研究所分离、鉴定、保存,并对其进行基因测序,是伪狂犬病毒相关研究所用标准毒株。伪狂犬病毒基因组长约150 kb,由UL(unique long),US(unique short)区和中间间隔的IRS和TRS重复序列组成。由于重组类型的不同,UL和US可顺向或反向连接,形成两种不同的异构体[5]。伪狂犬病毒能够侵染并标记神经细胞,并且满足神经传导所需要的跨突触传导、自我复制和宿主范围广的要求[6]且进行动物神经生物学实验较其他病毒安全。伪狂犬病毒神经传导具有方向性[7]:野毒株双向传导(顺行传导/逆向传导),减毒活疫苗株单向传导(逆向传导)[8]。病毒顺行传导由US9,gE和gI基因决定[9-10],它们是伪狂犬病毒轴突内顺行转运的必需基因[11]。US9基因表达产物与神经细胞内微管驱动蛋白3相结合介导病毒顺行传导过程[12]。同时,gE/gI可影响病毒顺行传导至轴突末端后的出胞运动,因此US9,gE和gI都是病毒顺行传导的必需基因。本实验采用Lipofectamine3000转染试剂,将PP63质粒与伪狂犬病毒Fa株基因组DNA共转染BHK-21细胞,空斑筛选得到gI/gE/US9重组缺失病毒,并命名为SA215-T。基因缺失重组病毒SA215-T感染宿主,可使宿主的致死时间更长,并且在突触间病毒将执行严格的逆向转运,为后续其神经传导的探索奠定基础。
1 材料与方法
1.1 试验材料
PP63质粒、伪狂犬病病毒闽A株(Fa)株、兔源PRV gE抗体、BHK-21细胞和PK-15细胞由四川农业大学动物生物技术中心提供;脂质体转染试剂LipofectamineTM3000 Reagent,购于Invitrogen公司;胎牛血清,DMEM,NEAA培养基购自Lifetechnology公司;HS-Taq酶,2×GC bufferⅡ,dNTP购自TaKaRa公司;gE/gI上下游引物由TaKaRa公司合成(表1);0.8%琼脂糖培养基自配。
1.2 实验方法
1.2.1 SA215-T构建
PP63-△gI△Us9是由郭万柱等[13]构建的伪狂犬病毒重组质粒,该质粒是在伪狂犬 Fa株BamH-7片段的基础上,通过NcoⅠ酶,敲除了完整的gE基因和部分的gI和US9基因。保留下来的部分△gI、△US9基因片段可作为伪狂犬重组的同源臂。限制性酶切位点NcoⅠ位于gI基因的第889 bp处,StuⅠ位于gI基因的第355 bp处,NcoⅠ位于US9和US2基因的第230 bp处,NcoⅠ切gI后剩余890 bp左右,NcoⅠ-StuⅠ约540 bp,因此gI剩余约350 bp作为同源重组左臂,NcoⅠ切去后US9和US2基因剩余部分约230 bp作为同源重组右臂。因此如果重组病毒构建成功,扩增的目的片段gI约为296 bp,gE基因为0 bp(图1)。
1.2.2 质粒的制备

图1 SA215-T构建图Fig.1 SA215-T schematic diagram
表1 引物序列
Table 1 Sequenses of the primers
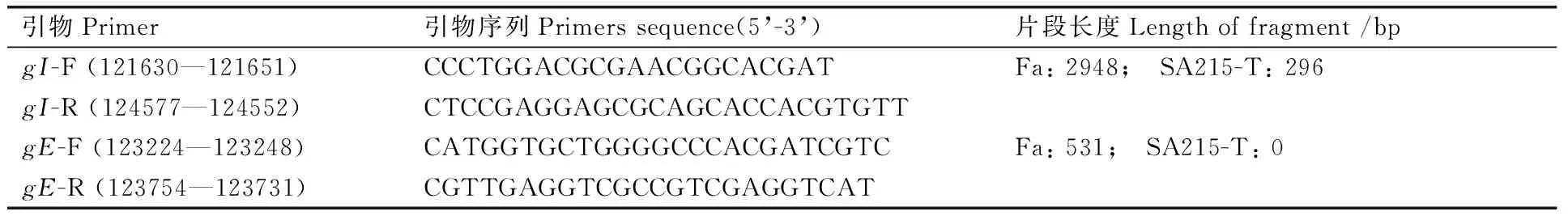
引物Primer引物序列Primerssequence(5’-3’)片段长度Lengthoffragment/bpgI-F(121630—121651)CCCTGGACGCGAACGGCACGATFa:2948; SA215-T:296gI-R(124577—124552)CTCCGAGGAGCGCAGCACCACGTGTTgE-F(123224—123248)CATGGTGCTGGGGCCCACGATCGTCFa:531; SA215-T:0gE-R(123754—123731)CGTTGAGGTCGCCGTCGAGGTCAT
采用碱裂解法抽提PP63 DNA,用35 μL Elution Buffer溶解DNA沉淀,振荡混匀存储于-20 ℃冰箱备用。
采用氯仿-饱和酚法抽提伪狂犬病毒Fa株的DNA ,用35 μL Elution Buffer溶解DNA沉淀,振荡混匀存储于-20 ℃冰箱备用。
1.2.3 PP63质粒和伪狂犬病毒Fa株DNA同源重组
参照Lipofectamine 3000脂质体转染系统说明书,取3支EP管分别标记为A,B,C。在A管中分别加入3.75 μL Lipofectamine 3000试剂和125 μL DMEM培养基并混匀。在B管中依次加入PP63质粒DNA 7 μL、PRV Fa株DNA 10 μL、P3000试剂5 μL和125 μL DMEM培养基并混匀。取A、B管中各125 μL液体加入C管中,漩涡震荡后,静置孵育5 min。将C管中的DNA-脂质体复合物加入至BHK-21细胞中,37 ℃,5% CO2温箱内孵育细胞2~4 d,至70%的细胞出现细胞病变(CPE)时,收获重组病毒。将重组病毒液进行10倍比稀释,每个稀释度取60 μL依次接种入PK-15细胞六孔盘中,在37 ℃,5% CO2恒温培养箱内吸附1 h,弃去病毒液,并用无钙镁水清洗细胞盘3次,每孔加预热的0.8%琼脂糖2 mL,置37 ℃,5% CO2恒温温箱中培养,48 h后用万分之一中性红染色,待空斑出现。显微镜下用铂耳无菌挑取空斑,加200 μL DMEM捣碎琼脂块,反复冻融3次后离心收获病毒液。将120 μL病毒液接种PK-15单层细胞中对病毒进行扩大培养,收获病毒液。
1.2.4 重组病毒PCR鉴定
扩增Fa和SA215-T 的gI/gE基因,PCR反应采用20 μL反应体系,gI/gE基因扩增程序为:95 ℃预变性4 min,94 ℃变性40 s,64.5 ℃退火1 min,72 ℃ 延伸1 min,重复35个循环,72℃终延伸10 min,12 ℃终止反应,反应完成后进行琼脂糖凝胶电泳检测和DNA测序。
1.2.5 重组病毒SA215-T gE蛋白的Western Blot印迹分析
提前24 h预备两瓶PK-15细胞,将亲本病毒Fa和重组病毒SA215-T分别接种PK-15细胞,待70%的细胞出现CPE时,反复冻融细胞3次,4 ℃,4 000g离心10 min收获病毒上清液,再将病毒上清液超离后获得蛋白质沉淀。取适量沉淀加入5×SDS-PAGE loading Buffer上样缓冲液,煮沸10 min。样品用12.5%分离胶和4%浓缩胶进行SDS-PAGE电泳,90 V电泳至溴酚蓝进入分离胶后,调电压120 V进行电泳。约4 h后当指示剂到达分离胶前沿2~3 cm处时,即可取出凝胶。取出凝胶加入配制好的考马斯亮蓝R-250染色液中染色过夜。然后用双蒸水洗掉凝胶表面多余染料,而后加入到脱色液脱色。使用三明治法按阴极夹板、海绵、二层滤纸、凝胶、硝酸纤维素膜、滤纸、海绵、阳极夹板的顺序制备夹心。然后将夹心放入Western电泳盒中,4 ℃,90 V,电泳6 h,将凝胶中的蛋白质转移到硝酸纤维素膜上。将硝酸纤维素膜甲醇固定后置3%牛血清白蛋白(BSA)中室温下封闭1 h。PBS-T洗涤3次后加PRV gE抗体,37 ℃湿盒作用1 h。继续用PBS-T洗涤3次,加入酶标SPA,37 ℃湿盒作用1 h。PBS-T洗涤3次后加入新鲜配制的4-氯-1-萘酚底物溶液,待条带特异性显色后加入冰乙酸终止反应。
1.2.6 重组病毒形态学鉴定
PRV Fa株和PRV SA215-T株以感染复数(multiplicity of infection,MOI)为1接种PK15单层细胞,感染后48 h,细胞CPE约为70%时收集细胞,4 ℃,4 000g低速离心8 min成小球,弃上清后取细胞沉淀,用含有2.5%的戊二醛固定1 h,低熔点琼脂糖包埋。在乙醇中逐级脱水,在氧化丙烯中透明。包埋于812环氧树脂中,59 ℃聚合作用4 d。超薄切片并用乙酸双氧铀染色后,使用H600透射电镜照相。
1.2.7 病毒生长曲线测定
取两个长宽约为6 cm × 10 cm的细胞瓶,各接种6 mL的PK-15消化细胞,细胞浓度约为2×106个·mL-1,在37 ℃,5% CO2的恒温培养箱内培养过夜,待细胞形成致密单层时各按MOI数值约为0.1的比例接种伪狂犬病毒Fa和重组病毒SA215-T。分别于6,12,24,36和48 h时吸取病毒上清液通过病毒空斑实验测定计算出病毒滴度。
2 结果与分析
2.1 PRV基因缺失病毒SA215-T构建和 PCR鉴定
采用Lipofectamine 3000转染试剂,将PP63质粒与伪狂犬病毒Fa株基因组DNA共转染BHK-21细胞,经过空斑筛选,获得了PRVgI/gE/US9重组缺失病毒,命名为SA215-T。
使用PK-15单层细胞对重组病毒空斑进行扩大培养后,收获病毒液。提取病毒DNA,通过PCR方法鉴定收获的病毒液gE/gI/US9是否缺失,结果如图2所示,重组病毒SA215-TgI引物扩增的片段为296 bp,gE基因无电泳条带,与预期的结果一致,表明SA215-T的gE和gI基因有效缺失。
2.2 重组病毒SA215-T gE蛋白免疫印迹
PRV重组病毒SA215-T及其亲本毒Fa株Western Blot检测结果见图3,结果显示重组病毒SA215-T株并不能与gE抗体显色,而对照组亲本株Fa株可见到特异性的染色条带,蛋白大小与预期一致。
2.3 重组病毒SA215-T电镜检测
对重组病毒SA215-T与亲本毒伪狂犬Fa株分别进行电镜检测,发现两者存在相似的病毒粒子形态,均呈现伪狂犬病毒的典型结构(图4)。
2.4 重组病毒SA215-T生长曲线测定
通过对重组病毒SA215-T生长曲线的测定,发现6 h取样时SA215-T和Fa的病毒滴度水平(pfu·mL-1)均保持在6左右,6 h后Fa病毒的增

M1,DL 2000;M2,250 bp DNA Ladder Marker;1,SA215-T gE基因扩增;2,Fa gE基因扩增;3,SA215-T gI基因扩增;4,Fa gI基因扩增。Lanes: M1, Marker DL2000; M2, 250 bp DNA Ladder Marker; 1, Samples of SA215-T amplified by gE-F/R primers; 2, Fa amplified by gE-F/R primers; 3, SA215-T amplified by gI-F/R primers; 4, Fa amplified by gI-F/R primers.图2 重组病毒SA215-T gE/gI基因的PCR鉴定Fig.2 Identification of Fa and recombinat PRV by PCR amplication of gE/gI genes

M,蛋白质marker;Fa,Fa株gE蛋白(约62.8 ku);SA215-T,SA215-T株gE蛋白M, Marker;Fa, gE protein in Fa;SA215-T, gE protein in SA215-T图3 Western Blot免疫印迹图Fig.3 Western Blotting of gE protein
长速度略微快于SA215-T的速度,并且两者在12 h时都开始进入病毒生长的平稳期。24 h到48 h时两株病毒滴度无明显差异,并且都保持在8.5左右的较高滴度水平(pfu·mL-1)(图5)。病毒空斑检测方法见图6,箭头所指处为病毒在PK-15细胞中形成的空斑。
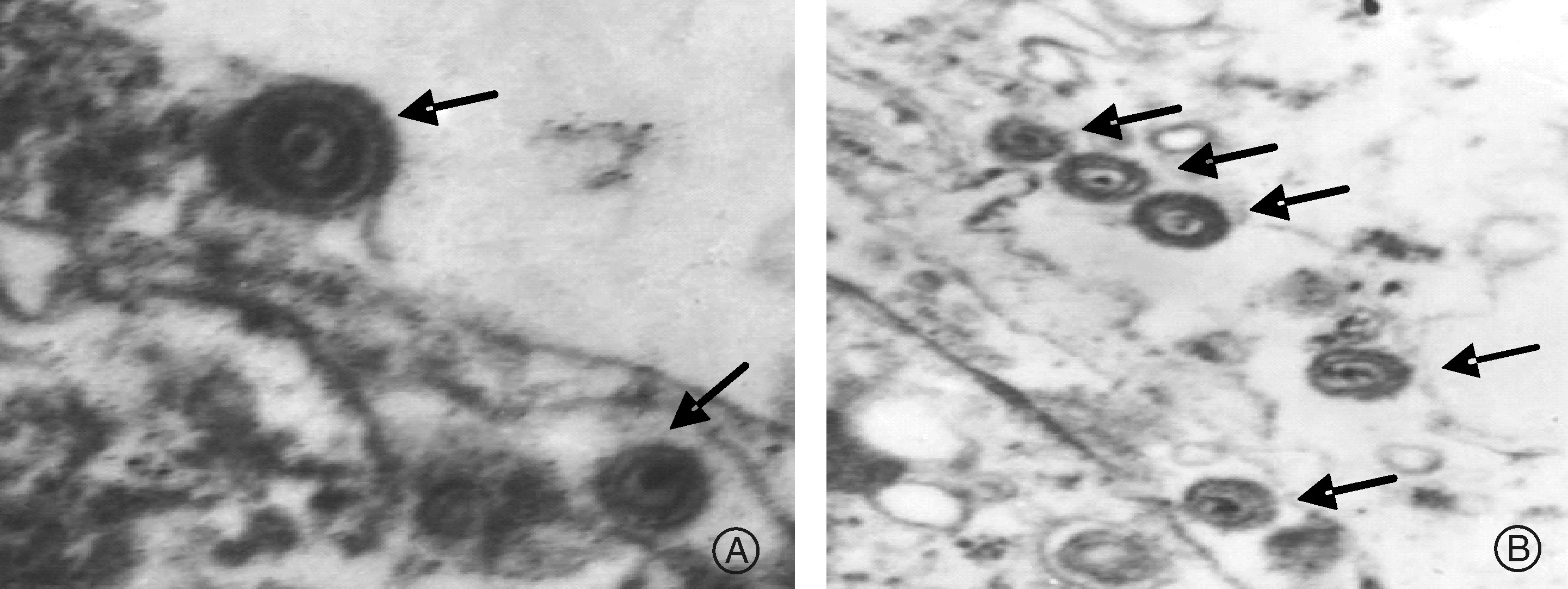
A,SA215-T细胞电镜图(×40 000);B,Fa细胞电镜图(×30 000);黑色箭头所指是病毒颗粒A:Electron microscope of SA215-T (×40 000); B: Electron microscope of Fa (×30 000); Two types of virus particles are indicated by the black arrow图4 PK-15细胞感染伪狂犬SA215-T和Fa细胞电镜图Fig.4 Electron microscope analysis of PK-15 cells infected by PRV SA215-T and Fa

图5 SA215-T和Fa在PK-15细胞中生长曲线图Fig.5 Growth curve analysis of the recombinant SA215-T
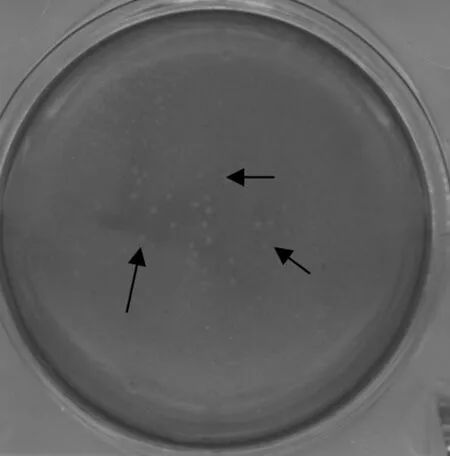
箭头所指处为病毒空斑Arrows indicate to viral plaques图6 重组病毒空斑试验Fig.6 Plaque-formation assay for selecting recombinant virus
3 讨论
目前,伪狂犬病毒弱毒株主要是通过自然致弱和人工改造完成。其中自然致弱毒多数是由鸡胚传代获得,如Bartha株。人工致弱毒又以重组改造为主,伪狂犬病毒具有复杂而庞大的基因组,其基因难以通过酶切、定点突变等方式敲除,而同源重组是解决这个问题的有效途径。本实验所用PP63-△gI△US9是由郭万柱,王琴构建的伪狂犬病毒重组质粒[13],该质粒是在伪狂犬Fa株BamHⅠ-7 片段的基础上,通过NcoⅠ酶,敲除了完整的gE基因和部分的gI和US9基因。保留下来的部分△gI、△US9基因片段可作为伪狂犬病毒基因重组的同源臂。有研究表明,脂质体法有比磷酸钙法更高的DNA转染效率[14],因此本实验采用Lipofectamine 3000脂质体转染体系将PP63质粒和伪狂犬Fa株基因组共转染入BHK-21细胞中。但是鉴于重组技术的效率问题,体系中除含有gI/gE/US9缺失的重组病毒外,还含有大量的伪狂犬野毒和部分的PP63质粒,因此还需要对重组病毒进一步进行纯化。本实验采用倍比稀释法,将重组病毒液进行10倍倍比稀释,然后将最高稀释倍数的病毒接种到盛有PK-15细胞的六孔盘中,经过反复10次的空斑筛选和PCR鉴定,最终获得了gI/gE/US9成功缺失的重组病毒SA215-T。
本研究还对重组病毒基因缺失位点进行了测序,基因测序结果准确描述了SA215-TgI/gE/US9三基因缺失的位点。为了更进一步验证SA215-T的基因缺失情况,本实验分别对SA215-T以及亲本毒Fa的gE蛋白进行了Western Blot免疫印迹检验,结果显示SA215-T并不能与gE抗体发生反应,说明SA215-T囊膜已不具备gE蛋白结构。成熟的伪狂犬病毒结构包含了核酸,衣壳,间质和囊膜4个部分,通过电镜检查可观察到SA215-T和Fa两者都保留着疱疹病毒的超微形态,说明gI/gE/US9三基因的缺失并未对病毒的基本结构产生显著的影响。
本实验测定了SA215-T与亲本株Fa在PK15细胞上的体外生长曲线,结果表明两者在细胞上的生长特性没有明显差异。说明gE基因是伪狂犬病毒复制的非必需基因,虽然gE缺失后会影响病毒在细胞间的扩散作用,但是gC对细胞的黏附作用能弥补gE缺失后病毒扩散能力的不足,因此缺失株仍能保证较高的感染滴度。三基因缺失病毒SA215-T滴度随时间的延长增长速率会略低于亲本毒Fa,但是12 h后两种病毒都可以达到较高的滴度,表明gE基因缺失在一定程度上影响了病毒在细胞上的生长速率,但是累积的病毒数量却未发生明显变化。这为后续SA215-T小鼠体内神经侵染实验奠定了良好的基础。
[1] 刘中原,刘石,徐卫松,等. 利用PCR技术对猪伪狂犬疫苗含毒量的评价 [J]. 浙江农业科学,2013 (4):475-477. LIU Z Y, LIU S, XU W S, et al. Using PCR technology to the pig pseudo rabies poisonous content evaluation. [J].JournalofZhejiangAgriculturalSciences, 2013 (4):475-477. (in Chinese)
[2] 邵定勇,黄红亮,唐兆新,等. 猪伪狂犬病病毒TK/gE双基因缺失株PRV/TK-/gE-的构建及其生物学特性[J]. 中国兽医科学,2013, 43(11):1127-1132. ZHAO D Y, HUANG H L, TANG Z X, et al. Construction and biological characterization ofTK/gE-null recombinant pseudorabies virus [J].ChineseVeterinaryScience, 2013, 43(11):1127-1132. (in Chinese with English abstract)
[3] WANG Y, QIAO S, LI X, et al. Molecular epidemiology of outbreak-associated pseudorabies virus (PRV) strains in central China.[J].VirusGenes, 2015, 50(3):401-9.
[4] 耿文学,唐波,华涛,等. 免疫增强剂对猪伪狂犬灭活疫苗的免疫增强作用 [J]. 浙江农业学报,2016,28(11):1828-1833. GENG W X, TANG B, HUA J B, et al. Improved immune efficiency of inactivated vaccine of pseudorabies virus by immunopotentiator [J].ActaAgriculturaeZhejiangensis, 2016, 28(11):1828-1833. (in Chinese with English abstract)
[5] 范克伟,戴爱玲,李晓华,等. 猪源伪狂犬病病毒福建龙岩分离株的鉴定及其TK基因和gE基因的分子特征 [J]. 中国兽医科学,2015,45(10):1021-1030. FAN K W, DAI A L, LI X H, et al. Identification of pseudorabies virus isolated from swine in Longyan of Fujian province and molecular characteristics ofTKandgEgenes of the isolate [J].ChineseVeterinaryScience, 2015, 45(10):1021-1030. (in Chinese with English abstract)
[6] KLUPP B G, HENGARTNER C J, METTENLEITER T C, et al. Complete, annotated sequence of the pseudorabies virus genome [J].JournalofVirology, 2004, 78(1):424-440.
[7] BEIER K T, SAUNDERS A, OLDENBURG I A, et al. Anterograde or retrograde transsynaptic labeling of CNS neurons with vesicular stomatitis virus vectors [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2011. 108(37):15414-15419.
[8] TONG W, LIU F, ZHENG H, et al. Emergence of a Pseudorabies virus variant with increased virulence to piglets [J].VeterinaryMicrobiology, 2015, 181(3/4):236-240.
[9] BRITTLE E E, REYNOLDS A E, ENQUIST L W. Two modes of pseudorabies virus neuroinvasion and lethality in mice [J].JournalofVirology, 2004, 78(23):12951-12963.
[10] CONG X, LEI J L, XIA S L, et al. Pathogenicity and immunogenicity of a gE/gI/TK gene-deleted pseudorabies virus variant in susceptible animals [J].VeterinaryMicrobiology, 2016, 182:170-177.
[11] GU Z, DONG J, WANG J, et al. A novel inactivated gE/gI deleted pseudorabies virus (PRV) vaccine completely protects pigs from an emerged variant PRV challenge [J].VirusResearch, 2015, 195:57-63.
[12] LYMAN M G, FEIERBACH B, CURANOVIC D, et al. Pseudorabies virus Us9 directs axonal sorting of viral capsids [J].JournalofVirology, 2007, 81(20):11363-11371.
[13] 张银梅, 郭万柱,汪铭书,等. 伪狂犬病病毒Fa株gp63(gⅠ)基因转移载体质粒的构建 [J]. 畜牧兽医学报,2001,32(4):338-344. ZHANG Y M, GUO W Z, WANG M S, et al. Construction of transfer vector plasmid of pseudorabies virus-Fa strain [J].ACTAVeterinariaetZootechnicaSinica, 2001, 32(4):338-344. (in Chinese with English abstract)
[14] PAßVOGEL L, KLUPP B G, GRANZOW H, et al. Functional characterization of nuclear trafficking signals in pseudorabies virus pUL31 [J].JournalofVirology, 2015, 89(4):2002-2012.
(责任编辑 卢福庄)
ConstructinggE,gIandUS9 gene deletion strain of pseudorabies virus
FAN Yi1, LI Bi1, GUO Wanzhu1, LI Ping1,HUANG Jianbo1, YANG Fan1, JIANG Ziyi1, ZHAO Jun1, XU Siyao1,DENG Yichao1, YIN Yue1, MAO Xiyu1, LYU Wenting1, XU Zhiwen1,2, ZHU Ling1,2,*
(1.VeterinaryMedicineCollegeofSichuanAgriculturalUniversity,Chengdu611130,China; 2.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611130,China)
Pseudorabies virus (PRV), a member of Herpes virus has an extremely broad range in nature and threatens the pig-industry development in our country. To explore the mechanism of nerve conduction of PRV, a virus mutant with a deletion ingE,gIandUS9 genes was constructed. Plasmid of PP63 and pseudorabies virus Fa strain genomic DNA were co-transfected into BHK-21 cells by using Lipofectamine 3000 transfection reagent, and a recombinant virus with the deletion ofgI/gE/US9 , named SA215-T, was screened and purified by plaque assay. PCR, gene sequencing. Western Blot, electron microscope and growth curve were used for identification of the deletion of genes, and features of the recombinant. The results showed that SA215-T was with effective deletion ofgIandgEgene by PCR,and was absent in the expression ofgEgene by Western Blot. There were no obvious differences in the morphology and growth curve of the recombinant virus as compared to its parental virus, they both achieved a high viral titer in cells.
pseudorabies virus;gI/gE/US9 gene; recombinant virus; gene deletion
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.04.04
2016-11-13
国家“十二五”科技支撑计划项目(2015BAD12B04);四川省科技支撑计划(2014NZ0043,2017NZ0038);长江学者与创新团队发展计划(IRT13083)
樊毅(1990—),男,四川资阳人,硕士研究生,研究方向为动物传染病病原分子生物学。E-mail: 348840733@qq.com
*通信作者,朱玲,E-mail: abtcxzw@126.com
S852.65;[Q812]
A
1004-1524(2017)04-0542-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(4): 542-547
樊毅,李碧,郭万柱,等. 伪狂犬病毒gE、gI和US9三基因缺失株的构建[J].浙江农业学报,2017,29(4): 542-547.
