肉桂醛体外抑制奶牛乳房炎主要致病菌的研究
2017-04-26程浩周梦洁胡飞叶葱葱彭本英张佳兰
程浩,周梦洁,胡飞,叶葱葱,彭本英,张佳兰
(长江大学动物科学学院,湖北荆州,434025)
肉桂醛体外抑制奶牛乳房炎主要致病菌的研究
程浩,周梦洁,胡飞,叶葱葱,彭本英,张佳兰*
(长江大学动物科学学院,湖北荆州,434025)
研究天然化合物肉桂醛对奶牛乳房炎主要致病菌——大肠杆菌、金黄色葡萄球菌和链球菌的抑菌效果。采用试管二倍稀释法测得肉桂醛对奶牛乳房炎主要致病菌金黄色葡萄球菌和标准金黄色葡萄球菌的体外最小抑菌浓度(MIC)分别为3.2 mmol/L和1.6 mmol/L;链球菌1.6 mmol/L;大肠杆菌和标准大肠杆菌6.4 mmol/L和3.2 mmol/L,且能完全抑制这三种菌的生长。肉桂醛的最小杀菌浓度(MBC)金黄色葡萄球菌和标准金黄色葡萄球菌分别为25.6 mmol/L和12.8 mmol/L;链球菌12.8 mmol/L;大肠杆菌和标准大肠杆菌25.6 mmol/L和12.8 mmol/L;在7 h内能有效杀灭这三种菌,肉桂醛对奶牛乳房炎主要致病菌有抑菌和杀菌能力,是一种潜在的奶牛乳房炎的临床治疗药物。
肉桂醛;乳房炎;抑菌;杀灭
目前奶牛生产中主要采用抗生素药物防治奶牛乳房炎,容易导致牛奶中抗生素残留及细菌产生耐药性,发展高效、无毒、无残留、安全的兽药成为防治奶牛乳房炎的研究热点。肉桂醛是肉桂科植物提取物的主要生物有效物质,为单一有机化合物。肉桂醛液体无色或淡黄色,有强烈的香气,难与水混匀,易与醇、醚混匀,易挥发,易氧化,对酸、碱不稳定。肉桂醛能较好抑制各种菌生长,并能杀灭各种细菌,同时也是抗真菌的活性物质[1-2]。有研究发现肉桂醛能特异性破坏细菌细胞壁葡聚糖和几丁质的合成,从而损伤细胞壁,进入细胞内,进而损伤细胞内的微结构而消灭细菌[3]。肉桂醛对大肠杆菌产生氧化胁迫,使过量的活性氧积累在大肠杆菌细胞内,升高SOD 活力,进一步氧化损伤细胞膜脂质,从而损伤和破坏细胞结构,最终导致大肠杆菌死亡[4]。因为肉桂醛能有效抑制细菌繁殖、防止微生物生长,且毒副作用低[5-6],其在医药、化工、食品和饲料等行业被广泛应用。肉桂醛作为饲料添加剂具有促进畜禽生长发育、促进饲料在动物体内的利用效率(增加营养素在畜禽体内的沉积量)、预防动物感染性疾病、抑制饲料中霉菌繁殖等作用。在养牛业中,肉桂醛作为瘤胃改良剂添加于饲料中能提高养牛效益[7-8]。本研究结合肉桂醛的抑菌、低毒及应用于牛饲料添加剂的特点,研究天然化合物肉桂醛对奶牛乳房炎主要病原菌的体外抑菌作用,以期为肉桂醛防治奶牛乳房炎提供依据。
1 材料与方法
1.1 试验菌株及试剂 试验所用的金黄色葡萄球菌(S.aureus)、大肠杆菌(E.coli)和无乳链球菌(S.agalactiae)均为本实验从鲜乳样中分离纯化并鉴定得到。同时购买标准菌种大肠杆菌(ATCC 43890)和金黄色葡萄球菌(ATCC 29213)做对照。营养肉汤培养基和营养琼脂由环凯微生物科技(生产批号分别为201510243、201508102)提供。无水乙醇为分析纯,98%的肉桂醛溶液由江西雪松天然药用油有限公司(生产批号150612)提供。
1.2 菌液与药液的配制 从液氮中取出40%甘油保护的各个菌株贮备菌液100 μL混匀于各自相应的培养基,于37 ℃,200 r/min的恒温摇床扩繁至快速生长阶段。然后在各自对应的固体、液体培养基中连续划线接种、扩繁两次来保证菌株旺盛的生命力(使用固体培养基37 ℃,0.5~1 d)。
无菌条件下分别挑取各个菌株的单菌落并在菌株对应的液体培养基中于37 ℃,200 r/min的恒温摇床扩繁至快速生长阶段(722E分光光度计测定OD600 nm=0.3,上海光谱仪器有限公司)[9],后用倍比稀释法在显微镜下计数,用各个菌株对应的液体培养基稀释菌液为1×108CFU/mL,冷藏用作试验。98%肉桂醛用75%酒精1∶9稀释,使肉桂醛浓度为741.5 mmol/L,-20 ℃保存备用。
1.3 试验方法
1.3.1 肉桂醛对奶牛乳房炎主要致病菌的抑制作用
1.3.1.1 肉桂醛对奶牛乳房炎主要致病菌的最小抑菌浓度(MIC) 采用各个菌株对应的液体培养基稀释法测定肉桂醛抑制奶牛乳房炎主要致病菌的最小浓度。将每13个灭菌试管排一列,每一列试管按表1加各个菌株对应的液体培养基、肉桂醛及稀释菌液[9-10],使细菌为5×105CFU/mL,恒温(37 ℃)培养0.5~1 d。光下肉眼观察试管中液体,以试管中液体透明、不分层和培养前一样的最小肉桂醛浓度作为其MIC,且重复三次MIC相同。
1.3.1.2 肉桂醛对奶牛乳房炎主要致病菌生长曲线的影响 无菌条件下从各个菌株固体培养基分别挑单菌落置于装有 3 mL 各自适宜液体培养基的试管内,并置于生化培养箱(LRH-250A,广东省医疗器械厂)中(37 ℃,12 h)静置培养。然后无菌条件下将 3 mL 的过夜培养的液体培养基菌液转接至 97 mL相应的液体培养基中,并置于全温震荡器中37 ℃、200 r/min 培养至快速生长阶段(OD600 nm=0.3,722E分光光度计,上海光谱仪器有限公司)。将上述将制备的菌液分别分装于6个 50 mL 的三角锥形瓶中,每个锥形瓶 15 mL,其中 5 个三角锥形瓶中肉桂醛终浓度分别为1/16 MIC、1/8 MIC、1/4 MIC、1/2 MIC和1 MIC;一个乙醇浓度为0.05%。将这6个 50 mL 三角锥形瓶置于全温震荡器中 37 ℃、200 r/min 培养,分别于 0、1、2、3、4、6、8、10 、12 h 测量一次OD600 nm(722E分光光度计,上海光谱仪器有限公司)值,然后绘制 OD值-时间曲线。
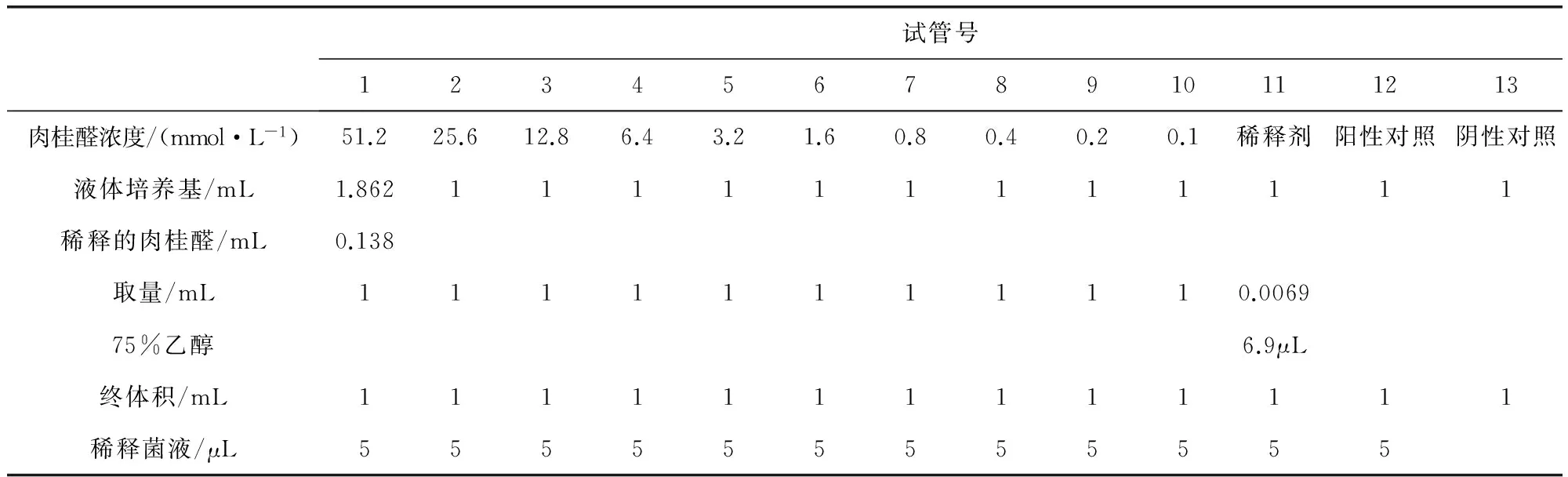
表1 肉桂醛对奶牛乳房炎主要致病菌的最小抑菌浓度
1.3.2 肉桂醛对奶牛乳房炎主要致病菌的杀灭作用
1.3.2.1 肉桂醛对奶牛乳房炎主要致病菌的最小杀灭浓度 类似于前面的处理,每7个灭菌试管排一列,试管的处理见表2,恒温(37 ℃)培养0.5~1 d后,光下肉眼观察试管中液体。把肉眼观察全部透明、不分层试管的液体通过接种环取液划线各个菌株对应的固体培养平板上,恒温(37 ℃)培养2 d。查看细菌生长情况,以菌落数不大于5个时的肉桂醛浓度为最小杀菌浓度(MBC)。
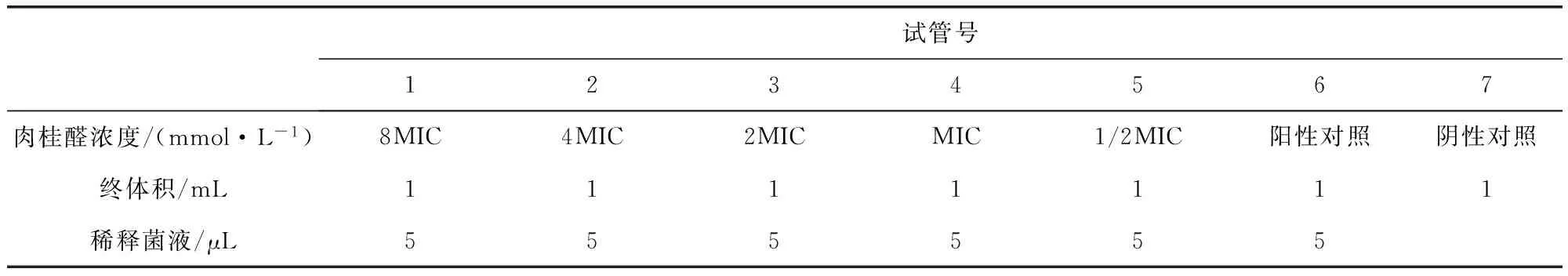
表2 肉桂醛对奶牛乳房炎主要致病菌的最小杀灭浓度
1.3.2.2 肉桂醛对奶牛乳房炎主要致病菌杀菌曲线的影响 菌种准备、扩大培养、分装及培养同上面。其中5个三角锥形瓶中肉桂醛终浓度分别为1/8 MBC、1/4 MBC、1/2 MBC、MBC和2 MBC;一个乙醇浓度为0.05%。在0、1、3、5、7、9、12、18 h 取样并稀释,用平板法计其活菌数,绘出细菌数-时间曲线。
2 结果与分析
2.1 肉桂醛对奶牛乳房炎主要致病菌的抑制作用 肉桂醛对奶牛乳房炎主要致病菌活性均有抑制,其中金黄色葡萄球菌和标准金黄色葡萄球菌的MIC为3.2 mmol/L和1.6 mmol/L;链球菌的MIC为1.6 mmol/L;大肠杆菌和标准大肠杆菌的MIC分别为6.4 mmol/L和3.2 mmol/L。稀释剂对照组加入最大剂量的稀释剂,试验结果表明,稀释剂不影响奶牛乳房炎主要致病菌的生长。
肉桂醛对奶牛乳房炎主要致病菌生长曲线的影响见图1、图2和图3。如图所示,1/16 MIC、1/8 MIC浓度的肉桂醛对奶牛乳房炎主要致病菌的生长几乎没有影响;1/4 MIC、1/2 MIC浓度的肉桂醛使奶牛乳房炎主要致病菌的生长曲线滞后,而MIC浓度的肉桂醛能有效抑制大肠杆菌和链球菌的生长,对金黄色葡萄球菌有一定的抑制作用。

图1 肉桂醛浓度对大肠杆菌生长曲线的影响
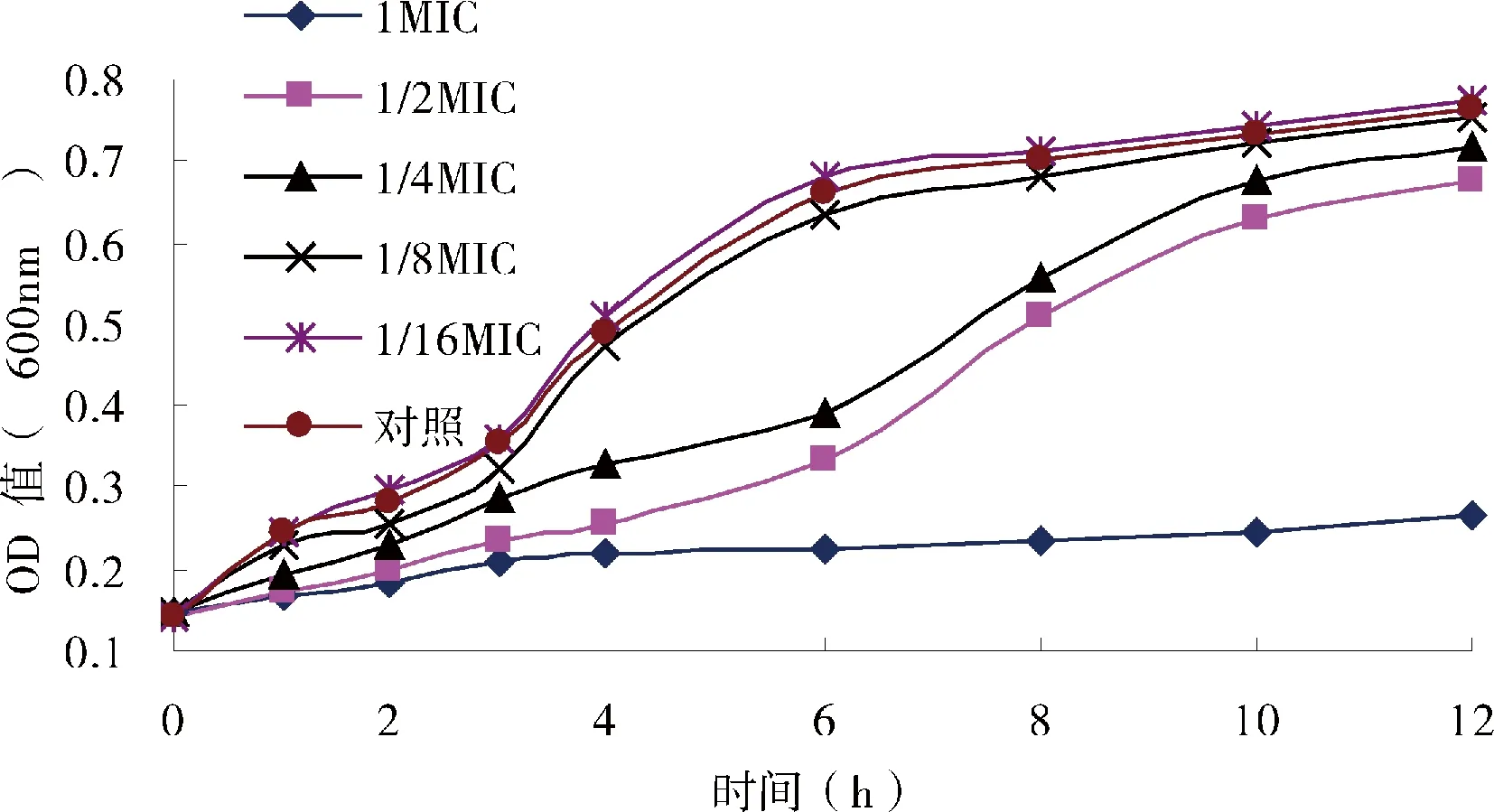
图2 肉桂醛浓度对金黄色葡萄球菌生长曲线的影响
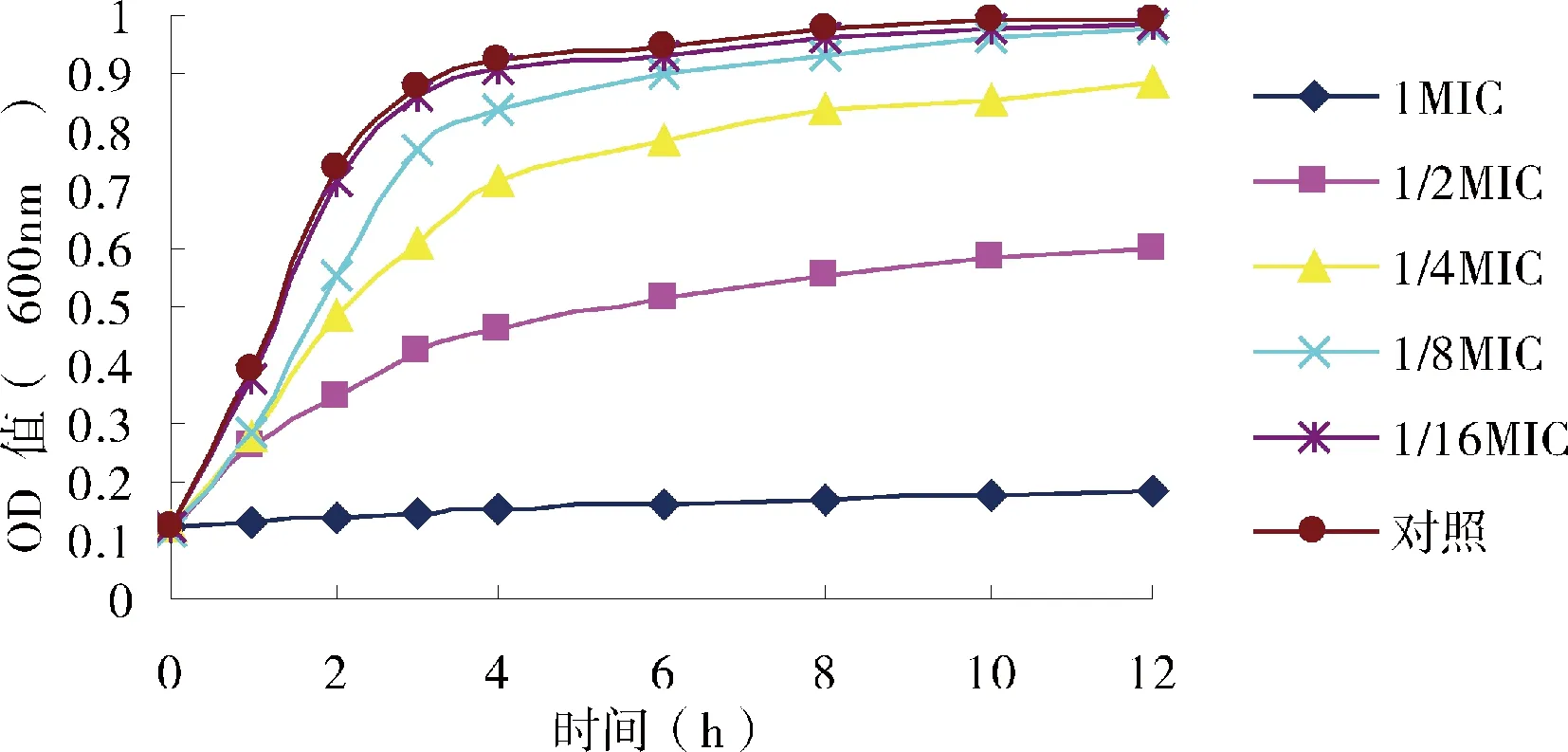
图3 肉桂醛浓度对无乳链球菌生长曲线的影响
2.2 肉桂醛对奶牛乳房炎主要致病菌的杀灭作用 肉桂醛对奶牛乳房炎主要致病菌均有杀灭作用,其中金黄色葡萄球菌和标准金黄色葡萄球菌的MBC分别为25.6 mmol/L和12.8 mmol/L;链球菌的MBC为12.8 mmol/L;大肠杆菌和标准大肠杆菌的MBC为25.6 mmol/L和12.8 mmol/L。
对照组添加0.05%的乙醇,7 h时,大肠杆菌、金黄色葡萄球菌和链球菌的细菌数约是原来的10倍,因此,稀释剂乙醇对细菌没有杀灭作用。肉桂醛对奶牛乳房炎主要致病菌的杀灭效果和趋势相似(图4、图5和图6)。1/8 MBC浓度的肉桂醛仅能抑制奶牛乳房炎主要致病菌的生长;1/4 MBC浓度的肉桂醛杀菌作用较弱; 1/2 MBC浓度的肉桂醛18 h内不能完全杀灭细菌;当肉桂醛的浓度为1 MBC和2 MBC时,7 h内能杀灭这3种奶牛乳房炎主要致病菌,且2 MBC的杀菌效果强于1 MBC,对大肠杆菌和金黄色葡萄球菌的杀灭效果优于无乳链球菌。
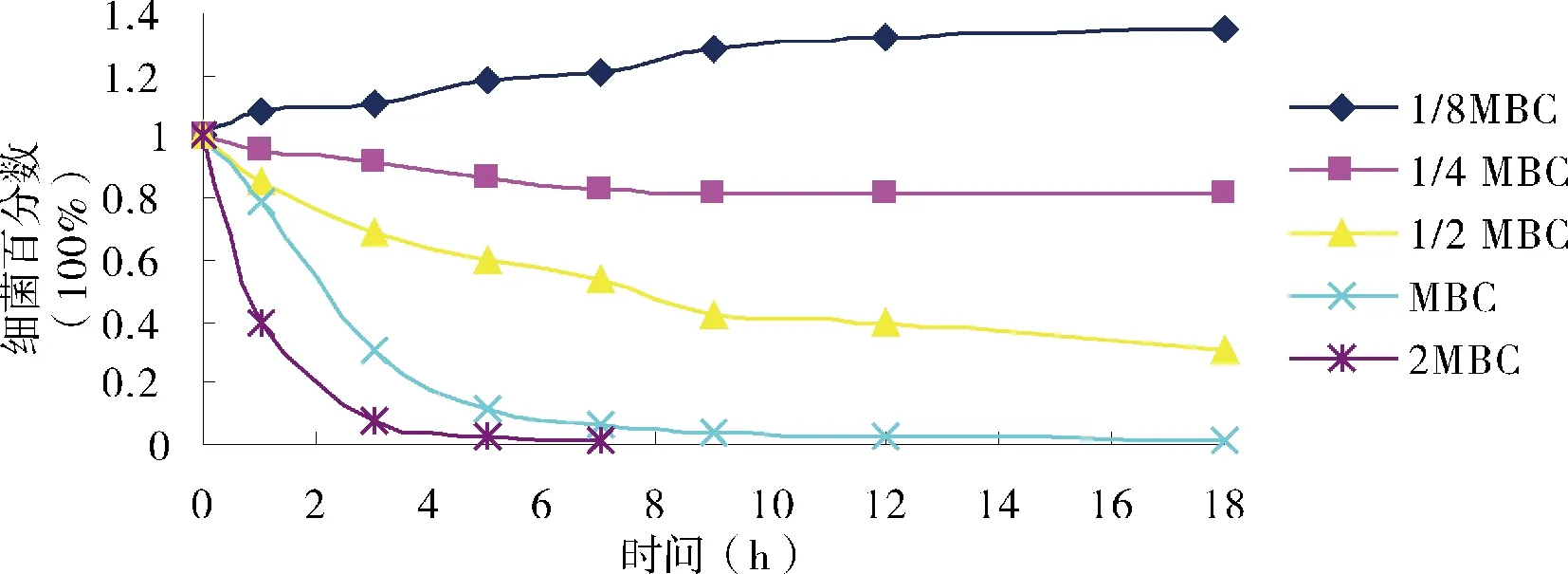
图4 肉桂醛对大肠杆菌的杀菌曲线
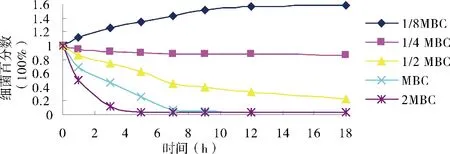
图5 肉桂醛对金黄色葡萄球菌的杀菌曲线
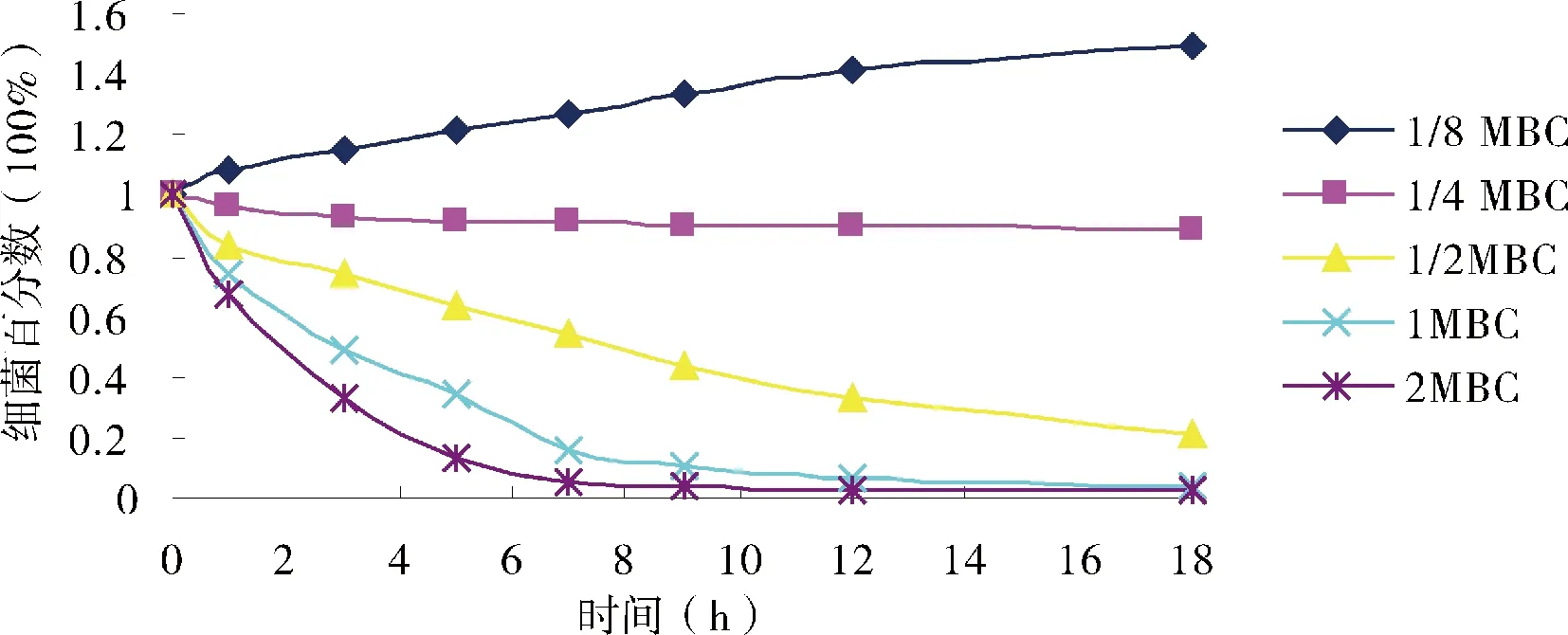
图6 肉桂醛对无乳链球菌的杀菌曲线
3 讨论与小结
肉桂醛具有挥发性,易氧化,将肉桂醛与其他物质结合,保存容易并能增强其抑菌效果,本研究用75%的乙醇作稀释剂,效果优于无水乙醇和二甲基亚砜(DMSO)。王新伟等研究结果表明:在植物提取物肉桂油、牛至油、柠檬醛和香芹酚中,肉桂醛的抑菌效果最好,尤其是对金黄色葡萄菌的抑菌效果显著优于大肠杆菌[11]。本研究的结果与其一致,并且肉桂醛对链球菌的抑菌作用最强。关于肉桂醛抑菌的作用机制,一种说法认为肉桂醛能破坏细菌或真菌的结构和功能的完整性,从而杀灭细菌[11-15]。另一种说法认为,肉桂醛通过进入细胞内干扰胞内代谢以及影响基因的正常表达,发挥其抑菌作用[16-19]。
张赟彬等研究表明肉桂醛对大肠杆菌和金黄色葡萄球菌的MIC和MBC,分别为0.25 μl/mL和0.55 μl/mL[20],而肉桂油对这两种菌的MIC为1.0 mg/mL,对大肠杆菌和金黄色葡萄球菌的MBC分别为4.0 mg /mL和2.0 mg/mL[21],本研究中肉桂醛对大肠杆菌的MIC和MBC分别为6.4 mmol/L和25.6 mmol/L,对金黄色葡萄球菌的MIC和MBC分别为3.2 mmol/L和25.6 mmol/L。出现这种差异,一方面与肉桂醛的纯度有关,也可能与所分离的细菌的耐药性有关。依据细菌产生耐药性的标准(MBC≥32 MIC)[9],说明奶牛乳房炎主要致病菌对肉桂醛尚未产生耐药性。
本试验结果表明肉桂醛对奶牛乳房炎主要致病菌有较强的抑菌和杀菌作用,且无耐药性,说明肉桂醛是一种潜在的奶牛乳房炎的临床治疗药物。肉桂醛是否具有较好的临床治疗效果还有待进一步的研究。
[1] Kim H O, Park S W, Park H D. Inactivation ofEscherichiacoliO157:H7 by cinnamicaldehyde purified from cinnamomum cassia shoot [J]. Food Microbiology, 2004, 21(1): 105-110.[2] 李京晶,籍保平,周峰. 丁香和肉桂挥发油的提取、主要成分测定及其抗菌活性研究[J]. 食品科学,2006,27(8): 64-68.
[3] Xing F, Hua H, Selvaraj J N,etal. Growth inhibition and morphological alterations of Fusarium verticillioides by cinnamon oil and cinnamaldehyde [J]. Food Control, 2014, 46: 343-350.
[4] Shen S, Zhang T, Yuan Y,etal. Effects of cinnamaldehyde onEscherichiacoliandStaphylococcusaureusmembrane[J]. Food Control, 2015, 47: 196-202.
[5] Sherikh S, Rimple B, Neelofar K,etal. Cinnamicaldehydes affect hydrolytic enzyme secretion and morphogenesis in oral Candida isolates [J]. Microb Pathogenesis, 2010, 52(5): 251-258.
[6] Michiels J, Missotten J, Fremaut D,etal.Invitrodose-response of carvacrol, thymol, eugenol and trans-cinnamaldehyde and interaction of combinations for the antimicrobial activity against the pig gut flora[J]. Livestock Science,2007,109(1/3): 157-160.
[7] Ishlak A, Günalb M, AbuGhazaleha A A. The effects of cinnamaldehyde, monensin and quebracho condensed tannin on rumen fermentation, biohydrogenation and bacteria in continuous culture system[J]. Anim Feed Sci Technol, 2015, 207: 31-40.
[8] Khorrami B, Vakili A R, Danesh Mesgaran M,etal. Thyme and cinnamon essential oils: Potential alternatives for monensin as a rumen modifier in beef production systems [J]. Anim Feed Sci Technol, 2015, 200: 8-16.
[9] 吴金梅. 甘草总黄酮抗金黄色葡萄球菌作用及其治疗奶牛乳房炎的应用研究[D]. 沈阳: 吉林大学,2012.
[10]李诗莹. 甘草总黄酮混悬乳房注射剂对奶牛乳房炎治疗效果研究[D]. 大庆: 黑龙江八一农垦大学,2015.
[11]王新伟,刘欢,魏静,等. 牛至油、香芹酚、柠檬醛和肉桂醛抑菌作用研究[J]. 食品工业,2010,5: 13-15.
[12]谢小梅,张文平,付颖瑗,等. 肉桂醛与柠檬醛抗曲霉菌作用机制的研究[J]. 中草药,2004,35(4):430-432.
[13]张文平,傅颖媛,谢小梅. 肉桂醛抗曲霉菌作用机制研究[J]. 江西医学院学报,2003,43(6): 10-13.
[14]谢小梅,龙凯,方建茹,等. 肉桂醛、柠檬醛抑制黄曲霉生长机制研究[J]. 中国公共卫生,2007,23(3): 301-302.
[15]汪琨,徐峥,汪倩雯,等. 肉桂醛特异性抑制酵母细胞壁合成的作用机理[J]. 食品与发酵工业,2012,38(3): 68-71.
[16]王帆,杨静东,王春梅,等. 肉桂醛对大肠杆菌和绿脓杆菌的作用机制[J]. 江苏农业学报,2011,27(4): 888-892.[17]方建茹,谢小梅,牛锋. 肉桂醛对烟曲霉细胞壁合成关键基因FKS表达的影响[J]. 现代药物与临床,2011,65(5): 389-392.
[18]Becerril R, Gómez-Lus R, Goni P,etal. Combination of analytical and microbiological techniques to study the antimicrobial activity of a new active food packaging containing cinnamon or oregano againstE.coliandS.aureus[J]. Analytical and Bioanalytical Chemistry, 2007, 388(5): 1003-1011.
[19]Kwon J A, Yu C B, Park H D. Bacteriocidal effects and inhibition of cell separation of cinnamicaldehyde on Bacillus cereus [J]. Letters in Applied Microbiology, 2003, 37(1): 61-65.
[20]Gill A O, Holley R A. Mechanisms of bactericidal action of cinnamaldehyde against Listeria monocytogenes and of eugenol against L. monocytogenes and Lactobacillus sakei [J]. Applied and Environmental Microbiology, 2004, 70(10): 5750-5755.
[21]张赟彬,刘笑宇,姜萍萍,等. 肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J]. 现代食品科技,2015,31(5): 31-35.
[22]Yunbin Zhang, Xiaoyu Liu, Yifei Wang,etal. Antibacterial activity and mechanism of cinnamon essential oil againstEscherichiacoliandStaphylococcusaureus[J]. Food Control, 2016, 59: 282-289.
(编辑:侯向辉)
Study on Cinnamaldehyde to Inhibit the Main Pathogenic Bacteria of Mastitis in Dairy Cowinvitro
CHENG Hao, ZHOU Meng-jie, HU Fei, YE Cong-cong, PENG Ben-ying, ZHANG Jia-lan*
(CollegeofAnimalScience,YangtzeUniversity,Jingzhou,Hubei434025,China)
The bacteriostatic effect of natural compounds cinnamaldehyde on the main pathogenic bacteriaEscherichiacoli,StaphylococcusaureusandStreptococcusof dairy cow mastitis was studied. Tube double dilution method was used to measure the minimum inhibitory concentration (MIC) of cinnamaldehyde on main pathogenic bacteria of dairy cow mastitisinvitro. The MIC of cinnamaldehyde againstStaphylococcusaureuswas 3.2 mmol/L and standardsStaphylococcusaureuswas 1.6 mmol/L. The MIC of cinnamaldehyde againstStreptococcuswas 1.6mmol/L,E.coliwas 6.4 mmol/L and standardsE.coliwas 3.2 mmol/L. Cinnamaldehyde can completely inhibit the growth of the three kinds of bacteria. The minimum bactericidal concentration (MBC) of cinnamaldehyde againstStaphylococcusaureusandE.coliwas 25.6 mmol/L. The MBC of cinnamaldehyde against standardsStaphylococcusaureus,Streptococcusand standardsE.coliwas 12.8 mmol/L. These three kinds of bacteria were killed in 7 h by cinnamaldehyde. Therefore, cinnamaldehyde has antibacterial and bactericidal capability against main pathogenic bacteria of dairy cow mastitis. And it is a kind of potential clinical treatment drug of dairy cow mastitis.
cinnamaldehyde; mastitis; antibacterial; sterilization
长江大学第七批大学生创新训练计划项目(2014017)
程浩,助理畜牧师,从事生物制品研究。
张佳兰。E-mail:zjlgpy88@163.com
2016-10-23
A
1002-1280 (2017) 03-0039-05
S859.79
