恩诺沙星注射液在猪体内的残留消除研究
2017-04-26黄耀凌刘智宏白玉惠王鹤佳李丹赵琪张玉洁吴辰斌徐士新
黄耀凌,刘智宏,白玉惠,王鹤佳,李丹,赵琪,张玉洁,吴辰斌,徐士新
(中国兽医药品监察所,北京 100081)
恩诺沙星注射液在猪体内的残留消除研究
黄耀凌,刘智宏,白玉惠,王鹤佳,李丹,赵琪,张玉洁,吴辰斌,徐士新*
(中国兽医药品监察所,北京 100081)
为研究恩诺沙星在猪体内的残留消除规律,验证休药期,以2.5 mg/kg体重肌内注射10%恩诺沙星注射液,每日2次,连续3 d。在最后一次给药后0、3、5、7、10 d时间点,采集肌肉、肝脏、肾脏、脂肪和注射部位肌肉,HPLC法测定组织中的恩诺沙星及其代谢物环丙沙星的残留量,并用WT1.4软件计算休药期。结果显示,恩诺沙星在猪肌肉、肝脏、肾脏、脂肪和注射部位肌肉的休药期分别是5.6、13.4、8.2、3.0、5.5 d。为保证兽药使用安全、消费者健康和食品安全,推荐恩诺沙星注射液在猪的休药期为14 d。
恩诺沙星;猪;残留;休药期
恩诺沙星是动物专用的氟喹诺酮类抗菌药,具有抗菌谱广、杀菌力强、作用迅速、体内分布广、副作用小等特点,广泛应用于畜禽养殖[1]。由于恩诺沙星在动物体内可不同程度代谢成环丙沙星,因此可食性组织中的药物残留标示物为恩诺沙星和代谢物环丙沙星。这类药物对动物骨骼生长发育有不良影响,禁用于幼龄动物和孕畜,同时对胃肠道、中枢神经、肝细胞均有一定的危害[2]。因此我国农业部发布了恩诺沙星在猪组织中的最高残留限量(MRL):肌肉100 μg/kg、肝脏200 μg/kg、肾脏300 μg/kg和脂肪100 μg/kg[3],并在农业部278号公告中规定了猪在使用恩诺沙星注射液后的休药期为10 d[4]。本实验通过对市售恩诺沙星注射液在猪体内残留消除规律的研究,计算恩诺沙星在猪不同组织的休药时间,以期为安全使用兽药和正确执行休药期规定提供科学的依据和建议。
1 材料和方法
1.1 药品与试剂 10%恩诺沙星注射液:批号1603002,山东兽药生产厂家提供;恩诺沙星对照品:含量99.9%,批号H0081206,中国兽医药品监察所提供;盐酸环丙沙星对照品:含量99.8%,批号H101310,中国兽医药品监察所提供;Bond Elut-C18固相萃取柱:100 mg/mL,安捷伦公司;甲醇、乙腈、正己烷:色谱纯;柠檬酸、乙酸铵、磷酸、三乙胺、磷酸二氢钾,均为分析纯。
1.2 仪器设备 Agilent1260高效液相色谱仪(配荧光检测器);固相萃取装置;pH计;高速冷冻离心机;Milli—Q超纯水仪。
1.3 溶液配制 0.05 mol/L磷酸/三乙胺溶液:取浓磷酸3.4 mL,用水稀释至1000 mL,用三乙胺调pH值至2.4。柠檬酸/乙酸铵缓冲液:取柠檬酸10.56 g,乙酸铵7.87 g,用水溶解并稀释至1000 mL,混匀。磷酸盐缓冲溶液(用于肌肉、脂肪组织):取磷酸二氢钾6.8 g,加水溶解并稀释至500 mL,用5.0 mol/L氢氧化钠溶液调节pH值至7.0。磷酸盐溶液(用于肝脏、肾脏组织):取磷酸二氢钾6.8 g,加水溶解并稀释至500 mL,混匀。洗脱液:取乙腈20 mL,用0.05 mol/L磷酸/三乙胺溶液稀释至100 mL,混匀。
1.4 试验动物 三元杂交健康猪30头,雌雄各半,体重为53±6.6 kg,购自北京某猪场。其中对照组5头,给药组25头。试验前7 d,自由采食饮水,饲喂不添加任何抗菌药物的全价配合饲料,试验前后各组饲养条件相同。
1.5 给药与样品采集 给药组以2.5 mg/kg体重剂量进行臀部肌内注射恩诺沙星注射液,每日2次,连续给药3 d,分两侧注射。最后一次给药后0、3、5、7和10 d分别随机宰杀5头,采集背长肌、肝脏、肾脏、脂肪和注射部位肌肉,于-20 ℃保存。
1.6 试验方法 采用实验室自建残留检测方法[5]对样品进行测定。
1.6.1 样品前处理 取(2±0.05)g样品,置50 mL离心管中,肌肉、脂肪试样加磷酸盐缓冲溶液10.0 mL,肝脏、肾脏试样加磷酸盐溶液20.0 mL,涡旋混匀,中速振荡5 min。15000 r/min离心10 min,取上清液于另一离心管中。肌肉、脂肪试样残渣中再加磷酸盐缓冲溶液10.0 mL;肝脏、肾脏试样残渣中再加磷酸盐溶液 20.0 mL,重复提取一遍。合并两次上清液,充分混匀,备用。
取肾脏上清液10 mL于另一50 mL离心管中,加5 mL正己烷,中速振荡5 min。5000 r/min离心5 min,取下层清液,混匀,备用。
固相萃取柱依次用甲醇、水各2 mL预洗。取备用液3.0 mL过柱,水1 mL淋洗,挤干。用洗脱液1.0 mL洗脱,挤干,收集洗脱液。经滤膜过滤后作为试样溶液,供高效液相色谱法测定。
1.6.2 色谱条件 色谱柱:Phenomenex Luna 5u C18(2)柱(250 mm×4.6 mm,5 μm);流动相:0.05 mol/L磷酸/三乙胺溶液+乙腈(82+18,V/V),使用前经微孔滤膜过滤(测肌肉和脂肪组织用);柠檬酸/乙酸铵溶液+乙腈(82+18,V/V),使用前经微孔滤膜过滤(测肝脏和肾脏组织时用);流速0.8 mL/min;检测波长:激发波长280 nm;发射波长450 nm;柱温40 ℃;进样量40 μL。
2 结果与分析
2.1 标准曲线 恩诺沙星和环丙沙星在0.5 ~ 800 ng/mL浓度范围内呈现良好的线性关系,其曲线方程分别为y= 3.6034x+ 0.5218和y= 7.4225x+ 1.0125,相关系数(R2)均为0.9999,标准溶液和组织色谱图见图1和图2。
2.2 组织中药物残留 按实验室检测方法对采集的注射部位、背长肌、脂肪、肝脏及肾脏样品进行测定。按检测方法的残留量计算公式,计算样品中恩诺沙星及代谢物环丙沙星的残留量,并用同时测定的阳性添加样品的回收率进行折算,以折算结果作为样品中恩诺沙星及代谢物环丙沙星的残留量。分别计算每个时间点5头猪的注射部位、肌肉(背长肌)、脂肪、肝脏及肾脏样品中恩诺沙星和代谢物环丙沙星(表1)和总残留量(表2)。
表1和表2结果显示,药物在停药0 d的注射部位浓度最高,其次为肝脏、肾脏和背长肌,脂肪组织中的药物浓度最低。药物在组织中的代谢较快,在停药后第3天,肌肉(背长肌)、脂肪和肾脏中的药物浓度已低于MRL,分别为46.6 μg/kg、92.5 μg/kg和24.1 μg/kg;注射部位在停药后第5 天低于MRL,为5.7 μg/kg;肝脏在第7 天低于MRL,为180.9 μg/kg。五种组织中的药物平均总残留量在停药后第7 天时均已降低至MRL之下。
2.3 休药期计算 采用WT1.4软件计算休药期,确保有95%的可信限使99%的残留低于MRL。10%规格恩诺沙星制剂在猪组织中的休药期计算和结果见表3,残留消除拟合图见图3。
结果显示,10%规格制剂在猪组织中的休药期分别为注射部位5.5 d、肌肉(背长肌)5.6 d、肝脏13.4 d、肾脏8.2 d和脂肪3.0 d,其中肝脏的休药期时间最长。为了确保消费者健康安全,建议10%规格恩诺沙星注射液在猪的休药期为14 d。

图1 恩诺沙星及环丙沙星混合标准溶液(30 ng/mL)

图2 猪肝中残留的恩诺沙星及环丙沙星色谱图(休药后第0 天)

组织停药时间/d不同编号猪组织中恩诺沙星残留量不同编号猪组织中环丙沙星残留量1234512345注射部位011422.99128.46949.616001.56487.6329.2441.2440.0587.8485.93183.771.2128.9388.8111.47.2ND10.015.26.45NDND5.317.16.2NDNDNDNDND711.4NDNDNDNDNDNDNDNDND10NDNDNDNDNDNDNDNDNDND肌肉(背长肌)03998.32906.94650.23780.74971.5503.5593.7603.8672.6709.4391.47.846.946.86.812.7ND11.29.5ND55.35.45.611.18.2NDNDNDNDND78.6NDNDNDNDNDNDNDNDND10NDNDNDND5.3NDNDNDNDND肝脏04596.33687.05994.44194.66044.5746.81075.91092.81336.41395.13262.2185.2335455.1233.2NDND12.412.4ND581.2110.8162.3489.2174.6NDNDNDNDND7287.4181.3110.2209.3116.1NDNDNDNDND10110.9101.899.2176.186.7NDNDNDNDND肾脏04439.14752.16589.87846.77402.0872.41142.91379.02153.51930.53125.128129.2128.915.7NDND25.410.3ND5NDND22.633.827.3NDNDNDNDND728.810.011.3ND13.9NDNDNDNDND1012.312.0NDND20.4NDNDNDNDND脂肪0937.1461.5968.9922.41158.745.337.790.899.984.1322.251.419.618.29.2NDNDNDNDND5NDNDND6.7NDNDNDND6.7ND7NDNDNDNDNDNDNDNDNDND10——————————
注:ND为未检出;“—”为未检测

表2 不同时间点恩诺沙星和环丙沙星在猪各组织中的总残留量 μg/kg
注:ND为未检出;“—”为未检测

图3 恩诺沙星注射液的组织残留消除拟合图
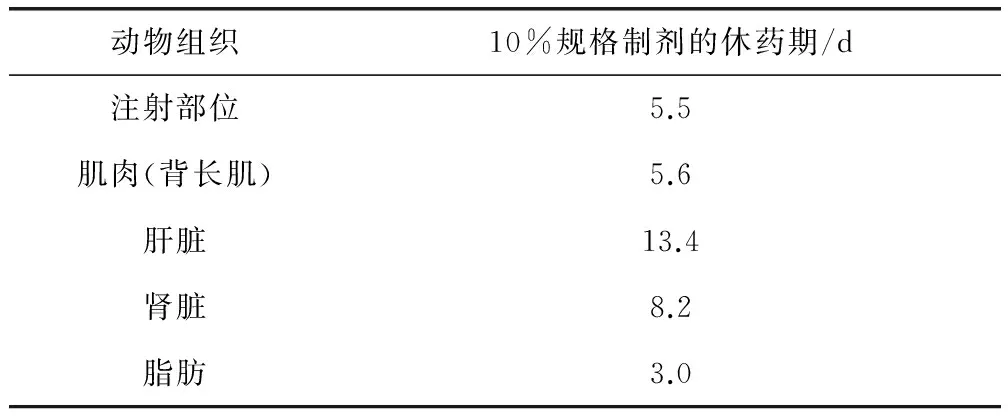
动物组织10%规格制剂的休药期/d注射部位5.5肌肉(背长肌)5.6肝脏13.4肾脏8.2脂肪3.0
3 讨论与小结
通过市售恩诺沙星注射液在猪的残留消除试验,发现这种市售注射液在猪组织中的残留消除规律与其他文献报道相近,代谢消除较快[6-8],与文献报道相比,都是肝脏和肾脏残留浓度较高,并迅速消除。但从组织残留浓度看,与刘小艳等[7]试验结果比较,本试验的药物总残留浓度较高,因为刘小艳报道其制剂在停药第5天后,各组织中未检测到药物残留。与仲锋等[6]试验结果比较,注射部位、肝脏、肾脏和脂肪在停药后第10天的残留浓度比较接近,本试验在停药后第10天的残留浓度分别为注射部位为未检出、肝脏为116.0 μg/kg、肾脏为8.9 μg/kg、脂肪为未检出;仲锋报道的残留浓度,注射部位为未检出、肝脏为95.2 μg/kg、肾脏为122 μg/kg、脂肪为未检出。这是因为肝脏和肾脏分别是恩诺沙星的代谢和排泄器官,休药后第10天药物残留浓度在肝脏和肾脏仍高于肌肉和脂肪。本试验中药物残留在组织中含量与文献不一致,可能是药物制剂生产工艺差异等因素造成的。
本试验的休药期计算中采用的经回收率折算后的样品残留浓度数据来进行。经WT1.4软件分析,采用回收率折算数据计算的休药期在肌肉和肝脏较未折算回收率的休药期时间略长。未折算回收率数据计算的休药期分别是注射部位5.4 d、肌肉4.6 d、肝脏12.6 d、肾脏8.2 d和脂肪3.8 d。这可能是采用回收率折算得到的恩诺沙星总残留浓度相对较高,因而计算得到的休药期时间更长,但这更能保证畜产品的安全、消费者的健康。
表3的结果表明,猪肌肉、肾脏、脂肪和注射部位的休药期符合农业部278号公告中恩诺沙星注射液休药期10 d的规定,但肝脏的休药期结果,与公告规定不一致。总残留数据经WT1.4软件计算,肝脏的休药期超过10 d,为14 d(13.4 d)。这可能是因为动物之间存在差异。虽然,在停药后10 d,5头动物肝脏中的药物残留都已低于MRL,但本试验数据采用WT1.4软件处理,在统计学上考虑了不同动物之间残留浓度的差异,确保有95%的可信限使99%的残留低于MRL,使计算得到的肝脏休药期数据超过了10 d。而其他文献报道,均根据残留浓度低于MRL的停药时间点来确定休药期[6~8]。
试验中市售恩诺沙星注射液在猪的休药期与农业部278号公告规定不一致,可能是动物间差异、休药期计算方式不同,也可能是制剂本身生产工艺不同等原因引起。因此,为了保证畜禽养殖生产过程中,科学用药,遵守兽药制剂的休药期规定,保障动物性产品的质量和消费者的食品安全,应进一步增加对市售兽药制剂休药期的验证研究,并对农业部公告上的休药期规定进行梳理。
[1] 丁丽玲,鲁晓旭,李银生,等. 蚯蚓体内恩诺沙星残留的检测方法研究[J]. 农业环境科学学报,2016,3:(2):403-408.
[2] 郭建华,李天真,苗刚,等. 乳酸环丙沙星等对金黄色葡萄球菌的体外抑菌试验[J]. 畜禽业,2011,6:59-60.
[3] 中华人民共和国农业部公告235号. 动物性食品中兽药最高残留限量[S].
[4] 中华人民共和国农业部公告278号:兽药休药期规定[S].
[5] 张玉洁,李倩,汪霞,等. 高效液相色谱法检测多种动物组织中氟喹诺酮类药物残留量的研究[J]. 中国兽药杂志,2012,46(7):18-22.
[6] 仲锋,郭筱华,黄齐颐,等. 恩诺沙星在猪组织中残留消除规律研究[J]. 中国兽药杂志,2005,39(2):6-9.
[7] 刘小艳,吴海坤,方炳虎,等. 恩诺沙星混悬液在猪体内残留消除规律研究[J]. 动物医学进展,2011,32(5):89-93.
[8] 罗雅劲,孙永学,李小娜,等. 恩诺沙星微囊剂在猪体内残留消除规律研究[J]. 中国畜牧兽医,2010,37(2):129-131.
(编辑:侯向辉)
Residue Depletion Study of Enrofloxacin Injection in Swine
HUANG Yao-ling,LIU Zhi-hong,BAI Yu-hui,WANG He-jia,LI Dan,ZHAO Qi,ZHANG Yu-jie,WU Chen-bin,XU Shi-xin*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
The residue depletion of enrofloxacin injection in the swine was studied. The preparation of 10% concentration was administrated intramuscularly at a dose of 2.5 mg/kg twice daily for 3 days. Tissue samples were collected at 0, 3, 5, 7 and 10 day after the last administration. The concentrations of residues including enrofloxacin and ciprofloxacin in tissues were analyzed and the withdrawal time was calculated by WT1.4 software. The result recommended that the withdrawal time of the 10% enrofloxacin injection in swine would be 14 days.
enrofloxacin; swine; residue; withdrawal time
2016年度国家农产品质量安全风险评估项目计划(GJFP201600705)
黄耀凌,副研究员,从事兽药安全评价研究。
徐士新。E-mail:xushixin@ivdc.org.cn
2016-11-09
A
1002-1280 (2017) 03-0048-07
S859.796
