吉林省犬细小病毒流行毒株的分离及VP2基因序列分析
2017-04-26张双伊淑帅王一鸣郭梦茹李响胡桂学
张双,伊淑帅,王一鸣,郭梦茹,李响,胡桂学*
(1.吉林农业大学动物科学技术学院,长春 130118;2.松原出入境检验检疫局,吉林松原 138000)
吉林省犬细小病毒流行毒株的分离及VP2基因序列分析
张双1,伊淑帅1,王一鸣1,郭梦茹1,李响2,胡桂学1*
(1.吉林农业大学动物科学技术学院,长春 130118;2.松原出入境检验检疫局,吉林松原 138000)
为了解吉林省宠物医院就诊犬犬细小病毒流行现状及毒株变异情况,从吉林省长春、吉林、辽源、松原、九台地区采集就诊犬肛门拭子73份,采用胶体金快速检测试剂盒检测后,阳性样品15份。选取具有代表性的6份病料使用F81细胞进行病毒的分离,成功分离到6株病毒(暂命名为JL-CC1、JL-CC2、JL-JL、JL-SY、JL-JT、JL-LY),经通用引物鉴定均为犬细小病毒。VP2基因序列分析结果显示,6株CPV分离株之间的核苷酸同源性为99.3%~100%,与近年来国内分离株核苷酸同源性为98.9%~99.9%,与国外分离株核苷酸同源性为98.3%~99.7%。遗传进化树结果表明,6株分离株分属4个分枝:JL-CC1、JL-LY、JL-SY与山东、辽宁分离株同属1个分枝,JL-CC2与黑龙江分离株同属1个分枝,JL-JT与吉林分离株同属1个分枝,JL-JL与2013年吉林、黑龙江分离株同属1个分枝。氨基酸序列比对显示6株分离株JL-CC1、JL-CC2、JL-JT、JL-LY、JL-SY属于New CPV-2a基因亚型,JL-JL株为属于New CPV-2b基因亚型。此外,6株CPV分离株在267、324、377、440位氨基酸发生了变异。结果表明,吉林省CPV以CPV-2a亚型为主,CPV-2b亚型为辅,并存在基因多变现象,可为吉林省CPV的有效防控提供数据支持。
吉林省;犬细小病毒;分离;VP2基因
犬细小病毒病是由犬细小病毒(Canine parvovirus, CPV)感染引起的一种犬急性高度接触性传染病,主要感染幼犬,临床症状表现为呕吐、腹泻、出血性肠炎以及白细胞显著减少。自1977年美国科学者Eugstet等首次从患病犬粪便中观察到CPV后,加拿大、日本、法国、德国、韩国等国家先后报道了本病的发生[1-2]。我国首次于1982年由梁世哲等报道了本病的发生,并于次年由徐汉坤等确定了本病在我国的流行[3]。目前,CPV已呈世界性流行,对宠物犬健康以及毛皮动物养殖业造成了严重的威胁。
CPV隶属于细小病毒科,细小病毒属,为单股正链DNA病毒。病毒粒子为等轴对称的二十面体结构,直径为20~24 nm,由衣壳和核酸组成,病毒无囊膜。CPV病毒粒子结构坚实致密,对外界环境抵抗力强。CPV基因组长约5200 nt,分子量为1.7×106,其基因组中包含2个启动子,利用宿主的RNA聚合酶Ⅱ分别启动结构蛋白(VP1, VP2)和非结构蛋白(NS1, NS2)编码基因的转录[4-6]。CPV只有一个抗原型,与FPV、MEV同源性较近,序列分析表明FPV与CPV的基因组差异不到1%,但宿主范围、血凝性、抗原性等存在着明显的差异。CPV可以通过基因漂移不断进化,随时间发生基因突变,CPV已由最初分离的CPV-2亚型,变异为CPV-2a、CPV-2b、CPV-2c、CPV-2c(a)、CPV-2c(b)5中基因亚型。其变异的主要特征为VP2蛋白第426位氨基酸的变异,426-天冬酰胺(Asn)为CPV-2与CPV-2a亚型,变异为天冬氨酸(Asp),则为CPV-2b亚型,变异为谷氨酸(Glu),则为CPV-2c亚型[7]。目前,中国流行的主要为CPV-2a、CPV-2b亚型,2010年报道CPV-2c亚型的感染,但未形成大的流行[8]。为了解吉林省宠物医院就诊犬CPV流行毒株的变异情况及基因亚型分布情况,本试验采用胶体金快速诊断试剂盒对长春、吉林、九台等5个地区宠物医院就诊犬病例进行了检测,并对CPV阳性病例进行了病毒分离与VP2基因测序及分析,以了解吉林地区CPV的分子流行病学与VP2基因遗传变异情况,以期为本地CPV的有效防控提供依据。
1 材料与方法
1.1 毒株及细胞株 CPV阳性毒株为吉林农业大学预防兽医学实验室保存;F81细胞为军事兽医研究所馈赠。
1.2 主要试剂与仪器 犬细小胶体金快速检测试剂盒购于意大利KoQine公司;Virus Genomic DNA Kit,Gel Extraction kit,Plasmid Mini Preparation kit购自Axygen公司;Ex Taq酶、10×buffer、dNTP、PMD-18T、DL 2000 maker等均购自TAKARA公司;MEM、0.05%胰酶、双抗、胎牛血清购自gibco公司。MikRo 22R高速冷冻离心机(德国HETTICH公司)、MIR-162 CO2恒温培养箱(日本SANYO公司)、TC-25/H PCR仪(BIOER公司)、DYY-6B电泳仪凝胶成像系统(BIO-RAD公司)等。
1.3 病料来源及处理 病料采集自2015-2016年吉林省长春、吉林、松原、九台、辽源5个地区宠物医院就诊的宠物犬,为患病犬的粪便样本。采集的粪便样本中加入含有1%双抗溶液的MEM涡旋混匀,反复冻融3次后,5000 r/min离心5 min,收集上清液10000 r/min离心5 min,再次收集上清液于新的离心管中,处理后的样本于-80 ℃保存。
1.4 犬细小胶体金试纸条检测 病料处理液使用KoQine公司的犬细小胶体金快速检测试剂盒进行检测,并设置阳性对照与阴性对照。
1.5 病毒分离 胶体金快速检测试剂盒检测结果为阳性的病料处理液经0.22 μm滤膜过滤除菌,按培养液体积的1/10接种于F81细胞,同时设置对照组,37 ℃吸附1 h,补充细胞维持液,37 ℃、5% CO2温箱中静置培养4~5 d,每日观察细胞病变情况。若无病变则于培养4~5 d后收集培养液,按照常规方法进行盲传,盲传5代后无病变则视为阴性;出现病变的细胞经反复冻融3次后收集病毒液,-80 ℃保存。
1.6 犬细小通用引物鉴定 使用Virus Genomic DNA Kit提取出现典型犬细小CPE的病毒液DNA,以病毒DNA为模板,去离子水、CPV阳性毒株DNA为阴、阳对照,使用CPV通用引物进行PCR扩增,扩增产物经1%琼脂糖凝胶电泳进行检测。
1.7 VP2全基因扩增及序列分析 根据NCBI上已发表的CPV-2株(GenBank登录号:M38245)基因序列设计扩增VP2全基因序列的引物,引物序列为VP2-F: 5’-ATGAGTGATGGAGCAGTTC-3’,VP2-R: 5’-AATATAATTTTCTAGGTGCTAG-3’,预期扩增片段大小为1755 bp。扩增条件为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1min 45 s,72 ℃终延伸10 min,共35个循环。PCR产物经1%琼脂糖凝胶电泳进行检测,经胶回收后连接pMD-18T载体,转化DH5α感受态大肠杆菌,挑取阳性菌落提取质粒,并送往上海生工有限公司测序。查找GenBank上已发表的国内外不同基因型的CPV毒株VP2基因序列,使用MEG7.0软件进行基因序列及氨基酸序列同源性分析,并绘制进化树。
2 结 果
2.1 胶体金试剂盒检测结果 本试验共采集患病犬粪便样本73份,经犬细小胶体金快速诊断试剂盒检测,CPV阳性样品15份,分别为长春6份、吉林3份、松原2份、九台2份、辽源2份。
2.2 病毒分离 选择具有代表性的6份胶体金检测阳性临床样品处理液,接种单层培养的F81细胞,并观察细胞病变。6份临床样品均于接毒后48~96 h细胞出现肿胀圆缩、拉网、脱落典型的细胞病变,对照组细胞正常(图1)。连续盲传3代,出现稳定的细胞病变,证明成功分离到6株病毒,暂命名为JL-CC1、JL-CC2、JL-JL、JL-SY、JL-JT、JL-LY。

A:接毒组细胞肿胀圆缩、拉网、脱落;B:对照组细胞无病变图1 接毒后细胞病变
2.2 犬细小通用引物鉴定结果 采用犬细小病毒通用引物对提取的病毒液DNA进行特异性扩增,经1%琼脂糖凝胶电泳检测,均在845 bp左右出现目的条带,与预期结果一致(图2)。经序列测定及在线Blast比对,与CPV同源性为98.3%~99.9%,确定分离到的6株病毒均为CPV。
2.3 VP2全基因扩增结果 采用设计的VP2全基因引物VP2-F/VP2-R对6株CPV分离株的VP2基因进行特异性扩增,扩增产物经1%琼脂糖凝胶电泳检测,均在1755 bp左右出现目的条带,与预期结果一致(图3)。
2.4 VP2基因遗传进化分析 CPV分离株VP2基因经PCR扩增、连接、转化后,将阳性克隆质粒送往上海生工生物工程公司测序,测序结果经拼接后得到CPV分离株的VP2全基因序列,均为1755 bp。基于VP2基因遗传进化分析结果表明,6株CPV分离株之间的核苷酸同源性为99.3%~100%,与近年来国内分离株核苷酸同源性为98.9%~99.9%,与国外分离株核苷酸同源性为98.3%~99.7%。其中,JL-CC1、JL-LY、JL-SY核苷酸同源性高达99.7%~100%;JL-CC2株与2013年黑龙江分离株核苷酸同源性达99.8%,JL-JT株与2008年吉林分离株核苷酸同源性达99.7%,JL-JL株与2013年吉林分离株核苷酸同源性达99.8%,6株CPV分离株与山东、辽宁等地方分离株核苷酸同源性也达到98.9%以上。查找GenBank上国内外不同基因型的CPV VP2基因序列,应用MEG 7.0软件进行序列分析,并绘制遗传进化树(图4)。

M:DL 2000Maker;1~6:JL-CC1、JL-CC2、JL-JL、JL-SY、JL-JT、JL-LY;7:阳性对照;8:阴性对照图2 犬细小通用引物鉴定结果

M:DL 2000Maker;1~6:JL-CC1、JL-CC2、JL-JL、JL-SY、JL-JT、JL-LY;7:阴性对照图3 CPV分离株VP2基因扩增结果

图4 CPV VP2核苷酸序列遗传进化树(▲代表CPV分离株)
由图可知,VP2基因遗传进化树分为2个大的分枝,分别为A分枝(主要包括本试验6株分离株与山东、辽宁、吉林、黑龙江、印度以及韩国分离株)与B分枝(主要包括美国、法国分离的CPV-2、CPV-2a、CPV-2b、CPV-2c毒株)。6株分离株分属4个分枝:JL-CC1、JL-LY、JL-SY与山东、辽宁分离株同属1个分枝,JL-CC2与黑龙江分离株同属1个分枝,JL-JT与吉林分离株同属1个分枝,JL-JL与2013年吉林、黑龙江分离株同属1个分枝。
2.5 VP2基因推导氨基酸序列分析 根据CPV分离株VP2基因推导VP2氨基酸序列,共编码584个氨基酸。比对6株分离株与GenBank中典型CPV基因型的氨基酸序列,分析CPV分离株基因变异位点(表1)。由代表CPV基因亚型的第87位、426位氨基酸可知,JL-CC1、JL-CC2、JL-JT、JL-LY、JL-SY均为426N,属于New CPV-2a基因亚型,仅JL-JL株为426D,属于New CPV-2b基因亚型。此外,6株CPV分离株在267、324、377、440位氨基酸发生了变异,主要表现为267: F→Y,324: Y→I,377: R→K,440: T→A,与中国分离株CPV/CN/HB1/2013、CPV/CN/JL6/2013等存在相同的变异,属于一个特殊的分枝。
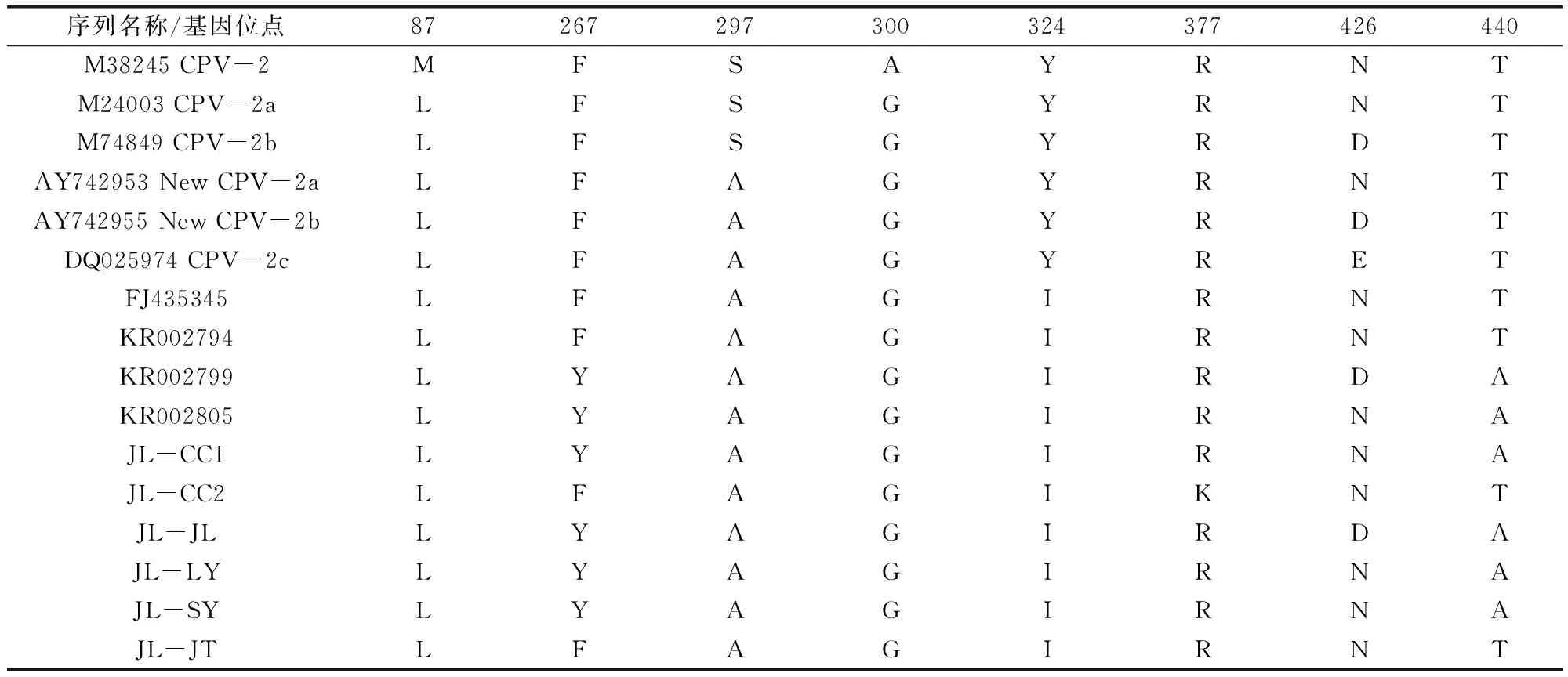
表1 CPV VP2基因推导氨基酸分析
3 讨 论
犬细小病毒主要感染幼犬,幼犬感染CPV后发病率高达90%,病死率可达到20%~50%。不同年龄阶段的幼犬感染后表现为不同的临床症状,子宫内感染或8周龄以下幼犬感染多表现为心肌炎型,2~6月龄幼犬感染多表现为肠炎型[9]。此外,部分CPV毒株还可以感染猫科动物、貂等毛皮动物,对宠物犬猫健康以及毛皮动物养殖业造成了严重的威胁。CPV仅有一个血清型,但经过长期变异后形成不同的基因亚型,主要包括CPV-2、CPV-2a、CPV-2b、CPV-2c。1978-1980年,主要为CPV-2基因型;1980年后,CPV-2 VP2蛋白发生了5个氨基酸的变异后成为CPV-2a亚型;1984年后,CPV-2a亚型VP2蛋白第426为氨基酸发生了变异进化为CPV-2b基因亚型;近年来,德国、阿根廷、南美等国家报道了CPV-2c基因亚型的出现[7, 10]。目前,世界范围内主要流行的毒株为CPV-2a与CPV-2b亚型,但部分国家流行毒株则以CPV-2c亚型为主,如巴西、乌拉圭等国家[11]。据报道,我国目前流行的毒株主要为CPV-2a亚型,其次是CPV-2b亚型,2010年报道了CPV-2c亚型的发生,但未形成大规模流行。CPV的诊断临床上主要依靠临床症状的观察以及生化、血常规、胶体金快速检测试剂盒,实验室诊断主要依靠病毒分离鉴定、PCR、LAMP等分子生物学检测技术以及血凝试验、ELISA等免疫学诊断方法[12]。病毒分离主要使用F81、MDCK、CRFK等细胞。基因型鉴定方法主要依据VP2基因,包括VP2全基因扩增与VP2基因可变区核酸PCR等方法,如Chinchkar等建立的VP2全基因扩增引物、Senda和Pereira等设计的CPV基因可变区PCR引物等[13-14]。本试验采用胶体金试纸条对临床样本进行初步检测,阳性样品使用F81细胞进行病毒分离,成功分离到6株病毒,经CPV通用引物鉴定为CPV毒株,并暂命名为JL-CC1、JL-CC2、JL-JL、JL-SY、JL-BC、JL-LY。
使用设计的VP2全基因序列引物对6株CPV分离株VP2基因进行扩增、测序,并与国内外CPV分离株进行基因比对分析与推导氨基酸变异情况分析。VP2基因遗传进化树主要分为2个大的分枝:A分枝与B分枝,6株CPV分离株属于A分枝,还包括2008-2014年我国山东、吉林、辽宁、黑龙江等地方分离株以及印度、韩国等亚洲分离株。B分枝主要包括美国、法国等欧美国家分离的不同基因亚型的CPV毒株。A分枝中,JL-CC1、JL-LY、JL-SY与山东、辽宁分离株同属1个分枝,同源性高达99.7%~100%;JL-CC2株与2013年黑龙江分离株同属1个分枝,核苷酸同源性达99.8%;JL-JT株与2008年吉林分离株同属1个分枝,核苷酸同源性达99.7%;JL-JL株与2013年吉林分离株同属1个分枝,核苷酸同源性达99.8%。经VP2基因推导氨基酸变异情况分析,6株分离株共存在6处变异,分别为267、300、324、377、426、440位氨基酸位点。其中,JL-CC1、JL-CC2、JL-JT、JL-LY、JL-SY426位氨基酸为天冬酰胺(N),属于New CPV-2a基因亚型,仅JL-JL株为天冬氨酸(D),属于New CPV-2b基因亚型。此外,6株CPV分离株在267、324、377、440位氨基酸发生了变异,主要表现为267: F→Y,324: Y→I,377: R→K,440: T→A,与中国分离株CPV/CN/HB1/2013、CPV/CN/JL6/2013等存在相同的变异。该变异已被相关文章报道过,中国、韩国、朝鲜等国家CPV分离株VP2蛋白第267、324、440位氨基酸与美国、欧洲等CPV分离株存在差异,形成了一个特殊的CPV分枝。丁轲等对2010-2013年河南省CPV流行毒株进行了分子流行病学调查,结果7株河南分离株VP2蛋白第267、322、324、333、440等11处氨基酸发生了变异,与本试验变异情况相似。此外,调查结果证明河南省流行的CPV以CPV-2a型和CPV-2b型并存,但以CPV-2a型为主,且基因呈多变异现象[15]。通过本试验对吉林省宠物医院就诊犬CPV流行毒株进行了分离及序列分析,结果提示吉林省CPV以CPV-2a亚型为主,CPV-2b亚型为辅,并存在基因多变现象,可为吉林省CPV的有效防控提供数据支持。
[1] Eugster A K, Bendele R A, Jones L P. Parvovirus infection in dogs [J]. Journal of the American Veterinary Medical Association, 1978, 173(10): 1340-1345.
[2] Goddard A, Leise A L. Canine parvovirus [J]. Veterinary Clinics of North America Small Animal Practice, 2010, 40(6): 1041-1053.
[3] 梁士哲, 魏喜仁, 范文光, 等. 狗传染性肠炎的研究[J]. 实验动物与比较医学, 1982, 4: 17-20.
[4] 孙梅, 吴建华, 白文军. 犬细小病毒研究进展[J]. 北京农业, 2013, 36: 29-31.
[5] Parrish C R, Have P, Foreyt W J,etal. The global spread and replacement of canine parvovirus strains [J]. J General Virology, 1988, 69 (5): 1111-1116.
[6] Desario C, Decaro N M, Cavalli A,etal. Canine parvovirus infection: which diagnostic test for virus?[J]. Journal of Viro-logical Methods, 2005, 126(1/2): 179-185.
[7] Decaro N, Desario C, Parisi A,etal. Genetic analysis of canine parvovirus type 2c [J]. Virology, 2009, 385(1): 5-10.[8] 张仁舟, 杨松涛, 冯昊, 等. 中国国内首次检测到犬细小病毒CPV-2c[J]. 中国病原生物学杂志, 2010,(4): 246-249.
[9] 李廷军. 犬细小病毒病的病理学观察[J]. 动物医学进展, 2009, 30(8): 125-128.
[10]Nicola D, Costantina D, Diane D A,etal. Molecular Epide-miology of Canine Parvovirus, Europe[J]. Emerging Infectious Diseases, 2007, 13(8): 1222-1224.
[11]Calderon M G, Mattion N, Bucafusco D,etal. Molecular characterization of canine parvovirus strains in Argentina: detection of the pathogenic variant CPV2c in vaccinated dogs[J]. Journal of Virological Methods, 2009, 159(2): 141-145.[12]Prittie J. Canine parvoviral enteritis: a review of diagnosis, management, and prevention[J]. Journal of Veterinary Emergency & Critical Care, 2004, 14(3): 167-176.
[13]Chinchkar S R, Subramanian B M, Rao N H,etal. Analysis of VP2 gene sequences of canine parvovirus isolates in India[J]. Archives of Virology, 2006, 151(9): 1881-1887.[14]Senda M, Parrish C R, Harasawa R,etal. Detection by PCR of wild-type canine parvovirus which contaminates dog vaccines[J]. Journal of Clinical Microbiology, 1995, 33(1): 110-113.
[15]丁轲, 余祖华, 彭春平, 等. 2011-2013年河南省犬细小病毒分子流行病学调查与分析[J]. 畜牧兽医学报, 2014, 45(10): 1671-1678.
(编辑:李文平)
Isolation and VP2 Gene Sequence Analysis of Epidemic Canine Parvovirus Strain in Jilin Province
ZHANG Shuang1,YI Shu-shuai1,WANG Yi-ming1,GUO Meng-ru1,LI Xiang2,HU Gui-xue1*
(1.CollegeofAnimalScienceandTechnology,JilinAgriculturalUniversity,Changchun, 130118,China; 2.SongyuanEntry-ExitInspectionandQuarantineBureau,Songyuan,Changchun,138000,China)
To investigate current prevalence and viariation of canine parvovirus (CPV) among dogs in pet clinics in Jilin province, 73 anal swabs of dogs in treatment were collected from Changchun, Jilin, Liaoyuan, Songyuan and Jiutai area, Jilin province. After detection by using colloid gold fast examination reagent kit, 6 representative samples from 15 positive samples were added to F81 cell culture, and all 6 isolates(tentatively named JL-CC1, JL-CC2, JL-JL, JL-SY, JL-JT, JL-LY) were successfully isolated and identified as CPV by universal primers. VP2 gene sequence analysis showed that the nucleotide sequence homology among 6 CPV isolates was 99.3%~100%, 98.9%~99.9% compared to current domestic isolates and 98.3%~99.7% compared to abroad isolates. Phylogenetic analysis indicated that the 6 isolates belonged to 4 branches: JL-CC1, JL-LY and JL-SY isolates in same branch with Shangdong and Liaoning isolates; JL-CC2 with Heilongjiang isolate; JL-JT with Jilin isolate; JL-JL with Jilin and Heilongjiang isolates (2013). Amino acid sequence alignment showed that the 5 CPV isolates JL-CC1、JL-CC2、JL-JT、JL-LY、JL-SY belonged to New CPV-2a gene subtype, while JL-JL belonged to New CPV-2b gene subtype. Besides, there were mutations appeared at the 267th, 324th, 377th and 440th amino acid. The above results indicate that CPV, accompanying with gene variation, is mainly CPV-2a gene subtype, and CPV-2b gene subtype is a supplement in Jilin province, which will provide data support for effective prevention and control of CPV in Jilin province.
Jilin province; canine parvovirus; isolation; VP2 gene
国家重点研究计划(2016YDF0501002)
张双,硕士研究生,从事动物病毒学研究。
胡桂学。E-mail: huguixue901103@163.com
2016-10-01
A
1002-1280 (2017) 03-0015-06
S852.4
