甲硝唑残留的胶体金试纸条的研制
2017-04-26呼秀智陈笑笑胡叶军缪翁晟途薛占永孙晓峥
呼秀智,陈笑笑,胡叶军*,缪翁晟途,薛占永,孙晓峥
(1.河北工程大学,河北邯郸 056021;2.杭州南开日新生物技术有限公司,浙江杭州 310051)
甲硝唑残留的胶体金试纸条的研制
呼秀智1,陈笑笑2,胡叶军2*,缪翁晟途2,薛占永1,孙晓峥1
(1.河北工程大学,河北邯郸 056021;2.杭州南开日新生物技术有限公司,浙江杭州 310051)
为方便药物残留的现场快速检测,利用胶体金免疫层析技术研制出了一种快速检测蜂蜜样本中甲硝唑残留的试纸条。将人工抗原与二抗包被到硝酸纤维素膜上依次作为检测线和控制线,样本中的甲硝唑与检测线上的人工抗原竞争性结合胶体金结合垫上的抗体-胶体金结合物,根据检测线和控制线的显色情况判断样本的阴阳性。结果显示:试纸条上人工抗原MNZ-BSA的包被量为0.5 mg/mL,二抗羊抗鼠IgG的包被量为0.54 mg/mL;试纸条对于甲硝唑的检出限为1 μg/kg,与4种硝基咪唑类药物有交叉反应,但甲硝唑的检出限最低;样本中添加溶液A处理并用乙酸乙酯作为提取剂,单个样本检测时间为20 min。该方法适用于甲硝唑残留的大规模现场快速检测。
胶体金;甲硝唑;试纸条;快速检测
甲硝唑(Metronidazole,MNZ)又名灭滴灵,化学名称为2-甲基-5-硝基咪唑-1-乙醇,属于硝基咪唑类药物。20世纪60年代,甲硝唑的抗厌氧菌感染的作用被研究人员发现[1],并于1978年被世界卫生组织定为抗厌氧菌首选药[2]。甲硝唑分子量171,为小分子物质,能以扩散的方式直接进入细菌细胞内。在无氧或者少氧的环境中,硝基能被电子传递蛋白还原成具有高细胞毒性的氨基。与细菌DNA反应时,能阻断其转录与复制,破坏其双螺旋结构,降解已合成的DNA,导致细胞死亡,最终起到快速杀灭厌氧细菌和抑制感染的作用[3-5]。因此,甲硝唑是治疗滴虫病和阿米巴病的特效药[1],常被用于畜牧生产中。甲硝唑大量的不合理使用已造成动物源性食品中该类药物的残留。临床研究表明,甲硝唑摄入过量会引起消化系统、神经系统、心血管系统、泌尿道的毒副反应,导致皮肤过敏及过敏性休克[6-7]。动物试验结果表明,甲硝唑有潜在的致癌性[8]。因此,各国对于该药物的用量都有严格限制。1998年,欧盟已禁止甲硝唑用于食用动物;2002年,美国FDA禁止甲硝唑在动物源性食品中使用[5];我国农业部第235号公告中规定甲硝唑允许作治疗用,但不得在动物性食品中检出[9]。2002年,我国农业部颁发了《无公害食品蜜蜂饲养兽药使用准则》,其中明确规定甲硝唑在蜂蜜中为不得检出[10]。但因抗菌效果显著且价格低廉,许多蜂农依旧使用甲硝唑防治蜜蜂的孢子虫病,从而导致蜂蜜中甲硝唑残留的产生。目前,检测甲硝唑残留的方法主要有高效液相色谱法[11-13]、液相色谱-串联质谱法[14-17]、加压毛细管电色谱法[18]、碳糊电极法[19]、酶联免疫分析法[20]等。虽然以上方法灵敏度高、重复性好、检出限低,但是样品前处理麻烦、对仪器设备要求高,对操作人员也有较高要求,不适用于现场快速检测。本研究基于胶体金免疫层析技术,开发了一种灵敏度高、特异性好、可实现快速现场检测的甲硝唑胶体金试纸条。
1 材料与方法
1.1 材料
1.1.1 主要试剂 氯金酸、聚乙二醇20000(PEG-20000)、海藻糖、羊抗鼠IgG、牛血清白蛋白(BSA)、卵清蛋白(OVA)、弗氏完全佐剂、弗氏不完全佐剂、Tween-20,美国Sigma-Aldrich公司;柠檬酸三钠、NaH2PO4、KH2PO4、Na2HPO4、甲醇、NaN3、HCl、乙腈、NaOH、甲硝唑、替硝唑、奥硝唑、二甲硝唑、罗硝唑标准品,华东医药股份有限公司;硝酸纤维素膜(NC膜)、玻璃纤维购于美国Millipore公司。
1.1.2 仪器设备 UV-2802紫外连续扫描分光光度计,美国UNICO公司;MYP11-2恒温磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;BioJet XYZ3000型点膜机,美国BioDot;恒温鼓风干燥箱,上海精宏实业设备有限公司;切割机,杭州市恒通设备有限公司;胶体金读数仪为杭州南开日新生物技术有限公司产品。
1.2 方法
1.2.1 溶液配置 PBS缓冲液:准确称取8 g NaCl、0.2 g KCl、1.44 g Na2HPO4、0.24 g KH2PO4溶于800 mL蒸馏水中,搅拌使各组分充分溶解,用HCl调节溶液pH值至7.4后,加蒸馏水定容至1 L,得到0.01 mol/L的PBS缓冲液。
PBST缓冲液:0.01 mol/L的PBS溶液中加入0.05% Tween-20。
PB溶液:准确称取NaH2PO4·H2O 2.6 g加蒸馏水溶解稀释至1 L,得到0.2 mol/L NaH2PO4水溶液。准确称取Na2HPO4·7H2O 53.6 g,加蒸馏水溶解稀释至1 L,得到0.2 mol/L Na2HPO4水溶液。取19 mL 0.2 mol/L NaH2PO4水溶液加入到81 mL 0.2 mol/L Na2HPO4水溶液中,得到0.2 mol/L PB溶液,加蒸馏水至2 L则成0.01 mol/L PB溶液。
PB缓冲液:0.01 mol/L PB溶液中加入0.2% NaN3。
标准溶液配置:用蒸馏水溶解标准品至浓度为100 mg/L的标准溶液,后续试验中,可用蒸馏水稀释成实际所需的浓度。
1.2.2 甲硝唑人工半抗原合成 参照佟宇川的方法[20],合成甲硝唑半抗原,4-(2-(2-甲基-5-硝基咪唑)-4-氧代)丁酸MSA。
1.2.3 甲硝唑人工抗原合成 参照陈昱润的方法[21],合成甲硝唑人工抗原MSA-BSA、MSA-OVA。
1.2.4 甲硝唑单克隆抗体的制备 参照石金磊、范国英等的方法[22-23],调整试验中的参数,制备纯化甲硝唑单克隆抗体。
1.2.5 胶体金溶液制备 准确称取一定量氯金酸,加超纯水得到0.01%的氯金酸水溶液,取100 mL加热至煮沸,边搅拌边加入1.50 mL 1%柠檬酸三钠溶液。继续加热煮沸至溶液呈酒红色,冷却至室温,加超纯水恢复至原体积,4 ℃储存。
1.2.6 抗体-胶体金结合物
1.2.6.1 标记pH值的确定 取9个1.5 mL离心管依次编号,每管加入1 mL胶体金溶液,用K2CO3和HCl调各管溶液的pH依次为3、4、5、6、7、8、9、10、11,摇晃混匀。分别在每管中加入一定量甲硝唑单抗,混匀后静置10 min,后加入100 μL 10% NaCl溶液,室温反应10 min,观察溶液颜色变化。将溶液颜色为红色的管子离心取上清,测定OD520的值,该值最大处的pH为标记pH。
1.2.6.2 胶体金标记抗体的最佳标记量测定 取7个1.5 mL离心管依次编号,每管加入1 mL胶体金溶液,用K2CO3调至标记pH,每管分别加入0、5、10、20、30、40、50 μg甲硝唑单抗,混匀后室温静置10 min。加入100 μL 10% NaCl溶液,室温静置10 min。观察每管溶液颜色变化。若颜色明显变蓝,且出现沉淀,说明抗体量太少,导致胶体金出现沉降;若溶液颜色为发现明显变化,仍为红色,则说明抗体量适合,最先不变色的管子抗体的量为最佳标记量。
1.2.6.3 抗体-胶体金结合物的制备 取已制备好的胶体金溶液50 mL,调至标记pH值,边搅拌边加入最适浓度的单克隆抗体,继续搅拌20 min,后加入5%的BSA,稀释至1%BSA。4 ℃,1500 r/min离心10 min后弃上清,沉淀用0.01 mol/LPB缓冲溶液重悬,置于4 ℃保存。
1.2.7 胶体金试纸条的制备
1.2.7.1 检测线、控制线包被浓度的调试 用缓冲液将MNZ-BSA稀释至0.1、0.15、0.5、1、1.5、2 mg/mL,二抗(羊抗鼠IgG)稀释至0.1、0.5、1、1.5、2 mg/mL,依次包被到NC膜上,与抗体-胶体金结合垫等组装成试纸条后,用PBST溶液滴板,观察两条线的显色情况,同时用金标读数仪读取检测线(T线)、控制线(C线)的值及两者的比值(T/C),以T/C值为1~2且显色良好时的浓度为工作浓度。
1.2.7.2 胶体金试纸条的组装 将稀释好的MNZ-BSA和羊抗鼠IgG通过点膜机喷于NC膜上,形成间隔5 mm的检测线(T线)和控制线(C线),37 ℃烘箱干燥7 h;抗体-胶体金结合物溶液按3 μL/cm喷至玻璃纤维上作为胶体金结合垫,37 ℃烘箱干燥8 h;依次将样品垫、胶体金结合垫、NC膜、吸水垫粘于PVC板上,用切条机切成3.84 mm宽度的试纸条,装入塑料板壳中压成试剂板。胶体金试纸条的结构如图1所示。

图1 胶体金试纸条结构图
1.2.8 样本处理 样本量的优化:分别取1、2、4、5 g 蜂蜜样本各2组,一组作为空白样品,一组添加1 μg/L的甲硝唑标准品溶液,对样本进行处理后观察空白组及添标组的显色情况。
样本添加溶液优化:分别将溶液A、溶液B、蒸馏水、PBS、饱和NaCl、HCl、乙醇、甲醇、NaOH作为添加溶液对空白样本及添标样本(1μg/kg)进行处理,观察显色情况。
提取剂优化:分别以乙酸乙酯、添加乙腈的乙酸乙酯及异丙醇作为提取剂提取空白样本及添标样本(1 μg/kg),观察显色情况。
样本处理过程:取蜂蜜4 g于15 mL离心管中,加入1 mL 溶液A,充分振荡至完全溶解后加入8 mL乙酸乙酯上下翻转振荡3 min,静置后取上清4 mL于5 mL离心管中吹干,加300 μL复溶液,用滴管冲洗,充分溶解管内壁残留,取100 μL待检。
1.2.9 样本检测 测试前,须将试剂板和待检样本溶液恢复至室温(20~30 ℃)。
操作步骤:将组装好的试剂板水平放置于观察者正面,用滴管吸取待检样本溶液于加样孔中垂直滴加3滴(约100 μL),加样后开始计时,在3~5 min内判读结果,其他时间判读无效。
结果判读:本试验采用对比法判读试验结果。若T线(检测线,靠近加样孔一端)显色比C线(控制线)显色深或一样深,判定为阴性;若T线显色比C线显色浅,或T线无显色,判定结果为阳性;若C线未出现则判定为无效。
1.2.10 试纸条各项指标测定
1.2.10.1 试纸条检出限 取蜂蜜空白样本进行预处理,添标至甲硝唑终质量分数为0、0.25、0.5、1、2.5、5、10、20 μg/kg,按优化后的方法处理样本并检测,每个浓度设3个重复,滴板检测并记录检测结果。
1.2.10.2 试纸条假阳性率 取蜂蜜空白样本20份进行预处理,按优化后的方法处理样本并检测,滴板检测并记录检测结果。统计阳性结果,计算假阳性率。
1.2.10.3 试纸条假阴性率 取蜂蜜空白样本进行预处理,添标至甲硝唑终质量分数为1、2.5、5、10、20 μg/kg,按优化后的方法处理样本并检测,每个浓度设10个重复,滴板检测并记录检测结果,计算假阴性率。1.2.10.4 试纸条均一性 用切条机将组装好的大卡切成3.84 mm的试纸条后,取来自于两张大卡的位于NC膜前后两端及中间的试纸条各2条组装成试剂板,用复溶液进行滴板,测试试纸条的均一性。
1.2.10.5 试纸条特异性 取甲硝唑、替硝唑、奥硝唑、二甲硝唑、罗硝唑标准品,配不同梯度的标准品溶液进行复溶液、样本测试,重复3次,统计结果。
1.2.10.6 试纸条稳定性 将组装好的试纸条置于放入干燥剂的铝箔袋中密封,室温干燥条件下保存,于生产当天,后每隔1个月抽取适量试纸条对空白样本、对终质量分数为1 μg/kg的甲硝唑添标样本进行检测,重复5次,根据结果判定试纸条的稳定性。
2 结果与分析
2.1 检测线、控制线包被浓度 本试纸条以对比法判断试验结果,同时用胶体金金标读数仪读取T、C、T/C的值,根据结果可知,检测线上MNZ-BSA抗原包被浓度为0.5 mg/mL,控制线上羊抗鼠IgG包被浓度为0.54 mg/mL,此时PBST溶液滴板后显色梯度最佳。
2.2 标记pH值的确定 根据之前所述试验方法,确定标记pH值为7.4。
2.3 胶体金标记抗体的最佳标记量的确定 根据之前所述试验方法,胶体金标记抗体最佳标记量为25 μg/mL,此时试剂条显色最佳。
2.4 样本处理优化结果 相较于其他的样本量,4 g的样本处理方法结果显示阴阳性之间显色差异不明显。样本中加入饱和NaCl后,显色梯度不大,而加入HCl和乙醇后显色几乎没有梯度,加入蒸馏水后显色梯度一般,加入溶液A、溶液B、PBS缓冲液后,显色梯度好,测试不同浓度的溶液A、溶液B、PBS缓冲液显色梯度后,确定溶液A为样本的添加溶液。对比提取剂乙酸乙酯中含乙腈和不含乙腈的结果,表明用含乙腈的乙酸乙酯会导致结果偏阳性;以异丙醇为提取剂时,阴性和阳性结果显色并未明显加强,因此本试验中以乙酸乙酯作为提取剂。
2.5 试纸条检出限 根据表1可知,该试纸条检出限为1 μg/kg,其中甲硝唑质量分数为10 μg/kg时T线消失。

表1 试纸条检出限
2.6 试纸条假阳性率 试纸条的假阳性率试验结果如表2所示, 20份阴性空白样本的假阳性率为5%,说明试纸条具有较好的阳性分辨率。

表2 试纸条假阳性率
2.7 试纸条假阴性率 试纸条的假阳性率试验结果如表3所示,50份加标样本的假阴性率为4%,说明试纸条在甲硝唑1 ~20 μg/kg浓度范围内有稳定的检测能力。
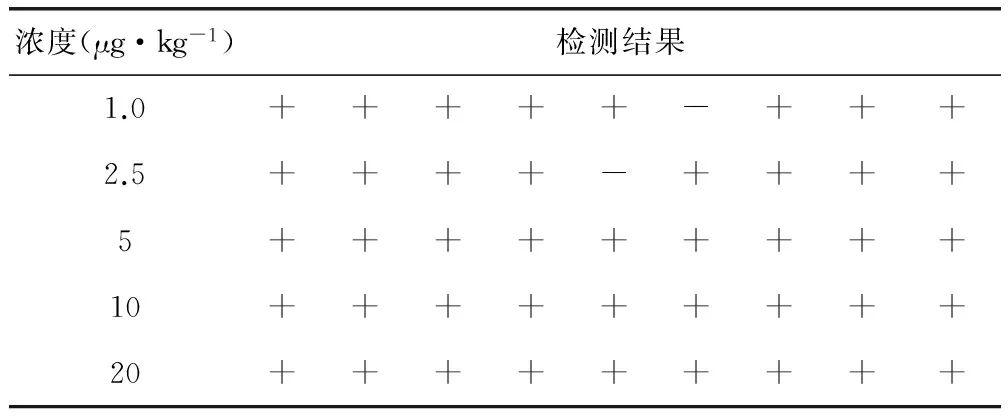
表3 试纸条假阴性率
2.8 试纸条均一性 试纸条的均一性试验结果如表4所示,表中数据为T/C的值。对比两张卡的相同位置显色和梯度可知试验结果无明显差异,说明卡间均一性良好。对比同一卡内不同位置显色和梯度,发现卡中间比两头显色稍浅,但差异不大,因此认为卡内的均一性也良好。
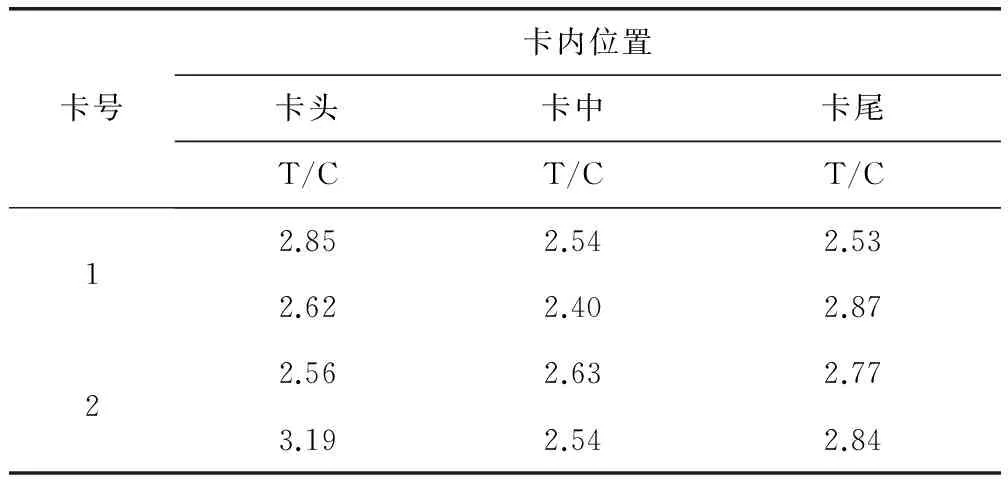
表4 试纸条均一性
2.9 试纸条特异性 试纸条特异性测试结果如表5、表6所示。由表5可知,试纸条对复溶液中甲硝唑的检出限为1 μg/L;由表6可知,试纸条对样本中甲硝唑的检出限为1 μg/kg;其他4种硝基咪唑类药物的检出限相对较高。由表5、表6对比得,试纸条对复溶液中甲硝唑的检出限与样本中甲硝唑的检出限相同,排除了样本基质效应对结果的影响,表现出试纸条对检测甲硝唑的强特异性。其他4种硝基咪唑类药物因样本基质作用影响,标准品添加在复溶液中的检出限比添加在样本中的要低。由此可知,从检测限浓度与基质效应两方面比较得出本试纸条可以用于检测甲硝唑残留的特异性更强,同时也可用于初步检测其他4中硝基咪唑类药物的残留。

表5 复溶液中添加标准品试纸条特异性测试结果

表6 样本添加标准品试纸条特异性测试结果
2.10 试纸条稳定性 试剂条稳定性试验结果如表7所示。在室温条件下保存,12个月内试纸条的显色梯度均未发生明显变化,假阳性率与假阴性率较低,检出限为1 μg/kg。从第13个月起试纸条显色出现偏差,假阳性率与假阴性率均逐渐增大。因此,甲硝唑胶体金试纸条在室温条件下可保存12个月。

表7 试纸条稳定性试验结果
3 讨论与小结
研究基于胶体金免疫层析原理,通过制备甲硝唑单克隆抗体成功研制了甲硝唑胶体金试纸条。样本前处理简单,通过提取、吹干、复溶即可进行滴板测试,整个过程只要20 min。相较于HPLC、ELISA等方法,远远缩短了检测时间。通过优化样本处理过程,改善了显色梯度,同时也提高了试纸条的检出限。结果表明,本试纸条检出限为1 μg/kg,在同行业中处于较优水平。与其他4种硝基咪唑类药物替硝唑、奥硝唑、二甲硝唑、罗硝唑的特异性试验结果显示,甲硝唑的检出限最低,其他4种硝基咪唑类药物的检出限相对较高。因此,本试纸条亦可用于替硝唑、奥硝唑、二甲硝唑、罗硝唑残留的初步检测。稳定性试验表明,在室温条件下,本试纸条的保存时间长达1年,稳定性高。
本试纸条操作简单、检测时间短、灵敏度高、保存时间长、成本低,适用于工商管理部门、食品加工企业等对甲硝唑在蜂蜜中残留的快速检测,同时也能初步检测替硝唑、奥硝唑、二甲硝唑、罗硝唑在蜂蜜中的残留,为大批量样本初筛提供依据。
[1] 周明行. 甲硝唑的临床应用[J]. 中华传染病杂志,1995,13(3):163-165.
[2] 王福银. 甲硝唑临床应用[J]. 黑龙江医学,2007,20(2):157-158.
[3] 温玉麟,张瑞文. 新的一类抗厌氧微生物药物——硝基咪唑类化合物[J]. 中国医药工业杂志,1985,16(7):36-42.
[4] Lamp D K C,Freeman C D,Klutman N E,etal. Pharmacokinetics and pharmacodynamics of the nitroimidazole antimicrobials[J]. Clinical Pharmacokinetics, 1999, 36(5):353-73.
[5] 汪纪仓,王大菊,杨自军,等. 硝基咪唑类药物残留检测方法研究进展[J]. 中国兽药杂志,2007,41(8):31-33.
[6] 李士哲. 甲硝唑的毒副作用[J].临床荟萃,1995,10(20):921-922.
[7] 艾霞. 鱼可食性组织和蛋、奶中甲硝唑残留的高效液相色谱检测法研究[D]. 华中农业大学,2004.
[8] 蒋克春. 甲硝唑的毒副作用及应用注意事项[J]. 航空军医,2003,31(4):183-184.
[9] 农业部畜牧兽医局.农业部发布动物性食品中兽药最高残留限量(续)[J].中国兽药杂志,2003,25(20):5-11.
[10]中华人民共和国农业行业标准NY 5138-2002 无公害食品蜜蜂饲养兽药使用准则[Z].
[11]王延映,彭麟,余祖功. 高效液相色谱法测定饲料中甲硝唑、地美硝唑和异丙硝唑[J]. 南京农业大学学报,2014,37(5):123-127.
[12]张林田,黄少玉,杨晞,等. 高效液相色谱法检测祛痘化妆品中6种抗生素及甲硝唑[J]. 分析试验室,2015,12:1403-1407.
[13]El-zaher A A,El-bagary R I,Elkady E F,etal. Stability indicating HPLC method for the simultaneous determination of ciprofloxacin hydrochloride and metronidazole in the presence of ciprofloxacin acid degradation product[J]. 2015,5:5-17.
[14]Wagil M,Maszkowska J,Ska A,etal. Determination of metronidazole residues in water,sediment and fish tissue samples[J]. Chemosphere,2015,119:S28-S34.
[15]Cheng Z,Ding C,Li Z,etal. Simultaneous determination of three triterpenes in rat plasma by LC-MS/MS and its application to a pharmacokinetic study of Rhizoma Alismatis extract[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2015,1008:32-37.
[16]Wagil M,Maszkowska J,Ska A,etal. A comprehensive approach to the determination of two benzimidazoles in environmental samples[J]. Chemosphere,2015,119:S35-S41.
[17]Ramzia E L,Asmaa A,Asmaa A. Simultaneous determination of ciprofloxacin hydrochloride and metronidazole in spiked human plasma by ultra performance liquid chromatography-tandem mass spectroscopy[J].Journal of Applied Pharmaceutical Science,2016,6(3): 041-047.
[18]董洁莹. 加压毛细管电色谱法检测水产品中药物残留研究[D]. 浙江海洋学院,2012.
[19]Nikodimos Y,Amare M. Voltammetric determination of metronidazole in pharmaceutical formulations using carbon paste electrode[J]. 2015.
[20]佟宇川. 莱克多巴胺、已烯雌酚、甲硝唑的抗原合成及酶联免疫检测法的建立[D]. 吉林大学,2012.
[21]陈昱润. 甲硝唑兽药残留酶联免疫分析方法[D]. 天津科技大学,2014.
[22]石金磊,陈永军,刘迎春,等. 呋喃妥因代谢物AHD单抗的制备及鉴定[J]. 畜牧与兽医,2014,46(1):20-23.
[23]范国英,张海棠,杨艳艳,等. 呋喃它酮代谢物AMOZ单克隆抗体的制备与免疫学特性鉴定[J]. 西北农业学报,2011,20(6):38-42.
(编辑:陈希)
Development of a Colloidal Gold Strip for Metronidazole Residues
HU Xiu-zhi1,CHEN Xiao-xiao2,HU Ye-jun2*, MIUWEN Sheng-tu2,XUE Zan-yong1,SUN Xiao-zheng1
(1.HebeiUniversityofEngineering,Handan056021,China;2.HangzhouNankaiBiotechCo.Ltd.,Hangzhou310051,China)
In order to achieve a rapid detection in drug residues field. A rapid method for detecting metronidazole residues in honey samples was developed by using colloidal gold immune chromatography technology. The MNZ-BSA and secondary antibody were covered into nitrocellulose membrane as test lines, which could compete the binding between metronidazole monoclonal antibody coating colloidal gold and free metronidazole, and results could be clarified by colors of two test lines. The results showed that the working concentration of MNZ-BSA was 0.5 mg/mL, and goat anti mouse IgG was 0.54 mg/mL. The detection limit of the strip for MNZ was 1 μg/kg. There were four kinds of nitro imidazoles drugs crossing reaction. The sample was added into solution A and extracted by ethyl acetate, and the result could be obtained in 20 min. This strip was available for rapid detection of metronidazole residues.
colloidal gold;metronidazole;strip;rapid detection
主要抗生素残留快速检测关键技术研究(1522101042)
呼秀智,硕士,副教授,从事食品安全检测方面研究。
胡叶军。E-mail:hyj664@163.com
2016-09-21
A
1002-1280 (2017) 03-0032-07
S859.79
