新疆中哈边境地区分离到远东型和西伯利亚型蜱传脑炎病毒
2017-04-26张桂林刘晓明伊小平
张桂林,孙 响,刘 然,郑 重,刘晓明,伊小平
新疆中哈边境地区分离到远东型和西伯利亚型蜱传脑炎病毒
张桂林1,孙 响1,刘 然1,郑 重1,刘晓明1,伊小平2
目的 研究新疆中哈边境阿拉套山夏尔西里自然保护区蜱传脑炎疫源地病原的基因型及生物学特征。方法 采用布旗法采集蜱,活蜱保存或液氮冻存;采用BALB/c小鼠与BHK-21细胞进行蜱传脑炎病毒分离培养;采用RT-PCR扩增蜱传脑炎病毒远东型FE和西伯利亚型S特异基因片段并测定其序列。结果 从新疆中哈边境阿拉套山夏尔西里自然保护区全沟硬蜱和森林革蜱中分离出16株蜱传脑炎病毒株,通过对扩增基因序列比对分析,明确其中13株为远东型,3株为西伯利亚型。结论 从新疆中哈边境阿拉套山夏尔西里自然保护区分离到远东型和西伯利亚型蜱传脑炎病毒,该地区为两种亚型病毒共存的蜱传脑炎自然疫源地。
蜱传脑炎病毒;远东型;西伯利亚型;疫源地;中哈边境
蜱传脑炎病毒(Tick-borne encephalitis virus, TBEV)属于黄病毒科(Flavivirdae)黄病毒属(Flavivirus),能导致人急性脑炎症状,并引起较为严重的后遗症。蜱传脑炎(Tick-borne encephalitis, TBE)是一种人兽共患病,主要由媒介蜱叮咬传播,分布地区与媒介全沟硬蜱、蓖籽硬蜱栖息生境密切相关。在世界上蜱传脑炎流行地区横跨欧洲、俄罗斯、中国、蒙古以及日本[1]。在中国蜱传脑炎疫源地主要分布在与俄罗斯、蒙古等蜱传脑炎流行国家接壤的地区,包括东北地区的长白山与大小兴安岭林区以及新疆天山北坡和阿尔泰山南坡林区[2-3]。根据基因序列和血清型的不同,蜱传脑炎病毒分为3个亚型,远东亚型(Far Eastern)、西伯利亚亚型(Siberian)和欧洲亚型(European),不同病毒亚型毒力不同,引起的临床症状及疾病的后果也不相同。远东亚型能导致非常严重的中枢神经系统疾病,如脑炎、脑膜炎能引起人的意识丧失,并对大脑和脊髓造成损害,恢复缓慢,留下严重的后遗症,致死率为5%~20%;西伯利亚亚型引起的急性症状较轻,很少造成瘫痪,但能形成慢性脑炎,致死率6%~8%;欧洲亚型引起的脑炎症状温和,致死率也较低,为0.5%~2%[4-5]。我国发现的蜱传脑炎病毒流行株均为远东亚型[6]。
夏尔希里自然保护区(东经81°43′~82°18′,北纬45°07′~45°23′)位于新疆北部中哈边境,地处阿拉套山南坡,属于博尔塔拉蒙古自治州博乐市。2011年该保护区发现2例蜱传脑炎疑似病例,后被确诊,且血清学调查发现当地人群蜱传脑炎感染率较高。2012年从该地区全沟硬蜱、森林革蜱中分离出13株远东亚型蜱传脑炎病毒,证实阿拉套山南坡夏尔西里自然保护区存在蜱传脑炎疫源地[7]。2014年再次从夏尔西里自然保护区全沟硬蜱中分离出3株西伯利亚亚型蜱传脑炎病毒,表明中哈边境夏尔西里自然保护区同时存在远东亚型和西伯利亚亚型蜱传脑炎病毒,是两种亚型病毒共存的蜱传脑炎自然疫源地。
1 材料与方法
1.1 标本来源 分别在2012年5月和2014年6月,采用布旗法和家畜体表捡法采集蜱,活蜱保存或在液氮中冻存。全沟硬蜱采集于阿拉套山南坡海拔1 400—1 800 m的针阔叶混交林林间灌丛,森林革蜱采集于海拔1 400—1 800 m阳坡草地。
1.2 主要试剂及实验动物 PureLinkTM RNA提取试剂盒购自Thermo Fisher公司,一步法RT-PCR 试剂盒购自Invitrogen公司,DL2000Marker购自Tiangen公司。BALB/c小鼠,SPF级,6~8周,♂,体重18~22 g,购自新疆医科大学实验动物中心。
1.3 引物设计及合成 蜱传脑炎远东型FE特异引物5′-TGG AGC TYG ACA AGA CCT CA-3′与 5′-TCC CAC YAG GAT CTT GGG CAA-3′,片段长度为785 bp;蜱传脑炎西伯利亚型S特异引物5′-GKG GAT GTG TCA CGA TCA CT-3′与5′-GCY GTY GGA AGG TGT TCC AGA-3′,片段长度为553 bp[8]。引物由上海生工生物工程公司合成。
1.4 病毒分离 将活蜱或冻存的蜱分类后分组,饥饿蜱50~60只/组,饱血蜱10~20只/组,经70%乙醇和灭菌PBS消毒后研磨,加入1 000 IU/mL青霉素和链霉素双抗,5 000 r/min离心,取上清。将蜱悬液上清按0.5 mL/只剂量腹腔接种6~8周的BALB/c小鼠,每组接种2—3只。接种后每日观察小鼠发病情况,连续观察28 d,发病频死的小鼠无菌解剖取脑组织连续传代,至第3代取发病症状稳定的小鼠脑组织研磨,离心,取上清接种BHK-21细胞,37 ℃ 5%CO2条件下培养,往复盲传3代后观察细胞病变现象。
1.5 病毒基因序列分析和鉴定
1.5.1 RNA提取及PCR扩增 取第3代发病小鼠脑组织研磨液和病变细胞培养上清液提取病毒RNA,按照RNA提取试剂盒说明书操作,提取物溶于40 μL DEPC处理的去离子水,置于-70 ℃冷藏备用。按照一步法RT-PCR试剂盒说明书操作,扩增体系为25 μL,其中包括5 μL RNA 提取物,上下游引物(10 μmol/L)各1 μL。扩增条件:50 ℃反转录30 min;92 ℃热变性3 min;4轮热循环中,每轮循环92 ℃热变性10 s,52 ℃退火30 s,68 ℃扩增1 min;之后35 轮热循环中,每轮循环92 ℃热变性10 s,58 ℃退火20 s,68 ℃扩增20 s,最后68 ℃延伸3 min。取5 μL扩增产物进行1%(m/v)琼脂糖凝胶电泳鉴定。阳性扩增产物交上海生工生物工程公司测序。
1.5.2 基因序列分析 利用DNAstar 7.0 SeqMan 程序,将扩增序列与GenBank其它蜱传脑炎病毒序列进行比对,分析分离株的序列特征。
2 结 果
2.1 病毒分离 于2012年5月和2014年6月,在夏尔西里自然保护区山地森林草甸生境中采集成蜱1 971只,其中全沟硬蜱(Ixodespersulcatus)1 740只,占数量组成的88.29%,森林革蜱(Dermacentorsilvarum)220只,占数量组成的11.16%,边缘革蜱(Dermacentormarginatus)6只,占组成的0.30%,和嗜群血蜱(Haemaphysalisconcinna)5只,占组成的0.25%。按照不同种类和雌雄分组,共24组蜱接种BALB/c小鼠分离病原,其中全沟硬蜱21组,森林革蜱2组,嗜群血蜱1组。接种后16组小鼠发病,其中全沟硬蜱14组,森林革蜱2组。发病小鼠脑组织连续传至3代。发病小鼠可出现蜷缩、毛耸、食欲减退,并能导致神经症状和死亡。西伯利亚亚型能导致小鼠四肢麻痹,失去运动能力;远东型能导致小鼠后肢或一侧肢体麻痹。将第3代发病小鼠脑组织研磨上清液接种BHK-21细胞并盲传3代,细胞出现圆缩、脱落病变现象。对发病小鼠脑组织和细胞培养物进行蜱传脑炎病毒远东型FE和西伯利亚型S基因PCR扩增,发现13组为远东型,3组为西伯利亚型(表1)。
表1 2012—2014年中哈边境夏尔西里自然保护区蜱传脑炎病毒分离结果
Tab.1 Tick-borne encephalitis virus isolated from Charles Hilary in 2012 and 2014

病毒分离时间Isolationtime标本来源Source接种组数No.ofinoculation阳性组数及编号Positivenumber蜱传脑炎基因型Genetype2012年全沟硬蜱(♀)86(01A,04A,05A,06A,07A,08A)远东型全沟硬蜱(♂)75(09A,11A,12A,13A,14A)远东型森林革蜱(♀/♂)22(16A,17A)远东型2014年全沟硬蜱(♀)43(X3,X4,X5)西伯利亚型全沟硬蜱(♂)20嗜群血蜱(♀)10
2.2 病毒基因序列分析 用蜱悬液接种BALB/c小鼠,有16组小鼠发病。对16组第3代发病小鼠脑组织RNA提取物和16组BHK细胞病毒培养物RNA提取物进行远东型FE基因和西伯利亚型S基因PCR扩增,并进行序列比对分析,表明分离株01A、04A、05A、06A、07A、08A、09A、11A、12A、13A、14A、16A、17A为同一序列, 为蜱传脑炎病毒远东亚型,与我国东北分离毒株MDJ-02株、森张株核苷酸序列同源性为99.5%,氨基酸序列同源性99.8%,与俄罗斯境内Svetlogrie 株、Karalerovo 株序列同源性达到98%。X4,X5,X6序列相同,为蜱传脑炎病毒西伯利亚亚型,与俄罗斯西伯利亚南部地区检出的Kemerovo-49-08西伯利亚亚型毒株核苷酸97.8%、氨基酸98%。电泳结果见图1。
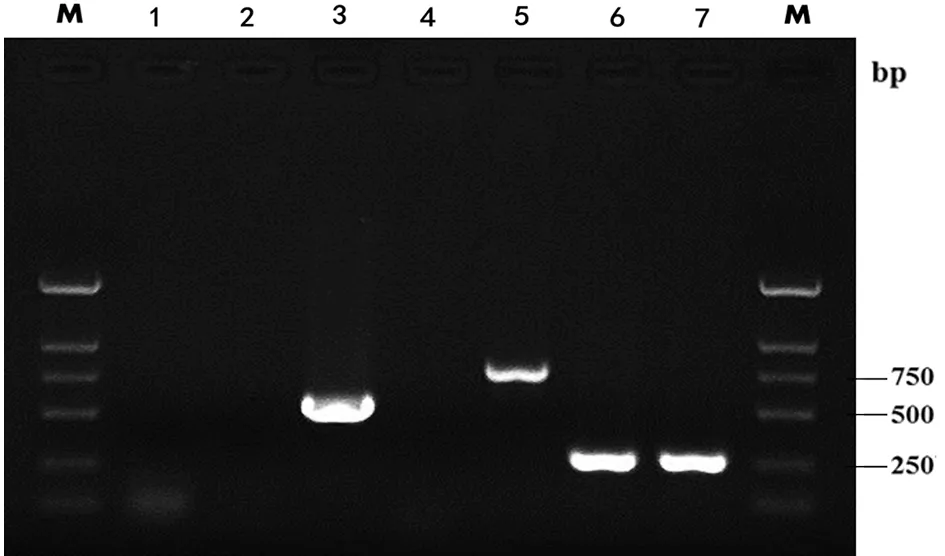
M: DNA Marker (DL2000);1: Negative control; 2: XJ-03A Negative result of Sib; 3: XJ-X5 Positive result of Sib; 4: XJ-X5 Negative result of FE ; 5: XJ-03A Positive result of FE; 6: XJ-03A Positive result of Flavivirus; 7: XJ-X 5 Positive result of Flavivirus图1 蜱传脑炎病毒远东型和西伯利亚型扩增结果Fig.1 RT-PCR product of Far-Eastern and Siberian subtypes of TBEV
3 讨 论
蜱传脑炎病毒3种亚型分布地区及传播媒介不同。欧洲亚型分布在中欧、东欧和北欧,传播媒介为蓖籽硬蜱(Ixodesricinus),远东亚型主要分布在俄罗斯远东和西伯利亚地区、中国北部、蒙古、日本以及巴尔干半岛国家,传播媒介为全沟硬蜱,西伯利亚亚型分布在俄罗斯西伯利亚地区、蒙古、芬兰、爱沙尼亚、拉脱维亚等国家,传播媒介也为全沟硬蜱,俄罗斯、爱沙尼亚、芬兰、拉脱维亚、蒙古等存在2种或3种亚型[9-11]。本研究从新疆中哈边境夏尔西里自然保护区全沟硬蜱和森林革蜱中分离出16株蜱传脑炎病毒,其中13株为远东亚型,3株为西伯利亚亚型。这是我国首次分离出西伯利亚亚型毒株,表明我国蜱传脑炎病毒也存在远东和西伯利亚2种亚型。全沟硬蜱为远东亚型和西伯利亚亚型的主要传播媒介,但是不同地区2种亚型在全沟硬蜱中的自然感染率不同,疫源地流行优势株也就不同。基于对E蛋白基因的PCR检测,俄罗斯远东地区全沟硬蜱远东亚型占70%,西伯利亚亚型占30%,在俄罗斯中部分离出的蜱传脑炎病毒株90%为西伯利亚亚型,10%为远东亚型,并且从蜱中检测到欧洲亚型,在俄罗斯西部西伯利亚亚型所占的比例继续上升,而远东亚型和欧洲亚型的比例下降[5]。本研究在夏尔西里自然保护区分离的蜱传脑炎病毒株中远东亚型占81.25%(13/16),西伯利亚亚型占18.75%(3/16),提示该疫源地以远东亚型为优势流行株。本研究从夏尔西里自然保护区同时分离出远东亚型和西伯利亚亚型,表明该地区蜱传脑炎疫源地存在蜱传脑炎病毒的两种亚型自然循环。在爱沙尼亚西部Laanemaa地区从鼠中分离到蜱传脑炎远东亚型,而在当地病人血样本中分离出欧洲亚型,表明在同一疫源地中存在着远东和欧洲两种亚型[12]。而本研究结果也进一步证实在同一块蜱传脑炎自然疫源地可同时存在两种亚型蜱传脑炎病毒。
不同蜱传脑炎亚型毒力和致病性不同,并且不同来源亚型分离株致病性也有明显不同。从俄罗斯远东和西伯利亚地区分离的Vasilchenko和Latvia-1-96西伯利亚亚型分离株致病性比远东亚型弱,但从西伯利亚Irkutsk地区分离的Irkutsk西伯利亚亚型分离株致病性比远东亚型毒力更强,西伯利亚亚型分离株(IR99-2f13和IR99-2f7)接种小鼠后存活率0%~10%,远东亚型(VL99-m11,D1283,KH98-5)接种小鼠后的存活率20%~50%,并且西伯利亚亚型分离株死亡的时间比远东亚型提前2-5 d[13]。在小鼠模型中,蒙古西伯利亚亚型分离株MGL-Selenge-13-14 毒力明显比分离株MGL-Selenge-13-12以及俄罗斯分离株IR99-2f7弱,并且由于毒力不同造成小鼠不同的临床症状[14]。本研究同时发现西伯利亚亚型与远东亚型所导致的小鼠神经症状不同,西伯利亚亚型可导致小鼠四肢麻痹失去运动能力,而远东亚型可导致小鼠后肢或一侧肢体麻痹。不同亚型病毒的毒力和致病性的差异也可能与所用的动物模型不同有关。
[1] Gritsun TS, Lashkevich VA, Gould EA. Tick-borne encephalitis[J]. Antiviral Res, 2003, 57: 129-146. DOI: 10.1016/S0166-3542(02)00206-1
[2]LYU Z, Liang GD. Advances in research on tick-borne encephalitis in China[J]. Chin J Epidemiol, 2009, 30(6): 641-643. DOI: 10.3760/cma.j.issn.0254-6450.2009.06.026 (in Chinese)
吕志,梁国栋.中国蜱传脑炎研究进展[J].中华流行病学杂志,2009,30(6):641-643.
[3]Sun X, Zhang GL, Liu R, et al. Tick-borne encephalitis endemic foci in Altai Mountains, Xinjiang, China[J]. Chin J Zoonoses, 2015, 31(12): 1189-1192. DOI: 10.3969/j.issn.1002-2694.2015.12.021 (in Chinese)
孙响,张桂林,刘然,等.新疆阿勒泰山地蜱传脑炎疫源地调查[J].中国人兽共患病学报,2015,31(12):1189-1192.
[4]Mansfield KL, Johnson N, Phipps LP, et al. Tick-borne encephalitis virus -a review of an emerging zoonosis[J]. J Gen Virol, 2009, 90: 1781-1794. DOI: 10.1099/vir.0.011437-0
[5] Suss J. Tick-borne encephalitis 2010: epidemiology risk areas and virus strains in Europe and Asia-an overview[J]. Ticks Tick Borne Dis, 2011, 2(1): 2-15. DOI: 10.1016/j.ttbdis.2010.10.007
[6]Lu Z, Michael B, Liang GD. Tick-borne encephalitis in mainland China[J]. Vec Borne Zoo Dis, 2008, 8(5): 713-720. DOI: 10.1089/vbz.2008.0028
[7] Zhang GL, Lin R, Sun X, et al. Investigation on the endemic foci of new emerged tick-borne encephalitis in Charles Hilary, Xinjiang[J]. Chin J Epidemiol, 2013, 34(5): 438-442. DOI: 10.3760/cma.j.issn.0254-6450.2013.05.006 (in Chinese)
张桂林,刘然,孙响,等.新疆夏尔西里自然保护区蜱传脑炎疫源地调查[J].中华流行病学杂志,2013,34(5):438-442.
[8] Daniel R, Hana S, Jan K, et al. Rapid subtyping of tick-borne encephalitis virus isolates using multiplex RT-PCR[J]. J Virol Methods, 2007, 144: 133-137. DOI: 10.1016/j.jviromet.2007.04.010
[9] Eckhardt P, Dieter G, Olaf Z. Tick-borne encephalitis (TBE) trends in epidemiology and current and future management[J]. Travel Med Infect Dis, 2010, 8: 233-245. DOI: 10.1016/j.tmaid.2010.08.001
[10] Sumilo D, Bormane A, Vasilenko V, et al. Upsurge of tick-borne encephalitis in the Baltic States at the time of political transition, independent of changes in public health practices[J]. Clin Microbiol Infect, 2009, 15(1): 75-80. DOI: 10.1111/j.1469-0691.2008.02121.x
[11] Anu EJ, Tapani T, Nathalie YU, et al. Siberian subtype tick-borne encephalitis virus, Finland[J]. Emerg Infect Dis, 2006, 12(10): 1568-1571. DOI: 10.3201/eid1210.060320
[12] Irina G, Sirkka V, Katarina BS, et al. Characterization of tick-borne encephalitis virus from Estonia[J]. J Med Virol, 2004, 74: 580-588. DOI: 10.1002/jmv.20224
[13]Daisuke H, Leonid I, Galina NL, et al. Distribution and characterization of tick-borne encephalitis viruses from Siberia and far-eastern Asia[J]. J Gen Viro, 2001, 82: 1319-1328. DOI: 10.1099/0022-1317-82-6-1319
[14] Memi M, Boldbaatar B, Bazartseren T, et al. Isolation and characterization of tick-borne encephalitis virus from Ixodes persulcatus in Mongolia in 2012[J]. Ticks Tick Borne Dis, 2015, 6: 623-629. DOI: 10.1016/j.ttbdis.2015.05.006
Isolation of tick-borne encephalitis virus Far-eastern subtype and Siberian subtype in the China-Kazakhstan border area in Xinjiang
ZHANG Gui-lin1, SUN Xiang1, LIU Ran1, ZHENG Zhong1, LIU Xiao-ming1, Yin Xiao-ping2
(1.CenterforDiseaseControlandPreventionofXinjiangMilitaryCommandRegion,Urumuqi830011,China; 2.AlashankouEntry-ExitInspectionandQuarantineBureau,Bole833418,China)
To investigate the genotype and the biological characteristics of Tick-borne encephalitis virus (TBEV) in Charles Hilary endemic foci in the China-Kazakhstan border area in Xinjiang, ticks were collected by flagging during May to June in 2012 and 2014, and were stored in liquid nitrogen. TBEV strains were isolated from tick samples by inoculating BALB/c mice and BHK-21 cells. The FE gene fragments of TBEV-Far and the S gene fragments of TBEV-Sib were detected by RT-PCR from infected mice brain tissue and BHK cells, and then subjected to sequence alignment. Totally 16 TBEV strains were isolated fromIxodespersulcatusandDermuceutersilvarum, among 13 strains were Far eastern subtype, three strains were Siberian subtype. It was first time that the TBEV-Sib was isolated in China. The Charles Hilary TBE natural foci were in the China-Kazakhstan border area, and both TBEV-Far and TBEV-Sib co-circulated.
Tick-borne encephalitis virus; TBEV-Far; TBEV-Sib; endemic foci; the border areas near Kazakhstan
10.3969/j.issn.1002-2694.2017.04.004
国家自然科学基金项目(No.U1303104)
1.新疆军区疾病预防控制中心,乌鲁木齐 830011; 2.阿拉山口出入境检验检疫局,博乐 833418 Email: xjglzhang@126.com
Supported by the National Natural Science Foundation of China (No. U1303104)
R373.3
A
1002-2694(2017)04-0312-04
2016-04-27 编辑:梁小洁
