微孔板稀释法检测结核分枝杆菌丙硫异烟胺耐药结果分析
2017-04-26苏碧仪谭耀驹吴爱武
苏碧仪,谭耀驹,吴爱武
微孔板稀释法检测结核分枝杆菌丙硫异烟胺耐药结果分析
苏碧仪1,谭耀驹2,吴爱武3
目的 以MGIT960快速药敏法为参照,微孔板稀释法检测结核分枝杆菌丙硫异烟胺耐药的效果。方法 采用MGIT960快速药敏(MGIT法)和微孔板稀释法对248株结核分枝杆菌临床分离株进行丙硫异烟胺药敏试验,检测结核分枝杆菌对该药物的耐药性。随机选取117株菌株进行该药物的11个浓度梯度(0.0625、0.125、0.25、0.5、1、2、4、8、16、32、64 μg/mL)的药敏检测,比较两种方法最低抑菌浓度的一致性。结果 MGIT法的平均检测时间为10.1 d,微孔板稀释法检测时间为8 d,两者差异有统计学意义(P<0.001)。与MGIT法测定结果比较,微孔板稀释法检测的敏感度为96.5%(55/57),特异度为93.2%(178/191),符合率为94.0%(233/248),Kappa值为0.84。两种方法所获得的MIC值的总一致率为81.2%(95/117), 其中在MIC值<8.0 μg/mL的分离株中,两种方法的一致率为86.3%(82/95);在MIC值≥8.0 μg/mL的分离株中,两种方法的一致率仅为59.1%(13/22)。结论 两种方法对丙硫异烟胺进行耐药检测有较高的一致性,但也存在一定的差异。微孔板稀释法比MGIT法简单,快速,适合用于结核分枝杆菌对丙硫异烟胺耐药性的快速检测。
结核分枝杆菌;丙硫异烟胺;药物敏感试验
世界卫生组织(WHO)结核病年度报告表明,结核分枝杆菌耐多药的比率呈上升趋势[1],严重威胁到人类的健康,成为了全球公共卫生问题。耐多药是指对利福平和异烟肼同时耐药,称为MDR-TB,MDR-TB是由于抗生素滥用和用药不规范造成的[2]。丙硫异烟胺是临床上用于治疗MDR-TB比较重要的二线药物[3],它的体外药敏的准确性和快速检测,对控制MDR-TB的传播很有价值。WHO把结核分枝杆菌药敏的金标准定为“比例法”[4],MGIT 960快速药敏(下简称MGIT法)就是比例法的一种,检测时间短、准确,对临床治疗有很好的指导作用,但由于MGIT 960快速药敏检测系统比较昂贵,阻碍了其在经济欠发达地区进行推广。微孔板稀释法药敏试验简单,成本低,而且可以同时检测多个浓度梯度[4],在很多抗结核药物检测中已经有推广,但关于丙硫异烟胺药敏检测的报道比较少。本研究旨在对微孔板稀释法与MGIT法检测结核分枝杆菌对丙硫异烟胺的药敏结果进行对比探讨。
1 材料与方法
1.1 菌株来源及试剂仪器
1.1.1 试验菌株 收集广州市胸科医院2014年的结核分枝杆菌菌株248株,均为经痰结核分枝杆菌培养阳性,菌种鉴定(基因芯片法[5])确定为结核分枝杆菌的菌株。所收集的菌株包含耐多药株(又称为MDR-TB,指结核分枝杆菌对利福平和异烟肼同时耐药)占26.2%(65/248)、泛耐药株(又称为XDR-TB,指结核分枝杆菌对任何喹诺酮类耐药,且至少对一种二线药物耐药的耐多药株)占3.2%(8/248)[6]、单耐药株(指结核分枝杆菌对一种一线药物耐药)占22.2%(55/248)、敏感株占25.4%(63/248),其它(至少对两种抗结核药耐药,但不包括MDR-TB和XDR-TB的耐药株)占23%(57/248)。质控菌株H37Rv由中国疾病预防控制中心国家结核病参比实验室提供。
1.1.2 主要试剂 丙硫异烟胺药物纯品,购自英国Fluorochem公司。Bactec MGIT 960培养管和Panta抑菌剂均由美国BD公司生产。Middlebrook 7H9 培养基干粉、Middlebrook OADC 购自美国BD公司。阿尔玛蓝(Alamar blue)显色剂购自美国BIO-RAD公司,用时稀释。
1.1.3 主要仪器设备 培养箱:湖北黄石恒丰医疗器械有限公司生产。 Bactec MGIT 960系统:美国BD公司生产。
1.2 检测方法
1.2.1 培养基的制备 按培养基配制说明书进行。
1.2.1.1 定性试验 Bactec MGIT 960培养管每组2支,每支加入0.8 mL OADC增菌剂,一支为对照管,另一支为含药管(丙硫异烟胺终浓度为2.5 μg/mL);定量试验:Bactec MGIT 960培养管每组12支,每支加入0.8 mLOADC增菌剂,一支为对照管,另外11支为含药管(丙硫异烟胺的浓度梯度为64、32、16、8、4、2、1、0.5、0.25、0.125、0.0625 μg/mL)。
1.2.1.2 7H9液体培养基 4.7 g干粉加入2 mL甘油,用蒸馏水定容到900 mL,于121 ℃高压灭菌20 min,冷却后放置4 ℃保存,临用时加入10 mL OADC增菌剂。
1.2.2 药敏试验
1.2.2.1 菌悬液的制备[7]研磨菌龄为2~3周的结核分枝杆菌培养物,配成1个麦氏比浊浓度(3×108CFU/mL)。MGIT法中,菌液作10倍和1 000倍稀释,配成3×107CFU/mL和3×105CFU/mL。微孔板稀释法中,菌液用7H9作10倍稀释,配成3×107CFU/mL。
1.2.2.2 接种、孵育、显色[7]①MGIT法:取500 μL、浊度为3×107CFU/mL菌液接种到含药管,取500 μL、浊度为3×105CFU/mL菌液接种到对照管中,装入专用药敏架,置Bactec MGIT 960系统内孵育。②微孔板稀释法:在96孔板中,每孔加入100 μL7H9培养基,在第12列加入95 μL 7H9培养基和5 μL丙硫异烟胺溶液(5 120 μg /mL),倍比稀释至第2列,得到从128~0.125 μg/mL的药液梯度,第1列为空白对照,每株菌接种一行,每孔加入100 μL稀释菌液。每批次均以H37Rv作为对照。96孔板用封口膜密封,37 ℃孵育7d后,每孔加入70 μL显色剂(Alarm blue:5%吐温—80=2∶5),隔天观察颜色变化。
1.2.2.3 结果判读标准[8]:①MGIT法:Bactec MGIT 960系统自动报告耐药或敏感结果,WHO推荐的耐药临界浓度为2.5 μg/mL。②微孔板稀释法:变红色为有菌生长,没有变红色,仍然是蓝色的为没菌生长,蓝色的孔所对应的最小药物浓度为药物的MIC值。耐药临界浓度为2.5 μg/mL。
1.3 质量控制 每批次药敏试验均用结核分枝杆菌标准菌株H37Rv(ATCC27294)作为敏感对照。
1.4 数据分析 试验数据采用SPSS 17.0软件进行分析处理,MGIT法和微孔板稀释法药敏试验测定时间的比较采用t检验,P<0.05表明差异有统计学意义。以MGIT法检测结果为参照,计算微孔板稀释法的特异度、敏感度和符合率,两种方法的一致性用Kappa检验,Kappa值≥0.75为一致性极好,Kappa值在0.4~0.75为一致性较好,Kappa值≤0.4时为一致性差。
2 结 果
2.1 微孔板稀释法和MGIT法检测结核分枝杆菌对丙硫异烟胺的药敏结果 微孔板稀释法和MGIT法检测丙硫异烟胺药敏所需时间的比较 MGIT法获得药敏结果的平均检测时间为10.1 d,微孔板稀释法获得结果的平均检测时间为8 d,较MGIT法早2.1 d,两者的差异有统计学意义(P<0.001),见表1。
表1 丙硫异烟胺药敏检测获得结果所需时间
Tab.1 The days required to get the results of drug susceptibility to PTO

检测方法Detectionmethod菌株数No.ofisolates平均测定时间(d)Theaveragetime测定时间范围(d)TimerangePMGIT法MGITmethod24810.15-13<0.001微孔板稀释法Thebrothdilutionmethod24888
2.2 微孔板稀释法与MGIT法检测丙硫异烟胺耐药性结果比较 对248例结核分枝杆菌临床分离菌株进行丙硫异烟胺的耐药性检测,以MGIT法测定结果为参照,微孔稀释方法检测丙硫异烟胺耐药性的敏感度为96.5%(55/57),特异度为93.2%(178/191),符合率为94.0%(233/248),经统计学分析(Kappa检验),两种方法的Kappa值为0.84,说明两种方法具有较好的一致性,见表2。
表2 微孔板稀释法与MGIT法检测丙硫异烟胺耐药性结果比较
Tab.2 Differences of drug resistance results to PTO between the broth dilution method and MGIT method

MGIT法MGITmethod耐药Resistance敏感Susceptibility敏感度(%)Sensitivity(%)特异度(%)Specificity(%)符合率(%)Concordancerate(%)Kappa微孔板稀释法Thebrothdilutionmethod耐药Resistance551396.593.294.00.84敏感Susceptibility2178
2.3 微孔板稀释法和MGIT法检测丙硫异烟胺MIC值结果比较(定量) 对117株结核分枝杆菌临床分离株进行丙硫异烟胺MIC检测,微孔板稀释法和MGIT法的一致率为81.2%(95/117)。在不同的MIC值范围内,两种方法药敏结果一致率有差异,在MIC值<8.0 μg/mL的分离株中,两种方法的一致率为86.3%(82/95),两种方法的一致性较好;在MIC值≥8.0 μg/mL的分离株中,一致率仅为 59.1%(13/22),见表3。
3 讨 论
耐多药结核病是全球比较严重的公共卫生问题,快速、准确的药敏试验,是耐多药结核病防控的首要条件,二线抗结核药物是临床抗结核治疗药物的重要组成部分。丙硫异烟胺是重要的二线抗结核药物之一,目前对于丙硫异烟胺的体外药物敏感性试验主要依靠固体比例法或者液体MGIT法,但是固体比例法所需时间较长,而MGIT法虽然大大缩短了检测时间,但是其检测成本较高,限制了其使用范围。微孔板稀释法由于其成本低廉、操作简便且检出时间短,目前广泛应用于临床检测结核分枝杆菌对一线和主要二线抗结核药物体外敏感性,但利用该方法进行丙硫异烟胺药敏检测的报道比较少,本研究评估了体外采用该方法进行丙硫异烟胺耐药性检测的可能性。结果表明,两种方法具有很好的一致性,且微孔板稀释法获得结果的检测时间比MGIT法短,MGIT法使用的设备比较昂贵,阻碍了该方法在经济水平低下地区推广,而微孔板稀释法操作简单、成本低、快速,和MGIT法一致性较好,且适用于多种其他药物同时开展[9],特别适合于基层实验室。
表3 微孔板稀释法和MGIT法检测丙硫异烟胺MIC值比较
Tab.3 The difference of PTO MIC between the broth dilution method and MGIT method
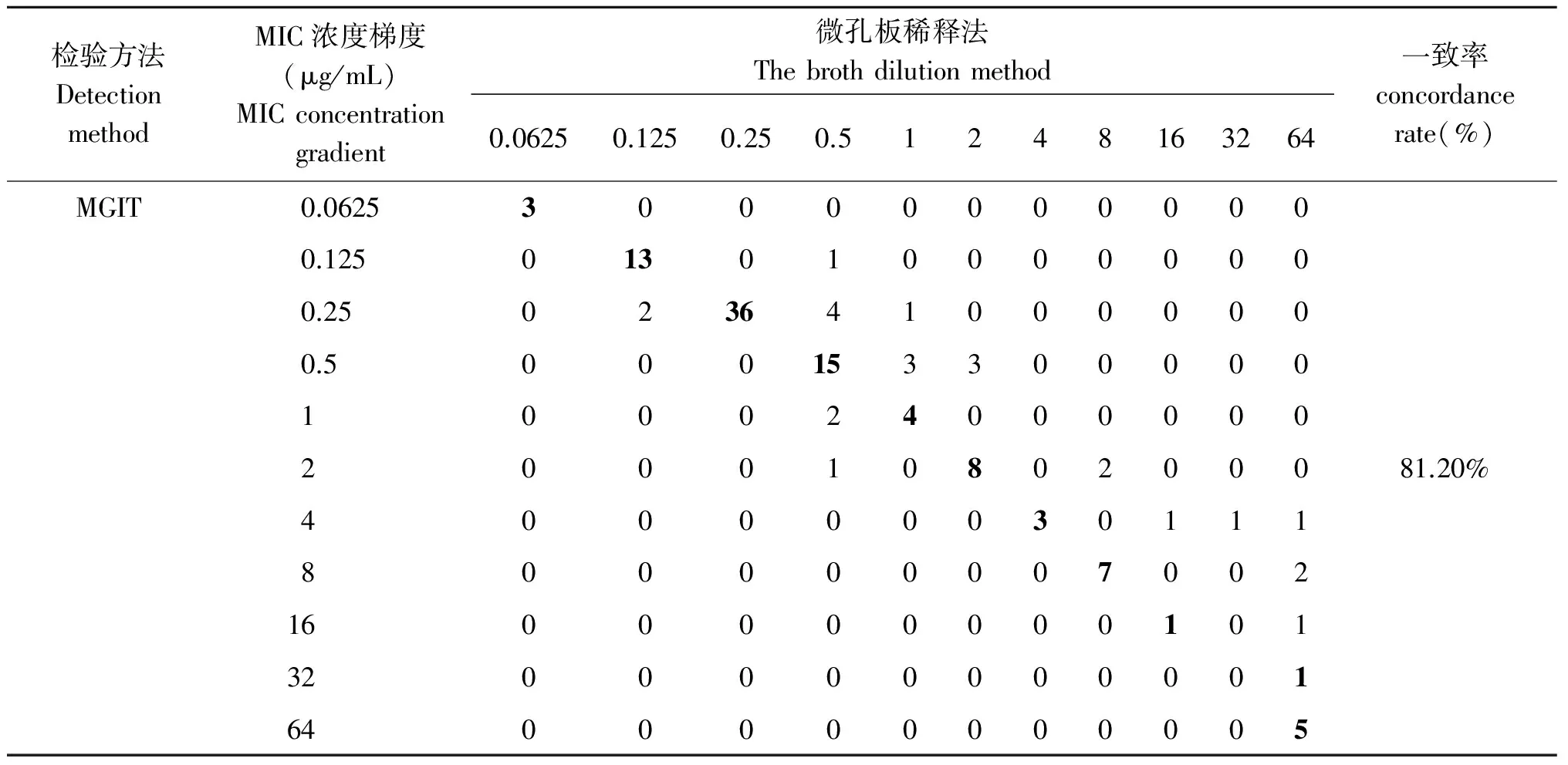
检验方法DetectionmethodMIC浓度梯度(μg/mL)MICconcentrationgradient微孔板稀释法Thebrothdilutionmethod0.06250.1250.250.51248163264一致率concordancerate(%)MGIT0.0625300000000000.1250130100000000.250236410000000.500015330000010002400000020001080200081.20%400000030111800000007002160000000010132000000000016400000000005
因为经费限制的原因,本研究在248株结核分枝杆菌中随机选择了117株进行定量的最低抑菌浓度(MIC)检测,结果发现对于敏感或者MIC较低的结核分枝杆菌而言,使用MGIT法和微孔板稀释法检测结核分枝杆菌对丙硫异烟胺的MIC具有较高的一致性。但是对于高浓度耐药的结核分枝杆菌(MIC>8.0 μg/mL)而言,两者的一致率明显较低,表现为以微孔板稀释法MIC检测值高于MGIT法检测值为主。有文献报道,乙胺丁醇的微孔板稀释法药敏试验也存在高浓度MIC值一致率较低的问题[10]。分析导致上述不一致的原因,首先可能是结核分枝杆菌本身生物学性质决定的,该菌在液体培养基中常聚集在一起呈“索状生长”,此特性使细菌难以完全均匀地分布在稀释液中,而微孔板稀释法的培养基体积仅200 μL,因为培养基量少,在液体培养基中因“索状生长”导致菌体聚集时,单位培养基体积里的细菌数比设定的菌数可能更多,容易使检测到的MIC值比实际高;但MGIT法液体培养基的体积却有7 mL,较大的培养体积缓冲了分枝杆菌聚集生长,对结果的影响起了一定的作用。其次,两种方法的检测原理存在一定差异,MGIT法是基于比例法检测,其判读结果标准为含药管中生长单位小于100判为敏感;而微孔板稀释法其判读结果时最低抑菌为完全抑制结核分枝杆菌生长的浓度,也就是说,生长单位小于100的菌株用MGIT法是判读为敏感而微孔板稀释法判读为耐药;有文献报道[11],耐药菌株的生长速率明显慢于敏感菌株,而丙硫异烟胺的耐药判定浓度折点为2.5 μg/mL,MIC值≥8.0 μg/mL的分离株为高度耐药菌株,当生长单位小于100时,用MGIT法判读为敏感而微孔板稀释法判读为耐药,因此两种方法原理的差异导致微孔板稀释法检测结果可能高于MGIT法。本研究提示当使用微孔板稀释法检测结核分枝杆菌的最低抑菌浓度时,对于高度耐药的结核分枝杆菌(MIC>8.0 μg/mL)而言其检测结果可能偏高。虽然如此,由于微孔板稀释法对丙硫异烟胺的耐药判定浓度折点为2.5 μg/mL,这个折点浓度远远<8.0 μg/mL,因此,使用此方法不影响对结核分枝杆菌丙硫异烟胺耐药性的检测。
总的来说,对结核分枝杆菌进行丙硫异烟胺耐药性检测,微孔板稀释法和MGIT法相比,检测结果一致性较好,且成本低、快速,值得在经济发展低下的偏远地区推荐使用。
[1] Home DJ, Pinto LM. Diagnostic accuracy and reproducibility of WHO-endorsed phenotypic drug susceptibility testing methods for first-line and second-line antituberculosis drugs[J]. J Clin Microbiol, 2013, 51(2):393-401.DOI:10.1128/JCM.02724-12
[2] Fang Q, Chen HG, Wang YN, et al. Multidrug-resistant tuberculosis (MDR-TB), 102 cases of drug resistance condition and resistance analysis of the causes[J]. J Practic Med, 2002, 18(10):1074-1075. (in Chinese)
方琼,陈洪光,王云南,等.耐多药结核病102例耐药状况及耐药原因分析[J].实用医学杂志,2002,18(10):1074-1075.
[3] Thee S, Garcia-Prats AJ, Donald PR, et al. A review of the use of ethionamide and prothionamide in childhood tuberculosis[J]. Tuberculosis, 2016, 97:126-136. DOI:10.1016/j.tube.2015.09.007
[4] Wu J, Gui XH, Li J, et al. Compare the proportion method and absolute concentration method for detecting mycobacterium tuberculosis drug sensitive[J]. Chin J Lab Med, 2011, 34(2):137-138. (in Chinese)
武洁,桂晓红,李静,等.比例法和绝对浓度法检测结核分枝杆菌药敏试验的比较[J].中华检验医学杂志,2011,34(2):137-138.
[5] Li XF, Liang GL, Pu D, et al. Application evaluation of gene chip technology in the identification ofMycobacteriumspecies and determination of anti-tuberculosis drug resistance[J]. Chin J Lab Diagn, 2015, 19(2):204-207. (in Chinese)
李晓非, 梁贵亮, 普冬, 等. 基因芯片技术在分枝杆菌菌种鉴定和结核耐药性检测中的应用及评价[J]. 中国实验诊断学, 2015, 19(2):204-207.
[6] Shi XC, Liu XQ. Multidrug-resistant TB diagnosis, treatment and prevention strategies[J]. J Peking Union Medical College Hospital, 2011, 02(4):305-309. (in Chinese)
侍效春,刘晓清.耐多药结核病的诊断、治疗和防治策略[J].协和医学杂志,2011,02(4):305-309.
[7] Zhang D, Wang Y, Lu J, et al.Invitroactivity of β-lactams in combination with β-lactamase inhibitors against multidrug-resistantMycobacteriumtuberculosisisolates[J]. Antimicrob Agents Chemother, 2015, 60(1):393-399. DIO:10.1128/AAC.01035-15
[8] World Health Organization. Policy guidance on drug-susceptibility testing (DST) of second-line antituberculosis drugs[R]. Geneva, WHO, 2008.
[9] Lu Y, Wang B, Zheng MQ, et al. Study of Alamar blue and MTT assays for determining the MIC of anti-tuberculosis drugs[J]. Chin J Anti-tuberc, 2007, 29(6):499-501. (in Chinese)
陆宇,王彬,郑梅琴,等.应用Alamar Blue和MTT测定抗结核药物最低抑菌浓度的研究[J].中国防痨杂志,2007,29(6):499-501.
[10] Sun Q, Zhao LL, Chen Y, et al. Comparison on the detection effects of three methods forMycobacteriumtuberculosisethambutol sensitivity test[J]. Chin J Anti-tuberc, 2015, 37(4):366-370. (in Chinese)
孙庆,赵丽丽,陈燕,等.三种方法进行结核分枝杆菌-乙胺丁醇药物敏感性试验的比较[J].中国防痨杂志,2015,37(4):366-370.
[11] Krüüner A, Yates MD, Drobniewski FA. Evaluation of MGIT 960-based antimicrobial testing and determination of critical concentrations of first-and second-line antimicrobial drugs with drug-resistant clinical strains ofMycobacteriumtuberculosis[J]. J Clin Microbiol, 2006, 44(3):811-818. DOI:10.1128/JCM.44.3.811-818.2006
Wu Ai-wu, Email:aiwwu66@163.com
Broth dilution method for the resistance ofMycobacteriumtuberculosisisolates to protionamide
SU Bi-yi1, TAN Yao-ju2, WU Ai-wu3
(1.GuangzhouMedicalUniversity,GuangzhouChestHospital,Guangzhou510182,China; 2.GuangzhouChesthospital,Guangzhou510095,China; 3.GuangzhouMedicalUniversity,Guangzhou510182,China)
We compared the MGIT 960 method, the reference, and the broth microdilution method for detecting the susceptibility ofMycobacteriumtuberculosisisolates to protionamide (PTO). We performed drug susceptibility testing for 248M.tuberculosisclinical isolates to PTO using MGIT 960 and broth microdilution method. In addition, a total of 117 isolates were randomly selected for further evaluation of the consistency of the minimal inhibitory concentrations determined by these two methods, and eleven concentrations of PTO had been involved accordingly (0.062 5, 0.125, 0.25, 0.5, 1, 2, 4, 8, 16, 32, 64 μg/mL). The MGIT method showed an average detection time of 10.1 days, while the detection period of broth microdilution method was 8 days, and the difference was statistically significant (P<0.001). In addition, the rate of the sensitivity, specificity and concordance between these two methods was 96.5% (55/57), 93.2% (178/191), and 94.0% (233/248), respectively. The Kappa value was 0.84. Comparison of the MIC values detected by different methods revealed that the overall concordance rate was 81.2% (95/117). For the isolates harboring low MIC values (MIC<8.0 μg/mL), the concordance rate was 86.3% (82/95), while that of the isolates with high MIC values was only 59.1% (13/22). In conclusion, our data demonstrate that the broth microdilution method showed excellent concordance with MGIT method for detecting the resistance rate ofM.tuberculosisisolates to PTO, indicating that the broth microdilution method with available performance, short turn-around time and convenient manual operation was suitable for rapid detection ofM.tuberculosisto PTO.
Mycobacteriumtuberculosis; protionamide; drug susceptibility test
10.3969/j.issn.1002-2694.2017.04.013
吴爱武,Email: aiwwu66@163.com
1.广州医科大学/广州市胸科医院,广州 510182; 2.广州市胸科医院,广州 510095; 3.广州医科大学金域检验学院,广州 510182
R378.9
A
1002-2694(2017)04-0357-05
2016-07-29 编辑:张智芳
