搅拌和通气对裂殖壶菌LX0809产DHA的影响
2017-04-25王杰鹏郗大兴
王杰鹏,罗 瑶,郗大兴
(吉林省希玛生物科技有限公司,吉林辽源136200 )
搅拌和通气对裂殖壶菌LX0809产DHA的影响
王杰鹏,罗 瑶,郗大兴
(吉林省希玛生物科技有限公司,吉林辽源136200 )
利用一株生产DHA专利菌株裂殖壶菌LX0809,在10 L全自动发酵罐中考察了16个搅拌转速和通气量组合对裂殖壶菌LX0809发酵产DHA的影响。生物量和总油脂的产量随搅拌转速和通风量的增加而增加,DHA占总油脂比例随搅拌转速和通风量的增加而降低,最终确定通气量为全程0.3 m3/h(通气比0.83),搅拌转速为前40 h 400 r/min,后56 h 300 r/min。发酵96 h放罐,细胞生物量92 g/L,油脂质量浓度52.3 g/L,DHA占总油脂含量为40.2%,DHA发酵产量高达21 g/L。
裂殖壶菌;DHA;发酵;搅拌;通气
二十二碳六烯酸(docosahexaenoicacid,简称DHA),属于n-3系列长链多不饱和脂肪酸,是大脑神经视觉细胞中重要脂肪酸成分,占大脑脂肪酸的25%~33%。DHA在胎儿和婴幼儿大脑及视觉系统发育过程中占有重要地位[1-3]。同时DHA有提高机体免疫力、阻止肿瘤细胞的异常增生[4-6]、降低心血管疾病发生概率等作用[7-8]。
DHA主要来源有南极磷虾油、深海鱼油和DHA藻油[9]。DHA藻油是唯一得到美国FDA认可的儿童DHA补充剂来源,有DHA含量大于35%和大于40%两种产品规格。DHA藻油的发酵菌株主要有裂殖壶菌、吾肯氏壶藻[10]和寇氏隐甲藻等。裂殖壶菌由于其生长繁殖快、发酵周期短、抗剪切力强、油脂产量高等优点,是发酵法生产DHA藻油的理想菌株。
生物量、总油脂产量和DHA占总油脂含量是评价裂殖壶菌发酵法生产DHA藻油的主要指标。本文中,笔者拟通过2因素4水平研究搅拌转速和通气量对发酵结果的影响,并通过搅拌转速分段控制实验来获得最优的发酵条件。
1 材料和方法
1.1 菌株
裂殖壶菌LX0809,由本企业筛选保藏。保藏号:CGMCC No.3535,已获菌种专利[11]授权。
1.2 培养基
种子培养基(g/L):葡萄糖30,酵母粉5,蛋白胨5,Na2SO412,MgSO42,KH2PO41,CaCl20.3。
发酵培养基(g/L):酵母粉15,谷氨酸钠20,MgSO45,KH2PO45,Na2SO412,CaCl20.6;微量元素(mol/L)为泛酸钙5×10-6、硼酸5×10-6、VB121×10-6、MnCl2·4H2O 5×10-6、ZnSO4·7H2O 5×10-6、CoCl2·6H2O 1×10-6、Na2MoO4·2H2O 1×10-6、CuSO4·5H2O 3×10-6、 NiSO4·6H2O 3×10-6、FeSO4·7H2O 3×10-6。
1.3 分析方法
1.3.1 葡萄糖浓度的检测方法
取1 mL发酵液用去离子水定容到一定体积,取1 mL稀释液10 000 r/min离心5 min,使用生物传感分析仪SBA-40D(山东省科学院)检测上清液葡萄糖浓度。
1.3.2 生物量的检测方法
取10 mL发酵液10 000 r/min离心5 min后弃上清液,再用10 mL去离子水悬浮菌体,然后10 000 r/min离心5 min弃上清液,收集菌体,105 ℃烘干至恒质量称量。
1.3.3 总油脂产量的检测方法
取1 g干燥菌粉加入20%HCl溶液7 mL,75 ℃水浴振荡40 min后,用20 mL正己烷抽提脂质,真空旋转蒸发器去尽溶剂,得到脂质称量[12]。
1.3.4 DHA占总油脂含量的检测方法
油样的脂肪酸甲酯化方法、安捷伦7890B气相检测方法和DHA甘油三酯质量百分含量计算方法,参照GB26400—2011食品添加剂 二十二碳六烯酸油脂(发酵法)。
1.4 10 L发酵罐培养条件
10 L全自动不锈钢发酵罐(上海保兴)中装液量为6 L,121 ℃原位在线灭菌20 min。发酵接种量为5%,罐压为0.05 MPa,温度为28 ℃,发酵pH为6.0,使用5 mol/L NaOH和2 mol/L H2SO4水溶液自动调节pH,残糖质量浓度低于10 g/L开始流加600 g/L葡萄糖,并保持残糖质量浓度为10 g/L左右,搅拌转速和通气量根据实验方案设置。
2 结果与讨论
2.1 搅拌转速和通气量对发酵结果的影响
DHA藻油的产品质量标准主要有35%和40%两种。如果发酵液中DHA含量低于40%,则必须经过冬化工艺以提高藻油中DHA含量到40%以上。为了探索在发酵液中提高DHA含量到40%的最优发酵条件,考察搅拌转速和通气量对DHA生产的影响。在10 L发酵罐中考察搅拌转速(r/min):200、300、400、500和通气量(m3/h):0.2、0.3、0.4、0.5(对应通气比:0.56、0.83、1.11、1.39),借助正交分析的方法研究2个因素各4个水平的16个组合对裂殖壶菌LX0809发酵产DHA藻油的生物量(dry cell weight)、总油脂产量(total fatty acids)、DHA占总油脂含量3个指标的影响。除搅拌和通气外,所有实验条件都相同,发酵实验结果如下表1所示,正交结果分析如表2所示。

表1 发酵实验结果

表2 正交试验结果分析
借助正交分析方法研究搅拌和通气对发酵结果的影响,优选当DHA质量分数为40%,同时获得尽可能多的总油脂产量的发酵工艺条件。
(a) 以生物量为指标,随着搅拌速度和通气量的提高,生物量越大;并且搅拌速度极差为72.75,大于通气量所得极差27.50,说明搅拌转速对生物量的影响效果更明显。
(b) 以总油脂产量为指标,随着搅拌速度和通气量的提高,总油脂的产量越大;并且搅拌速度极差为54.175,大于通气量所得极差20.050,说明搅拌转速对总油脂产量的影响效果更明显。
(c) 以DHA占总油脂含量为指标,随着搅拌速度和通气量的提高,DHA占总油脂含量越低;搅拌速度极差大小为11.325,大于通气量所得极差3.925,说明搅拌转速对DHA占总油脂含量的影响效果更明显。
综上所述,通过搅拌和通气调节DHA发酵过程的摄氧率,生物量及总油脂产量随着搅拌和通气的增大而增加,而DHA占总油脂的含量随着搅拌和通气的增大而降低。其中搅拌的影响效果明显大于通气,当搅拌速度为200和300 r/min时,DHA质量分数可以达到40%,但是生物量和总油脂产量偏少。
2.2 搅拌速度分段控制实验
裂殖壶菌发酵生产DHA油脂主要分为两个阶段:生长繁殖阶段和油脂积累阶段[13]。生物合成DHA的代谢路径主要有依赖O2的脂肪酸合成(FAS)途径和不依赖O2的多聚乙酰合成酶(PKS)途径[13-14]。研究表明裂殖壶菌合成DHA的路径是类似于细菌的PKS途径[15],且裂殖壶菌细胞内两个脂肪酸合成酶系同时存在[12]。摄氧率(OUR)是单位时间内单位体积发酵液中微生物摄取氧的量,记作r(O2)(mmol/(L·h)),即每小时每升发酵液的氧气实际消耗量。发酵前期主要进行细胞数量积累,油脂含量少,摄氧率高有利于细胞繁殖;在发酵的中后期油脂积累阶段,氮源基本耗尽,细胞繁殖减弱,用于维持细胞增殖的O2需求下降。而PKS途径不依赖O2,因此发酵中后期摄氧率相对大小能够反映细胞用于中短链饱和脂肪酸合成的FAS酶系的活力相对强弱。所以通过改变通气和搅拌调节发酵体系摄氧率,可以调节FAS路径的合成效率。摄氧率低有利于抑制中短链饱和脂肪酸合成,进而改变油脂中脂肪酸的组成比例。
本实验考察发酵前期400 r/min、后期300 r/min,分段转速控制对裂殖壶菌发酵产DHA藻油的影响。发酵40 h左右,氮磷源基本耗尽(数据未显示),因此搅拌转速切换时间选择为40 h。由于通气对发酵结果的影响相对偏小,通风量全程为0.3 m3/h(通气比0.83)。分段转速控制发酵结果如表3所示,分段转速控制发酵代谢曲线如图1所示。
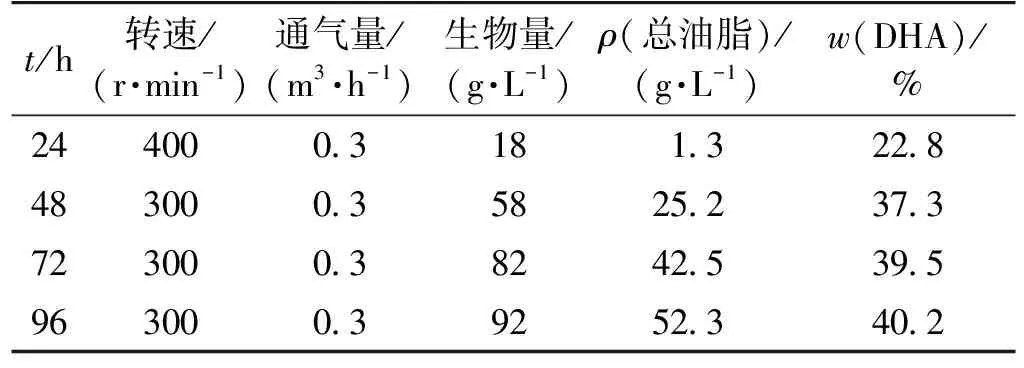
表3 搅拌分段控制发酵结果
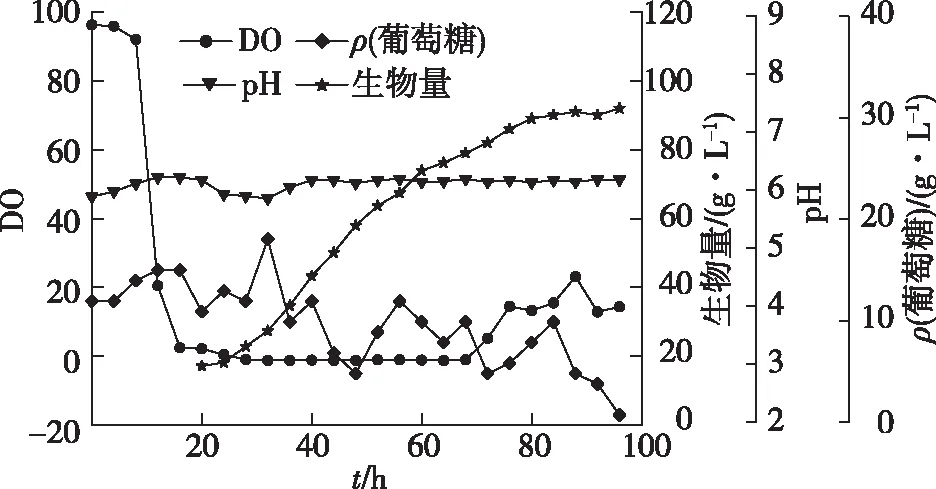
图1 搅拌分段控制发酵代谢曲线Fig.1 Metabolic curve of the stepwise agitation fermentation
由图1可知:通过搅拌转速的分段控制,在前40 h生长繁殖阶段,搅拌转速为400 r/min,40 h左右细胞进入油脂积累阶段,搅拌转速降为300 r/min。发酵96 h放罐,DHA占总油脂含量由48 h的37.3%提高到40.2%,生物量由48 h的58 g/L提高到92 g/L,总油脂产量从48 h的25.2 g/L提高到52.3 g/L,发酵后期48 h生物量的增长量基本都是油脂的积累。在过低的搅拌转速下,尽管DHA含量较高,达到44.3%,却导致细胞繁殖数量偏少,在96 h放罐时生物量和总油脂产量较低。
Ren等[15-16]报道在1.5 t发酵罐中发酵132 h,生物量71 g/L,总油脂产量35.17 g/L,DHA占总油脂含量44.82%,DHA产量15.76 g/L。本研究通过优化搅拌转速和通气量,发酵96 h生物量92 g/L,总油脂产量52.3 g/L,DHA占总油脂含量40.2%,DHA产量21 g/L。该发酵技术发酵周期短,且可以不经冬化工艺直接生产含量40%以上的DHA藻油,具有明显的竞争优势。
3 结论
本研究采用前40 h搅拌速度400 r/min,后56 h搅拌速度300 r/min的分段转速控制工艺,通气0.3 m3/h(通气比0.83),裂殖壶菌LX0809发酵96 h,生物量和总油脂仅略低于转速400 r/min、通气0.3 m3/h(通气比0.83)的实验,但是DHA的含量达到40.2%;DHA的含量略低于转速全程300 r/min、通气0.3 m3/h(通气比0.83)的实验,但是生物量达到92 g/L,总油脂产量达到52.3 g/L。既保证发酵96 h生物量和总油脂产量较高,也使DHA占总油脂含量达到40%。除搅拌和通气外,发酵罐中摄氧率还可能受到培养基、发酵温度、罐压、发酵罐结构等因素影响,后续将围绕摄氧率对裂殖壶菌LX0809发酵产DHA藻油的影响进行更加深入的研究。
[1] NETTLETON J A.Aren-3 fatty acids essential nutrients for fetal and infant development? [J].J Am Diet Assoc,1993,93:58-64.
[2] INNIS S M.Fatty acids and early human development[J].Early Human Deve,2007,83(12):761-766.
[3] NEWTON I.Long-chain polyunsaturated fatty acids:the new frontier in nutrition[J].Lipid Technol,1998,10:77-81.
[4] SIDDIQUI R A,HARVEY K,STILLWELL W.Anticancer properties of oxidation products of docosahexaenoic acid[J].Chem Phys Lipids,2008,153(1):47-56.
[5] BERQUIN I M,MIN Y,WU R,et al.Modulation of prostate cancer genetic risk by omega-3 and omega-6 fatty acids[J].J Clin Invest,2007,117(7):1866-1875.
[6] HUNG P,KAKU S,YUNOKI S,et al.Dietary effect of EPA-rich and DHA-rich fish oils on the immune function of Sprague-Dawley rats[J].Biosci Biotechnol Biochem,1999,63:135-140.
[7] MASSON S,LATINI R,TACCONI M,et al.Incorporation and washout ofn-3 polyunsaturated fatty acids after diet supplementation in clinical studies[J].J Cardiovasc Med,2007,8:S4-S10.
[8] COVINGTON M B.Omega-3 fatty acids[J].Am Fam Physkian,2004,70(1):133-140.
[9] SIJTSMA J,SWAAF ME de.Biotechnological production and applications of theω-3 polyunsaturated fatty acid docosahexaenoic acid[J].Appl Microbiol Biotechnol,2004,64:146-153.
[10] COHEN Z,RATLEDGE C.Single cell oil Emicrobial and algal oils[M].2nd ed.Urbana:AOCS Press,2010.
[11] 杨勇,郗大兴.一种海洋真菌裂殖壶菌(Schizochytrium)LX0809及其工业应用:10000055.4[P],2010-01-06.
[12] HAUVERMALE A,KUNER J,ROSENZWEIG B,et al.Fatty acid production inSchizochytriumsp.:involvement of a polyunsaturated fatty acid synthase and a type I fatty acid synthase[J].Lipids,2006,41(8):739-747.
[13] 常桂芳.氧对裂壶藻利用甘油产 DHA 影响机制及其高密度发酵的研究[D].无锡:江南大学,2013.
[14] QIU X.Biosynthesis of docosahexaenoic acid(DHA,22:6-4,7,10,13,16,19):two distinct pathways[J]. Prostagland,Leukotri Essent Fatty Acids,2003,68(2):181-186.
[15] REN L J,JI X J,HUANG H,et al.Development of a stepwise aeration control strategy for efficient docosahexaenoic acid production bySchizochytriumsp.[J].Appl Microbiol Biotechnol,2010,87:1649-1656.
[16] QU L,JI X J,REN L J,et al.Enhancement of docosahexaenoic acid production bySchizochytriumsp.using a two-stage oxygen supply control strategy based on oxygen transfer coefficient[J].Appl Microbiol,2010,52:22-27.
(责任编辑 管珺)
Effects of agitation and aeration on DHA production bySchizochytriumLX0809
WANG Jiepeng, LUO Yao, XI Daxing
(JiLin Xima Biotechnology Co.,Ltd.,Liaoyuan 136200,China)
StrainSchizochytriumLX0809 that could accumulate DHA was used in this study.The effects of agitation and aeration on DHA production were investigated in a 10-L fermenter with 16 fermentation experiments.Dry cell weight and total fatty acids increased with the increase of agitation and aeration,whereas DHA content decreased with the increase of agitation and aeration.Total fatty acids and DHA content increased under the optimal condition when the aeration was 0.3 m3/h,and agitation was kept at 400 r/min for the first 40 h and 300 r/min for latter 56 h.Dry cell weight,DHA in total fatty acids, DHA content and the DHA yield reached 92 g/L,52.3 g/L,40.2% and 21 g/L,respectively.
Schizochytrium; DHA; fermentation; agitation; aeration
10.3969/j.issn.1672-3678.2017.01.003
2016-03-10
国家高技术研究发展计划(863计划) (2014AA021701)
王杰鹏(1984—),男,四川绵阳人,研究方向:发酵工程,E-mail:wangjiepeng1999@163.com
R282.71
A
1672-3678(2017)01-0016-04
