菊糖芽孢乳杆菌利用麸皮水解液发酵生产D乳酸
2017-04-25孙骏飞何冰芳
孙骏飞,周 成,何冰芳,吴 斌
(1.南京工业大学生物与制药工程学院,江苏南京211800;2.扬子江药业集团有限公司,江苏泰州225321;3.南京工业大学 药学院,江苏南京211800)
菊糖芽孢乳杆菌利用麸皮水解液发酵生产D乳酸
孙骏飞1,周 成2,何冰芳3,吴 斌1
(1.南京工业大学生物与制药工程学院,江苏南京211800;2.扬子江药业集团有限公司,江苏泰州225321;3.南京工业大学 药学院,江苏南京211800)
考察菊糖芽孢乳杆菌YBS1-5利用麸皮的水解液发酵生产D-乳酸的性能。首先研究了不同蛋白酶对麸皮中蛋白组分的水解效率,优选酸性蛋白酶并对其进行水解工艺的优化,最终其水解液中的含氮量为4.6 g/L,水解效率为85.8%。对酸性蛋白酶的水解液残渣进行稀酸预处理后,利用纤维素酶对其进行酶解。通过批次补料酶解,水解液中的还原糖质量浓度达141.2 g/L,其中葡萄糖质量浓度为138.1 g/L、木糖质量浓度为1.4 g/L。利用麸皮的蛋白酶水解液和纤维素酶水解液替代葡萄糖和酵母粉发酵制备D-乳酸。在96 h内,D-乳酸产量达99.5 g/L,生产速率达1.04 g/(L·h),转化率89.1%。
D-乳酸;麸皮;菊糖芽孢乳杆菌;碳源;氮源
D-乳酸不仅是多种手性化合物合成的前体,而且在提高聚乳酸材料热稳定性等方面具有重要作用[1]。目前,D-乳酸主要是通过微生物发酵获得的。培养基中葡萄糖和酵母膏的成本占整个生产成本的68%左右[2]。因此,很多研究者已经开始寻找廉价的原料进行D-乳酸的发酵生产。目前已有利用纸板[2]、米糠[2]、玉米芯[3]和甘蔗汁[3]等作为D-乳酸发酵的碳源,另外也有利用花生粉[4]、豆粕粉[5]以及棉籽粕[6]作为D-乳酸发酵的氮源[3-6],这些方法显著降低了D-乳酸的生产成本。但使用不同的原料分别作为碳氮源仍存在原材料的供给和运输成本等问题[2]。如能寻找一种廉价生物质作为碳氮源,将进一步降低D-乳酸的生产成本。
我国的小麦种植面积巨大,麸皮是小麦的最外层表皮组织,我国每年麸皮产量接近2.0×107t[7]。麸皮含有丰富的蛋白组分,廖福真等[8]利用麸皮作为L-乳酸生产的氮源,发酵液中乳酸质量浓度达116.31 g/L。Favaro等[9]利用麸皮作为碳源制备乙醇,最终糖和乙醇的转化率达95%。然而,目前还未有同时利用麸皮作为碳源和氮源制备D-乳酸的报道。
在前期工作中,笔者所在课题组选育获得一株菊糖芽孢乳杆菌突变株YBS1-5,其以葡萄糖和酵母粉作为碳氮源,发酵制备D-乳酸的产量达到125.3 g/L[3]。本研究中,笔者分别利用蛋白酶和纤维素酶对麸皮进行水解,考察菌株YBS1-5利用水解液作为碳氮源发酵制备D-乳酸的性能,以期为D-乳酸的低成本和高效制备提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种
菊糖芽孢乳杆菌YBS1-5(CCTCC M 2012516),由实验室成员自行诱变选育获得(专利申请号:201310414127.3)。
1.1.2 培养基
平板培养基(g/L):葡萄糖2,酵母粉1,蛋白胨2,KH2PO42,无水乙酸钠2,MgSO40.2。
种子培养基(g/L):葡萄糖 20,酵母粉 1,蛋白胨 2,MgSO40.2,麸皮 2,CaCO314。
基础发酵培养基(g/L):葡萄糖 150,酵母粉 5, MgSO40.5,CaCO390。
以上培养基pH都为7.0。
1.2 方法
1.2.1 蛋白酶水解性能的考察及其水解条件的优化
将木瓜蛋白酶、酸性蛋白酶、碱性蛋白酶以及中性蛋白酶(均购自于江苏锐阳生物科技有限公司)按操作手册上的条件和用量以质量分数20%的底物酶解6 h,测定水解液中的含氮量。在优选蛋白酶的基础上,分别在质量分数15%、17%和20%底物浓度下酶解6 h,测定水解液的含氮量和氮回收率。进而在最优条件下,考察蛋白酶的水解进程曲线,研究水解时间对麸皮酶解效率的影响。
1.2.2 纤维素酶水解条件优化
1)麸皮的蛋白酶水解残渣的稀酸预处理。把烘干的蛋白酶水解液残渣按质量分数20%的底物浓度,利用2%的H2SO4进行高温(125 ℃)处理150 min,待处理完成后利用蒸馏水清洗至中性烘干备用。
2)纤维素酶水解条件的优化。分别按质量分数5%、10%、15%和20%的底物浓度和10 FPU/g麸皮干质量的纤维酶添加量进行酶解72 h,测定水解液中的还原糖浓度。在最佳底物浓度的条件下,分别添加5、10、15、20和25 FPU/g麸皮残渣的纤维素酶,考察不同的酶添加量对酶解效率的影响。批次补料酶解的初始底物质量分数为10%,纤维素酶添加量为20 FPU/g麸皮残渣,酶解12 h后分别利用两种方式进行补料水解:①一次性补加10%的底物及其相应的纤维素酶;②补加5%的底物及相应的纤维素酶,水解24 h后再补加5%的底物及相应的纤维素酶。两组的最终底物质量分数都为20%,测定两种方式下酶解液中的还原糖浓度。
1.2.3 利用水解液进行D-乳酸发酵
利用纤维素酶水解液和蛋白酶水解液替代发酵培养基中的葡萄糖和酵母粉进行D-乳酸的发酵实验。培养温度37 ℃,转速100 r/min。进行定期取样,测定发酵液中的残糖含量和D-乳酸含量。
1.2.4 分析方法
1)麸皮组分的测定。根据国标GB 5009.9—2008测定麸皮中淀粉含量,根据国标GB/T 5009.5—2003测定麸皮中脂肪含量,根据NREL法测定麸皮中面的纤维素、半纤维素以及木质素的含量,根据国标GB 50095—2010测定麸皮中蛋白质含量,根据国标GB 5009.4—2010测定麸皮中灰分含量[10]。
2)D-乳酸的定量分析。本研究中产物的光学纯度采用高效液相色谱手性法(HPLC)进行检测:手性柱Sumichiral CA 5000(Sumika Chemical Analysis Service,Japan),柱温35 ℃,流动相1 mmol/L CuSO4溶液,流速1.0 mL/min,检测波长254 nm(UV)。
3)葡萄糖的检测。发酵液中的葡萄糖浓度由山东省科学院生物研究所生产的SBA生物传感分析仪进行测定。
4)酶解液含氮量的测定。本实验中酶解液的含氮量由济南海能公司生产的K9860型凯氏定氮仪测定。
5)纤维素酶酶活的测定。分别利用滤纸和4-硝基苯基-β-D-吡喃葡萄糖苷为底物测定纤维素酶的滤纸酶活和β-葡萄糖苷酶酶活。经测定,纤维素酶的滤纸酶活为343 U/g,β-葡萄糖苷酶酶活为318 U/g。
6)糠醛、5-羟甲基糠醛的测定。采用Chromasil C18(Allteck)的色谱柱,20%的甲醇作为流动相,流速设定为1 mL/min,在284 nm的波长下进行检测,柱温为30 ℃。
7)总酚含量的测定。按照文献[11]所述,将1 mL的样品加到2.5 mL福林-酚试剂和4 mL 12% Na2CO3溶液中,在45 ℃反应1.5 h,反应终止后利用分光光度计在756 nm处测定其吸光值,以香草醛为标准物质绘制标准曲线。
2 结果与讨论
2.1 麸皮组分的测定
本研究首先测定麸皮的组成成分,结果表明麸皮中蛋白质质量分数达到19.7%(表1),含氮量较为丰富,而在前期研究过程中发现菊糖芽孢乳杆菌YBS1-5对氮源等营养物质需求较少[3],其最佳的酵母粉添加量为5 g/L,麸皮中的蛋白含量完全能够满足D-乳酸发酵生产的需求。

表1 小麦麸皮的组成
2.2 蛋白酶水解条件的优化
2.2.1 蛋白酶种类的选择
目前,廉价废弃物的蛋白质水解可分为酸水解和酶水解两种方法,而酶水解对材料中营养物质的破坏较少,是目前较为常用的方法[4]。按照操作手册的添加量和水解条件,研究不同蛋白酶对麸皮的酶解(表2),考察蛋白酶种类对水解效率的影响,结果如图1所示。由图1可知:碱性蛋白酶和酸性蛋白酶水解效率较高,分别为57.1%和51.5%。所以初步选取碱性蛋白酶和酸性蛋白酶,进一步优化其水解工艺。不同的原材料水解时所选用的蛋白酶也有所差异。王文高等[12]利用中性蛋白酶、碱性蛋白酶、风味蛋白酶等3种蛋白酶对大米中的蛋白质进行水解,最终选用碱性蛋白酶水解酶类,水解效率能够达到75%。欧克勤等[13]利用风味蛋白酶、中性蛋白酶以及碱性蛋白酶对米糠中的蛋白质进行溶解性实验,结果表明中性蛋白酶对于米糠中的溶解性最为明显(达56%)[13]。

表2 蛋白酶的参数

图1 蛋白酶对麸皮水解效率的影响Fig.1 Effects of protease on wheat bran hydrolysis efficiency
2.2.2 底物麸皮的浓度对蛋白酶水解效率的影响
考察不同的底物浓度对蛋白酶水解效率的影响,结果如图2所示。由图2可知:在底物质量分数为15%的条件下,酸性蛋白酶和碱性蛋白酶水解液中的含氮量分别为4.04和3.99 g/L,氮回收率为85.4%和84.3%。当底物质量分数增加到17%时,两种蛋白酶水解液中的含氮量分别为4.53和4.36 g/L,有较大提升,其氮回收率为84.5%和81.3%,略微下降。而进一步增加麸皮浓度,则水解液中的含氮量和氮回收率都有明显下降。此外,在最佳的底物浓度下,酸性蛋白酶的效率要高于碱性蛋白酶。因此,选择酸性蛋白酶按质量分数17%的底物浓度进行酶解。

图2 不同底物浓度对蛋白酶水解效率的影响Fig.2 Effects of different substrate concentration on hydrolysis efficiency by acid protease
2.2.3 酸性蛋白酶水解时间的选择
考察酸性蛋白酶水解时间对其水解效率的影响,结果如图3所示。由图3可以发现:酸性蛋白酶在前8 h内酶解效率较高,氮回收率较高,随着时间的延长,酶解液中的氮回收率和氮浓度在8 h之后增长缓慢,所以最终选取的最适酶解时间是8 h。酸性蛋白酶水解液中氮的质量浓度可达到4.6 g/L,氮回收率能够达到85.8%。

图3 水解时间对酸性蛋白酶水解效率的影响Fig.3 Effects of hydrolysis time on hydrolysis efficiency by protease
徐忠等[14]利用木瓜蛋白酶提取麸皮中的蛋白质成分,水解6 h后最终的提取率能够达到44.34%。隋明等[15]通过中性蛋白酶去除小麦麸皮中的蛋白质,水解1 h后,蛋白质残留为8.47%。
2.2.4 利用酸性蛋白酶水解液进行发酵实验
由于酵母粉中的氮含量为10%左右,若要代替发酵培养基中的酵母粉(5 g/L),每升发酵培养基需添加酸性蛋白酶水解液110 mL。分别以酵母粉和水解液为氮源进行菌株YBS1-5的发酵研究,结果如图4所示。由图4可知:在初始糖为150 g/L时,经过84 h的发酵后,其发酵液中的乳酸质量浓度分别达121.3和114.2 g/L,糖酸转化率为90.1%和89.1%,产酸速率为1.44和1.35 g/(L·h)。这表明酸性蛋白酶的水解液可用于替代酵母粉,作为菌株YBS1-5发酵的氮源。John等[16]使用蛋白酶处理后的麸皮水解液进行L-乳酸的生产,发现该种方法可以使酵母提取物的使用量降低到原来的1/10。

图4 酸性蛋白酶水解液发酵实验结果Fig.4 Fermentation experiment results of with wheat bran hydrolysate by acid protease
2.3 纤维素酶水解条件的优化
由于木质纤维素材料的结晶度高,为提高酶解效率需要对其进行预处理,而稀酸法是目前比较常用的预处理方法[17]。本研究利用该技术对麸皮蛋白酶处理残渣进行预处理,获得的固体残渣组分如表3所示,由表3可知:经过稀酸处理后,麸皮残渣中的半纤维素含量大幅下降,而纤维素和木质素含量有所增加。
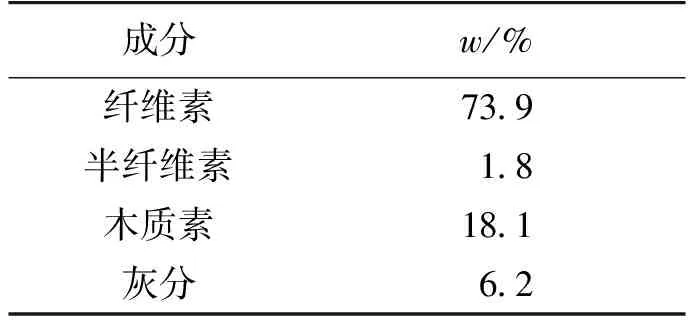
表3 麸皮残渣中的各组分含量
2.3.1 底物浓度对纤维素酶水解效率的影响
考察底物浓度对纤维素酶水解效率的影响,结果如图5所示。由图5可知:在5%的底物浓度下,其水解液中水解效率最高达到76.1%,但是酶解液中还原糖质量浓度为33.1 g/L;当底物质量分数达到15%时,其酶解液中的还原糖质量浓度达到最高,为93.2 g/L,转化率为71.3%;随后,当底物质量分数为20%,其酶解液还原糖浓度和转化率都有大幅下降。通过对酶解液中的还原糖浓度和酶解效率综合考虑,最终选取15%的底物浓度作为纤维素酶的酶解底物浓度。
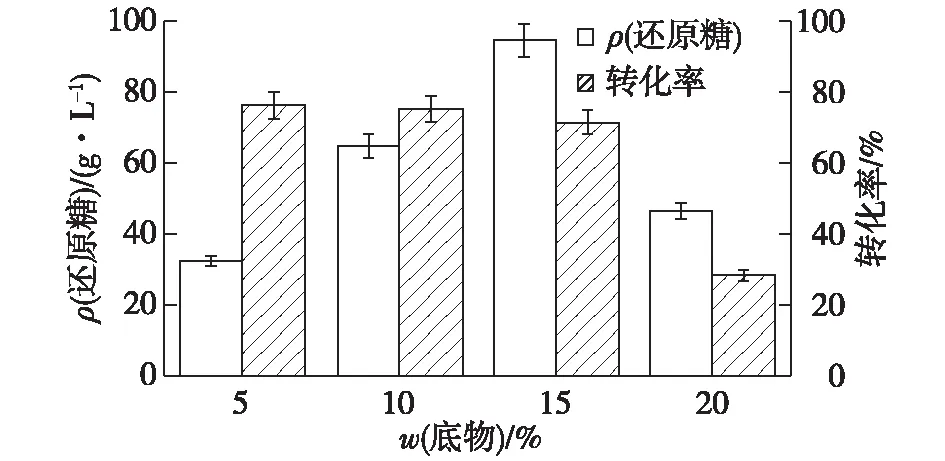
图5 底物浓度对还原糖浓度和转化率的影响Fig.5 Effects of substrate concentration on reducing sugar concentration and conversion rate
2.3.2 纤维素酶添加量的优化
进一步考察不同纤维素酶添加量对纤维素酶水解效率的影响,结果如图6所示。由图6可知:随着纤维素酶添加量的增加,酶解液中的还原糖浓度逐步提高,但是当加酶量达到20 FPU/g麸皮残渣时,水解液还原糖质量浓度为114.6 g/L,转化率可达87.1%,而后进一步增加酶量,酶解效率提升较少。综合考虑,选择20 FPU/g麸皮残渣为最终的加酶量。
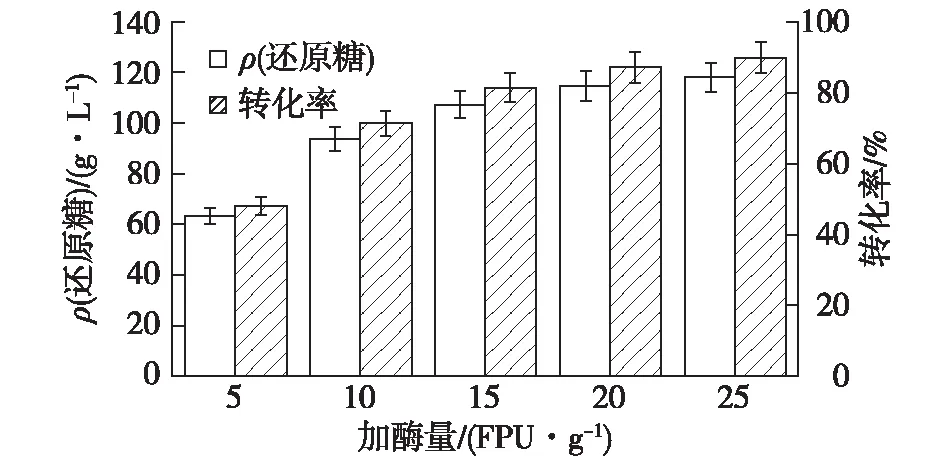
图6 加酶量对还原糖浓度和转化率的影响Fig.6 Effects of enzyme dosage on reducing sugar concentration and conversion rate
2.3.3 纤维素酶酶解时间的优化
考察酶解时间对纤维素酶酶解效率的影响,结果见图7。由图7可知:在初始的12 h内,还原糖浓度增加较快;随着时间的延长,酶解液糖浓度和转化率的增加量逐渐减少,达到48 h后,酶解液中还原糖质量浓度为109.6 g/L,纤维素转化率达83.4%。而进一步增加酶解时间还原糖浓度基本不变,因此选择48 h作为酶解时间。
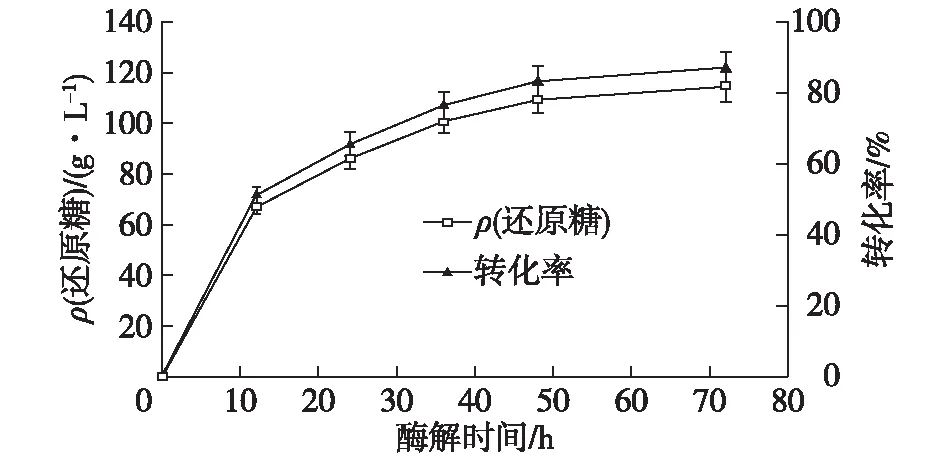
图7 酶解时间对酶解效率的影响Fig.7 Effects of time on enzymatic hydrolysis efficiency
2.3.4 纤维素酶酶解过程分批补料的研究
由于单批次的纤维素酶水解液中最终的还原糖浓度只能达到109.6 g/L,与D-乳酸发酵常用的发酵糖质量浓度(150 g/L)相差较大。许多研究已报道,通过分批补料的方式进行纤维素的酶解,不仅有利于底物和纤维素酶的充分接触,而且在水解液中残留的纤维素酶也得到了良好的利用,克服了高底物浓度所存在的问题[18-19]。因而利用分批补料方式来提高水解液中的糖浓度。通过酶解进程曲线发现在整个酶解过程的前12 h内,纤维素酶的酶解效率能够达到总效率的60%。考察两种补料方式酶解液中还原糖浓度和纤维素酶水解效率的影响,结果如图8所示。由图8可以发现:通过一次补料的方式能够使得纤维素酶水解液中的还原糖质量浓度得到大幅提升(129.4 g/L),但要低于两次补加的方式(141.2 g/L),两次补加的方式中,葡萄糖浓度接近于D-乳酸发酵的初始糖浓度。
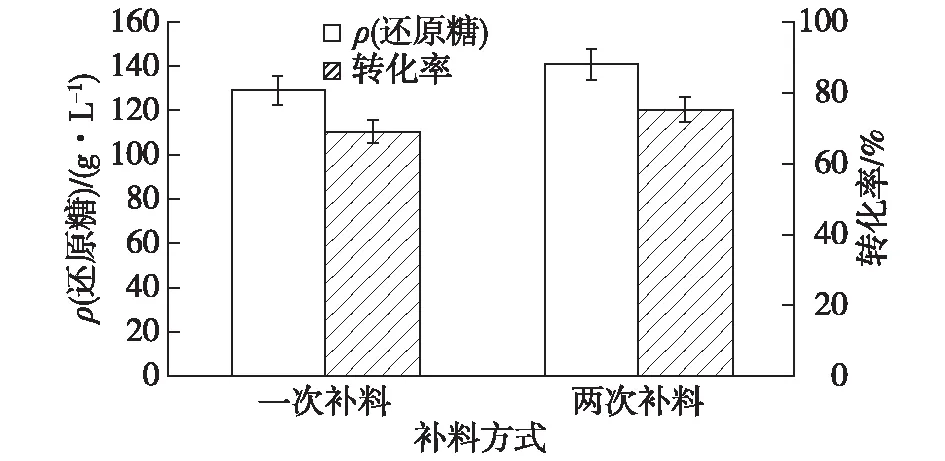
图8 不同补料方式对糖浓度和转化率变化的影响Fig.8 Effects of different fed-batch on reducing sugar concentration and conversion rate
2.4 利用麸皮的蛋白酶水解液和纤维素酶水解液发酵制备D-乳酸
利用纤维素酶水解液和蛋白酶水解液替代酵母粉和葡萄糖进行D-乳酸的发酵实验,结果如图9所示。在纤维素酶的水解液中添加蛋白酶水解液后,经测定,最终培养基葡萄糖质量浓度达122.8 g/L。通过图9可以发现:在122.8 g/L的初始葡萄糖浓度下,经过96 h发酵,发酵液中D-乳酸质量浓度为99.5 g/L,转化率为89.1%,产酸速率为1.04 g/(L·h),由于在菊糖芽孢乳杆菌YBS1-5中无代谢木糖的关键酶,所以在该发酵液中的木糖无法利用,其浓度保持不变。而该菌通过利用初始糖质量浓度为124.7 g/L的葡萄糖酵母粉培养基,发酵84 h后,发酵液中乳酸质量浓度可达104.1 g/L,转化率为90.9%,产酸速率可达1.24 g/(L·h)。结果表明,利用麸皮作为原料的D-乳酸产量接近利用葡萄糖和酵母粉的产量,但发酵时间较长。木质纤维素在稀酸预处理过程中会产生糠醛、5-羟甲基糠醛、酚类等多种发酵抑制物[20],笔者进一步检测了麸皮发酵培养基中各抑制物的浓度,发现糠醛和5-羟甲基糠醛的浓度基本检测不到,而总酚类物质的质量浓度为0.23 g/L,总酚类物质可能是菌株YBS1-5发酵时间延长的主要因素。
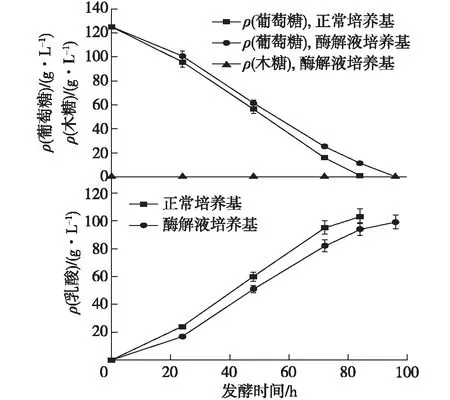
图9 D-乳酸发酵的进程曲线Fig.9 Fermentation process of hydrolyzate
2.5 D-乳酸生产过程的物料衡算
目前,D-乳酸的生产主要是利用葡萄糖和酵母粉作为碳氮源进行生产的,本研究利用麸皮作为碳氮源发酵生产D-乳酸。两种发酵原料成本的初步核算如表4所示。由表4可知:以麸皮为原料的价格低于葡萄糖和酵母粉,该技术还实现了农业废弃物资源的再利用,具有良好的经济价值。此外,随着纤维素酶产业的进一步发展,该工艺的原料成本将进一步下降。
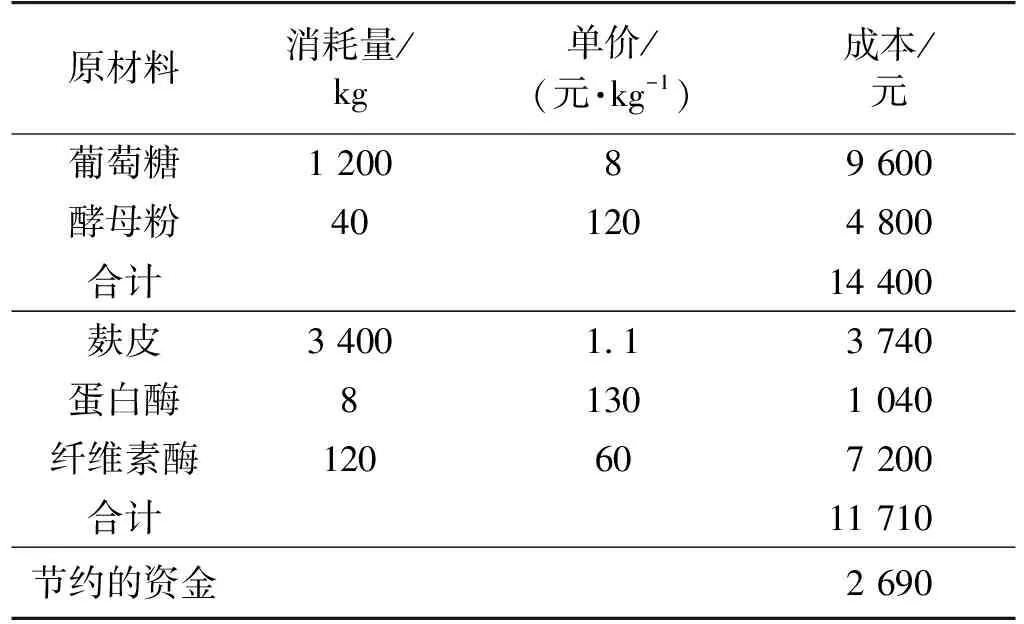
表4 生产1 t乳酸的碳氮源成本比较
3 结论
利用蛋白酶和纤维素酶对小麦麸皮进行处理,蛋白酶水解条件:酸性蛋白酶、质量分数17%的底物、酶解8 h,最终的酶解液含氮量可达4.6 g/L,水解效率为85.8%。纤维素酶水解条件:经两次分批补料,总底物质量分数达20%,纤维素酶添加量为20 FPU/g、酶解时间72 h,酶解液还原糖质量浓度达141.2 g/L,其中葡萄糖质量浓度可达138.1 g/L,木糖质量浓度为1.4 g/L。最终通过纤维素酶水解液和蛋白酶水解液代替葡萄糖和酵母粉进行D-乳酸发酵,经过96 h后,发酵液D-乳酸质量浓度达99.5 g/L,转化率为89.1%,产酸速率达1.04 g/(L·h),最终通过物料衡算发现,每生产1 t乳酸可节约资金2 690元。本研究以麸皮的蛋白酶水解液和纤维素酶水解液为碳氮源,利用菊糖芽孢乳杆菌YBS1-5发酵制备D-乳酸,为廉价农业废弃物发酵制备D-乳酸的深入研究提供了基础,极大地降低了原材料的成本。
[1] 许婷婷,柏中中,何冰芳.D-乳酸制备研究进展[J].化工进展,2009,28:991-996.
[2] AKAO S,NAGARE H,MAEDA M,et al.Combined use of sugars and nutrients derived from young maize plants for thermophilic L-lactic acid fermentation[J].Ind Crops Prod,2015,69:440-446.
[3] BAI Z,GAO Z,SUN J,et al.D-lactic acid production bySporolactobacillusinulinusYBS1-5 with simultaneous utilization of cottonseed meal and corncob residue[J].Bioresour Technol,2016,207:346-352.
[4] WANG L,ZHAO B,LI F,et al.Highly efficient production of D-lactate bySporolactobacillussp. CASD with simultaneous enzymatic hydrolysis of peanut meal[J].Appl Microbiol Biotechnol,2010,89:1009-1017.
[5] NGUYEN C M,KIM J S,NGUYEN T N,et al.Production of L- and D-lactic acid from wasteCurcumalongabiomass through simultaneous saccharification and cofermentation[J].Bioresour Technol,2013,146:35-43.
[6] HAMA S,MIZUNO S,KIHARA M,et al.Production of D-lactic acid from hardwood pulp by mechanical milling followed by simultaneous saccharification and fermentation using metabolically engineeredLactobacillusplantarum[J].Bioresour Technol,2015,187:167-172.
[7] AKHTAR M,TARIQ A F,AWAIS M M,et al.Studies on wheat bran arabinoxylan for its immunostimulatory and protective effects against avian coccidiosis[J].Carbohydr Polym,2012,90:333-339.
[8] 廖福真,黄康宁,徐颖,等.不同氮源种类对米根霉RM167-12发酵生产L-乳酸的影响[J].广西轻工业,2011(9):33-34.
[9] FAVARO L,BASAGLIA M,Casella S.Processing wheat bran into ethanol using mild treatments and highly fermentative yeasts[J].Biomass Bioenergy,2012,46(46):605-617.
[10] 杨月欣.中国食物成分表[M].北京:北京大学医学出版社,2002.
[11] 赵晓娟,李敏仪,黄桂颖,等.Folin-Ciocalteu法测定苹果醋饮料的总多酚含量[J].食品科学,2013,34(8):31-35.
[12] 王文高,陈正行,姚惠源.不同蛋白酶提取大米蛋白质的研究[J].粮食与饲料工业,2002(2):41-42.
[13] 欧克勤,林立,王亚琴,等.不同蛋白酶处理对米糠蛋白溶解性的影响[J].食品科技,2009(2):157-159.
[14] 徐忠,薄凯.小麦麸皮木瓜蛋白酶法提取工艺研究[J].哈尔滨商业大学学报(自然科学版),2007,23(6):729-732.
[15] 隋明,邱春丽,张俊苗.中性蛋白酶去除小麦麸皮中蛋白的技术参数的研究[J].包装与食品机械,2013(3):18-21.
[16] JOHN R P,NAMPOOTHIRI K M,PANDEY A.Simultaneous saccharification and L-(+)-lactic acid fermentation of protease-treated wheat bran using mixed culture ofLactobacilli[J].Biotechnol Lett,2006,28:1823-1826.
[17] AIMEIDA J R,MODIG T,PETERSSON A,et al.Increased tolerance and conversion of inhibitors in lignocellulosic hydrolysates bySaccharomycescerevisiae[J].J Chem Technol Biotechnol,2007,82:340-349.
[18] Chen M,Zhao J,Xia L.Enzymatic hydrolysis of maize straw polysaccharides for the production of reducing sugars[J].Carbohydr Polym,2008,71:411-415.
[19] CAO Y,TAN H.Structural characterization of cellulose with enzymatic treatment[J].J Mol Struct,2004,705:189-193.
[20] BAI Z,GAO Z,HE B,et al.Effect of lignocellulose-derived inhibitors on the growth and D-lactic acid production ofSporolactobacillusinulinusYBS1-5[J].Bioproc Biosys Eng,2015,38:1-9.
(责任编辑 管珺)
D-lactic acid fermentation using hydrolysate of wheat bran bySporolactobacillusinulinus
SUN Junfei1,ZHOU Cheng2,HE Bingfang3,WU Bin1
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China;2.Yangtze River Pharmaceutical Group,Taizhou 225321,China;3.College of Pharmacy,Nanjing Tech University,Nanjing 211800,China)
The performance of D-lactic acid fermentation using hydrolysate of wheat bran bySporolactobacillusinulinusYBS1-5 was investigated. Considering the differences of hydrolysis efficiency by different protease of wheat bran, we setected acid protease and optimized the hydrolysis condition.The nitrogen concentration of hydrolysate was 4.6 g/L and the hydrolysis efficiency was 85.8%.Using cellulase to hydrolyze wheat bran that was pretreated by diluted acid.By the optimal fed-batch, the reducing sugar concentration in the hydrolysate was 141.2 g/L,glucose concentration was 138.1 g/L and xylose concentration was 1.4 g/L.We used the hydrolysate as carbon source and nitrogen source to produce D-lactic acid.After 96 h fermentation,the concentration of D-lactic acid was 99.5 g/L,the rate of production was 1.04 g/(L·h) and the conversion ratio was 89.1%.
D-lactic; wheat bran;Sporolactobacillusinulinus; carbon source; nitrogen source
10.3969/j.issn.1672-3678.2017.01.001
2016-04-19
国家重点基础研究发展计划(973计划)(2011CB707405);江苏省自然科学基金(BK201411456)
孙骏飞(1990—),男,河北沧州人,研究方向:生物化工;吴 斌(联系人),副研究员,E-mail:wubin1977@njtech.edu.cn
Q815
A
1672-3678(2017)01-0001-07
