柯萨奇病毒腺病毒受体在肺癌中的表达和意义
2017-04-24董元焕孙蕾娜战忠利
董元焕,孙蕾娜,战忠利
柯萨奇病毒腺病毒受体在肺癌中的表达和意义
董元焕1,孙蕾娜2,战忠利2
目的:明确柯萨奇病毒腺病毒受体(CAR)在正常肺组织、癌旁组织及肺癌组织中的表达情况以及在体外CAR失表达对人肺鳞状细胞癌NCI-H520细胞增殖与侵袭迁移的影响。方法:收集肺癌手术切除新鲜标本100例及其对应的癌旁组织和正常肺组织,应用免疫组织化学、Western blot和RT-PCR法检测CAR蛋白和mRNA的表达情况;在体外运用RNAi技术建立稳定的低表达CAR的人肺鳞状细胞癌NCI-H520细胞系,用平板克隆形成实验和Transwell侵袭及迁移实验观察RNAi抑制CAR基因表达对NCI-H520肺癌细胞增殖与侵袭迁移的影响,并通过建立动物模型动态观察瘤体的生长。结果:免疫组织化学结果显示,CAR阳性率为48%。Western blot法检测CAR蛋白和RT-PCR检测CAR mRNA在肺癌组织中明显高于正常肺组织和癌旁组织。筛选得到三组CAR基因表达受到抑制的NCI-H520稳定细胞系。半定量RT-PCR和Western blot结果显示,三组稳定细胞系中CAR mRNA和蛋白质表达均有不同程度的下降,其中shRNA-2抑制作用最强。平板克隆形成实验显示,shRNA-2抑制CAR基因表达后,NCI-H520细胞的增殖能力有所下降(P>0.05),Transwell侵袭及迁移实验显示,NCI-H520细胞侵袭迁移能力明显下降(P<0.05)。动物模型结果显示,抑制CAR的表达,则动物体内移植瘤的生长就会缓慢。结论:CAR与肺癌形成和进展有关,并能够促进肺癌细胞的侵袭和迁移活动。裸鼠肺癌移植瘤模型构建成功,为以后肺癌的研究奠定基础。利用RNAi有效抑制了CAR基因的表达,并抑制NCI-H520细胞在裸鼠体内瘤体的生长,CAR有望成为肺癌基因治疗的靶点之一。
柯萨奇病毒腺病毒受体;Western blot;逆转录聚合酶链反应;平板克隆形成实验;移植瘤模型
柯萨奇病毒腺病毒受体(coxsackievirus and adenovirus receptor,CAR)是柯萨奇B组病毒(coxsackie B virus,CBV)和腺病毒(adenovirus,Ad)与靶细胞结合的共同受体,于1997年通过免疫亲和层析的方法得到分离和识别[1]。CAR属于细胞粘附分子中的免疫球蛋白超家族[2],由365个氨基酸组成的I型跨膜糖蛋白。目前的研究表明:CAR一方面作为黏附分子[3],在“维系”细胞与细胞之间“紧密连接”的过程中起着极其关键的作用;另一方面作为病毒受体,在介导病毒侵入细胞的过程中也发挥着重要作用。近年来的多项研究发现,CAR与多种肿瘤的发生发展也有关,且在不同的肿瘤中具有不同的生物学行为。本实验对100例非小细胞肺癌组织进行免疫组织化学检测及Western blot方法与RT-PCR方法检测,采用RNA干扰抑制人肺鳞癌细胞系NCI-H520中CAR基因表达,并建立NCI-H520裸鼠皮下移植瘤模型,观察CAR对肺癌的发生发展及肿瘤生长的影响。
1 资料和方法
1.1 标本来源 收集天津医科大学附属肿瘤医院手术切除的新鲜手术标本100例及其对应的正常及癌旁组织,均经术后病理证实为非小细胞肺癌。男70例,女30例;年龄31~77岁,中位年龄54岁。标本收集严格按照无菌操作,在手术中收集的标本立即放入液氮中,迅速冰冻,放入-80℃保存。
1.2 细胞系 肺癌细胞NCI-H520、LTEP-2、A549三种细胞系由天津医科大学附属肿瘤医院生物治疗与免疫实验室惠赠。NCI-H446和H1299两种细胞系由天津医科大学附属肿瘤医院生化实验室惠赠。五种细胞株均培养于含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基中,并在含5%CO2的37℃孵箱中培养。
1.3 实验方法 各亚型人非小细胞肺癌共100例,每例包括癌、癌旁及正常肺组织。分两组:(1)进行石蜡组织切片和免疫组织化学染色,观察CAR的表达(2)取新鲜组织进行RT-PCR、Western blotting定量检测CARmRNA及蛋白表达。对高表达CAR人肺癌细胞系进行两组实验:(1)SiRNA静默CAR表达。(2)空白对照,采用平板克隆形成法检测细胞生长增殖能力采用Transwell侵袭实验检测细胞体外侵袭力。
1.4 动物实验 建立RNAi抑制CAR基因表达的肺鳞状细胞癌NCI-H520稳定表达细胞系,将CAR基因沉默的NCI-H520细胞移植于裸鼠体内构建移植瘤模型。
1.5 统计学分析 实验均重复三次,计量实验数据以均值标准差(±s)表示,应用SPSS 13.0统计软件进行方差分析,两两比较采用Dunnett-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学方法定性检测CAR在肺癌标本中的表达 免疫组织化学结果显示,100例肺癌标本中,48例阳性表达CAR,阳性率48%,见图1。

图1 肺鳞癌和腺癌中CAR表达
2.2 Western blot检测CAR蛋白、应用RT-PCR检测mRNA表达 CAR蛋白在肺癌组织中的表达高于正常组织和癌旁组织,其差异有统计学意义(P= 0.009,P=0.027,n=100),见表1。

表1 Western blot检测CAR蛋白在正常组织、癌旁组织、癌组织中的表达
CAR mRNA在肺癌组织中表达高于癌旁或正常肺组织,其差异有统计学意义(P=0.007,P= 0.022,n=100),见表2,图2。
表2 RT-PCR检测CAR mRNA表达的相对灰度值(±s)

表2 RT-PCR检测CAR mRNA表达的相对灰度值(±s)
注:与正常肺组织比较,aP<0.05;与癌旁组织比较,bP<0.05
组织类别正常肺组织癌旁组织癌组织CAR mRNA(±s) 1.000±0.012 1.048±0.035 1.282±0.072a、b
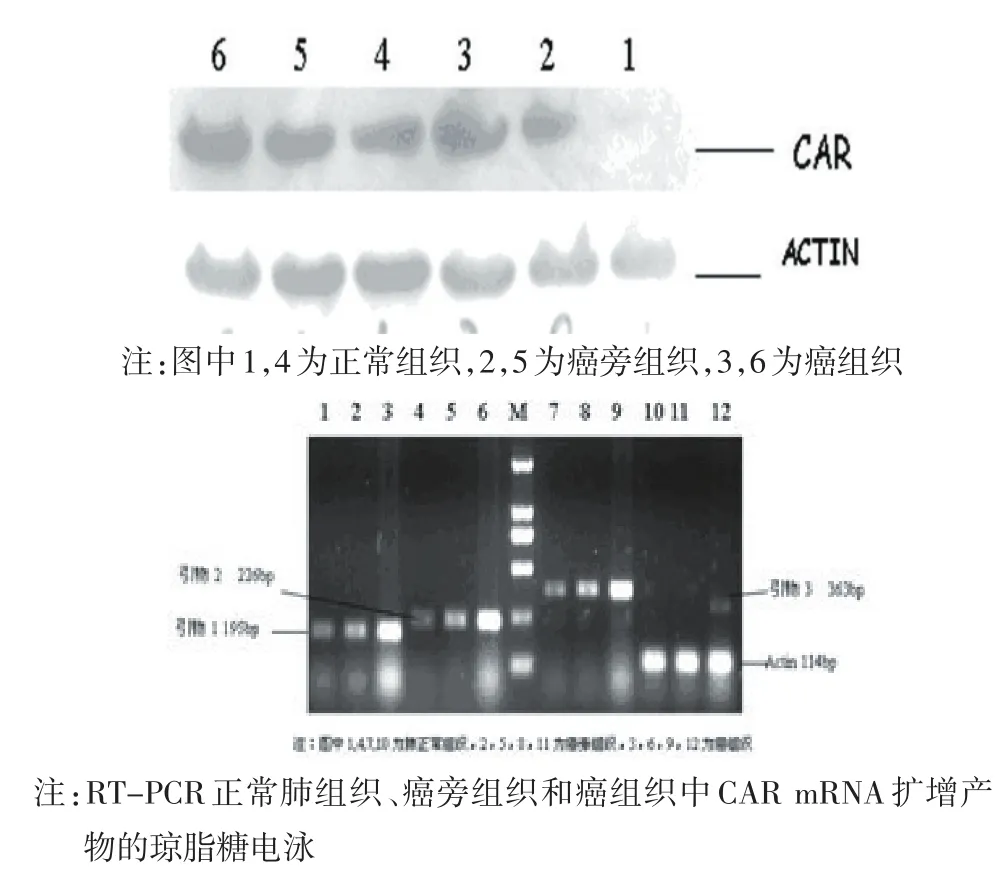
图2 Western blot检测CAR蛋白及RT-PCR扩增结果
2.3 RT-PCR、Western blot检测五种肺癌细胞系中CAR mRNA及CAR蛋白的表达 五种肺癌细胞系中CAR mRNA表达水平与其蛋白表达水平相一致,NCI-H520细胞系的CAR基因表达水平最高,因此我们选取NCI-H520细胞系进行后续的RNAi研究,见图3。
2.4 建立RNAi稳定表达细胞系 在6孔板中,应用X-treme HP转染试剂,瞬时转染NCI-H520细胞三组shRNA重组质粒和空载体阴性对照质粒,RNAi稳定表达的多克隆肺癌细胞株筛选成功,见图4。

图3 PCR及Western检测五种细胞系CAR表达

图4 转染NCI-H520细胞三组shRNA重组质粒和空载体阴性对照质粒
2.5 RNAi稳定表达细胞系中CAR基因表达干扰的抑制效果 3组重组质粒中shRNA2对NCI-H520 CAR mRNA表达的抑制作用最强,见图5。

图5RT-PCR检测CAR mRNA表达变化
2.6 应用Western blot检测CAR蛋白表达干扰的抑制效果 3组重组质粒中shRNA2对NCI-H520 CAR蛋白表达的抑制作用最强,见图6。

图6 Western检测CAR蛋白表达
2.7 平板克隆形成实验检测抑制CAR表达后对细胞增殖能力的影响 两周后三组细胞增殖情况。显微镜下观察计数三组细胞在6孔板中形成的克隆数,得到相应克隆形成率(见图7)。空白对照组、阴性对照组及实验组克隆形成率分别为71.2%、59.0%和53.8%,方差分析比较三组细胞克隆形成率差异无统计学意义(P>0.05)。结果表明CAR基因表达抑制后对NCI-H520细胞系增殖能力影响不大。

图7 抑制CAR表达后对细胞增殖能力的影响
2.8 Transwell侵袭实验检测抑制CAR表达后对细胞能力的影响 显微镜下观察计数(见图8),空白对照组侵袭Matrigel穿过滤膜数为(52.20±3.65)个,阴性对照组侵袭Matrigel穿过滤膜数为(46.10±2.16)个,实验组侵袭Matrigel穿过滤膜数为(19.60±2.58)个,空白对照组与阴性对照组间差异无统计学意义,实验组与空白对照组间差异有统计学意义(P<0.05)。结果显示:针对目的基因的RNAi降低NCI-H520细胞CAR表达后,细胞的侵袭能力明显低于空白对照组。
2.9 Transwell迁移实验检测抑制CAR表达后对细胞迁移能力的影响 显微镜下观察计数(见图9),空白对照组穿过滤膜数为(71.50±1.48)个,阴性对照组穿过滤膜数为(69.40±3.65)个,实验组穿过滤膜数为(21.80±2.75)个,空白对照组与阴性对照组间差异无统计学意义,实验组与空白对照组间差异有统计学意义(P<0.05)。结果显示:针对目的基因的RNAi降低NCI-H520细胞CAR表达后,细胞的迁移能力明显低于空白对照组。

图8 Transwell小室检测三组细胞侵袭能力的改变

图9 Transwell小室检测三组细胞迁移能力的改变
2.10 肿瘤形成实验 利用RNAi有效抑制了CAR基因的表达,并有效抑制了移植瘤的生长,见图10。
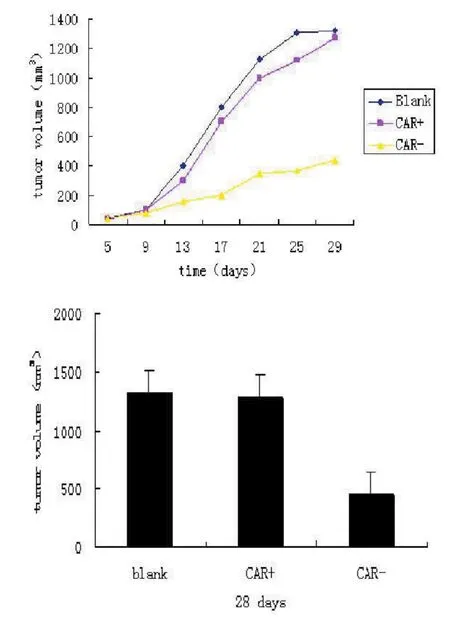
图10 3组人肺癌细胞株NCI-H520裸鼠体内移植瘤的生长曲线及体积变化
3 讨论
肺癌的发病率在恶性肿瘤中位居前列,且呈逐年上升趋势,其中非小细胞肺癌的发生更是引起高度重视[4]。肺癌的发生机制是当今研究的重点方向[5]。自1997年初识CAR蛋白后,其表达量与多种疾病的关系得到广泛的研究探讨[6]。随着对腺病毒载体基因治疗的深入,CAR蛋白在肺癌中的表达及其与临床病理因素及预后的关系得到了更为深入的研究。目前已证实,CAR表达于多种肿瘤组织中,如食管癌、结肠癌、胃癌、胶质瘤等[7-8]。Giaginis等[9]在对子宫内膜癌的研究中发现,高分化子宫内膜癌几乎不表达CAR,他通过分析CAR表达与细胞增殖抗原Ki67表达的关系发现,CAR的高表达与肿瘤增殖能力的增加有关。并且在大多数骨肉瘤细胞系、所有的Ewing肉瘤细胞系[10]、乳腺癌[11]中CAR表达也是增加的。两个相反的结论提示我们,CAR在不同类型的肿瘤具有不同的生物行为。
关于CAR与肺癌关系的研究,目前报道的不多。我们应用RT-PCR、免疫组织化学和Western blot方法,检测了大量肺癌组织样品中CAR的表达情况,相关的在组织学水平上研究CAR表达的临床意义尚未见报道。我们发现,在CAR mRNA和蛋白在正常肺组织和癌旁组织中几乎无表达,但是在大多数的肺癌标本中CAR无论核酸和蛋白均有高水平的表达,这提示CAR的表达与肺癌可能具有相关性。为了深入了解CAR基因在肺癌发生发展过程中的作用,本研究在此基础之上,采用RNA干扰方法建立CAR表达稳定下调的肺癌细胞系,对CAR基因的功能进行了较系统的研究。
Verma等[12]于2003年首次将RNAi应用到裸鼠移植瘤[13-14]内,随后国内外学者进行了大量的RNAi裸鼠体内研究。本课题组采用RNA干扰(RNAi)技术静默CAR基因的表达,并且应用于裸鼠移植瘤中。在平板克隆形成实验中发现,CAR基因表达抑制后对NCI-H520细胞系体外增殖能力影响不大,但是在肿瘤形成实验中实验组与空白对照组和阴性载体对照组相比,瘤体重量明显减小。说明利用RNAi有效抑制了CAR基因的表达,并有效抑制了移植瘤的生长,从而为进一步探索CAR基因的生物学功能和利用RNAi技术抑制肿瘤发生发展提供实验依据。Qin等[15]在研究CAR在成瘤过程中的角色时,还比较了对照组与反义CAR细胞在体外生长潜力的差别,发现在塑料上生长时两者增殖能力仅有极微小的差别,但在软琼脂上形成集落后,这种相对性增殖能力差异表现出明显的不同。这些数据与我们的实验结果一致,预示在裸鼠体内CAR的表达在肺癌的增殖中是必须的,并且在激发肺癌细胞某种亚型的有效形成中是必须的。RNAi技术是指由人工导入的双链RNA介导的特异性的转录后基因沉默技术。通过敲低肿瘤的凋亡抑制基因、促增生基因、肿瘤细胞浸润转移基因的表达,达到抑制肿瘤的效果。同时,RNAi在裸鼠移植瘤内可作为肿瘤放化疗的辅助手段。
综上所述,本研究在之前研究基础上,利用建立和筛选得到的稳定抑制CAR基因表达的肺鳞状细胞癌NCI-H520细胞系,运用平板克隆形成实验和Transwell侵袭及迁移实验分析了CAR降表达组、空载体组及未转染组之间增殖、侵袭、迁移能力的差异,揭示了CAR基因对NCI-H520细胞增殖、侵袭和迁移的影响。研究结果显示,CAR基因对肺癌细胞增殖能力的影响不显著,但其在肺癌细胞的侵袭及迁移过程中发挥了重要作用,CAR基因的表达水平的高低可能代表了肺癌细胞侵袭迁移能力的大小。在此我们初步探讨了CAR基因在体外培养的人肺癌细胞中的生物学功能,为进一步通过肺癌动物模型在体内研究CAR基因的作用打下了基础,同时也为人CAR基因的生物学功能及其在肺部肿瘤中作用机制的研究提供了参考。
[1]Bergelson JM,Cunningham JA,Droguett G,et al.Isolation of a common receptor for Coxsackie B viruses and adenoviruses 2 and 5 [J].Science,1997,275(5304):1320-1323.
[2]Philipson L,Pettersson RF.The coxsackie-adenovirus receptor--a new receptor in the immunoglobulin family involved in cell adhesion[J].Curr.Top.Microbiol.Immunol,2004,273(273):87-111.
[3]Majhen D,Stojanovic N,peljko T,et al.Increased expression of the coxsackie and adenovirus receptor downregulates αvβ3 and αv β5 integrin expression and reduces cell adhesion and migration[J]. Life Sci,2011,89(7-8):241-249.
[4]Zhang WF,Wu FL,Shao HW,et al.Chimeric adenoviral vector Ad5F35L containing the Ad5 naturallong-shaft exhibits efficient gene transferinto human Tlymphocytes[J].J Virol Methods,2013,194(21):52-59.
[5]Reeh M,Bockhorn M,Gorgens D,et al.Presence of the coxsackievirus and adenovirus receptor(CAR)in human neoplasms:a muhitumour array analysisl J1[J].Br J Cancer,2013,109(7):1848-l858.
[6]王永亮,王丹,郭慧,等.Livin蛋白在非小细胞肺癌中的表达及其临床意义[J].现代生物医学进展,2014,14(4):748-751.
[7]Ma J,Zhao J,Lu J,et al.Coxsackievirus and adenovirus receptor promotes antitumor activity of oncolytic adenovirus H101 in esophageal cancer[J].Int J Mol Med,2012,30(6):1403-1409.
[8]Stecker K,Vieth M,Oschel A,et al.Impact of the coxsackievirus and adenovirus receptor on the adenoma-carcinoma sequence of colon cancer[J].Br J Cancer,2011,104(9):1426-1433.
[9]Giaginis CT,Zarros AZ,Papaefthymiou MA,et al.Coxsackievirus and adenovirus receptor expression in human endometrial adenocarcinoma:possible clinical implications[J].World J Surg Oncol,2008,6(1):59-64.
[10]Nakano MY,Boucke K,Suomalainen M,et al.The first step of adenovirus type 2 disassembly occurs at the cell surface,independently of endocytosis and escape to the cytosol[J].J Virol,2000,74 (15):7085-7095.
[11]Gu W,Ogose A,Kawashima H,et al.High-level expression of the coxsackievirus and adenovirus receptor messenger RNA in osteosarcoma,Ewing’s sarcoma,and benign neurogenic tumors among musculoskeletaltumors[J].Clin CancerRes,2004,10(11):3831-3838.
[12]Verma UN,Surabhi RM.Schmaltieg A,el al.Small interfering RNAs directed against beta-catenin inhibit the in vitro and in vivo growth of colon cancer cells[J].Clin Cancer Res,2003,9(4):1291-1300.
[13]李风奎,王纯跃.实验动物学.郑州:郑州大学出版社,2001,8:140-141.
[14]吴学文,王邦茂,曹晓沧.hTR反义PS—ODN联合顺铂对人胃癌裸鼠皮下移植瘤作用的体内研究[J].肿瘤研究与临床,2005,17(4):226-229.
[15]Qin M,Escuadro B,Dohadwala M,et al.A novel role for the coxsackie adenovirus receptor in mediating tumor formation by lung cancer cells[J].Cancer Res,2004,64(18):6377-6380.
(收稿:2016-08-06 修回:2017-02-22)
(责任编辑 屈振亮 何培坤)
Coxsackie Adenovirus Receptor Expression in Lung Cancer and Its Significance
DONG Yuan-huan,SUN Lei-na,ZHAN Zhong-li
Department of Pathology,Ninghe District Hospital,Tianjin(301500),China
Objective To investigate the expression of(Coxsackie virus adenovirus receptor,CAR)in normal lung tissue,para-cancerous tissue and lung cancer tissues and the effect of CAR expression in vitro on proliferation,invasion and migration of human lung squamous cell carcinoma NCI-H520 cells. Methods Total 100 cases of lung cancer,adjacent tissues and normal lung tissues were collected.Immunohistochemistry,Western blot and RT-PCR were used to detect the expression of CAR protein and mRNA.RNAi technique was used to diminish CAR expression.The effects of RNAi on the proliferation,invasion and migration of NCI-H520 lung cancer cells were studied by plate cloning assay and transwell invasion and migration experiments.The animal model was used to study the growth of the cancer cells in vivo. Results Immunohistochemical results showed that the positive rate of CAR was 48%.Western blot analysis showed expression of CAR protein and CAR mRNA were significantly higher in lung cancer than that in normal lung tissues and cancer-adjacent tissues.Three NCI-H520 sub-lines with inhibited CARgene were screened.Semi-quantitative RT-PCR and Western blot showed that the expression of CAR mRNA and protein in these cells decreased in different degrees,and shRNA-2 had the strongest inhibitory effect.Plate clone formation assay showed that shRNA-2 inhibited the proliferation of NCI-H520 cells(P<0.05).Transwell invasion and migration experiments showed that CAR-inhibited NCI-H520 cells had a significant decrease in invasion and migration(P<0.05).Animal model results show that following the inhibition of CAR expression,the growth of transplanted tumors in animals was inhibited slow. Conclusion CAR is associated with the development and progression of lung cancer and can promote the invasion and migration of lung cancer cells.Nude mice lung cancer transplanted tumor model was successfully established for the future study of lung cancer.The expression of CAR gene was effectively inhibited by RNAi,and,therefore,the growth of NCI-H520 cells in nude mice was inhibited.CAR was expected to be one of the targets of lung cancer gene therapy.
Coxsackie adenovirus receptor;western blot;RT-PCR;colony formation assay transwell experiments;transplanted tumor model
R734.2
A
1007-6948(2017)02-0113-06
10.3969/j.issn.1007-6948.2017.02.003
天津市卫生局局级基金项目(2010KZ11)
1.天津市宁河区医院病理科(天津 301500)
2.天津医科大学附属肿瘤医院病理科;国家肿瘤临床医学研究中心(天津 300600)
战忠利,E-mail:dongyuanhuan1@163.com
