正天丸的镇痛作用及机制研究*
2017-04-22付文君魏江平刘慧兰徐世军
付 昆,付文君, 魏江平, 郑 航, 吴 倩,孟 诗, 刘慧兰,徐世军△
(1. 四川省中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137;2. 成都中医药大学,成都 610075;3. 重庆医科大学附属成都第二临床学院,成都市第三人民医院,成都 610031;4. 北京中医药大学第三附属医院,北京 100029)
正天丸的镇痛作用及机制研究*
付 昆1,2,3,付文君1,2, 魏江平1,2, 郑 航1,2, 吴 倩1,2,孟 诗1,2, 刘慧兰4△,徐世军1,2△
(1. 四川省中药资源系统研究与开发利用国家重点实验室培育基地,成都 611137;2. 成都中医药大学,成都 610075;3. 重庆医科大学附属成都第二临床学院,成都市第三人民医院,成都 610031;4. 北京中医药大学第三附属医院,北京 100029)
目的:考察正天丸镇痛作用以及镇痛机制,为其治疗偏头痛提供药理学依据。 方法:小鼠连续预给药5 d,采用热板、冰乙酸、甲醛3个经典疼痛动物模型观察正天丸对疼痛小鼠的镇痛作用;采用紫外分光光度法测定甲醛疼痛模型各组小鼠血清中前列腺素E2(PGE2)和脑组织中谷氨酸(Glu)含量,硝酸还原酶法测定血清中一氧化氮(NO)含量以及ELISA法检测脑中降钙素基因相关肽(CGRP)含量,探讨其镇痛的作用机制。 结果:正天丸能提高热刺激小鼠的痛阈值,延长冰乙酸所致的小鼠扭体反应潜伏期,减少扭体次数,并能显著缩短甲醛致痛小鼠的Ⅰ相和Ⅱ相舔、咬足时间;明显降低甲醛致疼痛模型小鼠血清PGE2、脑组织Glu和CGRP含量,显著提高外周血清NO含量。 结论:正天丸具有明显的镇痛作用,其镇痛机制与抑制中枢Glu、CGRP释放、降低外周疼痛介质PGE2含量、促进外周NO合成有关。
正天丸;镇痛;一氧化氮;前列腺素E2;谷氨酸;降钙素基因相关肽
偏头痛是一种以反复出现单侧头痛为特征的慢性神经血管疾病,除了疼痛以外还常伴随其他神经系统症状,如恶心、畏光、畏声、气味恐惧、疲倦以及自律、精神、感觉和运动功能紊乱[1]。偏头痛发作时产生剧烈的疼痛是所有症状中最主要的病症[2],也是影响患者生活质量的关键所在。研究表明,反复或者高强度的有害刺激会导致Aδ和C纤维的伤害感受器敏化,其激活的阈值降低(即痛觉敏化)[3],释放兴奋性氨基酸(谷氨酸,Glu)和神经肽(如P物质和CGRP)等神经递质,激活感觉神经元,将冲动通过神经纤维传导至大脑产生痛觉。外周和中枢痛觉敏化正是偏头痛的病理基础[4],是导致痛觉出现的核心机制。正天丸(zhengtian pill,ZTP)作为临床治疗偏头痛的常用中成药,探讨其镇痛作用可为该药治疗偏头痛提供进一步的药理学依据,然而迄今尚未见有关该药针对疼痛本身的作用和机制的报道。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级昆明小鼠,体质量16~22 g,雌雄兼用,成都达硕生物科技有限公司提供(动物许可证号SCXK(川)2013-24)。国家中医药管理局成都中医药大学中药药理三级实验室动物房室温20~26 ℃,明暗12 h/12 h交替,适应性饲养3 d,自由饮水和进食。
1.1.2 药物与试剂 正天丸(华润三九医药股份有限公司生产,批号1501034H),阿司匹林肠溶片(拜耳医药保健有限公司,批号BJ23036),盐酸吗啡注射液(东北制药集团沈阳第一制药有限公司,批号150409-1,临用前用生理盐水稀释成0.1%的吗啡溶液),NO含量测试盒(批号20160707),谷氨酸测试盒(批号20160718),考马斯亮蓝蛋白测试盒(批号20160712),小鼠CGRP酶联免疫试剂盒(批号20160721)均购自南京建成生物工程研究所,甲醛、冰乙酸、羧甲基纤维素钠(CMC-Na)、氢氧化钾、甲醇均为分析纯(成都科龙化工试剂厂),试验用水为双蒸水。
1.1.3 主要仪器 电子分析天平(FA1204L,上海越平科学仪器有限公司),电热恒温水温箱(HH·WZ1·420S,上海跃进医疗器械有限公司),智能热板仪(RB-200,成都泰盟科技有限公司),湘仪离心机(TDZ5-WS,湖南湘仪实验室仪器开发有限公司),酶标仪(3001,Thermo Scientific),紫外-可见分光光度仪(UV2600,天美(中国)科学仪器有限公司)。
1.2 方法
1.2.1 ZTP镇痛作用研究
(1)ZTP对乙酸致痛模型的影响——扭体法:40只小鼠雌雄各半,按体质量分层随机分为CMC对照,ZTP高、中、低剂量及阿司匹林对照5组各8只。按照表1剂量ZTP用0.5%CMC-Na溶液混悬灌胃,CMC对照组给予0.03 ml·g-1CMC-Na溶液,连续给药5 d。末次给药60 min后,各组小鼠均腹腔注射0.7%冰乙酸0.2 ml/只,观察并记录小鼠出现扭体反应的时间(扭体潜伏期)以及15 min内发生扭体反应的次数,并依照抑制率(%)=(CMC组平均扭体次数-药物组平均扭体次数)/CMC组平均扭体次数×100%计算药物对小鼠扭体反应的抑制率。
(2)ZTP对热刺激致痛模型的影响——热板法:选用雌性小鼠放于(55±0.5)℃热板仪上,以小鼠出现舔后足的时间(痛阈值)作为痛反应指标筛选痛阈值5~30 s者为合格鼠,按体质量分层随机分为CMC、ZTP高、中、低剂量组和吗啡组5组各8只。实验前测定各组小鼠给药前痛阈值,测2次取平均值,每次测量间隔不少于5 min。CMC对照组及ZTP各剂量组同(1)项灌胃给药。吗啡组只给药1次,于实验前30 min腹腔注射0.1%吗啡0.01 ml·g-1。末次给药后于30、60、90、120 min分别测定各组小鼠痛阈值。为防止动物烫伤,超过60 s仍不出现痛反应者,应从热板仪取出,痛阈值计为60 s。
(3)ZTP对甲醛致痛模型的影响——福尔马林实验:40只小鼠,雌雄各半,与(2)项分组及给药。吗啡组给药30 min后,其余各组末次灌胃60 min后,分别于小鼠右后足底皮下注射5%甲醛溶液20μL/只,立即置于2000 ml烧杯中,观察并记录0~5 min(Ⅰ相,早发相)和10~30 min(Ⅱ相,迟发相)2个时相小鼠舔、咬右后足的累计时间。计算药物对甲醛致痛反应的抑制率,抑制率(%)=(CMC对照组舔足时间-给药组舔足时间)/CMC对照组舔足时间×100%。
观察结束后,摘除小鼠眼球取血,3500 rpm离心10 min,分离血清,-20℃保存待测。然后脱臼处死冰上取脑,生理盐水漂洗、滤纸拭干,-70℃保存待测。
1.2.2 ZTP镇痛作用机制研究 取(3)项下小鼠血清100μL加入0.5mol/L的KOH-CH3OH溶液2ml,置于(50±0.5)℃水浴箱中异构化20 min,再加甲醇2.5 ml,离心2500rpm×10 min,取上清于紫外分光光度仪278nm处测定吸光度(A)值[5]。以PGE2吸光度值表示PGE2含量。另取血清100μL,按试剂盒说明测定血清中NO含量。取出冻存脑组织准确称重,按1∶9加入9倍体积的生理盐水,冰浴条件下匀浆,3500rpm×10 min离心,取上清液严格按照试剂盒说明操作,检测脑Glu、CGRP含量。
2 结果
2.1 ZTP对小鼠扭体反应的影响
表1显示,ZTP各剂量组均能不同程度地延长小鼠出现扭体反应的潜伏期和减少15 min内扭体的次数,但与溶剂CMC组比较,中、高剂量组扭体潜伏期差异有统计学意义(P≤0.05),低剂量组差异无统计学意义(P>0.05);中、高剂量组对小鼠扭体次数的抑制更明显(P≤0.01),抑制率分别可达42.07%和49.52%,而低剂量组比较差异无统计学意义(P>0.05)。
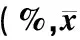
表1 ZTP对醋酸所致小鼠扭体反应的作用±s)
注:与CMC对照组比较:*P≤0.05,**P≤0.01(表2~4同)
2.2 ZTP对热刺激小鼠痛阈的影响
表2显示,ZTP在给药1 h后起效,能一定程度延长60、90、120 min各时间点热刺激所致小鼠痛反应的潜伏期,提高小鼠的痛阈值,其镇痛效应可持续到2 h,中、高剂量组与CMC对照组比较差异有统计学意义(P≤0.05),其镇痛作用弱于吗啡。
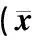
表2 ZTP对热板实验小鼠痛反应潜伏期的影响±s)
2.3 ZTP对甲醛致痛模型小鼠2个时相痛反应的影响
甲醛溶液足底皮下注射给药后,会诱发小鼠出现早发相(即Ⅰ相,0~5 min)和迟发相(Ⅱ相,10 min以上)2个时相舔、咬注射足的痛反应。表3显示,ZTP对Ⅰ、Ⅱ相小鼠痛反应均有抑制作用,小鼠Ⅰ、Ⅱ相舔、咬足时间明显下降,与CMC对照组比较,中、高剂量抑制更明显(P≤0.05),但镇痛效果略弱于吗啡。
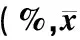
表3 ZTP对甲醛致痛小鼠Ⅰ、Ⅱ相痛反应时间的影响±s)
2.4 ZTP对甲醛模型小鼠血清及脑组织中疼痛因子的影响
表4显示,ZTP各剂量组均能有效降低甲醛疼痛小鼠外周血清PGE2含量,与CMC组比较(P≤0.01或P≤0.05);ZTP中、高剂量则显著升高血清中NO含量(P≤0.01);对于中枢脑内递质Glu,ZTP有明显抑制作用,高、中、低剂量均有效(P≤0.01);且ZTP亦能降低小鼠脑内CGRP含量,高剂量效果更显著(P≤0.01)。
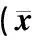
表4 ZTP对甲醛模型小鼠各疼痛因子水平的影响±s)
3 讨论
偏头痛是一种常见的慢性神经系统疾病,但发病机理尚不明确。目前最主流的三叉神经血管反射学说将偏头痛归结于血管活性肽诱导的神经源性炎症、颅内外血管扩张和中枢疼痛传递内源性抑制减少综合作用的结果[6]。偏头痛发作时,刺激三叉神经纤维(包括C和Aδ纤维)诱发CGRP和其他血管活性物质的释放,导致硬脑膜和外周组织神经源性炎症[7]。可见神经源性炎症是偏头痛重要的病理进程,神经性炎性痛是其主要的病症表现。
中医理论认为,肝脏功能失调可以引起头痛。如《脉经·头痛》认为:“足厥阴与少阳气逆,则头目痛。”偏头痛患者除头痛外,情绪异常亦为重要表现,常见烦躁、恐惧及发急、悲观失望等,说明本病与肝失疏泄、不能正常调节情志有关[8]。这与前文提到的偏头痛常伴随的神经系统功能紊乱不谋而合。肝失疏泄则气机失常,气机逆乱,壅遏络脉。《证治准绳》曰:“病头痛者,凡此皆脏腑经脉之气逆上,逆乱于头之清道,致其不得运行,壅遏精髓而痛者也。[9]”头痛是偏头痛临床最主要的症状和体征,有效缓解疼痛是治疗的主要目的。ZTP具有通络止痛的功效,因而研究其镇痛作用可为其治疗偏头痛提供进一步的药理学依据。
本研究结果显示,ZTP对热板、乙酸、甲醛诱发的疼痛反应均有不同程度的抑制作用,说明其镇痛作用确切。其中热板法是以热刺激产生急性痛,常用于评价镇痛药的中枢作用,而扭体法诱发的炎性痛常作为外周炎性疼痛模型,提示ZTP既可能有中枢作用也有外周作用。而甲醛模型引发了2个时相反应,Ⅰ相是直接刺激C纤维伤害感受器,造成神经伤害诱导神经性痛[10],Ⅱ相则是外周组织炎症和中枢敏化综合作用出现的持续炎性痛反应[11],因而是较好的慢性疼痛模型,与偏头痛的疼痛类型有较高的契合度。ZTP对上述3个疼痛模型均有镇痛作用,尤其中、高剂量能较明显地抑制乙酸扭体反应和甲醛引发的Ⅰ、Ⅱ相反应,显示出对神经炎性疼痛的镇痛活性,因此佐证了ZTP对偏头痛的治疗作用。
甲醛作为疼痛刺激物质,外周组织受到其伤害性刺激促使初级传入神经元和背角神经元释放,诸如Glu、P物质、CGRP的兴奋性神经递质[12]。随后Glu激活其离子型受体NMDA离子通道,促进Ca2+内流,引起酶级联反应,刺激前列腺素(包括PGE2)的释放[13]。PGE2既是炎症介质又是致痛因子,炎症组织PGE2的增加可引起痛觉过敏和痛觉超敏的发生[14]。释放的Glu亦可通过诱导脊髓背角神经元突触可塑性而使痛觉敏化[15]。CGRP则参与调节心血管系统、神经源性炎症和痛觉传入[16]。ZTP干预后,甲醛模型小鼠脑Glu、CGRP和血清PGE2水平均明显下降,提示ZTP不仅可以通过抑制中枢部位Glu、CGRP的释放,而且可以抑制外周疼痛介质PGE2的合成,从而抑制中枢和外周痛觉敏化,达到镇痛效果。
NO是一种气体信号分子,能双向调节痛觉,既可致痛又可镇痛[17]。这种双重作用具体以何种效应体现依赖于病理进程所处阶段[18]、疼痛模型[19]、给药途径[20]以及NO供体(前体)或抑制剂的剂量[21]。本次实验条件下,ZTP和吗啡能显著增加甲醛模型小鼠外周血中NO浓度,提示ZTP可能通过促进外周水平的NO释放而发挥镇痛作用,同时NO浓度升高也会增强吗啡的镇痛效果[22]。这一结果与文献[11,23-24]中NO调控疼痛的报道是一致的,但与偏头痛病理过程中NO的作用并不一致,我们推测可能与二者的疼痛模型不同有关。
综上可知,正天丸镇痛作用较明确,其镇痛部位既可能位于中枢也可能在外周,作用机制可能与抑制中枢Glu、CGRP的释放、降低外周PGE2含量并促进外周NO合成、抑制痛觉敏化有关。
[1] PIETROBON D,STRIESSING J. Neurobiology of migraine[J]. Nat Rev Neurosci,2003,4(5):386-398.
[2] MELO-CARRILLO A,LOPEZ-AVILA A. A chronic animal model of migraine, induced by repeated meningeal nociception, characterized by a behavioral and pharmacological approach[J]. Cephalalgia,2013,33(13):1096-1105.
[3] LATREMOLIERE A,WOOLF CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity[J]. J Pain,2009,10(9):895-926.
[4] SARCHIELLI P,DI FILIPPO M,NARDI K,et al. Sensitization, glutamate, and the link between migraine and fibromyalgia[J]. Curr Pain Headache Rep,2007,11(5):343-351.
[5] 黄媛恒,陈健,黄仁彬,等. 玉郎伞提取物抗炎作用及机制研究[J]. 中国新药杂志,2008,17(20):1764-1767.
[6] HARGREAVES RJ,SHEPHEARD SL. Pathophysiology of migraine new insights[J]. Can J Neurol Sci,1999,269(3):S12-S19.[7] YILMAZ IA,OZGE A,ERDAL ME. Cytokine polymorphism in patients with migraine: some suggestive clues of migraine and inflammation[J]. Pain Med,2010,11(4):492-497.
[8] 杨洪军. 偏头痛病因病机、治法与方药的相关研究[D]. 北京:北京中医药大学,2002.
[9] 王肯堂. 证治准绳·杂病证治准绳[M]. 倪和宪,点校. 北京:人民卫生出版社,2014:182-190.
[10] STUCKY CL,GOLD MS,ZHANG X. Mechanisms of pain[J]. Proc Natl Acad Sci USA,2001,98(21):11845-11846.
[11] GHORBANZADEH B,MANSOURI MT,HEMMATI AA,et al. Involvement of L-arginine/NO/cGMP/KATPchannel pathway in the peripheral antinociceptive actions of ellagic acid in the rat formalin test[J]. Pharmacol Biochem Behav,2014,126:116-121.
[12] CODERRE TJ,KATZ J,VACCARINO AL,et al. Contribution of central neuroplasticity to pathological pain: review of clinical and experimental evidence[J]. Pain,1993,52(3):259-285.
[13] KAWAMATA T,OMOTE K. Activation of spinal N-methyl-D-aspartate receptors stimulates a nitric oxide/ cyclic guanosine 3,5-monophosate/glutamate release cascade in nociceptive signaling[J]. Anesthesiology,1999,91(5):1415-1424.
[14] HOFACKER A,COSTE O,NGUYEN HV,et al. Downregulation of cytosolic prostaglandin E2synthase results in decreased nociceptive behavior in rats[J]. J Neurosci,2005,25(39):9005-9009.
[15] CHIECHIO S,NICOLETTI F. Metabotropic glutamate receptors and the control of chronic pain[J]. Curr Opin Pharmacol,2012,12(1):28-34.
[16] RUSSO AF. Calcitonin gene-related peptide (CGRP): a new target for migraine[J]. Annu Rev Pharmacol Toxicol,2015,55:533-552.
[17] SCHMIDTKO A,TEGEDER I,GEISSLINGER G. No, no pain? The role of nitric oxide and cGMP in spinal pain processing[J]. Trends Neurosci,2009,32(6):339-346.
[18] ROCHA J, PEIXOTO ME,JANCAR S,et al. Dual effect of nitric oxide in articular inflammatory pain in zymosan-induced arthritis in rats[J]. Br J Pharmacol,2002,136(4):588-596.
[19] SOUSA AM,PRADO WA. The dual effect of a nitric oxide donor in nociception[J]. Brain Res,2001,897(1-2):9-19.
[20] PAUL-CLARK MJ,GILROY DW,WILLIS D,et al. Nitric oxide synthase inhibitors have opposite effects on acute inflammation depending on their route of administration[J]. J Immunol,2001,166(2):1169-77.
[21] KAWABATA A,MANABE S,MANABE Y,et al. Effect of topical administration of L-arginine on formalin-induced nociception in the mouse: a dual role of peripherally formed nitric oxide in pain modulation[J]. Br J Pharmacol,1994,112(2):547-550.
[22] PATAKI I,TELEGDY G. Further evidence that nitric oxide modifies acute and chronic morphine actions in mice[J]. Eur J Pharmacol,1998,357(2-3):157-162.
[23] NGUELEFACK TB,DUTRA RC,PASZCUK AF,et al. Antinociceptive activities of the methanol extract of the bulbs of Dioscorea bulbifera L. var sativa in mice is dependent of NO-cGMP-ATP- sensitive-K+channel activation[J].J Ethnopharmacol,2010,128(3):567-574.
[24] COSTA A,GALDINO G,ROMERO T,et at. Ang-(1-7) activates the NO/cGMP and ATP-sensitive K+channels pathway to induce peripheral antinociception in rats[J]. Nitric Oxide,2014,37:11-16.
Effect and molecular mechanisms of Zhengtian Pill on antinociception
FU Kun1,2,3,FU Wen-jun1,2,WEI Jiang-ping1,2,ZHENG Hang1,2, WU Qian1,2,MENG Shi1,2,LIU Hui-lan4△,XU Shi-jun1,2△
(1.SichuanProvincialStateKeyLabBreedingBaseofSystematicResearch,DevelopmentandUtilizationofChineseMedicineResources,Chengdu611137,China;2.ChengduUniversityofTraditionalChineseMedicine,Chengdu610075,China; 3.The3rdPeople’sHospitalofChengdu,2ndAffiliatedChengduClinicalCollegeofChongqingMedicalUniversity,Chengdu610031,China;4.The3rdAffiliatedHospital,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective: To investigate the analgesic effect and molecular mechanisms of Zhengtian Pill (ZTP) to provide the pharmacological evidence of migraine therapy. Methods: The hot plate test, acetic acid-induced writhing test and formalin test were used to assess the analgesic effect of ZTP after administration for 5 days. After the formalin test, Prostaglandin E2(PGE2) and nitric oxide (NO) in mice serum, glutamate (Glu) and calcitonin gene related peptide (CGRP) in mice brain were measured by Ultraviolet spectrophotometry, Nitrate reductase approach and ELISA kits, respectively, to analyze their changes in content via the intervention of ZTP. Results: ZTP elevated pain threshold to thermal stimuli, also prolonged latency time to writhing reaction and decreased number of writhing in acetic acid test in mice. Furthermore, ZTP significantly reduced total time of licking, biting the injected paw in the biphasic responses induced by formalin in mice. Meanwhile, ZTP markedly reduced content of PGE2in mice serum, Glu and CGRP in mice brain, whereas ZTP increased NO level in peripheral mice serum. Conclusions: ZTP can exert analgesic effect on nociception induced by thermal, acetic acid and formalin stimuli. These molecular mechanisms involve not only in inhibition of release of central Glu, CGRP and peripheral PGE2, but also in promotion of synthesis of peripheral NO.
Zhengtian Pill; analgesia; NO; PGE2; Glu; CGRP
国家自然科学基金青年基金项目(81303082)-正天丸干预血管活性物质所致偏头痛的机制研究
付 昆,男,四川简阳人,主管药师,医学硕士,从事中药神经与精神药理学研究。
△通讯作者:刘慧兰,女,副主任医师,从事中医的基础与临床研究,Tel:010-52074242,E-mail:liuhlbj@163.com;徐世军,男,教授,博士研究生导师,从事中药神经与精神药理学研究,Tel:028-61800231,E-mail:docxu@126.com。
R289.5
B
1006-3250(2017)03-0401-04
2016-08-23
