肺癌与HPV感染相关性的初步研究
2017-04-21朱少君韩秀娟第四军医大学唐都医院病理科陕西西安710038
姚 丽,巩 丽,朱少君,韩秀娟,兰 淼,张 伟 (第四军医大学唐都医院病理科,陕西西安710038)
·检验与转化医学·
肺癌与HPV感染相关性的初步研究
姚 丽,巩 丽,朱少君,韩秀娟,兰 淼,张 伟 (第四军医大学唐都医院病理科,陕西西安710038)
目的:应用液相芯片技术分析肺癌患者与HPV感染的相关性.方法:重组质粒表达HPV16 E6和E7蛋白,同微球偶联后作为抗原,应用Luminex系统检测肺癌患者血清中的相应抗体.结果:肺癌组HPV16 E6/E7抗体水平显著高于正常对照组,肺鳞状细胞癌与腺癌肿瘤组对比,肺鳞状细胞癌HPV16 E6/E7抗体阳性率显著高于肺腺癌组,差异具有统计学意义(P<0.05).结论:HPV感染与肺鳞状细胞癌具有一定的相关性,为进一步研究肺鳞状细胞癌发生的分子机制提供了依据.
肺癌;HPV;液相芯片
0 引言
肺癌从组织学上分为小细胞肺癌和非小细胞肺癌[1],而非小细胞肺癌主要包括鳞状细胞癌和腺癌.人乳头瘤病毒(human papillomavirus,HPV)病毒为DNA病毒,通常感染人体特定部位的皮肤和粘膜的基底细胞.根据其与人类肿瘤的关系,HPV可分为高危型(HPV16,HPV18,HPV31,HPV33,HPV35)、中危型(HPV31,HPV33,HPV35)和低危型(HPV6,HPV11)[2-3].众所周知 HPV感染可以导致宫颈癌,HPV感染与阴道、肛门和阴茎癌等外阴部癌症的发生存在明显的相关性[4].本研究应用高通量的Luminex 100 液相芯片技术检测肺癌与HPV病毒感染的关系以及相关的HPV类型,为肺癌的预测及预防提供理论基础及临床方法,现报道如下.
1 材料和方法
1.1 实验标本患者血清标本选自唐都医院,经临床及病理诊断为肺癌的患者82例,正常对照血清选自健康献血者67例.
1.2 主要试剂酪蛋白及谷胱甘肽购自sigma公司,蛋白酶抑制剂购自Roche公司,CBSK及滤膜板均购自millipore公司,链霉素标记的藻红蛋白购自Invitrogen公司,其他试剂均为进口分析纯.pGEX⁃HPV16⁃tag质粒由本实验室保存.
1.3 方法
1.3.1 高度危险型HPV16 E6和E7蛋白表达 质粒pGEX⁃GST⁃HPV16 E6/E7⁃tag电转化 E.coli BL21(DE3),挑单克隆的菌落,在含有氨苄霉素的5 mL LB中37℃震荡培养12 h,然后接种于60 mL LB中,37℃震荡过夜,加入 350 mL LB,当室温培养至OD600=0.5时,加IPTG诱导剂诱导蛋白表达6 h,离心收集菌体,重悬于PBS,超声裂解,14000 rpm离心,收集上清液.用Bradford法测量蛋白浓度.
1.3.2 G⁃C微球包被HPV16 E6/E7蛋白及纯化1 mg/mL含GST⁃HPV16 E6/E7⁃tag蛋白的菌体裂解液加适量的G⁃C微球,室温避光摇床孵育1 h,阻断缓冲液洗涤3次,其他的菌液杂蛋白由于不含有GST蛋白无法与G⁃C微球结合,故通过洗涤过程被清除,加适量阻断缓冲液重悬.
1.3.3 血清检测 血清1∶50孵育于阻断缓冲液,室温1 h.滤膜96孔板加50 μL HPV16 E6/E7蛋白包被的G⁃C微球和50 μL孵育后的血清,室温1 h,真空泵阻断缓冲液洗涤3次,1∶1000生物素标记的羊抗人IgG100 μL,室温1 h,洗涤3次,1∶1000链霉素标记的藻红蛋白100 μL,室温1 h,洗涤3次,100 μL阻断缓冲液重悬,Luminex系统检测MFI.
1.4 统计学处理采用SPSS17.0统计学软件进行数据分析,行t检验,P<0.05表示差异有统计学意义.
2 结果
2.1 应用Luminex系统检测肺癌患者及正常对照血清中HPV16 E6/E7抗体Luminex系统检测的优点在于不同的微球具有不同的光谱,能够被单独识别,故本次实验应用两种微球分别包被两种HPV抗原(HPV16 E6和E7蛋白),置于1个反应体系中同时检测1份血清中的HPV16的两种抗体.结果显示,肺癌组HPV16 E6/E7抗体水平显著高于正常对照组(图1).
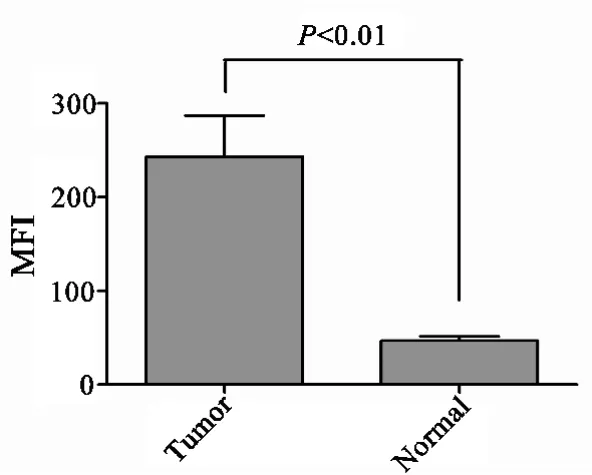
图1 肺癌患者及正常对照血清中HPV16抗体检测结果
2.2 应用Luminex系统检测肺鳞状细胞癌及肺腺癌患者血清中HPV16 E6/E7抗体选取肺癌患者82例作为研究对象,其中肺鳞状细胞癌患者50例,肺腺癌患者32例,通过Luminex系统检测肺鳞状细胞癌及肺腺癌患者血清中HPV16 E6/E7抗体,结果显示,肺鳞状细胞癌患者血清中HPV16 E6/E7抗体阳性率显著高于肺腺癌组,差异具有统计学意义(P<0.05).
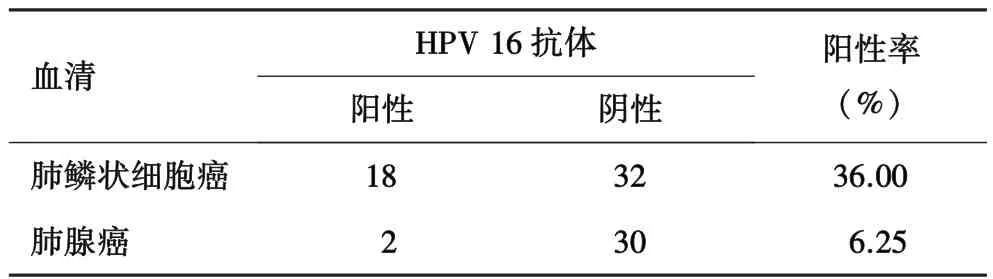
表1 肺鳞状细胞癌及肺腺癌患者血清中HPV16抗体水平检测
3 讨论
1979年,Syrjänen[5]首次在肺癌中观察到 HPV感染病灶的形态学改变.随后,不同的研究机构应用不同方法检测肺癌组织中是否含有HPV DNA,如斑点印记、原位杂交、Sourthern bolt及PCR法[6-7].但由于方法的不同及实验室之间的差异,不同的个案报道中,HPV DNA的检出率相差很大[8].肺癌从组织学上分为小细胞肺癌和非小细胞肺癌[9],而非小细胞肺癌又包括鳞状细胞癌和腺癌[10].肺鳞状细胞癌通常的发病模式为在各种因素作用下支气管的纤毛柱状上皮鳞状上皮化生,然后经过不同阶段的不典型增生,最后癌变形成鳞状细胞癌[11-12].这个过程同HPV易感染宫颈的鳞柱交界处有相似之处.HPV病毒含有两个主控转化过程的原癌基因:E6和E7[13],其蛋白的抗体在健康人群中少有发现,只同浸润性癌高度相关,具有很好的特异性和敏感性,这可能是因为在初次感染和隐性感染中HPV病毒E6和E7蛋白表达的量少或未接触到免疫系统[3,14].
本研究应用高通量Luminex系统检测肺癌患者血清中的HPV16抗体,结果显示,与正常健康人群血清相比,肺癌患者血清中HPV16抗体水平明显增高,并且肺鳞状细胞癌患者血清HPV16抗体阳性率高于腺癌患者,这提示HPV可能参与肺鳞状细胞癌的癌变过程,为肺鳞状细胞癌的预防、诊断和治疗提供了新的思路和靶点.
[1]Sullivan I,Planchard D.ALK inhibitors in non⁃small cell lung cancer:the latest evidence and developments[J].Ther Adv Med Oncol,2016,8(1):32-47.
[2]Choi YJ,Park JS.Clinical significance of human papillomavirus genotyping[J].J Gynecol Oncol,2016,27(2):e21.
[3]Xu Y,Liu S,Yi H,et al.Low prevalence of human papillomavirus in head and neck squamous cell carcinoma in Chinese patients[J].J Med Virol,2015,87(2):281-286.
[4]Chen J,Zhao KN.HPV⁃p53⁃miR⁃34a axis in HPV⁃associated cancers[J].Ann Transl Med,2015,3(21):331.
[5]Syrjänen KJ.Condylomatous changes in neoplastic bronchial epitheli⁃um.Report of a case[J].Respiration,1979,38(5):299-304.
[6]Galvan A,Noci S,Taverna F,et al.Testing of human papillomavirus in lung cancer and non⁃tumor lung tissue[J].BMC Cancer,2012,12:512.
[7]Syrjanen KJ.HPV infections and lung cancer[J].J Clin Pathol,2002,55(12):885-891.
[8]Zhai K,Ding J,Shi HZ.HPV and lung cancer risk:a meta⁃analysis[J].J Clin Virol,2015,63:84-90.
[9]Couraud S,Zalcman G,Milleron B,et al.Lung cancer in never smokers⁃⁃a review[J].Eur J Cancer,2012,48(9):1299-1311.
[10]利基林.血管内皮生长因子在非小细胞肺癌中的表达意义[J].转化医学电子杂志,2015,2(4):18-19.
[11]郭楠楠,李珊珊,张 文,等.血清标志物(NSE、CEA、CA⁃125、CYFRA21⁃1)和分子标志物(MDR⁃1、LRP、RRM⁃1、EGFR、ERCC⁃1、BRCA⁃1)在非小细胞肺癌患者原发灶和转移淋巴结的表达[J].转化医学电子杂志,2014,1(1):24-29.
[12]Clément⁃Duchêne C,Alla F,Gauchotte G,et al.Is there a relationship between the presence of lung mucosa preinvasive lesions and lung cancer incidence?Influence of tobacco consumption[J].Lung Cancer,2014,84(2):134-138.
[13]Zang B,Huang G,Wang X,et al.HPV⁃16 E6 promotes cell growth of esophageal cancer via downregulation of miR⁃125b and activation of Wnt/beta⁃catenin signaling pathway[J].Int J Clin Exp Pathol,2015,8(10):13687-13694.
[14]Grm HS,Bergant M,Banks L.Human papillomavirus infection,cancer&therapy[J].Indian J Med Res,2009,130(3):277-285.
Primary study on the correlation between lung cancer and HPV infection
YAO Li,GONG Li,ZHU Shao⁃Jun,HAN Xiu⁃Juan,LAN Miao,ZHANG Wei
Department of Pathology,Tangdu Hospital,Fourth Military Medi⁃cal University,Xi'an 710038,China
AIM:To analyze the correlation between lung cancer and HPV infection by Luminex technology.METHODS:HPV16 E6/E7 proteins binding to microparticle were expressed with recombinant plasmid.The corresponding antibodies in serum of patient with lung cancer were detected by Luminex technology.RESULTS:The level of HPV16 E6/E7 antibodies in lung cancer group were significantly higher than those of normal control group,and the difference was statistically significant(P<0.05).The antibody positive rate of HPV16 E6/E7 in squamous cell carcinoma of lung group was significantly higher than that of adenocarcinoma group,and the difference was statistically significant(P<0.05).CON⁃CLUSION:There was a correlation between HPV infection and lung squamous cell carcinoma,which will be helpful for the further study of molecular mechanism of lung squamous cell carcinoma.
lung cancer;HPV;liquichip
R734.2
A
2095⁃6894(2017)02⁃46⁃02
2016-11-25;接受日期:2016-12-10
陕西省自然科学基础研究计划项目(2013JQ4039)
姚 丽.博士,主治医师.研究方向:肿瘤分子病理学.Tel:029⁃84777744 E⁃mail:yaoli@fmmu.edu.cn
张 伟.主任医师,教授.E⁃mail:zhangyi@fmmu.edu.cn
