三种检测技术在不孕不育症患者解脲脲原体检测中的应用比较
2017-04-20王利军
王利军
(郑州市妇幼保健院检验科,河南郑州450000)
三种检测技术在不孕不育症患者解脲脲原体检测中的应用比较
王利军
(郑州市妇幼保健院检验科,河南郑州450000)
目的应用实时荧光核酸恒温扩增检测技术(Simultaneous Amplification and Testing,SAT)、液体培养法、荧光定量PCR法检测不孕不育症患者解脲脲原体(Ureaplasma urealyticum,Uu),对检测结果进行评估,以评价临床效果。方法对180例不孕不育症患者取泌尿生殖道拭子和尿液样本各一份,拭子样本采用SAT检测法、液体培养法及荧光定量PCR法进行检测,尿液标本再进行SAT方法检测,并对结果进行分析。结果三种方法检测解脲脲原体,阳性率分别为45.00%、48.33%、46.67%,差异无显著意义(P>0.05)。结论SAT检测不孕不育患者解脲脲原体与液体培养法和荧光定量PCR法相比具有较好相关性,为解脲脲原体的临床实验室诊断提供了新的检测手段。
实时荧光核酸恒温扩增检测技术;SAT;液体培养法;PCR;解脲脲原体
近年来,随着不孕不育症发病率的逐渐上升,解脲脲原体引起的生殖道感染日益受到关注,已成为备受关注的公共卫生问题之一[1,2]。本文主要应用实时荧光核酸恒温扩增检测技术(SAT)、液体培养法、荧光定量PCR法检测不孕不育症患者解脲脲原体(Uu),对检测结果进行评估,以评价临床效果。
1 材料与方法
1.1标本来源和采集选取2014年3月至2016年5月来我院就诊确诊的不孕不育患者,年龄22~43岁,由门诊医生采集女性生殖道标本。拭子样本采集:用医用棉拭子伸入女性宫颈口约1~2cm,旋转1周,停留10s后取出,并将拭子头放入1ml生理盐水浸泡贴管壁挤干,取0.5ml加入0.5ml专用尿液保存液混匀,立即检测或-20℃保存待测。尿液标本采集:取清晨首次尿,或长时间(至少1h)不排尿后的首段尿1ml加入1ml专用尿液保存液混匀,立即检测或-20℃保存待测。同一患者收集到的三份拭子标本分别做Uu-SA、TUu培养及Uu-PCR,尿液标本只做Uu-SAT。
1.2主要试剂及仪器解脲脲原体(Uu)核酸检测试剂盒(RNA恒温扩增)和专用磁珠分离装置(上海仁度生物科技有限公司);解脲脲原体培养鉴定药敏试剂盒(珠海丽珠试剂有限公司);ABI Prism 7600实时荧光定量PCR仪及检测试剂盒(中山大学达安基因股份有限公司)
1.3实验方法三种检测严格按照试剂盒说明书进行。
1.4统计分析方法采用SPSS 19.0统计软件,各组试验数据处理均采用χ2检验来进行差异统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1三种检测方法结果的比较三种方法检测解脲脲原体,阳性率分别为45.00%、48.33%、46.67%,差异无显著意义(P>0.05);尿液SAT检测阳性率为46.11%,与液体培养法相比,差异无显著意义(P>0.05),表明SAT检测解脲脲原体具有较好的相关性,见表1。
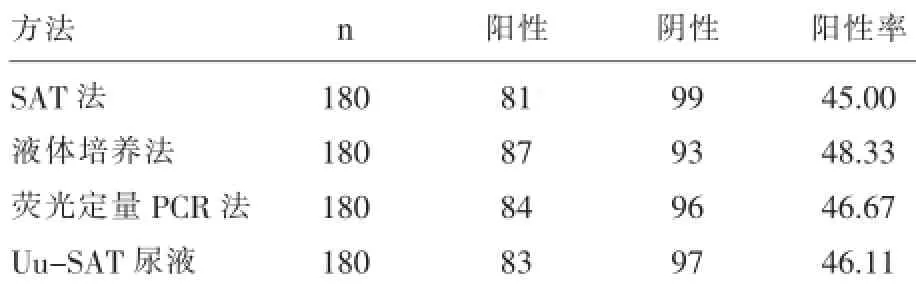
表1 三种检测方法阳性率的比较
3 讨论
解脲脲原体(Uu)是一类大小介于细菌和病毒之间的没有细胞壁的原核细胞微生物,是人类泌尿生殖道的常见病原体之一,也是育龄夫妇不孕不育的重要原因之一[2,3]。
目前,Uu临床检测主要有培养法和荧光定量PCR法。液体培养法虽然操作简便,可同时做药敏试验,能指导临床用药,是目前临床实验室最常用的检测方法[4]。但是它主要依据培养基颜色变化来判断有无Uu的生长,主观性强,易造成假阳性或假阴性结果,且培养常需24~48h[5]。荧光定量PCR虽具有灵敏度高、特异性好、检测快速的优点,但也存在需后期处理[6],同时需要严格规范的实验条件和昂贵的实验仪器,适合大型医院,尚不能广泛应用[7]。
实时荧光核酸恒温扩增检测技术(Simultaneous Amplification and Testing,SAT)是采用RNA恒温扩增技术原理,结合实时荧光检测的一种新的RNA检测技术[8,9]。本文使用SAT技术对患者拭子及尿液标本进行解脲脲原体RNA检测,结果发现三种方法检测解脲脲原体,阳性率分别为45.00%、48.33%、46.67%,差异无显著意义(P>0.05);尿液SAT检测阳性率为46.11%,与液体培养法相比,差异无显著意义(P>0.05),表明SAT检测解脲脲原体具有较好的相关性;由于SAT法无须高速离心、高温加热,RNA在环境中易降解,交叉污染少,并且采用水相洗涤,特异性靶标捕获,反应抑制物少,可有效解决污染引起的假阳性问题及有效减少假阴性,提高检测灵敏度[9]。
在检测结果中,对于出现SAT检测阴性而液体培养法或PCR定量法检出阳性的情况,可能是操作过程中受到RNase的作用使得RNA降解,因此在实验操作过程中必须使用专用加样器,并且离心管、吸头等一次性耗材实验前必须进行高压灭菌,防止影响结果[10]。近年来研究认为[11,12],PCR法虽然有较高的灵敏度和特异性,但不能区分所检测的DNA是来自活菌还是死菌,患者治疗后病菌死亡,但病菌DNA仍在体内继续存在一段时间,PCR检测阳性,容易导致过度治疗[13-15]。
综上所述,实时荧光核酸恒温扩增检测技术作为新一代的核酸检测技术在临床实验室生殖道解脲脲原体检测中,既具备了PCR的灵敏度和特异性,又具有很好的判愈效果,同时又可采用尿液作为检测标本,方便患者及医务人员,是值得推广的一种检测方法。
[1]朱海勇.455例泌尿生殖道感染者支原体检测与药敏分析[J].现代医院2010,10(12):15-16.
[2]邓国明.解脲支原体感染与不孕不育症相关性分析[J].华夏医学,2014,27(4):80-82.
[3]纪榕荣,张洪文.泌尿生殖道解脲支原体感染的分型研究进展[J].实用医学杂志,2009,25(6):997-999.
[4]朱燕.解脲支原体感染与输卵管妊娠的关系分析[J].当代医学,2008,14(20):84285.
[5]丁大朋,万丽平.应用荧光定量PCR与常规方法检测解脲脲原体、沙眼衣原体的比较[J].医学与哲学,2015,36(4):57-59.
[6]王长海,马红英.三种方法筛查解脲脲原体的效果比较[J].检验医学与临床,2016,13(2):267-267.
[7]黄会,赵香依,吴多荣,等.荧光定量PCR检测女性生殖道解脲脲原体原体的应用评价[J].海南医学,2015(18):2720-2722.
[8]高正琴,邢进.TaqMan MGB探针法实时荧光定量PCR快速检测支原体的研究[J].药物分析杂志,2011,31(9):1170-1175.
[9]曾成龙,冯婷,闫丹,等.液体培养法、PCR法和SAT法在解脲支原体检测中的应用比较[J].中国麻风皮肤病杂志,2016,32(7).
[10]张慧慧,熊国亮.SAT技术检测肺结核患者痰标本中结核分枝杆菌的临床应用研究[J].实验与检验医学,2015(4):407-409.
[11]Miron ND,Socolov D,Mares M,et al.Bacteriological agents which play a role in the development of infertility[J].Acta Microbiologica Et Immunologica Hungarica,2013,60(1):41-53.
[12]曾成龙,冯婷,闫丹,等.液体培养法、PCR法和SAT法在解脲支原体检测中的应用比较[J].中国麻风皮肤病杂志,2016,32 (7):397-398.
[13]李林海,何宇玲,石玉玲,等.实时荧光定量PCR检测泌尿生殖道患者尿液解脲脲原体[J].热带医学杂志,2012,12(1):57-59.
[14]杨艳,代文成,刘璇,等.荧光定量PCR检测新疆地区不孕不育患者UU、CT结果分析[J].中国优生与遗传杂志,2014,(11).241-243.
[15]吴建英,宋建新,曹金萍,等.多重PCR快速检测3种食源性致病菌[J].实验与检验医学,2014(2):146-149.
R446.19,R446.5,R518.9
A
1674-1129(2017)02-0239-02
10.3969/j.issn.1674-1129.2017.02.032
2016-10-17;
2016-12-12)
