糯米蛋白质与黄酒氨基酸的相关性分析
2017-04-20陈金斌芮鸿飞方佳宁吴梦妮刘兴泉程秀秀
陈金斌,芮鸿飞,方佳宁,吴梦妮,刘兴泉,程秀秀
(1.浙江农林大学农业与食品科学学院,浙江杭州311300;2.温岭市食品药品检验检测中心,浙江台州317500)
糯米蛋白质与黄酒氨基酸的相关性分析
陈金斌1,2,芮鸿飞1,方佳宁1,吴梦妮1,刘兴泉1,程秀秀1
(1.浙江农林大学农业与食品科学学院,浙江杭州311300;2.温岭市食品药品检验检测中心,浙江台州317500)
以36个糯米品种为原料酿造黄酒,通过红外谷物分析仪测定原料糯米中总蛋白质含量,用考马斯亮蓝G250在595 nm波长下的最大光吸收测定原料糯米中可溶性蛋白质含量,并采用异硫氰酸苯酯(PITC)-柱前衍生高效液相色谱法对黄酒的氨基酸进行定量定性分析,建立糯米蛋白质和黄酒氨基酸的相关性与回归性分析。结果表明,糯米总蛋白和黄酒游离氨基酸总量的相关系数为0.826,达到极显著水平;糯米总蛋白质和黄酒单一氨基酸相关系数较好,R=0.931;糯米可溶性蛋白质与黄酒游离氨基酸总量的相关系数为0.303,糯米可溶性蛋白质与单一氨基酸的相关系数为0.704,糯米可溶性蛋白质的相关系数均不如糯米总蛋白质显著。
糯米;蛋白质;黄酒;氨基酸;相关性
黄酒是我国最具民族特色的酒精饮料,具有悠久的酿造历史[1]。酿造黄酒以米类为原料,因为大米淀粉含量高,蛋白质、脂肪含量低,能使酒中残留的界限糊精和低聚糖多,口味也更醇厚。我国多数名优黄酒用糯米酿造,由于糯米中淀粉含量稍高于其他米类,而蛋白质等成分却相对较低,因此酿成的酒杂味更少,残留的糊精和低聚糖含量多,口味更加醇厚,深受人们的喜爱[2]。
黄酒中含有丰富的营养,研究发现其含有21种氨基酸,人体自身不能合成必须依靠食物摄取的8种必需氨基酸在黄酒中都具备[3],因此其也有“液体蛋糕”的美称。在酒的酿造中,酵母作为菌种在氨基酸的产生过程中起到了重要的作用,而氮源与酵母的生长代谢活动关系密切[4]。葡萄酒[5-6]、啤酒[7-9]及其他发酵酒[10]关于原料蛋白质与酒中氨基酸和香气等研究较多,而原料糯米营养组成对酒品质影响方面目前研究得还较少。本实验收集分析了36个糯米样品中总蛋白质含量和可溶性蛋白质的含量,并且通过分析糯米所酿黄酒中游离氨基酸含量,建立了糯米总蛋白质及可溶性蛋白质与黄酒氨基酸的相关性,为探究原料糯米蛋白质对黄酒氨基酸含量的影响提供了可靠的理论依据。
1 材料与方法
1.1 材料、试剂及仪器
样品及耗材:36个不同品种的糯稻;17种氨基酸对照品(纯度≥98%,sigma公司);异硫氰酸苯酯(PITC,phenyl-isothiocyanate,纯度≥98%,sigma公司)。
仪器设备:丹麦FOSST ECATOR公司生产的XDSContentAnalyzer AD-1100光栅型近红外光谱分析仪;岛津公司高效液相色谱仪(包括LC-20AT二元泵,SPD-M 20A二极管阵列检测器,CTO-10ASVP自动控温箱及LC Solution工作站等),日本岛津UV-1800紫外可见分光光度计。
1.2 实验方法
1.2.1 糯米总蛋白的测定
糯米样品直接放入近红外谷物分析仪中扫描获得光谱,利用MPLS模型和WinISI软件进行数据统计计算。用近红外模型分析平均值(ANL%)表示糯米中蛋白质含量[11-13]。
1.2.2 糯米可溶性蛋白质的测定
可溶性蛋白质的测定使用考马斯亮蓝G250(Coomassie brilliant blue G-250)。蛋白质与考马斯亮蓝G-250结合在595 nm波长下有最大光吸收且与蛋白质含量成正比。考马斯亮蓝G-250法操作简单快捷,反应迅速灵敏,常作为可溶性蛋白质的测定方法。
1.2.3 酿酒实验
糯稻脱壳精米后称取精糯米300 g,加水淘洗干净无米糠。然后将糯米加水超过米层6~10 cm的高度,用单层纱布遮盖,室温下(18℃左右)浸泡2 d。
将浸好的糯米上电热蒸锅蒸煮15min,蒸好的糯米饭颗粒完整、外硬内软、疏松不烂。将蒸好的米饭用自来水冷却,使淋饭后的糯米饭温度保持在40℃。取质量为糯米质量0.1%的活性酵母粉加入质量为酵母粉10~30倍的38~40℃水中复水活化30~60m in,依次向酒坛中投入糯米、水、麦曲、液体酵母,搅拌均匀,控制落坛温度在28~30℃,放置于30℃的恒温箱中培养发酵。黄酒落坛后按时开耙,发酵4~5 d时封紧坛口,密切关注酒的发酵情况,若温度过高时,需及时开耙降温和通风降温。
1.2.4 黄酒氨基酸的测定
采用异硫氰酸苯酯(PITC)柱前衍生-高效液相色谱法[14-16]对黄酒中的氨基酸进行测定,氨基酸衍生产物在紫外波段254 nm有吸收。用C18色谱柱分离后,紫外检测器检测,根据氨基酸标准样品的保留时间与待测样品中的组分的保留时间进行定性,外标法定量分析。
色谱分析条件:色谱柱:Inertsil ODS-4 column (3μm,4.6×250mm);保护柱:InertsilODS-SP(5μm, 4.0×10mm);进样体积:10μL;流速:1.0m L/min;柱温:38℃;检测波长:254 nm;流动相A液:10mM的磷酸缓冲盐pH6.2,流动相B液:乙腈;线性梯度洗脱程序为(B液/%):0~8m in:5%;8~30min:5%~33%;30~35 m in:33%;35.01~40 m in:90%;40.01~55m in:5%;55.01m in:stop。
标准溶液衍生化:准确量取1m L的氨基酸混合对照品溶液,置于刻度试管中,用0.1 mol/L的HCl定容至4m L。取1 m L稀释后的标准溶液精确加入0.5m L的14%三乙胺的乙腈溶液和0.5m L的1.2%异硫氰酸苯酯的腈溶液摇匀,室温静置60m in。反应完全后3000 r/m in离心5min,取上清液加入2m L正己烷萃取,经0.45µm有机滤膜过滤后进样。
样品衍生化:取0.25m L离心后的黄酒上清液,加入0.75m L的高纯水,精确加入0.5m L的14%三乙胺的乙腈溶液和0.5m L的1.2%异硫氰酸苯酯的乙腈溶液摇匀,室温下静置60m in。反应完全后以3000 r/min离心5m in,取上清液加入2m L正己烷萃取,经0.45µm有机滤膜过滤后进样。
1.2.5 数据分析方法
本文的数据是使用spss17.0数据分析软件对样品数据进行相关性分析后得到的。
2 结果与分析
2.1 糯米总蛋白质和可溶性蛋白质含量(表1)
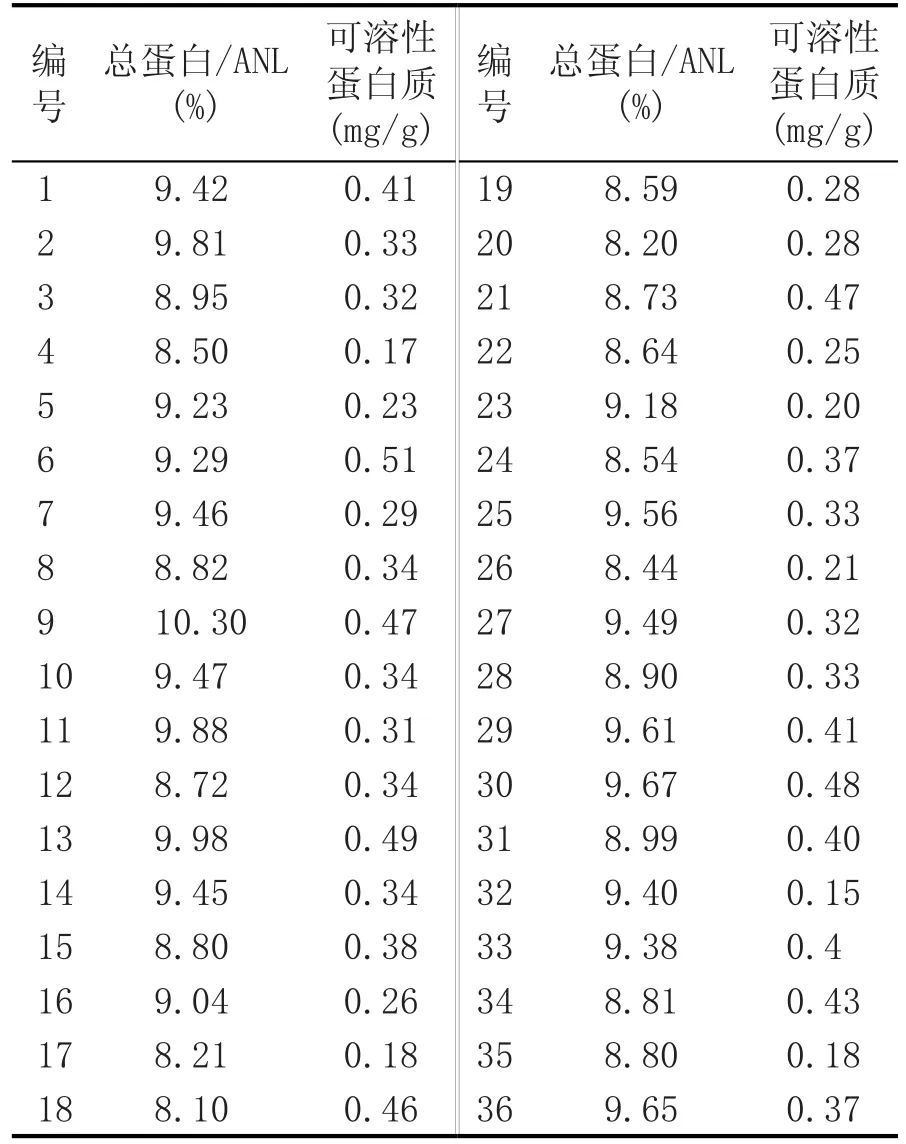
表1 糯米蛋白质检测结果
采用近红外光谱分析测定糯米总蛋白含量在8.10%~10.30%之间。其中9号总蛋白含量最高为10.30%,1号、2号、5号、6号、7号、10号、11号、13号、14号、16号、23号、25号、27号、29号、30号、32号、33号、36号18个糯米样品总蛋白含量在9%~10%之间,其余的17个糯米样品总蛋白含量在8%~9%之间。可溶性蛋白质含量位于前3位的糯米样品依次为6号、13号和30号。
2.2 黄酒氨基酸的含量
氨基酸是黄酒的主要成分和营养物质之一,黄酒中氨基酸的种类和含量非常丰富,主要来自原料糯米。原料糯米经过浸泡、蒸煮和发酵之后,大部分蛋白质被微生物发酵利用产生氨基酸,一部分水解成分子量小的肽类物质,剩下的则留在发酵液中[17]。FAO/WHO在1973年提出的理想蛋白质标准是:人体必需氨基酸和总氨基酸含量的比值是40%左右,人体必需氨基酸和非必需氨基酸含量的比值是60%以上[18]。黄酒氨基酸检测结果见表2,从表2可以看出,黄酒必需氨基酸(essential am ino acid,EAA)和总氨基酸(totalam ino acid,TAA)含量的比值(N/T)为28.7%~36.2%,必需氨基酸和非必需氨基酸(non-essential acid,NEAA)含量比值(N/E)为40.2%~56.7%,黄酒中必需氨基酸和总氨基酸含量的比值以及必需氨基酸和非必需氨基酸含量的比值接近于人体理想蛋白质标准,因此黄酒对人体是比较理想的蛋白质模型,适合人体的生长需要。
黄酒游离氨基酸总量差异明显,其呈味氨基酸含量由高到低依次为:苦味氨基酸、甜味氨基酸、鲜味氨基酸。根据表2黄酒氨基酸检测结果可知,36个黄酒样品中苦味氨基酸的含量为2437 mg/L± 79.4mg/L,甜味氨基酸含量为1191mg/L±41.4mg/L,鲜味氨基酸的含量为203mg/L±8.0mg/L。其中13号、11号、7号氨基酸含量最高,分别为5283.1mg/L、5046.6mg/L、4867.2mg/L。
PITC柱前衍生-高效液相色谱法的氨基酸标准图谱和黄酒氨基酸图谱分别见图1和图2,黄酒中17种氨基酸的检测结果见表2。
2.3 糯米总蛋白质与黄酒氨基酸的相关性分析
糯米总蛋白质与黄酒游离氨基酸的相关性分析结果见表3。从表3可以看出,糯米总蛋白质和黄酒游离氨基酸的整体相关系数(Multiple R)非常高,R=0.931。表明以糯米总蛋白质预测黄酒氨基酸的解释能力为93.1%,调整后的R2也达到了74.1%。这表示17个独立变量可以解释糯米总蛋白质为93.1%的变化量,F回归=6.894>F0.01(17,18)= 3.21,P<0.01,模型检验的结果指出回归系数达到显著水平,该解释力具有统计学意义。单一氨基酸的Pearson相关性分析中,从呈味氨基酸的分类看,甜味氨基酸Gly与糯米总蛋白的相关性为正相关,达到了显著水平(p<0.05),而另外的16种氨基酸与糯米总蛋白的相关性也为正相关,而且达到了极显著水平(p<0.01),说明黄酒单一氨基酸与糯米总蛋白质含量高度相关。系数估计的结果显示,Lys具有最大的解释力,Beta达2.294,表示糯米总蛋白质含量越高,黄酒中Lys越多。
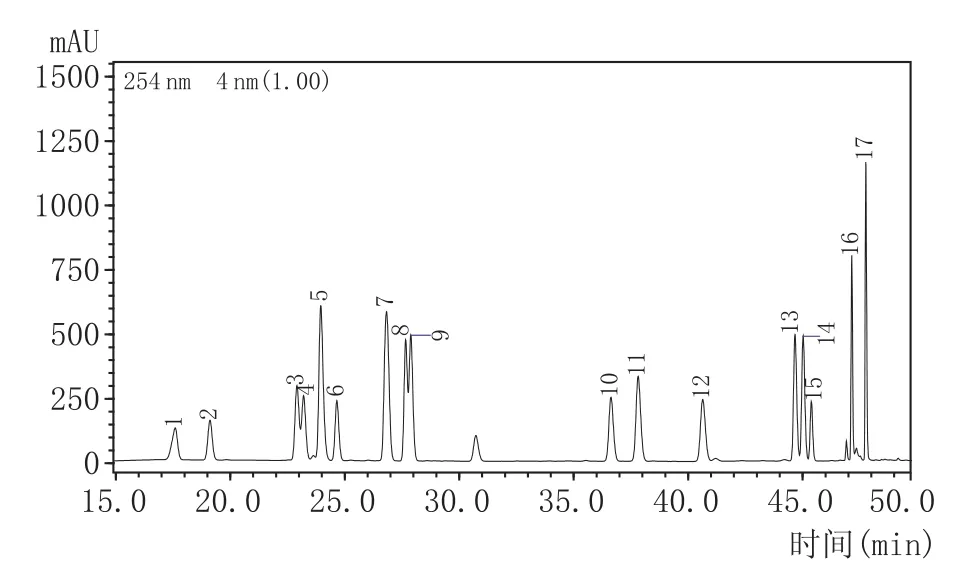
图1 氨基酸标准图谱

图2 黄酒氨基酸图谱

表2 黄酒氨基酸检测结果(mg/L)
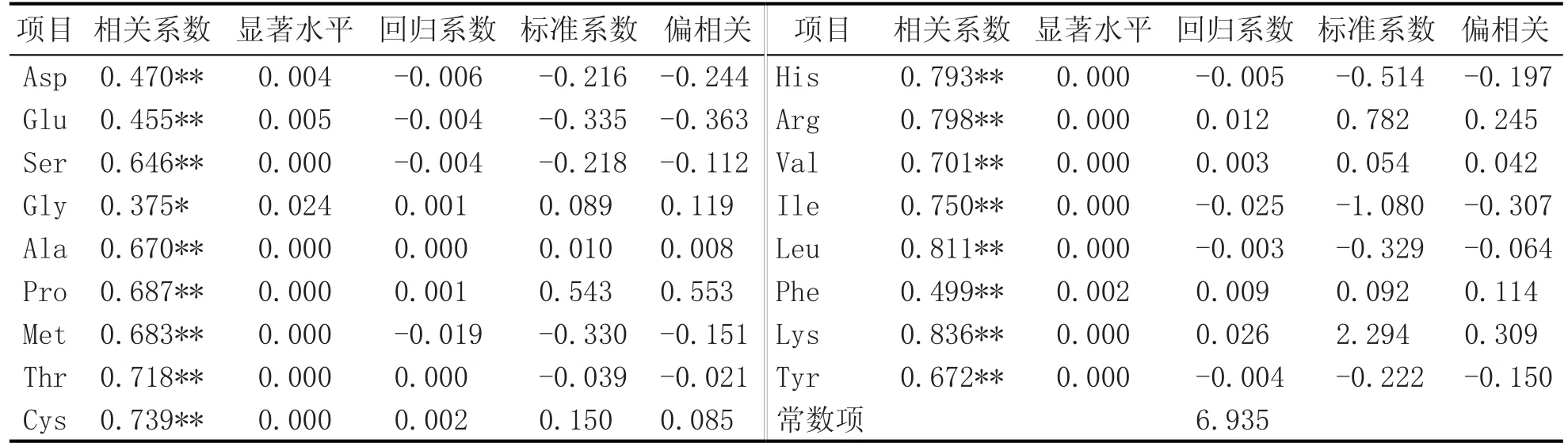
表3 糯米总蛋白质与黄酒游离氨基酸的相关性分析结果
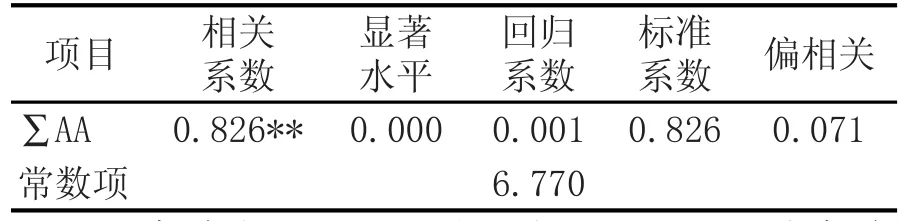
表4 糯米总蛋白质与黄酒游离氨基酸总量的相关性分析结果
由表4糯米总蛋白与黄酒游离氨基酸总量的相关性分析结果可以看出,糯米总蛋白质和黄酒游离氨基酸总量的相关系数(Multiple R)与标准系数(Beta)皆为0.826,这两个系数的检验值相同,F回归= 72.812>F0.01(1,34)=7.44,P<0.01,回归系数达到极显著水平,该解释力具有统计学意义。系数估计的结果表明,糯米总蛋白质含量能够有效预测黄酒氨基酸含量,Beta系数为0.826,表示糯米总蛋白质含量越高,黄酒氨基酸含量越高。9号样品糯米总蛋白质含量最高,在所酿造的黄酒中氨基酸总量和各种游离氨基酸的含量也较高。
2.4 糯米可溶性蛋白质与黄酒氨基酸的相关性分析
糯米可溶性蛋白质与黄酒游离氨基酸的相关性分析结果见表5,糯米可溶性蛋白质与黄酒游离氨基酸的整体相关系数为0.704,低于糯米总蛋白质与黄酒氨基酸的相关系数,调整后的相关系数只有0.496,F回归=1.042<F0.05(17,18)=3.21,P=0.464,模型检验的结果指出回归系数未达到显著水平,该相关系数的解释力没有统计学意义。单一氨基酸和可溶性蛋白质的相关性分析中,各种氨基酸和可溶性蛋白质的相关系数均不高于0.332,只有Pro的相关系数为0.332,在0.05水平上达到显著,其他16种氨基酸的相关系数均未达到显著水平,综合整体的情况,糯米可溶性蛋白质和黄酒氨基酸的相关性并不明显。
由表6糯米可溶性蛋白质与黄酒游离氨基酸总量的相关性分析结果可看出,糯米可溶性蛋白质和黄酒游离氨基酸总量的相关系数为0.303,回归系数的检验值也相同,F回归=3.428<F0.05(1,34)= 4.13,P=0.073,回归系数不显著,该解释力没有统计学意义。系数估计的结果不具有统计学意义,Beta系数为0.303。说明糯米可溶解性蛋白质和黄酒氨基酸总量的相关性不明显。

表5 糯米可溶性蛋白质与黄酒游离氨基酸的相关性分析结果

表6 糯米可溶性蛋白质与黄酒游离氨基酸总量的相关性分析结果
3 结论
糯米总蛋白质与黄酒游离氨基酸的总体相关系数较大,R=0.931,且具有统计学意义;糯米总蛋白质和黄酒游离氨基酸总量的总体回归系数为0.826,具有统计学意义且相关性达到极显著水平。糯米总蛋白质与黄酒单一氨基酸的相关性均为正相关,且两者的相关性都达到了显著或者极显著水平。而糯米可溶性蛋白质和黄酒氨基酸之间的相关性不明显。这说明糯米中蛋白质在很大程度上影响黄酒中游离氨基酸的含量,糯米中总蛋白质含量越高,黄酒游离氨基酸的含量也相对越高。在36个糯米品种中,从糯米总蛋白质含量、黄酒氨基酸含量综合考虑,9号、11号和13号糯米总蛋白质含量高,酿造的黄酒氨基酸总量也较高,是酿造黄酒的优质糯米原料。
本研究从统计分析的角度研究糯米原料蛋白质对黄酒氨基酸含量的影响,以后将进一步研究糯米营养成分如何转变为黄酒组成成分的合成机理和转变路径。
[1]陈双.中国黄酒挥发性组分及香气特征研究[D].无锡:江南大学,2013.
[2]杜木英.西藏青稞酒发酵微生物及酿造技术研究[D].重庆:西南大学,2008.
[3]谢广发.绍兴黄酒功能性组分的检测与研究[D].无锡:江南大学,2005.
[4]MO F,ZHAO H F,LEIH J,etal.Effectsof nitrogen composition on fermentation performanceof brewer's yeast and theabsorption of peptidesw ith different molecularweights[J].Applied biochemistry and biotechnology,2013,171(6):1339-1350.
[5]MAESTREO,SANTOSDUENAS IM,PEINADO R,et al.Changes in am ino acid composition during w ine vinegarproduction in a fully automatic pilotacetator[J]. Processbiochemistry,2008,43(8):803-807.
[6]GUTIERREZA,CHIVAR,GUILLAMON JM.Arginine addition in the stationary phase influences the fermentation rate and synthesisof aroma compounds in a syntheticmust fermented by three commercialw ine strains[J].LWT-food scienceand technology,2014,60:1109-1016.
[7]万春艳.大豆活性肽对酵母增殖代谢及啤酒发酵的影响研究[D].广州:华南理工大学,2012.
[8]YU ZM,ZHAO H F,ZHAOM M,etal.Metabolic flux and nodes controlanalysisofbrewer’s yeastsunder different fermentation temperature during beerbrew ing [J].Applied biochemistry and biotechnology,2012,168 (7):1938-1952.
[9]LEIH J,LIH P,MO F,etal.Effectsof Lysand His supplementationson the regulation of nitrogen metabolism in lager yeast[J].Appliedm icrobiology and biotechnology,2013,97(20):8913-8921.
[10]CHEN D,CHIA JY,LIU SQ.Impactof addition of aromatic amino acidson non-volatileand volatile compounds in lycheew ine fermentedw ith Saccharomyces cerevisiae MERIT.ferm[J].International journalof foodm icrobiology,2014,170:12-20.
[11]刘登峰.黄酒发酵过程的建模与优化[D].无锡:江南大学,2014.
[12]肖昕,谢新华,毛兴学.用近红外透射光谱技术测定精米蛋白质含量研究[J].分析测试学报,2004,23(4):43-45.
[13]舒庆尧,吴殿星,夏英武,等.用近红外反射光谱测定小样本糙米粉的品质性状[J].中国农业科学,1999,32(4):92-97.
[14]黄松,王杰,丁婕,等.三七中十八中游离氨基酸柱前衍生化-HPLC法测定[J].中国医药工业杂志,2011,42(1):54-56.
[15]陈圆,杨虹,程文,等.柱前衍生-反向液相色谱法检测花生粕中的18种氨基酸含量[J].河南工业大学学报, 2011,32(4):68-73.
[16]钟其顶,高红波,熊正河,等.PITC柱前衍生高效液相色谱法测定黄酒中17种氨基酸方法研究[J].酿酒,2010, 37(5):74-76.
[17]顾国贤.酿造酒工艺学[M].2版.北京:中国轻工业出版社,1996:458-459.
[18]天津轻工业学院,无锡轻工业学院.食品生物化学[M].北京:中国轻工业出版社,2005.
Analysisof the Correlationsbetween Am ino Acid Content in Yellow Rice W ine and Protein Content in G lutinousRice
CHENG Jinbin1,2,RUIHongfei1,FANG Jianing1,WUMengni1,LIU Xingquan1and CHENG Xiuxiu1
(1.College of Agriculture and Food Science,Zhejiang Agriculture and Forestry University,Hangzhou,Zhejiang 311300; 2.Wenling Food&Drug Inspection and Testing Center,Taizhou,Zhejiang 317500,China)
Yellow ricew inewas produced by using 36 kinds of glutinous rice respectively under the same conditions.The total protein in glutinous ricewasmeasured by the infrared grain analyzer,the soluble protein content in glutinous ricewasmeasured by Coomassie brilliantblue G250 at595 nm wavelength ofmaximum lightabsorption spectrometry,and qualitative and quantitative analysis of am ino acid content in the produced yellow ricew ine sampleswas performed by using phenylisothiocyanate(PITC)pre-column derivatization HPLC.Finally,amodel for correlation and regression analysis of protein content in glutinous rice and amino acid content in yellow ricew inewas setup.The results showed that,the correlation coefficientbetween total protein in glutinous rice and total free amino acid in yellow ricew inewas 0.826,whichwas of extreme significance;the correlation coefficientbetween totalprotein in glutinous rice and amino acid in yellow ricew inewas 0.931;the correlation coefficientbetween soluble protein content in glutinous rice and total free amino acid in yellow ricew inewas 0.303;and the correlation coefficientbetween soluble protein in glutinous rice and amino acid in yellow ricew inewas0.704.The correlation coefficientof soluble protein in glutinous ricewas inferior to thatof totalprotein in glutinous rice.
glutinous rice;protein;yellow ricew ine;amino acid;correlation
TS262.3;TS261.4;TS261.7
A
1001-9286(2017)04-0051-06
10.13746/j.njkj.2017008
2017-01-10
陈金斌(1983-),男,浙江台州,本科,工程师,研究方向:食品分析与检测,E-mail:ruihongfei1991@163.com。
刘兴泉(1973-),男,浙江杭州,博士,教授,研究方向:黄酒质量控制与食品安全研究,E-mail:liuxq@zafu.edu.cn。
