响应面法优化白地霉(Galactomyces candidum)发酵产果胶酶
2017-04-20于振林贾会勇王颉刘亚琼陈雪洋
于振林,贾会勇,王颉,刘亚琼,陈雪洋
(河北农业大学食品科技学院,河北保定071001)
响应面法优化白地霉(Galactomyces candidum)发酵产果胶酶
于振林,贾会勇,王颉,刘亚琼,陈雪洋
(河北农业大学食品科技学院,河北保定071001)
为解决红枣浓缩汁超滤困难的现象,对实验室保藏菌株白地霉进行液体发酵产果胶酶工艺条件的优化。首先采用单因素实验设计果胶酶发酵的适宜条件,并在此基础上进行响应面优化,通过Design Expert8.05统计软件确定培养基的适宜组合。结果表明,果胶酶发酵的较适宜条件为:发酵时间4 d,发酵温度30℃,接种量7%,红枣果胶添加量0.9%,硫酸铵添加量2%。回归分析得到的优化发酵条件为:发酵时间3.66 d,发酵温度29.13℃,红枣果胶添加量0.89%,此时的酶活是7648.71 U/m L。
白地霉;液态发酵;果胶酶;培养基优化
果胶酶(pectinase)是指能够催化果胶质分解的多种酶的总称[1],按其作用效果可分为果胶水解酶、果胶裂解酶、果胶酯酶和原果胶酶等[2]。果胶酶是国际上公认的重要的四大工业酶制剂之一,已有40多年的生产应用历史,目前在食品加工、饲料加工、生物技术、纺织、造纸、环境保护、诱导植物抗病等领域得到广泛应用[1]。果胶酶在适宜的条件下可使底物组织柔化、分解,得到小分子产物,从而降低提取液的黏度,提高生产效率,节约生产成本[3]。
天然的果胶酶广泛分布于高等植物和微生物中,微生物因具有生长速度快、生长条件简单、代谢过程特殊和分布广等特点而成为果胶酶的重要来源[4]。在微生物中,细菌、放线菌、酵母和霉菌都能代谢合成果胶酶[5]。尤华等[6]以Aspergillus sp.XZ-131为生产菌种进行液体发酵产果胶酶,通过正交实验优化培养基,最终酶活达300 U/m L。田林茂等[7]以黑曲霉HG-1为生产菌种,采用单因子实验和正交实验进行固态发酵,所得果胶酶酶活力可达22248 U/g。Patil等[8]以葵花盘作为基质,接种Aspergillus niger DMF 27进行液态发酵,得到内切果胶酶最大产酶率为12.6 U/g。Cavalitto等[9]采用响应面分析法对Geotrichum klebahnii ATCC42397产原果胶酶的发酵条件进行了优化,结果显示,pH值和铁离子对原果胶酶产率有显著影响,在较优条件下原果胶酶产率达到236 U/m L。
河北省是农业大省,农产品资源丰富,尤以枣类资源居多[10]。红枣浓缩汁作为延长红枣产业链的新型产品,其研发逐渐受到关注。但是在制汁过程中红枣果胶的存在会导致果汁超滤困难,因此需要使用果胶酶进行水解[11]。而目前国内缺少针对红枣果胶性质开发的果胶酶,大型果品加工企业使用的果胶酶是法国进口的用于加工浓缩苹果汁的酶制剂,不适合处理红枣果实[12]。通过利用实验室保藏菌株白地霉,以红枣果胶为唯一碳源进行发酵产酶条件的优化,得到适用于红枣果汁、果酒澄清的酶制剂,其具有很好的专一性。
1 材料与方法
1.1 材料
菌种:白地霉(Galactomyces candidum),由河北农业大学食品科技学院从枣园土壤中分离筛选保藏。
马铃薯葡萄糖固体培养基(PDA):北京索莱宝科技有限公司。
摇瓶种子培养基(PDB)(g/L):去皮马铃薯200,葡萄糖20,自然pH值,121℃灭菌20m in。
红枣果胶的制备[13]:准确称取100.00 g经粉碎的干枣,放入1000m L的烧杯中,添加400m L的蒸馏水,盐酸调pH2,搅拌均匀后放在超声波中超声30 min,超声完后立即拿出,置于恒温水浴锅中90℃浸提90m in,反应完毕以后冷却过滤,取滤汁加入3%活性炭于80℃条件下脱色30m in,冷却后加入等体积的无水乙醇沉淀20m in,4000 r/m in离心得到沉淀,沉淀用95%的乙醇溶液冲洗3次,去除单糖与双糖。沉淀真空冷冻干燥至恒重,保存备用。
摇瓶初始发酵培养基(g/100 m L):红枣果胶0.7,硫酸铵2,磷酸二氢钾3.8,磷酸氢二钾0.2,硫酸镁0.5,无水氯化钙0.05,pH 5.5,121℃灭菌20min。
1.2 实验方法
1.2.1 种子培养
取保藏菌种在PDA培养基上活化2 d后,用无菌生理盐水将孢子洗下,制成3.5×107个/m L浓度的孢子悬浮液。按5%的接种量(v/v)接入灭过菌的摇瓶种子培养基中,置于回转式摇床上30℃振荡培养,摇床转速160 r/m in,,每隔一段时间将培养基取出,用定量滤纸过滤并烘干至恒重,通过称干重法确定种子培养的最佳时间,结果见图1。
1.2.2 粗酶液的提取
将发酵液在4℃下以8000 r/m in离心10m in后取上清液作为粗酶液,并于4℃保存,供酶活测定用。
1.2.3 果胶酶活力的测定[14]
各取1.0m L、pH 4的磷酸氢二钠-柠檬酸缓冲液配制的浓度为1%的红枣果胶底物溶液分别放入甲、乙2支25m L具塞试管中,于50℃条件下预热5 m in。甲管中加入0.2 m L经适当稀释的粗酶液,50℃水浴反应30m in后加2m L的DNS终止反应,沸水浴5m in,冷却后蒸馏水定容到25m L,摇匀;乙管中加入0.2m L经适当稀释并灭活的粗酶液,50℃水浴反应30m in后加2m L的DNS终止反应,沸水浴5m in,冷却后蒸馏水定容到25m L,摇匀。在540 nm下测定其吸光值。在上述反应体系中,每分钟催化红枣果胶产生1μg半乳糖醛酸所需的酶量定义为1个酶活力单位,以U/m L表示。
果胶酶活力计算公式:

式中:X——果胶酶活力;
A甲——粗酶液的吸光度值;
A乙——空白样的吸光度值;
100——粗酶液的稀释倍数;
5——测定酶活时取了1/5m L原酶液;
1000——1mg=1000μg;
t——反应时间,m in;
K——标准曲线的斜率。
1.2.4 发酵条件对产酶的影响实验设计
采用单因素实验分别研究发酵时间、发酵温度、接种量、红枣果胶添加量、氮源种类、硫酸铵添加量等对果胶酶活性的影响。
1.2.4.1 发酵时间对产酶的影响
取种子培养液按6%(v/v)接种量接种于40m L初始发酵培养基中,在160 r/m in、30℃条件下进行摇瓶发酵培养,分别在1 d、2 d、3 d、4 d、5 d终止发酵,于50℃、pH4的酶促反应条件下分别测定其果胶酶活力,探究不同发酵时间对产酶的影响,实验重复3次。
1.2.4.2 发酵温度对产酶的影响
取种子培养液按6%(v/v)接种量接种于40m L初始发酵培养基中,在160 r/m in条件下摇瓶发酵培养4 d,发酵温度分别为24℃、27℃、30℃、33℃、36℃,发酵结束后,在50℃、pH4的酶促反应条件下分别测定其果胶酶活力,探究不同发酵温度对产酶的影响,实验重复3次。
1.2.4.3 不同接种量对产酶的影响
取种子培养液分别按4%(v/v)、5%(v/v)、6% (v/v)、7%、8%(v/v)接种量接种于40m L初始发酵培养基中,在160 r/m in、30℃条件下摇瓶发酵培养4 d,发酵结束后,在50℃、pH4的酶促反应条件下分别测定其果胶酶活力,探究不同接种量对产酶的影响,实验重复3次。
1.2.4.4 红枣果胶添加量对产酶的影响
取种子培养液按7%(v/v)接种量接种于红枣果胶添加量分别为0.3%(m/v)、0.5%(m/v)、0.7%(m/v)、0.9%(m/v)、1.1%(m/v)的40 m L摇瓶发酵培养基中,在160 r/m in、30℃条件下摇瓶发酵培养4 d,发酵结束后,在50℃、pH4的酶促反应条件下分别测定其果胶酶活力,探究红枣果胶含量对产酶的影响,实验重复3次。
1.2.4.5 氮源种类对产酶的影响
取种子培养液按7%(v/v)接种量接种于氮源分别为硫酸铵、氯化铵、尿素、牛肉膏、蛋白胨(添加量均为2%)的40m L摇瓶发酵培养基中,在160 r/min、30℃条件下摇瓶发酵培养4 d,发酵结束后,在50℃、pH4的酶促反应条件下分别测定其果胶酶活力,探究氮源种类对产酶的影响,实验重复3次。
1.2.4.6 硫酸铵添加量对产酶的影响
取种子培养液按7%(v/v)接种量接种于40m L摇瓶发酵培养基中,以硫酸铵为氮源,分别添加1.0%(m/v)、1.5%(m/v)、2.0%(m/v)、2.5%(m/v)、3.0%(m/v),在160 r/m in、30℃条件下摇瓶发酵培养4 d,发酵结束后,在50℃、pH4的酶促反应条件下分别测定其果胶酶活力,探究硫酸铵添加量对产酶的影响,实验重复3次。
1.2.5 响应面实验设计
综合考虑单因素实验结果,以发酵时间、发酵温度、红枣果胶含量为影响因素,果胶酶活力为响应值,设计3因素3水平的响应面实验,实验结果采用Design Expert 8.05统计软件进行分析。因素水平表见表1。

表1 响应面因素水平表
2 结果与分析
2.1 白地霉生长曲线
白地霉的生长曲线见图1。
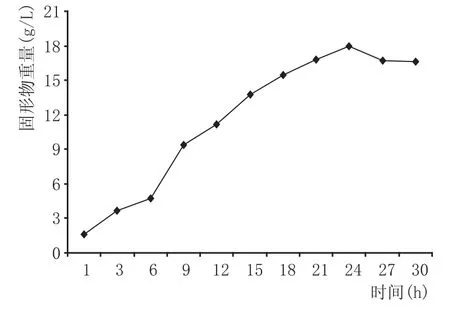
图1 白地霉生长曲线
由图1可知,白地霉的生长曲线大致呈S形分布,孢子发芽的迟滞期需0~6 h;之后菌丝伸长增多,进入对数生长期,需6~24 h;24 h后固形物重量减轻,曲线趋向平稳,进入生长稳定期。因此,种子培养基的培养时间约需24 h。
2.2 半乳糖醛酸标准曲线的绘制(表2)
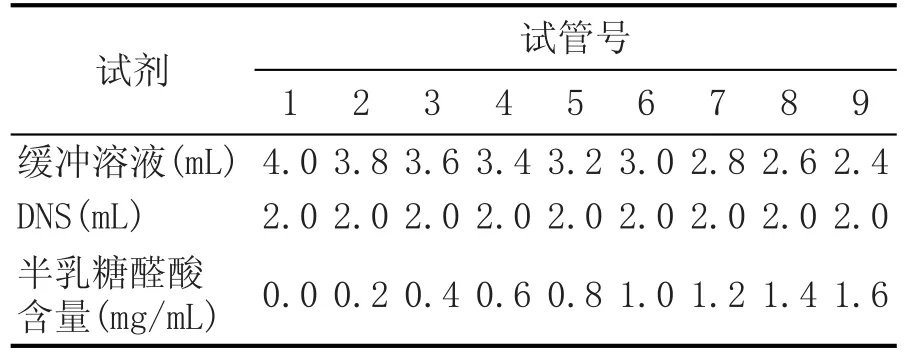
表2 半乳糖醛酸标准曲线的制作
取9支25m L的具塞试管按1—9顺序编号,按表1加入相应试剂后(其中DNS试剂的配制参照苑鹏的方法[15]),于沸水中精确反应5m in,冷却后用蒸馏水定容至25m L,摇匀,于540 nm波长处测其吸光度值,从而得到半乳糖醛酸含量标准曲线,标准曲线如图2所示,其中半乳糖醛酸含量(x)与吸光度值A(y)的线性方程为y=0.3501x-0.0472,R2= 0.9976,吸光度值要在0.019~0.806之间,否则须重新稀释。
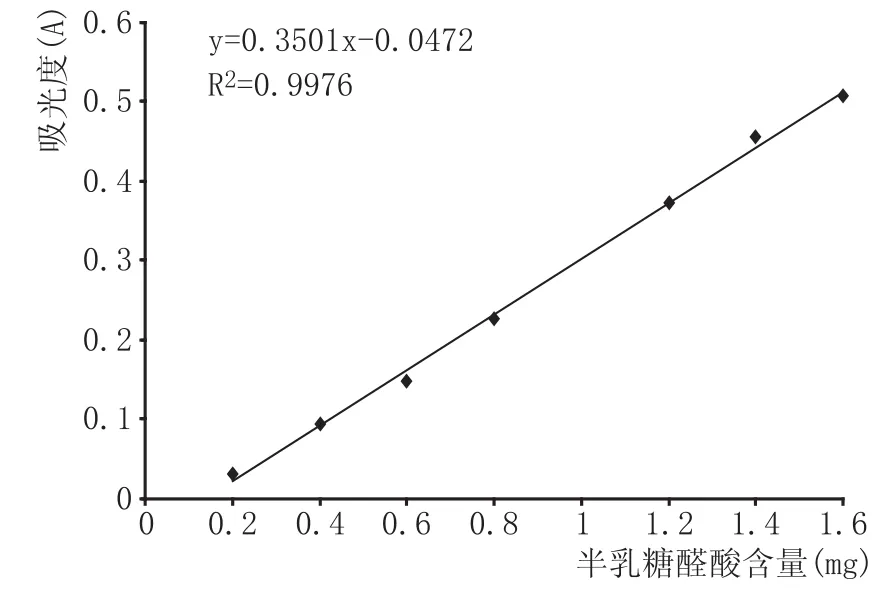
图2 半乳糖醛酸标准曲线
2.3 发酵条件对产酶的影响结果
2.3.1 发酵时间对产酶的影响(见图3)
由图3可知,随着发酵时间的延长,果胶酶活力呈先增大后减小的趋势,在发酵第4天时,产酶能力达到最大值7127.83 U/m L。这可能是因为在发酵初期,培养基中的营养物质主要用于菌体的生长,代谢产物积累较少,随着发酵时间的延长,代谢产物的大量积累可能产生某种抑制剂,导致部分菌体发生自溶现象[16]。经单因素方差分析,发酵时间对产酶具有极显著性影响(P<0.01)。因此,发酵4 d较为适宜。

图3 发酵时间对产酶的影响
2.3.2 发酵温度对产酶的影响(见图4)
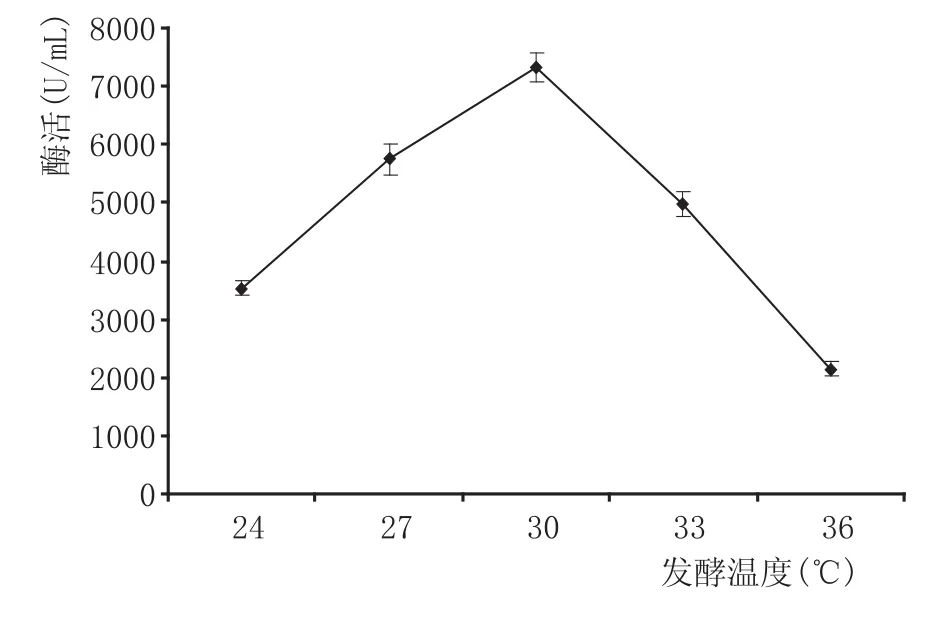
图4 发酵温度对产酶的影响
由图4可知,随着发酵温度的升高,果胶酶活力呈先增大后减小的趋势,在30℃时,产酶能力达到最大值7335.5U/m L。微生物生长均有其适宜的温度范围,温度过高或过低均会抑制其生长,从而影响发酵过程中代谢产物的生成。经单因素方差分析,30℃较其他发酵温度对产酶具有极显著性影响(P<0.01)。
2.3.3 接种量对产酶的影响(见图5)
由图5可知,随着接种量的增加,果胶酶活力呈先增大后减小的趋势,当接种量为7%时酶活为7681.45 U/m L。若接种量过高,则导致菌体繁殖过快,营养物质消耗迅速,造成发酵体系内菌体生长与代谢产酶失去平衡[17]。据方差分析,接种量对产酶具有极显著性影响(P<0.01)。
2.3.4 红枣果胶添加量对酶活的影响(见图6)
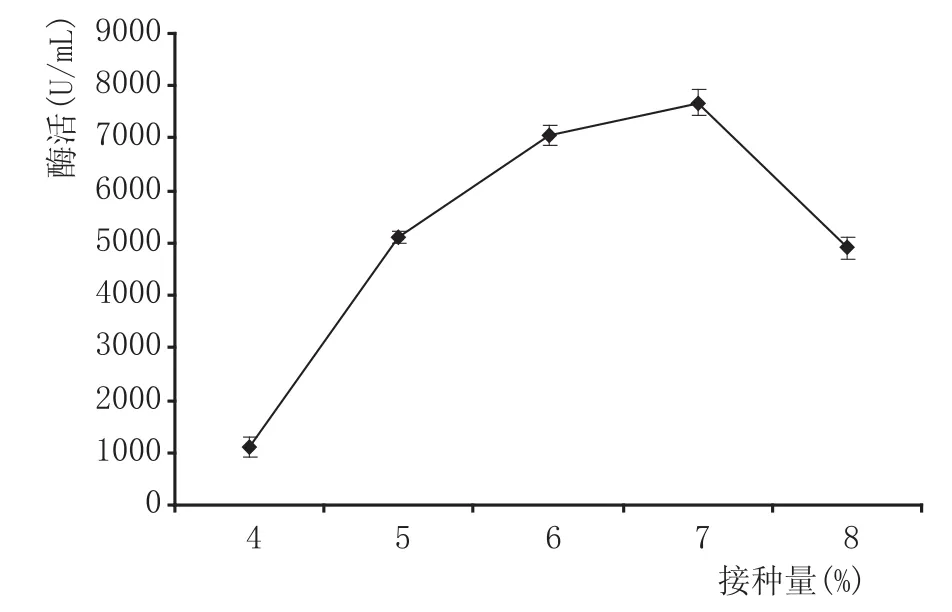
图5 接种量对产酶的影响

图6 红枣果胶添加量对产酶的影响
由图6可知,当果胶添加量为0.9%时,菌株产酶能力达到最大值7819.92 U/m L。此后,随着果胶添加量的增大,酶活力逐渐下降,这是由于碳源浓度偏大会导致培养基内溶氧不足,菌体代谢受抑制,致使产酶能力降低。据方差分析,红枣果胶添加量对产酶具有极显著性影响(P<0.01)。
2.3.5 氮源种类对酶活的影响(见图7)
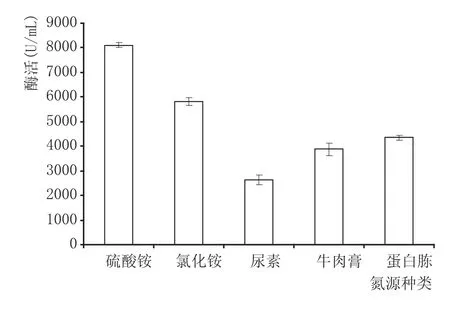
图7 氮源种类对产酶的影响
由图7可知,无机氮源(硫酸铵、氯化铵)比有机氮源(牛肉膏、蛋白胨)更有利于产酶。在发酵初期,无机氮源首先被消耗,发酵期间无机氮源可以控制发酵过程中菌体生长时期和代谢产物形成时期的协调[18]。硫酸铵为氮源时产酶能力最大,为8096.73 U/m L。
2.3.6 硫酸铵添加量对酶活的影响(见图8)
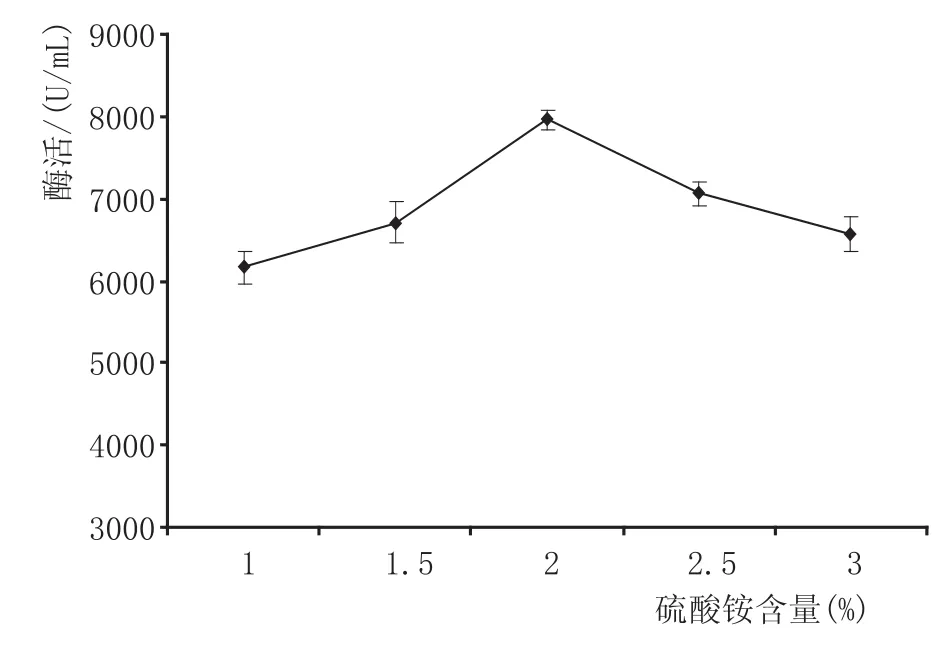
图8 硫酸铵含量对产酶的影响
由图8可知,随着发酵培养基硫酸铵含量的增加,果胶酶活力呈先增大后减小的趋势,在硫酸铵含量为2%时,产酶能力达到最大值7958.26 U/m L。这是因为硫酸铵含量过高会导致培养基pH值发生变化,偏离菌体生长适宜的酸碱范围,导致产酶能力下降。据方差分析,硫酸铵含量对产酶具有极显著性影响(P<0.01)。
2.4 响应面实验结果及分析
2.4.1 回归模型的建立
响应面实验结果见表3,回归模型显著性检验结果见表4。以酶活Y为响应值,对实验数据进行回归拟合,得到二次响应面回归模型为:

该回归模型具有很高的显著性(P<0.01),失拟项不显著(P>0.05),说明方程对实验的拟合良好。该模型一次项中的A、B,二次项中的A2、B2、C2对实验指标有显著或极显著的影响,其余各项不显著。模型决定系数R2=0.9617,调整决定系数Radj2= 0.9124,说明该模型能较好描述95%响应值的变化,其拟合程度较好,实验误差较小,因此可以用此模型对实验进行分析和预测。
2.4.2 响应面及等高线分析

表3 响应面方案及结果
分别将模型中发酵时间(A)、发酵温度(B)、红枣果胶含量(C)固定在0水平,得到另外2个因素对酶活的子模型,再根据子模型绘制出三维曲面图和等值线图,结果见图9。其中,三维曲面图越凸的位点酶活越大,等值线的中心位点对应的酶活最大。
根据回归分析结果可知,发酵时间、发酵温度、红枣果胶含量的两两因素之间的交互作用均不显著(P>0.05)。由F值可知,对果胶酶活影响的主次次序为发酵时间>发酵温度>红枣果胶含量。通过Design Expert软件分析,可得到较适宜的发酵条件为:发酵时间3.66 d,发酵温度29.13℃,红枣果胶含量0.89%,此时的酶活是7648.71 U/m L。考虑到操作中的实际性和便利性,将较适宜的发酵条件修改为,发酵时间3.5 d,发酵温度29.0℃,红枣果胶含量0.9%。为检验响应面实验设计结果的可靠性,在得到优化后的适宜发酵条件下进行验证实验,重复3次,以较适宜条件发酵得到果胶酶活为7526.77 U/m L,与响应面得到的模型预测值相比,误差不显著,因而说明建立的回归模型能较为准确地预测实际发酵情况。
3 结论
由于红枣富含果胶,在制汁过程中超滤困难,因此需要借助果胶酶进行酶解。目前国内缺少针对红枣果胶性质开发的果胶酶,大型果品加工企业使用的果胶酶是法国进口的用于加工浓缩苹果汁的酶制剂,不适合处理红枣果实。为针对性地解决这一难题,本研究采用实验室保藏菌种白地霉,并以红枣果胶为唯一碳源进行发酵培养,得到可应用于红枣果胶的酶活力较高的果胶酶。通过单因素实验确定该菌株的较适发酵产酶条件为:发酵时间4 d,发酵温度30℃,接种量6%,红枣果胶含量0.9%,氮源种类为硫酸铵,硫酸铵含量2%。在单因素实验的基础上采用响应面法进行优化,回归分析得较适宜的发酵条件为:发酵时间3.66 d,发酵温度29.13℃,红枣果胶含量0.89%,此时的酶活是7648.71 U/m L。发酵时间对菌株产酶影响极显著,发酵温度对菌株产酶影响显著,而发酵培养基果胶含量对菌株的产酶能力影响不显著。

表4 回归模型方差分析


图9 各因素对产酶影响的响应面图和等高线图
[1]李祖明,张洪勋,白志辉,等.微生物果胶酶研究进展[J].生物技术通报,2010(3):42-49.
[2]KASHYAPD R,VOHRA PK,CHOPRA S. Applicationsof pectinases in the commercial sector:a review[J].Bioresource technology,2001,77(3):215-227.
[3]蓝丽精,蔡琪敏,宋迤明,等.草酸青霉液体发酵产果胶酶条件的优化及其产物的酶学性质[J].微生物学杂志, 2011(4):36-41.
[4]PERAZA L,ORTIZM A,PEBERDY JF.Grow th and pectinase production by Aspergillusmexican strain protoplast regenerated under acidic stress[J].Applied biochemistry and biotechnology,2003,111(1):15-27.
[5]张海燕,吴天祥.微生物果胶酶的研究进展[J].酿酒科技,2006(9):82-85.
[6]尤华,陆兆新,冯红霞.曲霉液体发酵产原果胶酶的条件优化研究[J].微生物学通报,2003(1):26-30.
[7]田林茂,张红燕,刘成,等.黑曲霉HG-1发酵苹果渣生产果胶酶的工艺优化及部分酶学性质[J].生物技术,2008 (2):74-77.
[8]PATILSR,DAYANANDA.Production of pectinase from deseeded sunflower head by Aspergillusniger in submerged and solid-state conditions[J].Bioresource technology,2006,97:2054-2058.
[9]CAVALITTO SF,M IGNONEC F.Application of factorialand doehlertdesigns foroptim ization of protopectinase production by a Geotrichum klebahnii strain[J].Process biochem istry,2007,42:175-179.
[10]葛文光,马立然,王洁.河北省枣产业的现状和优势及发展对策[J].农业现代化研究,2011,06:713-716.
[11]艾克拜尔·艾海提.红枣浓缩清汁与饮料加工工艺研究[D].无锡:江南大学,2013.
[12]裘纪莹,王未名,陈建爱,等.微生物果胶酶的研究进展[J].中国食品添加剂,2010(4):238-241.
[13]田继武,刘朝良,朱保建,等.桑枝皮中果胶的提取工艺优化[J].食品科学,2011(16):22-26.
[14]张浩森.果胶酶高产菌种的筛选及其酶学性质的研究[D].无锡:江南大学,2008.
[15]苑鹏.果胶酶基因的克隆表达及其在小尾寒羊瘤胃环境中的多样性分析[D].北京:中国农业科学院,2012.
[16]卢晓华,杨苗,王常高,等.产果胶酶菌株的筛选鉴定及产酶条件优化[J].食品工业科技,2016(2):189-193.
[17]柯崇榕,田宝玉,杨欣伟,等.果胶酶高产菌株EIM-4的鉴定及其液体发酵条件优化[J].生物技术,2008(5):69-72.
[18]王丽丽,刘晓兰,郑喜群,等.黑曲霉固态发酵产生果胶酶条件的优化[J].食品科技,2008(5):14-18.
Optim ization of the Fermentation Conditionsof Galactomyces candidum to Produce Pectinase by Response SurfaceM ethod
YU Zhenlin,JIA Huiyong,WANG Jie,LIU Yaqiong and CHEN Xueyang
(College of Food Science and Technology,HebeiAgricultural University,Baoding,Heibei071001,China)
In order to solve the problem of difficultultrafiltration of jujube concentrated juice,the fermentation conditions of Galactomyces candidum preserved in the lab to produce pectinase were optim ized.Firstly,the optimum fermentation conditions were designed by single factor test,then response surfacemethod was applied,and the optimum compositions of the culturemedium were determined by Design Expert 8.05.The results showed that the optimum fermentation conditions were as follows:4 d fermentation time,fermentation temperature was at 30℃,the inoculating quantity was 7%,the adding level of jujube pectin was 0.9%,and the adding level of(NH4)2SO4was 2.0%.The optimum fermentation conditions by regression analysiswere obtained as follows:fermentation timewas 3.66 d,fermentation temperaturewas at29.13℃,the adding levelof jujube pectin was0.89%,and pectinase activity was up to 7648.71 U/m L.
Galactomyces candidum;liquid-state fermentation;pectinase;optim ization of culturemedium
TS201.3;TQ920
A
1001-9286(2017)04-0026-07
10.13746/j.njkj.2016376
河北省科技支撑项目(15227106D)。
2016-12-20
于振林(1992-),女,硕士研究生,研究方向为微生物发酵。
刘亚琼。
优先数字出版时间:2017-03-15;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170315.1630.004.htm l。
