药物涂层球囊药物释放和微粒脱落的体外评估方法
2017-04-20宋精忠,谢琦宗,卢金华等
药物涂层球囊药物释放和微粒脱落的体外评估方法
【作 者】宋精忠,谢琦宗,卢金华,王刚,龙汉先健科技(深圳)有限公司,深圳市,518057
目的 开发药物释放和微粒脱落的体外测试方法,解决现有评估方法的缺点与不足。方法 使用离体猪血管作为靶作用部位在自制的股髂动脉模型中进行体外转载实验,增加扩张过程和回撤过程的药物损失实验,细分微粒测试通道并使用显微法联合Image-Pro Plus软件测试大微粒的数量和具体尺寸。结果 转载率测试方法分辨度较好,实现了物料平衡,可获得更详尽的数据。结论 所开发的方法为企业配方筛选、台架实验和临床前动物试验提供了参考。
药物球囊;药物释放;微粒脱落;药物转载;体外评估
【 Writers 】SONG Jingzhong, XIE Qizong, LU Jinhua, WANG Gang, LONG Han
Lifetech Scienti fi c (Shenzhen) Co. Ltd, Shenzhen, 518057
【 Abstract 】Objective Development in vitro test methods for drug release and particle release from drug coated balloon to address the disadvantages and inadequacy of existing assessment methods. Methods In vitro drug transfer test were carried out using the isolated porcine vessel as target site in the self-designed iliofemoral artery model, drug loss experiment during dilatation and retraction were added in drug release test, the particle test channel was subdivided and the size and number of the large particles were measured by microscopy combined with Image-Pro Plus software. Results The result shows that the method is feasible and the discrimination is good. The material balance can be achieved. More detailed data can be obtained. Conclusion The developed in vitro evaluation method provides a reference for formulation screening, in vitro bench testing and in vivo pre-clinical animal testing.
0 引言
经皮腔内介入治疗技术是心血管治疗领域新兴的技术,药物洗脱球囊由于具有无植入物永久保留在病人体内,没有聚合物涂层导致的炎性反应及内皮化障碍等优点,使得药物洗脱球囊导管在血管介入领域受到极大的追捧。随着巴德和美敦力所开发的药物球囊导管陆续被美国FDA批准上市,药物洗脱外周球囊导管在下肢动脉疾病中的应用越来越被广大医患所接受,越来越多的临床试验证明了药物球囊在治疗某些病变的有效性[1-3],针对药物球囊导管的研究热度也越来越高。
针对药物支架的产品标准及指导原则相对比较完善和成熟,但目前尚无有关药物球囊的产品标准、指导原则及指南,研究者主要依据药物—器械组合类产品的通用标准[4]来开发新产品,或者参考药物支架的相关标准及指导原则。但通用标准往往比较笼统,很少涉及细节,而针对药物支架的相关标准,由于产品特点和作用方式等的差异,有时又不完全适用,涉及药物涂层体外评价的方法各不相同,这导致药物球囊的研究显得无据可依。
Seidlitz A[5]等,通过将自制的藻酸钙凝胶膜制成圆柱状凝胶物,作为体外转载试验的模拟血管使用,并采用ASTM F-2394-07模型,模拟药物球囊作用路径,测试药物浓度并计算转载率。Kelsch B[6]等,在体外干燥环境下扩张并摇晃,收集扩张过程中剥离的药物涂层,评价涂层的粘附性。将球囊导管在充满血液的环境中通过止血阀、指引导管并在搅动的血液环境中保持1 min,评价药物涂层的脱落性能以及到达靶部位前的药量损失。Kaule S[7]等,使用ASTM F-2394-07的模型模拟路径,在模型的远端连接硅胶管作为目标血管,计算药物转载、残留和损失。其对微粒计数测试的方法是,输送到目标位置后,收集冲洗及扩张过程中的溶液,测试≥10 μm和≥25 μm的微粒数目。
基于笔者对所查文献的理解,发现不少研究者对药物球囊的药物释放行为和微粒脱落水平的研究存在一些不足之处。表现如下:①药物释放行为研究测试模型多选择ASTM标准的模型,与产品实际作用部位和路径不同;②使用硅胶管或自制的管状凝胶等作为模拟血管不能很好的模拟体内血管壁对药物的吸附作用;③对药物球囊使用过程的涂层去向的分解不够细致,不能做到物料平衡;④对于药物球囊微粒脱落的研究不够全面细致。本文针对药物释放和微粒脱落评估的不足之处,尝试开发几种方法,期望能解决这些问题。
1 仪器
球囊与支架输送系统测试设备(型号IDTE2000)购自Machine Solution Inc.;液相色谱仪(LC-20AT)购自岛津;液质联用仪(API4000)购自AB sciex;手持式匀浆机(T10)购自IKA;Talboys Advanced Vortex Mixers 购自Troemner;量筒式微量砂芯过滤装置(砂芯片直径20 mm,滤膜直径25 mm) 购自建湖亚东玻璃仪器;数码体视镜(EZ4 HD)购自Leica; Image-Pro Plus 6.0图像分析软件来自 Media Cybernetics。
2 材料
紫杉醇对照品购自中国食品药品检定研究所;药物洗脱外周球囊导管(规格3.0 mm×40 mm,5.0 mm×60 mm)由先健科技(深圳)有限公司自制;医用混合纤维素聚酯薄膜(直径25 mm,孔径0.8 μm,黑色)购自天津市领航实验设备有限公司;指引导管(6F MPA1)购自Cordis;指引导丝(V18TM0.018"×300 cm Control WireTM) 购自Boston Scientif i c。
3 方法
3.1 体外药物释放测试模型
使用自制的髂股动脉模型,该模型基本尺寸按与正常成年人1:1比例设计制作,用于模拟下肢动脉的路径。按对侧翻山手术流程依次置入导丝、导管。通过IDTE2000球囊与支架输送系统测试设备输送循环介质。模型浸没在恒温为(37±2) ℃的生理盐水中。
3.2 体外药物释放测试步骤
沿导丝将球囊通过指引导管推送至预扩张部位,收集输送过程的流出液,测试流出液的药物浓度。扩张球囊至(200~400) kPa,收集扩张过程的流出液,测试流出液的浓度。选择大小适中的猪心脏,解剖获取冠状动脉的左回旋支和右冠。在导管末端连接离体猪血管,作为球囊扩张靶部位。沿导丝将球囊通过指引导管推送至血管的预扩张部位,用充盈器迅速充盈到预定压力,并维持2 min,泄压后撤出球囊导管,收集回撤过程的流出液,测试流出液的浓度。剪下球囊导管,测试球囊表面残留药量。准确截取球囊扩张部位的血管,测试血管药物含量。
3.3 药物含量测试
血管组织样品的前处理方法:经体外模拟后取下的靶血管,经冷冻干燥,快速称重,室温下解冻2 h,精密加入适量空白匀浆液,使用手持式匀浆机研磨。超声10 min,离心5 min,取上层清液加入一定比例的乙腈,漩涡混合,再经低温高速离心沉淀。取上清液进LC-MS/MS分析。
LC-MS/MS仪器主要工作参数:API4000 QTRAP型三重四极杆串联质谱仪,配备电喷雾电离源(ESI),分析柱:Agela Venusil XBP C8 (2.1 × 50 mm, 5 μm),梯度洗脱,ESI正离子检测模式。
剪下的球囊导管使用甲醇浸提,收集的输送、扩张和回撤过程流出液,均使用甲醇溶解,定容后进液相色谱测试。
HPLC仪器主要工作参数 色谱柱:Agilent ZORBAX SB-C18,4.6×2.5 μm,250 mm,柱温:30oC,进样量:10 μL,流速:0.8 mL/min, 流动相:甲醇/水/乙腈=23/41/36(V/V/V),检测波长:227 nm。
3.4 体外微粒测试模型
使用ASTM F2394-07,X.2.4模型,按手术流程依次置入导丝、导管,在导管末端连接适宜内径的硅胶管,作为球囊扩张靶部位。头端连接蠕动泵用于输送介质,选择恒温为(37±2) ℃的生理盐水作为介质,模型浸没其中。
3.5 体外微粒测试实施步骤
沿导丝推送球囊导管到硅胶管部位,迅速充盈球囊至名义压力,卸压后回撤球囊,并持续冲刷鞘管,收集模拟使用过程中产生的微粒悬浮液。设置自定义通道 10 μm、25 μm、50 μm、100 μm,将待测悬浮液置于取样口测试。
量取均匀的10 mL待测悬浮液,倾倒入量筒式微量砂芯漏斗中,真空泵抽吸,微粒被截获在微孔滤膜上,再使用EZ4 HD数码体视镜对微孔滤膜拍照,并将所有照片无缝合成为一张完整的照片。打开Image-Pro Plus软件,选择“area”和“feret(max)”二个参数,并分别将最小阈值设定为7 850和100,则可以自动输出所有符合设定要求的微粒的具体尺寸数据。
4 结果
使用三种配方的药物球囊,规格为3.0 mm×40 mm,在体外测试模型下,分别用离体猪血管和硅胶管做转载率试验,结果如图1显示,模拟血管的转载率为4.23%±0.64%、12.34%±2.47%、16.62%±5.21%,硅胶管测试的转载率1.5 3%±0.1 6%、2.66%±0.35%、3.15%±0.78%。硅胶管测试的结果区分度不如离体猪血管。

图1 不同配方使用不同模拟血管的转载率Fig.1 Drug transfer rate of different formulations using different simulated vessels
使用自制的药物球囊,体外模拟药物释放的每个过程,结果如图2所示。输送过程损失为47.42%±4.72%。扩张过程损失为24.27%±4.45%,模拟使用转载率为12.29%±3.44%,回撤过程损失7.61%±4.65%,球囊撤出导管后最终残留在球囊表面的药物含量10.81%±3.55%。各部分的药物比例总和为102.40%,达到物料平衡。

图2 体外模拟各过程的药物释放Fig.2 Drug release from drug coated balloon during each process in vitro simulate use
对配方2和配方3的药物球囊分别进行微粒测试,数据如表1所示。除常规≥10 μm,≥25 μm的数据外,通过细分通道可以进一步得出≥50 μm,≥100 μm的数据,这使得对25 μm以上的微粒的分布有了进一步的认识。另外,对收集的微粒悬浮液,进行显微法联合Image-Pro Plus软件定量分析,可以获得大尺寸微粒的具体信息,如表2和图3、图4所示。虽然大尺寸微粒的数目相似,但具体尺寸的大小却不尽相同。
5 讨论
药物球囊的开发过程中,转载率是关乎产品有效性的重要指标,不管球囊表面初始负载的药物密度如何,也不论涂层配方中使用了何种添加剂,或使用了何种药物涂覆工艺,真正起到抑制平滑肌细胞增生和迁移作用的,是转载到血管表面并被血管组织摄取的药物。而在球囊导管输送及扩张的使用过程中,都不可避免地产生了大量的微粒,脱落的微粒随血流冲刷至下游血管,可能造成血管堵塞。因此,微粒脱落是药物球囊产品安全性的重点评估项目。大多数研究者都意识到了上述二个重要研究内容,然而笔者发现文献报道的一些体外评估方法都有着不同的缺陷,该文尝试解决这些问题并带来一些益处,具体如下:

表1 光阻法微粒测试数据的对比图Tab.1 Comparison of particle test data using the light obscuration particle count test
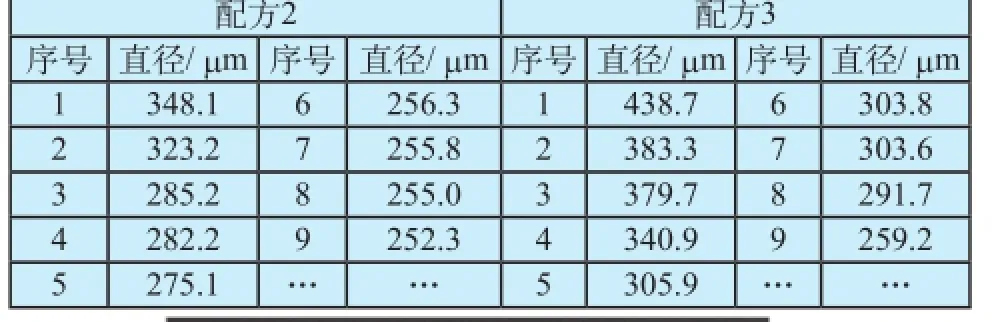
表2 显微法联合Image-Pro Plus测试微粒数据Tab.2 Microscopic combined Image-Pro Plus particle count test data

图3 配方2微粒测试显微法图片Fig.3 Formulation 2 microscopic combined Image-Pro Plus particle test image

图4 配方3微粒测试显微法图片Fig.4 Formulation 3 microscopic combined Image-Pro Plus particle test image
(1)部分研究的体外转载试验使用了硅胶管作为模拟血管,而硅胶管与在体状态的血管的性能差异很大,特别是血管内皮对药物涂层的吸附能力、血管的弹性、血管的解剖结构等。另外体外模拟研究多使用F-2394-07模型,这与产品实际作用部位不同。这都会导致体外评估的药物转载能力与真实转载能力有较大的差异。本单位使用新鲜的猪冠脉血管作为体外模拟测试的模拟血管,并采用自制的外周体外测试模型开展体外测试,该方法与产品实际使用情况更加接近,模拟程度更高,因而结果更加可靠。
(2)对于体外药物释放过程,大多研究者只关注了输送过程损失率,药物转载率和药物残留率。而药物球囊导管到达靶部位以后,从开始扩张到与血管壁接触的过程中,仍然会有药物脱落。真正有机会被血管摄取的药物,是在球囊与血管壁接触瞬间前,球囊表面所携带的药物。扩张的过程虽然很短,但扩张过程损失的药量不可忽视。另外,球囊回撤过程期间,亦会有药物涂层脱落。忽视了这二个细节,将导致很难做到物料平衡。该文除了评估输送过程的药物损失、转载率和残留率以外,还评估了扩张过程和回撤过程的药物损失,解决了药物球囊使用过程涂层的物料平衡问题。
(3)按文献报道的通道设置测试的微粒结果稍单一,只有大于10 μm和25 μm的微粒数目。该文细化微粒测试的通道,进一步细分50 μm,100 μm等通道的微粒,同时采用显微法,并辅助利用Image-Pro Plus软件,自动测算每一个微粒的尺寸参数。相比于公开的数据,该文开发的评价方法,获得的数据更加详实,对微粒的粒径分布、形态的描述更加细致。
然而,该研究仍然存在一些局限性,比如:①体外转载测试所使用的血管,测试时成自然伸长状态,与体内真实的立体结构仍有差异;体外的即时转载率并没有与动物体内试验做对比,不能完全代表产品在体内的有效性。②对微粒的体外描述比较详实,但并没有深入研究不同尺寸涂层微粒在体内的行为变化。
6 结论
使用自制的股髂动脉模型,且远端连接猪冠脉血管,用于评估药物球囊体外转载能力的方法可行,相对于使用硅胶管作为模拟血管,该方法的分辨率更高。对于模拟使用过程药物释放的研究显示,球囊扩张和回撤阶段释放的药物总量不可忽视,研究扩张和回撤过程的药物释放情况,有助于更深入地掌握药物球囊的释放行为。光阻法结合显微法用于表征微粒脱落的水平,并结合Image-Pro Plus软件实现自动计数,比单纯使用光阻法获得的信息更加细致。以上针对药物释放及微粒脱落的研究方法与思路,特别适合于产品开发期间配方筛选、工艺优化、质量控制方面。
[1] Tepe G, Zeller T, Albrecht T, et al. Local delivery of paclitaxel to inhibit re-stenosis during angioplasty of the leg[J]. N Engl J Med, 2008, 358(7): 689-699.
[2] Liistro F, Grotti S, Porto I, et al. Drug-eluting balloon in peripheral intervention for the superf i cial femoral artery: the DEBATE-SFA randomized trial[J]. Jacc Cardiovasc Intervent, 2013, 6(12): 1295-1302.
[3] Werk M, Langner S, Reinkensmeier B, et al. Inhibition of restenosis in femoropopliteal arteries: paclitaxel-coated versus uncoated balloon: femoral paclitaxel randomized pilot trial[J]. Circulation, 2008, 118(3): 1358-1365.
[4] BS EN ISO 12417-1:2015, Cardiovascular implants and extracorporeal systems - Vascular device-drug combination products[S]. BSI Standards Publication, 2015.
[5] Seidlitz A, Kotzan N, Nagel S, et al. In vitro determination of drug Transfer from drug-coated balloons[J]. PLOS ONE, 2013, 8(12): e83992.
[6] Kelsch B, Scheller B, Biedermann M, et al. Dose response to paclitaxel-coated balloon catheters in the porcine coronary overstretch and stent implantation model[J]. Invest Radiol, 2011, 46(4): 255-263.
[7] Kaule S, Minrath I, Stein F, et al. Correlating coating characteristics with the performance of drug-coated balloons-a comparative in vitro investigation of own established hydrogel-and ionic liquidbased coating matrices[J]. PLOS ONE, 2015, 10(3): e0116080.
In Vitro Evaluation Method for Drug Release and Particle Release from Drug Coated Balloon
drug coated balloon, drug release, particle release, drug transfer, in vitro evaluation
R965
A
10.3969/j.issn.1671-7104.2017.02.017
1671-7104(2017)02-0140-04
2016-10-13
深圳市科技创新委员会战略性新兴产业(生物产业发展)专项资金(CXZZ20140813102720940);国家食药监总局创新医疗器械特别审批绿色通道项目(2015061)
宋精忠,E-mail: songjingzhong@lifetechmed.com
龙汉,E-mail: longhan@lifetechmed.com
