双氨基离子液体-水二组分物系汽液平衡的测定
2017-04-19郭开华皇甫立霞杨菁茏
周 岚,郭开华,陈 莹,皇甫立霞,杨菁茏
(中山大学 工学院,广东 广州 510006)
双氨基离子液体-水二组分物系汽液平衡的测定
周 岚,郭开华,陈 莹,皇甫立霞,杨菁茏
(中山大学 工学院,广东 广州 510006)
采用功能型离子液体3-丙胺基-三丁基磷甘氨酸盐([aP4443][Gly])水溶液,在温度范围为278.15~408.15 K、水溶液中离子液体含量(w)在10.00%~95.05%之间的汽液平衡进行了测定,获得了98组蒸汽压实验数据,并采用电解质非随机双液体模型对实验数据进行了拟合,获得了阴阳离子与水分子间的相互作用系数。实验结果表明,[aP4443][Gly]的亲水性很强;实验测量结果与模型计算结果较好符合,平均相对误差为2.94%。
双氨基离子液体;水溶液;汽液平衡
离子液体在合成、催化、萃取、工业分离领域受到重视,特别在CO2脱除方面,氨基功能化离子液体,可在压力较低的条件下显著提升离子液体的CO2吸收能力[1-7]。近年来,多采用水溶液来改进氨基功能化离子液体对CO2气体的吸收性能;离子液体水溶液体系中阴阳离子与水分子之间的相互作用,需要通过对溶液的蒸汽压(汽液平衡)的测定来揭示。Yang等[8-9]对1-氨丙基-3-甲基咪唑溴盐([APMIm]Br)离子液体水溶液体系的CO2吸收性能进行了测定。王赞霞等[10-11]对3-丙胺基-三丁基磷甘氨酸盐([aP4443][Gly])与水的二组分物系进行了研究。氨基功能化离子液体水溶液特别适合天然气中CO2等酸气的脱除。在离子液体水溶液CO2脱除工艺建模中,必须对水溶液体系中水的活度系数等数据有清晰的表达,这可通过对离子液体水溶液的蒸汽压数据的测定来获得。粟航等[12]采用等容蒸汽液测量法对[APMIm]Br离子液体水溶液的汽液平衡特性进行了测定。Ren等[13]对1-乙基-3-甲基咪唑磷酸二甲酯盐水溶液的蒸汽压进行了研究。Passos等[14-16]对多种离子液体水溶液进行了蒸汽压测定。关婷婷等[17-18]测定和研究了1-丁基-3-甲基咪唑四氟硼酸盐、1-乙基-3-甲基咪唑醋酸盐、1-己基甲基咪唑氯盐水溶液的汽液平衡。
本工作对双氨基功能化离子液体[aP4443][Gly]水溶液在较大温度和浓度范围的蒸汽压进行测定,以获得体系的汽液相平衡特性及其活度系数数据;并采用电解质非随机双液体(eNRTL)模型,揭示该电解质水溶液体系中阴阳离子与水分子间的相互作用特性,为[aP4443][Gly]水溶液的CO2吸收及相关应用推广提供基础。
1 实验部分
1.1 试剂
[aP4443][Gly]:纯度大于99%,由兰州化学物理研究所提供(测试前真空加热蒸馏处理10 h,并在氮气氛围下采用海诺公司SFY-3A型微量水分测量仪测定离子液体初始含水率为(2 160±200)× 10-6(w));去离子水:实验室自制(电导率小于1 μs/cm)。
1.2 装置
图1为实验装置的示意图。由图1可知,工作环境由制冷恒温槽(233.15~368.15 K,温度波动(30 min)小于0.01 K,温度均匀度小于0.01 K)及恒温油槽(363.15~573.15 K,温度波动(30 min)小于0.01 K,温度均匀度小于0.01 K)保证,工作环境为油浴。温度传感器和压力传感器均经过补偿修正。在实验前测量去离子水的饱和蒸汽压,并与NIST数据库数据[19]进行对比,系统压力测量的不确定度为0.83%。
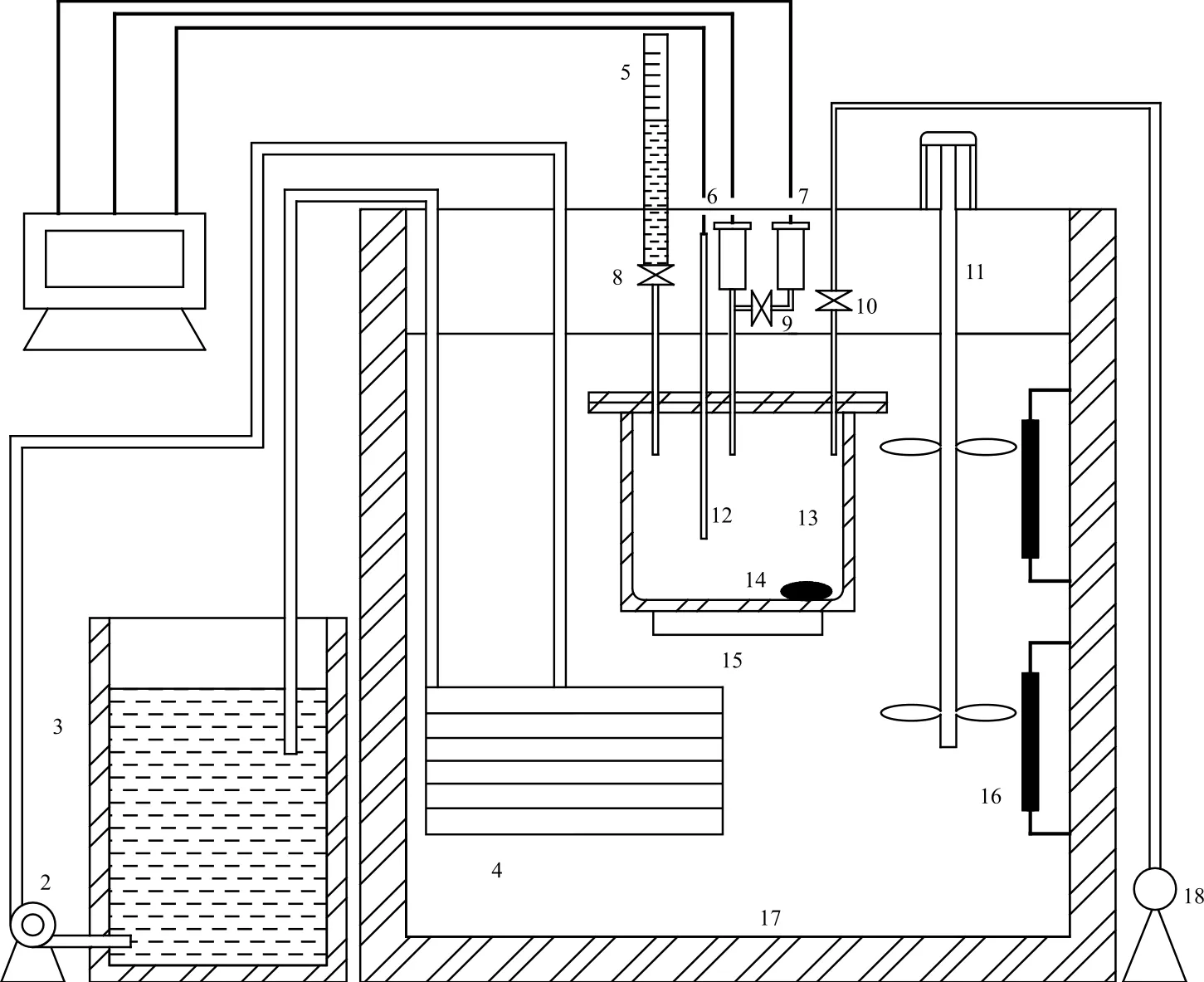
图1 实验装置的示意图Fig.1 Schematic diagram of experimental installation.
1.3 步骤
实验前准备:将不锈钢反应釜抽真空12 h,去除前期离子液体可能从空气中吸收水分造成的偏差。关闭阀门8和10,关闭真空泵,将反应釜置于恒温油浴17中,启动并控制制冷恒温槽温度,通过铜管换热器4,维持油浴温度在308.15 K。
称量约55 g离子液体[aP4443][Gly],装入不锈钢反应釜13中并密封好。将去离子水装入量液管5中,接着打开阀门8,使其加入到反应釜中,达到所需量后,关闭阀门。开启真空泵后,接着开启阀门10抽真空3次,每隔5 min 1次,每次1 min(真空泵抽走水分(0.07±0.001)g/min)。为了使加入到反应釜中的水与离子液体混合均匀,在抽真空结束后启动磁力搅拌器15,通过磁子14的转动使水与离子液体充分混合,待两者混合均匀后开启降温至278.15 K,等到反应釜内达到汽液平衡一段时间后,约1 h,记录数据。从278.15 K开始至408.15 K,以10 K为温度间隔,升温测量。在每测量完一个浓度对应的温度数据后,通过量液管5向反应釜中加水,重复上述相关步骤,直至完成测量。
水溶液中离子液体含量的确定采用称重法。加入反应釜的离子液体通过电子天平称量,扣除离子液体初始含水量,获得离子液体的质量。在反应釜加入水后,溶液质量再次通过电子天平称量,并扣除反应釜密封后抽真空过程中的失水量,获得水溶液的质量。综合考虑各称重过程、离子液体初始含水量和抽真空过程中失去水的误差,分析获得离子液体含量的不确定度。得到的7个溶液试样的离子液体含量(w)及其不确定度分别为:(95.05± 0.05)%,(89.99±0.05)%,(85.04±0.05)%,(70.23±0.04)%,(50.18±0.03)%,(30.01±0.02)%,(10.00±0.02)%。
2 结果与讨论
2.1 纯水蒸汽压的校验
表1为纯水的蒸汽压测试数据与NIST数据库数据[19]的对比。由表1可知,实验测量结果与对应的NIST数据符合较好,其平均相对误差为0.83%,验证了实验测试数据的准确度。而在一定浓度下蒸汽压和温度的准确测量是影响实验结果的决定因素。
2.2 实验结果
共测量7个试样,以1表示水,以2表示离子液体;w2为离子液体在水溶液中的质量分数,w2分别为10.00%,30.01%,50.18%,70.23%,85.04%,89.99%,95.05%;在278.15~408.15 K范围内,以10 K为温度间隔,共测量14个温度点,总共得到98个数据点的相平衡数据。
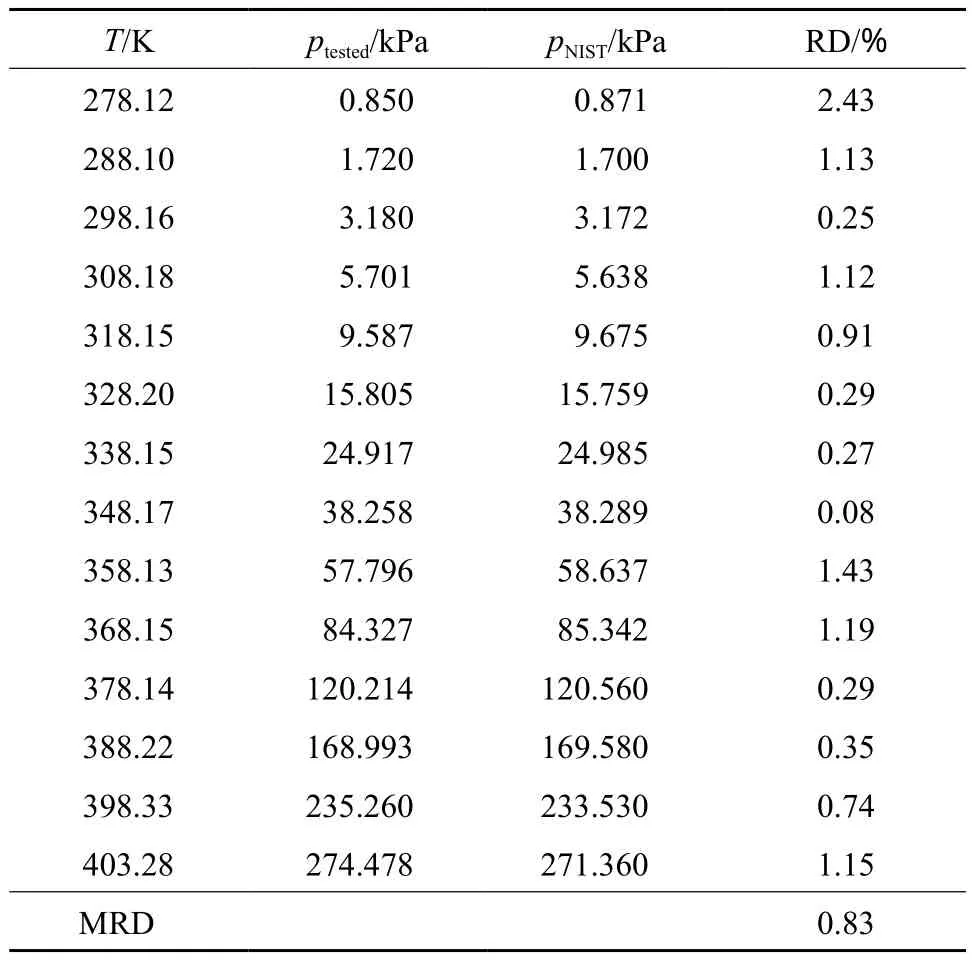
表1 纯水的蒸汽压测试数据与NIST数据[19]的对比Table 1 Comparison between the measured vapor pressure data and the NIST data[19]for pure water
水在离子液体水溶液中的活度系数(γ1)按式(1)计算。

式中,p为压力,kPa;ps1为水的饱和蒸汽压,kPa;x1为水的摩尔分数,%;T为温度,K;φ1为水的气相逸度系数;ν1为水的摩尔容积,L/ mol;R为通用气体常数,J/(mol·K)。ν1和ps1的数值可从NIST数据库[19]查得。
逸度系数的比值按式(2)计算。
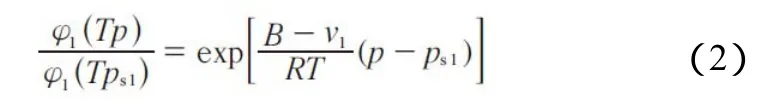
式中,B为水的二阶维里系数,B值依据文献[20]计算得到。
表2为[aP4443][Gly]水溶液蒸汽压实验测量值和模型计算值的对比。相对误差(RD)的计算见式(3)。

平均相对误差(MRD)的计算见式(4)。
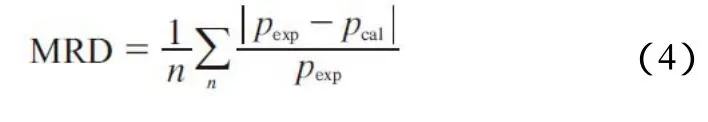
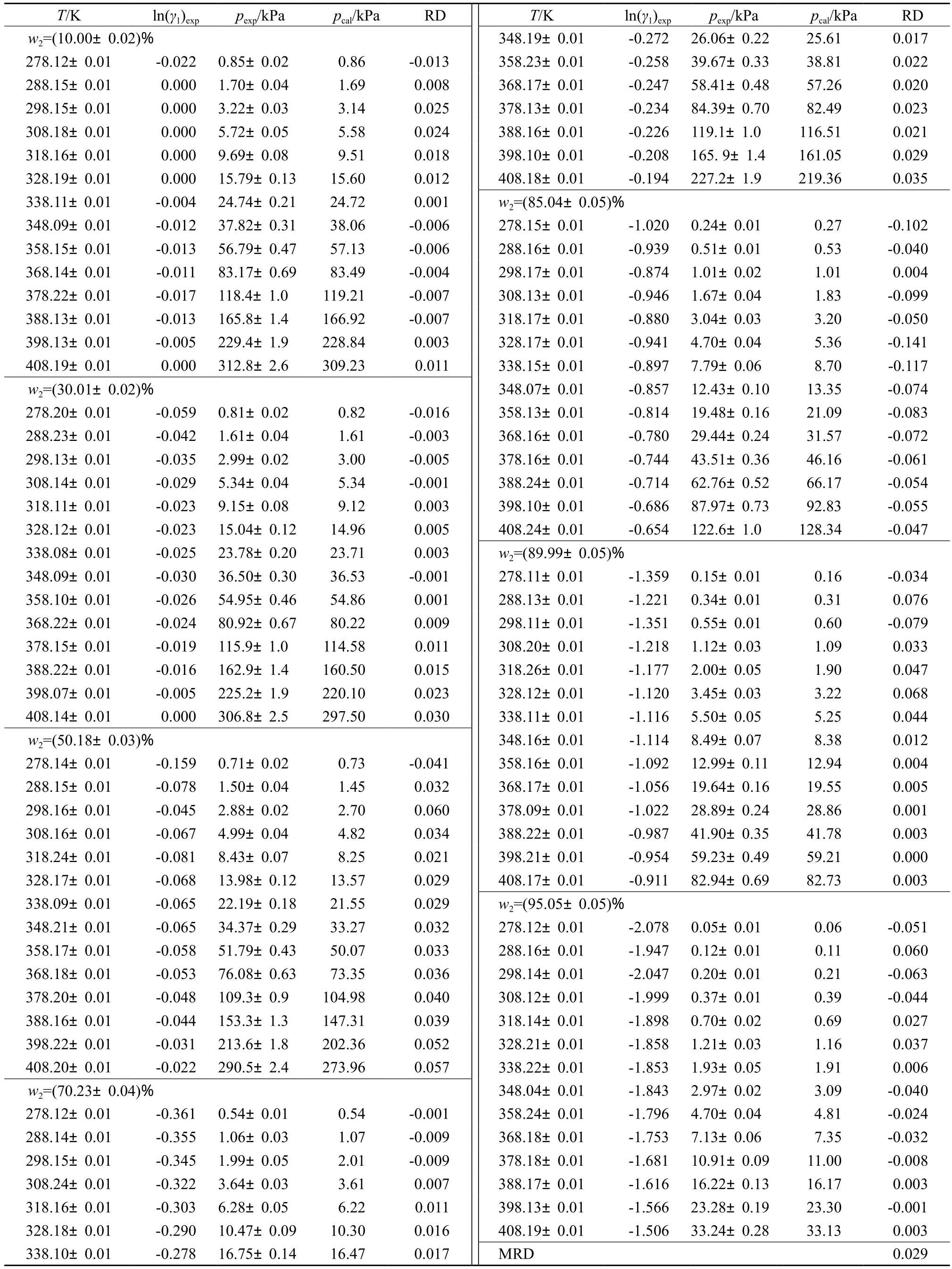
表2 [aP4443][Gly]水溶液蒸汽压实验测量值和模型计算值的对比Table 2 Comparison between experimental data and calculated data of vapor pressure for[aP4443][Gly](2)+water(1)
2.3 拟合与讨论
采用eNRTL模型[21]对实验数据进行拟合,eNRTL模型广泛应用于电解质体系的热力学建模[22-23],将离子液体水溶液,看做由水分子、阳离子和阴离子组成的离子化多元体系,分别以W,c,a表示,考虑了电解质的远程电荷作用项和当地组分作用项的联合作用。在eNRTL模型中,水的活度系数根据式(5)计算。

式中,lc代表当地组分作用项,其活度系数计算式如下:
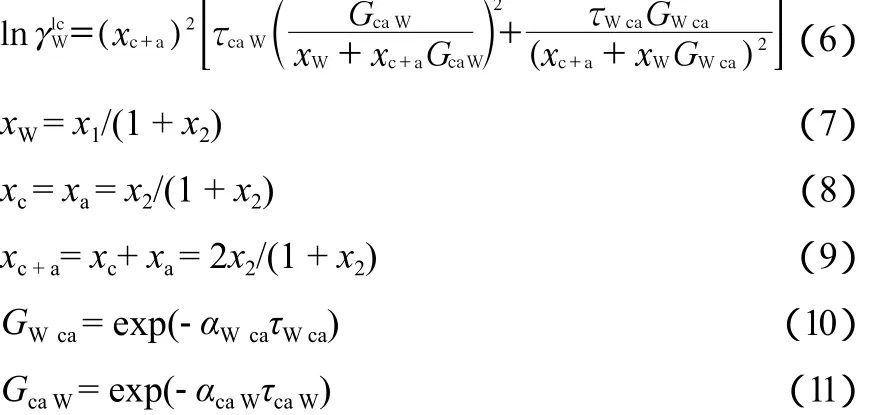
式中,xW,xc,xa分别为在离子-水体系中的水分子、阳离子和阴离子的摩尔分数;下标W ca表示阴阳离子对水的作用;下标ca W表示水对阴阳离子的作用;αWca,αcaW为eNRTL方程的非随机因子,均取0.3计算;τWca,τcaW分别为表示阴阳离子与水之间的相互作用系数,与温度T有关,通过对实验数据进行拟合获得;GWca,GcaW分别为与二元相互作用相关的参量,由式(10)~(11)确定。
PDH代表远程电荷作用项,其活度系数计算式如下[21-22]:
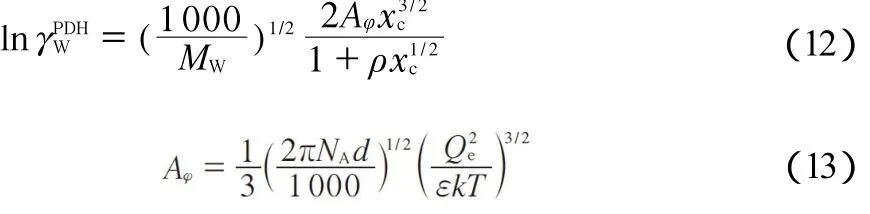
式中,MW是水的相对分子质量;ρ为常数,取值为14.9;d为水的密度,g/cm3;Aφ为Debye-Huckel参数;ε为水的介电常数,计算式[22]见(14)。
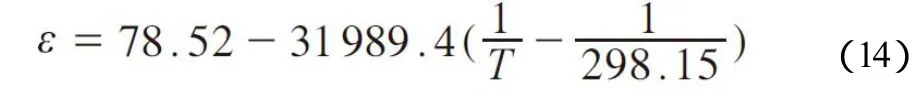
对获得的实验数据进行拟合,可得到[aP4443][Gly]水溶液中阴阳离子与水的相互作用系数τWca和τcaW,其数值可表示为与温度的函数,见式(15)。

式中,aij,bij,cij为系数,通过对实验数据拟合获得,相互作用系数见表3。

表3 相互作用系数Table 3 Interaction parameters
利用以上所确定的活度系数模型及相关参数可计算得到蒸汽压pcal。
图2为[aP4443][Gly]水溶液蒸汽压实验测量值与模型计算值的对比。由图2可知,模型计算结果与实验测量数据符合较好,最大误差为14.12%,平均相对误差为2.94%;在w2<50.18%时,由于水溶液蒸汽压较大,在对数图中数据显示较为集中。
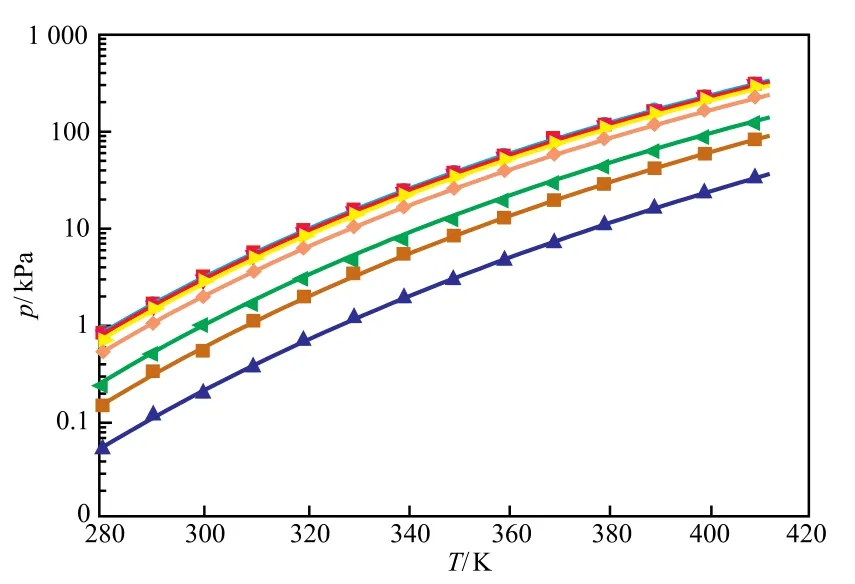
图2 [aP4443][Gly]水溶液蒸汽压实验测量值与模型计算值的对比Fig.2 Comparison between the measured vapor-liquid equilibrium data and the calculated results for the[aP4443][Gly] aqueous solutions.● Pure water;■ 10.00%(w);▼ 30.01%(w);► 50.18%(w);◆ 70.23%(w);◄ 85.04%(w);■ 89.99%(w);▲ 95.05%(w);— Calculated
图3为[aP4443][Gly]水溶液中离子液体摩尔分数的变动对蒸汽压的影响。由图3可知,实验测量值与模型计算值的一致性很好。
图4为[aP4443][Gly]水溶液中离子液体摩尔分数的变动对水的活度系数的影响。由图4可知,水的活度系数对拉乌尔定律呈现很强的负偏移,该偏移与温度相关,温度越低,该负偏移越强,表明该离子液体亲水性很强,其水溶液具有作为吸收式制冷循环工质的潜力。
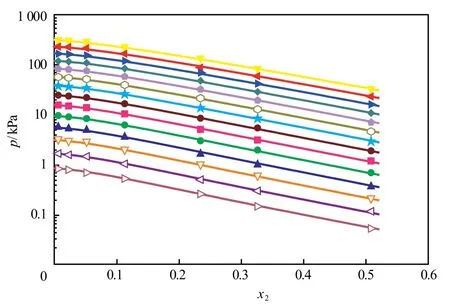
图3 [aP4443][Gly]水溶液中离子液体摩尔分数的变动对蒸汽压的影响Fig.3 Effects of the [aP4443][Gly] mole fraction in the[aP4443][Gly] aqueous solutions on the vapor pressure.▼ 408.19 K;◄ 398.14 K;► 388.18 K;◆ 378.16 K;368.17 K;358.17 K;★ 348.12 K;● 338.18 K;■ 328.12 K;● 318.18 K;▲ 308.17 K;298.14 K;288.16 K;278.14 K;— Calculated
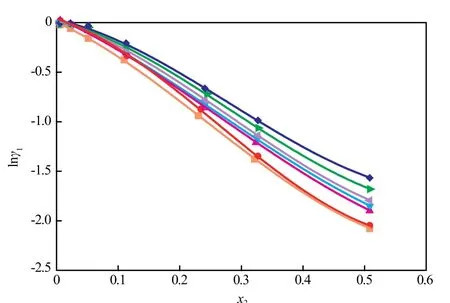
图4 [aP4443][Gly]水溶液中离子液体摩尔分数的变动对水的活度系数的影响Fig.4 Effects of the [aP4443][Gly] mole fraction in the[aP4443][Gly]aqueous solutions on the activity coefficient of water(1) in the[aP4443][Gly]solutions(2).■ 278.14 K;● 298.14 K;▲ 318.18 K;▼ 338.12 K;◄ 358.17 K;► 378.16 K;◆ 398.14 K
3 结论
1)通过对[aP4443][Gly]水溶液体系在温度范围为278.15~408.15 K、水溶液中离子液体含量(w)在10.00%~95.05%之间的汽液平衡进行了测定,获得了[aP4443][Gly]水溶液的汽液平衡特性及其活度系数数据,测量结果表明[aP4443][Gly]的亲水性很强。
2)采用eNRTL模型,对实验测量数据进行分析和计算,实验测量数据和拟合结果符合较好,平均相对误差为2.94%。同时得到了[aP4443][Gly]水溶液中阴阳离子与水分子间的相互作用系数,揭示了该电解质水溶液体系中阴阳离子与水分子间的相互作用特性,为[aP4443][Gly]水溶液CO2吸收特性及相关应用提供了基础。
符 号 说 明
AφDebye-Huckel参数
aij,bij,cij相互作用系数τ与温度的关系式中的系数
B 水的二阶维里系数
d 水的密度,g/cm3
GWca,GcaW与二元相互作用相关的参量
k 玻尔兹曼常数1.380 54×10-16
lc 当地组分作用项
M 相对分子质量
NA阿伏伽德罗常数,6.022 51×1023
p 压力,kPa
pNISTNIST数据库对应的某一温度下的压力,kPa
ps1水的饱和蒸汽压,kPa
ptested验证实验测得的纯水在某一温度下的蒸汽
压,kPa
PDH 远程电荷作用项
Qe电子电荷,4.802 98×10-10
R 通用气体常数,J/(mol·K)
T 温度,K
w2离子液体在水溶液中的质量分数,%
x 摩尔分数,%
α eNRTL方程的非随机因子
γ 活度系数
φ 气相逸度系数
ν 液相摩尔容积,L/mol
τ 相互作用系数
ρ 常数,取值为14.9
ε 水的介电常数
下标
1 水组分
2 离子液体组分
a 阴离子
c 阳离子
W 水分子
[1] Zhai Haibo,Rubin E S. Systems analysis of ionic liquids for post-combustion CO2capture at coal-fired power plants[J]. Energy Proce,2014,63:1321-1328.
[2] Stevanovic S,Gomes M F C. Solubility of carbon dioxide,nitrous oxide,ethane,and nitrogen in 1-butyl-1-methylpyrrolidinium and trihexyl (tetradecyl) phosphonium tris (pentafluoroethyl) trifluorophosphate (eFAP) ionic liquids[J].J Chem Thermodyn,2013,59(2):65-71.
[3] Sistla Y S,Khanna A. CO2absorption studies in amino acidanion based ionic liquids[J].Chem Eng J,2015,273:268-276.
[4] Zhang Yi,Yu Ping,Luo Yunbai. Absorption of CO2by amino acid-functionalized and traditional dicationic ionic liquids:Properties,Henry’s law constants and mechanisms[J].Chem Eng J,2013,214(3):355-363.
[5] Ren Jie,Wu Linbo,Li Bogeng. Potential for using simple 1,2,4-triazole salt solutions as highly efficient CO2absorbents with low reaction enthalpies[J].Ind Eng Chem Res,2013,52(25):8565-8570.
[6] Yang Benqun,Zhou Feng,Liu Shimin,et al. Interaction between CO2and ionic liquids confined in the nanopores of SAPO-11[J].RSC Adv,2015,5(60):48908-48915.
[7] Wang Congmin,Luo Xiaoyan,Luo Huimin,et al. Tuning the basicity of ionic liquids for equimolar CO2capture[J].Angew Chem,2011,50(21):4918-4922.
[8] Yang Tao,Bi Yin,Guo Kaihua. Carbon dioxide absorption in 1-aminopropyl-3-methylimidazolium bromide aqueous solutions[J].CIESC J,2012,63(10):3152-3157.
[9] 李松,杨翠莲,毕崟,等. [APMim]Br离子液体溶液水含量对CO2溶解度影响[J].工程热物理学报,2015,36(7):1407-1412.
[10] 王赞霞,傅莉,张建敏,等. [aP(4443)][Gly]-H2O两元体系物性测定CO2吸收性能[J].过程工程学报,2011,11(5):818-822.
[11] Wang Zanxia,Fu Li,Xu Hui,et al. Density,viscosity,and conductivity for the binary systems of water + dual aminofunctionalized ionic liquids[J].J Chem Eng Data,2012,57(4):1057-1063.
[12] 粟航,郭开华,吴雅倩,等. 1-氨丙基-3-甲基咪唑溴盐水溶液的汽液相平衡[J].化工学报,2013,64(11):3888-3893.
[13] Ren Jing,Zhao Zongchang,Zhang Xiaodong. Vapor pressures,excess enthalpies,and specific heat capacities of the binary working pairs containing the ionic liquid 1-ethyl-3-methylimidazolium dimethylphosphate[J].J Chem Thermodyn,2011,43(4):576-583.
[14] Passos H,Khan I,Mutelet F,et al. Vapor-liquid equilibria of water+alkylimidazolium-based ionic liquids:Measurements and perturbed-chain statistical associating fluid theory modeling[J].Ind Eng Chem Res,2014,53(9):3737-3748.
[15] Królikowska M,Zawadzki M,Królikowski M. Physicochemical and thermodynamic study on aqueous solutions of dicyanamide-based ionic liquids[J].J Chem Thermodyn,2014,70(1):127-137.
[16] Królikowska M,Paduszyński K,Królikowski M,et al. Vapor-liquid phase equilibria and excess thermal properties of binary mixtures of ethylsulfate-based ionic liquids with water:New experimental data,correlations,and predictions[J].Ind Eng Chem Res,2014,53(47):18316-18325.
[17] 关婷婷,孙立,皇甫立霞,等. 离子液体[BMIM]BF4+ H2O汽液相平衡实验研究[J].低温物理学报,2011,33(3):194-197.
[18] Guo Kaihua,Bi Yin,Sun Li,et al. Experiment and correlation of vapor-liquid equilibrium of aqueous solutions of hydrophilic ionic liquids:1-Ethyl-3-methylimidazolium acetate and 1-hexyl-3-methylimidazolium chloride[J].J Chem Eng Data,2012,57(8):2243-2251.
[19] NIST Chemistry Web Book. NIST standard reference database. Number 69[EB/OL].[2016-05-12].http://webbook. nist. gov/chemistry/.
[20] Harvey A H,Lemmon E W. Correlation for the second virial coefficient of water[J].J Phys Chem Ref Data,2004,33(1):369-376.
[21] Chen Chau-Chyun,Song Yuhua. Generalized electrolyte NRTL model for mixed-solvent electrolyte systems[J].AIChE J,2004,50(8):1928-1941.
[22] Chen Chau-Chyun,Britt H I,Boston J F,et al. Local composition model for excess Gibbs energy of electrolytesystems:Ⅰ. Single solvent,single completely dissociated electrolyte systems[J].AIChE J,1982,28(4):588-596.
[23] Zhang Ying,Chen Chau-Chyun. Thermodynamic modeling for CO2absorption in aqueous MDEA solution with electrolyte NRTL model[J].Fluid Phase Equilib,2011,311(1):67-75.
(编辑 杨天予)
Determination of vapor-liquid equilibrium of dual-amino ionic liquid aqueous solution
Zhou Lan,Guo Kaihua,Chen Ying,Huangfu Lixia,Yang Jinglong
(School of Engineering,Sun Yat-Sen University,Guangzhou Guangdong 510006,China)
The vapor-liquid equilibrium of (3-aminopropyl)tributylphosphonium glycinate([aP4443][Gly]),a functional ionic liquid with good absorbility to CO2,aqueous solutions was measured in the temperature range from 278.15 K to 408.15 K and in the [aP4443][Gly] mass fraction range from 10.00% to 95.05%. 98 Groups of the vapor pressure data of the [aP4443][Gly]-water systems were obtained. The interaction coefficients between cations and water molecules and between anions and water molecules were gained by means of the electrolyte Non-Random Two-Liquid(eNRTL) model. The experimental and calculated data were correlated well,and the mean relative deviation was 2.94%. It was showed that the hydrophilicity of[aP4443][Gly] was strong.
dual-amino ionic liquid;aqueous solution;vapor-liquid equilibrium
1000-8144(2017)02-0202-07
TQ 013.1
A
10.3969/j.issn.1000-8144.2017.02.010
2016-08-24;[修改稿日期] 2016-11-04。
周岚(1992—),男,湖南省邵阳市人,硕士生,电话 15521395593,电邮 zhoulan92@163.com。联系人:皇甫立霞,电话 020-39332892,电邮 huangpulixia99@126.com。
国家自然科学基金项目(51076169);广东省自然科学基金重点项目(9251027501000001)。
