糖化白蛋白诱导人近端肾小管上皮细胞产生损伤与炎性反应的表达
2017-04-19李海霞焦莉莉
段 楠 刘 怡 李海霞 焦莉莉
(北京大学第一医院检验科,北京 100034)
·基础研究 ·
糖化白蛋白诱导人近端肾小管上皮细胞产生损伤与炎性反应的表达
段 楠 刘 怡 李海霞*焦莉莉
(北京大学第一医院检验科,北京 100034)
目的 探讨在糖化白蛋白(glycated albumin,GA)刺激下,人近端肾小管上皮细胞(HK-2细胞系)中肾损伤分子-1(kidney injury molecule-1,KIM-1)、中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipocalin,NGAL)及炎性反应相关细胞因子的表达情况。方法 分别采用不同浓度的GA与白蛋白(albumin,Alb)刺激HK-2细胞12 h、24 h及48 h,通过real-time PCR和酶联免疫吸附法(enzyme-linked immunesorbent assay,ELISA)分别检测NGAL、KIM-1的mRNA表达与蛋白释放水平,并运用流式液相多重蛋白定量技术检测血管内皮生长因子 (vascular endothelial growth factor,VEGF)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin-8,IL-8)和可溶性细胞间黏附分子-1(soluble intercellular cell adhesion molecule-1,sICAM-1)等细胞因子的浓度。结果 与对照组与Alb组比较,GA刺激HK-2细胞12 h、24 h和48 h均能显著上调KIM-1和NGAL的mRNA表达(P<0.05)以及KIM-1和NGAL蛋白的释放(P<0.05);GA组sICAM-1、VEGF与IL-8水平在各时间点均高于Alb组和对照组(P<0.05)。结论 GA能上调KIM-1和NGAL mRNA的表达与蛋白的释放,并促进炎性细胞因子的分泌从而对肾小管造成损伤,提示GA可反映糖尿病肾脏受累情况。
糖化白蛋白;近端肾小管上皮细胞;肾损伤分子-1;中性粒细胞明胶酶相关载脂蛋白;细胞因子
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetes mellitus,DM)最主要的微血管病变之一,为终末期肾病的主要病因之一。自2011年以来,我国糖尿病相关的慢性肾脏病(chronic kidney disease,CKD)比例已超过肾小球肾炎导致的CKD[1]。2型DM导致的DKD中,肾小球的病理改变并不常见,主要病变是小管间质炎性反应或血管损伤[2]。晚期糖基化终产物(advanced glycation end products,AGEs)与DM血管合并症如DKD的发病机制密切相关[3]。糖化白蛋白(glycated albumin,GA)是AGEs的前体之一,主要应用于监测近期(2~3周)血糖的控制情况。有实验[4]证明GA能够促进近端肾小管上皮细胞中炎性反应因子如可溶性细胞间黏附分子-1(soluble intercellular cell adhesion molecule-1,sICAM-1)和白细胞介素-8(interleukin-8,IL-8)的释放,上调肾损伤分子-1(kidney injury molecule-1,KIM-1)的合成[5],但肾小管损伤标志物中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipocalin,NGAL)的表达如何尚不明确。本研究拟进一步以不同浓度的GA刺激人近端肾小管上皮细胞(HK-2细胞系),并于不同时间点观察肾小管损伤相关分子NGAL和KIM-1及炎性反应相关细胞因子血管内皮生长因子(vascular endothelial growth factor,VEGF)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等的表达情况。
1 材料与方法
1.1 主要材料与试剂
人GA、人白蛋白(albumin,Alb)(Sigma公司,美国),DMEM F-12培养基(Hyclone公司,美国),胎牛血清(Gibco公司,美国),青霉素、链霉素和两性霉素B(Lonza公司,美国),胰蛋白酶消化液(Gibco公司,美国),Trizol试剂(Invitrogen公司,美国),cDNA反转录试剂盒(Invitrogen公司,美国),SYBR®GreenPCR荧光染料(Invitrogen公司,美国),人类KIM-1和NGAL Elisa试剂盒(R&D公司,美国),人类VEGF、TNF-α、IL-8和sICAM-1流式液相多重蛋白定量试剂盒(BD公司,美国)。
1.2 实验方法
1.2.1 细胞培养
实验使用人近端肾小管上皮细胞HK-2细胞系,购自美国标准培养物保藏中心(American Type Culture Collection,ATCC)。细胞培养于含有10%(体积分数)胎牛血清体积比,1×10 000 U/L青霉素、10 000g/L链霉素及20g/L两性霉素B的DMEM-F12培养基中传代培养,培养于37 ℃、 5%(体积分数)CO2饱和湿度空气培养箱。倒置显微镜下观察形态,3d左右HK-2细胞生长融合成单层细胞,呈典型的铺路石状镶嵌排列。
1.2.2 细胞分组与刺激
取生长良好的细胞接种于6孔版,待细胞生长至视野70%~80%汇合时,无血清DMEM-F12培养基同步化12 h,随机分成对照组与实验组:(1)空白对照组:无刺激;(2)人Alb对照组:4个Alb浓度梯度亚组(0.5 g/L、1.0 g/L、5 g/L[5]、10 g/L)(3)人GA组:分为2个GA浓度梯度亚组(0.5 g/L[5]、1.0 g/L)。对以上各组细胞分别进行12 h、24 h与48 h的刺激。每组实验至少重复3次。
1.2.3 实时荧光定量PCR测定细胞中KIM-1与NGAL mRNA含量
按照Trizol说明书提取各组细胞总RNA,以2 μg总RNA按照反转录试剂盒说明书反转录获得cDNA,在ABI 7500仪器(Life Tech, Applied Biosystems)进行荧光实时定量PCR(real-time PCR)。总反应体积20L,反应条件:预变性95 ℃ 10 min,变性95 ℃ 15 s及退火60 ℃ 60 s(共40个循环)。引物设计使用Primer Premier 6.0,由生工(上海)公司合成,稀释为 10 μmol/L工作液,序列见表1。每次3个复孔,每个实验重复3次。目的基因mRNA Ct 值用GAPDH Ct值校正。根据所得Ct值,运用2-ΔΔCT相对定量法计算内参、目的基因的相对表达量。

表1 引物序列
1.2.4 酶联免疫吸附法(enzyme-linked immunesorbent assay,ELISA)测定培养上清液中KIM-1与NGAL浓度
各组细胞在相应物质不同浓度与不同时间刺激后,分别收集上清液。按照说明书进行ELISA反应,各步骤结束后30 min内使用酶标仪于450 nm波长处读取每孔吸光度值,根据吸光度值与倍比稀释浓度建立KIM-1和NGAL浓度的标准曲线,样品中KIM-1和NGAL浓度从标准曲线读取。
1.2.5 流式液相多重蛋白定量检测培养上清液中细胞因子浓度
各组细胞在相应物质不同浓度与不同时间刺激后,分别收集上清液。按照说明书步骤进行操作各步骤,使用CantoⅡ仪器(BD)应用流式技术读取上样管中位荧光强度值,根据中位荧光强度值与倍比稀释浓度分别建立VEGF、TNF-α、IL-8和sICAM-1浓度的标准曲线,样品中细胞因子浓度从标准曲线读取。
1.3 统计学方法
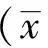
2 结果
2.1 GA与Alb对HK-2细胞KIM-1和NGAL mRNA表达的影响
HK-2细胞用不同浓度GA和Alb(0.5 g/L GA与等量0.5 g/L Alb和10倍量5 g/L Alb组;1.0 g/L GA与等量1.0 g/L Alb和10倍量10 g/L Alb组)刺激12 h、24 h和48 h后,以实时荧光定量PCR检测KIM-1和NGAL mRNA的表达。细胞在3组时间刺激下KIM-1和NGAL mRNA的表达差异均无统计学意义(P=0.070,P=0.150),不同Alb浓度组KIM-1、NGAL mRNA的表达差异无统计学意义(P>0.05)。与空白对照组和Alb对照组比较,GA刺激HK-2细胞12 h、24 h和48 h后,都显著提高每个时间点KIM-1和NGAL mRNA的表达(P<0.05)。0.5 g/L GA组与1.0 g/L GA组相比,具有较高的KIM-1和NGAL mRNA的表达,其中24 h的KIM-1 mRNA和12 h的NGAL mRNA比较,差异有统计学意义(P<0.05)(图1)。
2.2 GA与Alb对HK-2细胞KIM-1和NGAL释放的影响
刺激24 h后细胞KIM-1的释放显著高于12 h (P<0.05),但NGAL的释放在12 h与24 h之间无显著性改变(P=0.140);刺激48 h后细胞KIM-1和NGAL的含量均显著高于12 h与24 h(P<0.05),达到最高水平。与空白对照组比较,GA刺激12 h时HK-2细胞KIM-1和NGAL均出现显著上升(P<0.05),刺激24 h二者的变化均不明显,刺激48 h时KIM-1含量显著升高(P<0.05),而NGAL浓度的改变差异无统计学意义(P>0.05)。与Alb对照组比较,GA刺激12 h后0.5 g/L GA组中KIM-1释放显著高于0.5 g/L Alb组(P<0.05),NGAL释放改变不明显。刺激24 h后,1.0 g/L GA组KIM-1显著高于10 g/L Alb组(P<0.05),0.5 g/L GA组NGAL的释放显著高于5 g/L Alb组(P<0.05)(图2)。刺激48 h后,KIM-1和NGAL的释放均在0.5 g/L GA组显著高于 5 g/L Alb组,在1.0 g/L GA组显著高于1.0 g/L Alb组(P<0.05)(图2)。

图1 不同浓度下各时间点GA与Alb对HK-2细胞KIM-1及NGAL mRNA水平的影响
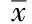
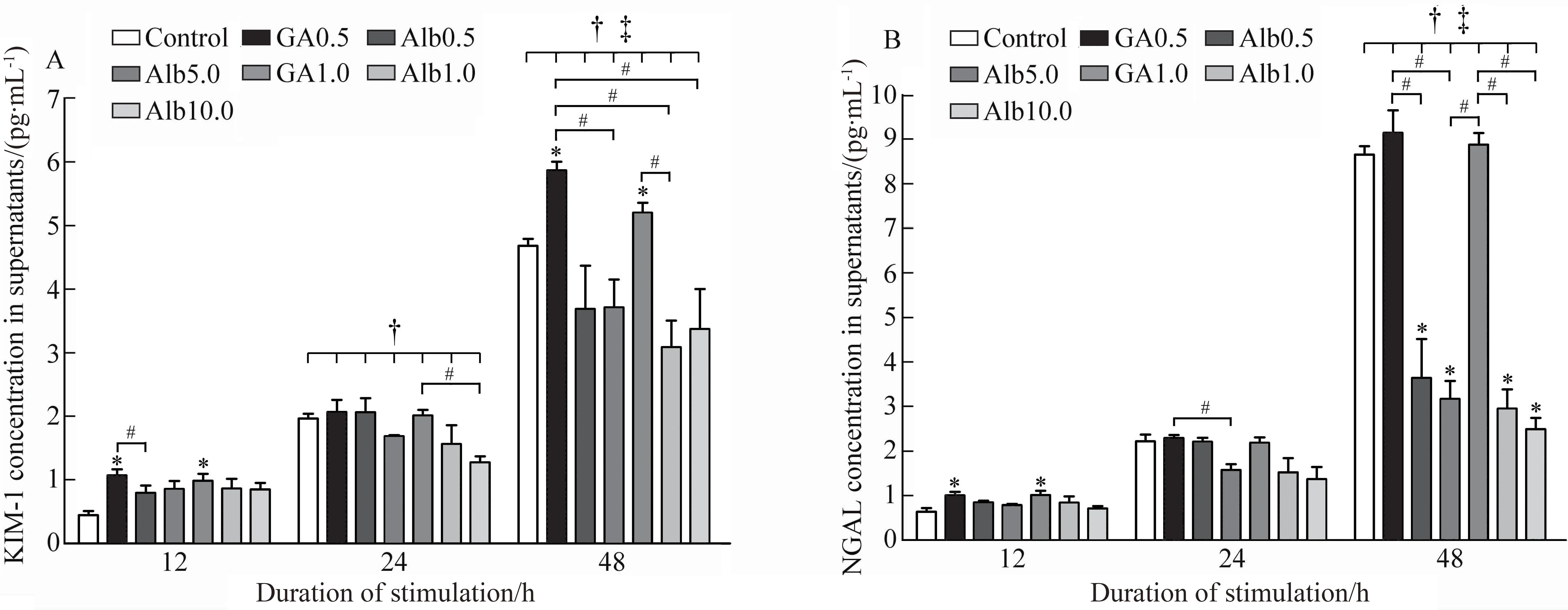
图2 不同浓度下各时间点GA与Alb对HK-2细胞释放KIM-1及NGAL的影响
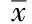
2.3 GA与Alb对HK-2细胞释放细胞因子的影响
各刺激组细胞培养上清液中均未检测到TNF-α有效值。刺激HK-2细胞不同时间后,24 h下细胞sICAM-1、VEGF和IL-8的含量显著高于12 h(P<0.05);48 h下各组细胞上述因子的浓度显著高于12 h与24 h(P<0.05),达到最高水平。与对照组相比,GA组具有显著较高的sICAM-1(图3A)、VEGF(图3B)和IL-8(图3C)水平(P<0.05);与Alb组相比,GA组也同样具有较高的sICAM-1、VEGF和IL-8释放。其中,GA刺激12 h后,sICAM-1、VEGF和IL-8含量均显著高于相应Alb组(P<0.05);刺激24 h后,s-ICAM和VEGF的释放显著高于相应Alb组(P<0.05),IL-8含量改变不明显;刺激48 h后,1.0 g/L GA组sICAM-1含量显著高于相应Alb组(P<0.05),VEGF释放改变不明显,0.5 g/L GA组IL-8显著高于5 g/L Alb组(P<0.05)。另外,各个时间点1.0 g/L GA组sICAM-1的释放显著高于0.5 g/L GA组(P<0.05)(图3A)。
3 讨论
本研究利用GA刺激人近端肾小管上皮细胞(HK-2细胞)模拟糖尿病肾病肾小管损伤的细胞模型,观察到GA能促进KIM-1和NGAL等肾小管损伤相关分子的表达与释放,并且诱导炎性细胞因子VEGF、sICAM-1与IL-8的产生,提示AGEs能够以GA的形式造成肾小管细胞的损伤和炎性反应。
糖尿病肾病的发病机制不明,许多因素参与其发病过程。其中,持续高血糖导致蛋白质非酶促糖基化所形成的AGEs可能是造成糖尿病肾脏损伤的机制之一,高血糖与AGEs共同影响肾小管的功能[3]。已知白蛋白约占人血浆蛋白浓度的70%,糖基化会影响其正常生理功能,糖化白蛋白是临床上监测血糖的重要指标之一。本研究模拟体外糖基化刺激肾损伤的细胞模型,将HK-2细胞置于人血清GA与Alb的环境中,观察GA引起的肾小管损伤相关分子和炎性细胞因子的表达。在刺激浓度条件选择中,考虑到人体环境下GA与Alb比例的正常范围,将其设立为:0.5 g/L、GA[5]0.5 g/L Alb(等量)和5 g/L Alb[5](10倍量)组,并增设了大剂量GA处理组(1.0 g/L)以及相应的1.0 g/L Alb(等量)和10 g/L Alb(10倍量)组,探讨不同浓度GA处理是否与肾小管细胞损伤和炎性反应程度存在量效关系。
近端肾小管上皮细胞是糖尿病肾病肾小管间质损伤和肾功能下降的关键所在,Ⅰ型跨膜糖蛋白KIM-1表达于去分化近端肾小管上皮细胞,在肾损伤时释放到尿液中并且与肾小管间质的炎性反应和纤维化相关,被认为是早期肾损伤的标志物。研究[5]显示,短时间(4 h)单纯高糖处理HK-2细胞无KIM-1释放。本研究显示,单纯Alb(同浓度及高浓度)处理对HK-2细胞KIM-1的表达没有影响;而经GA刺激后,HK-2细胞KIM-1 mRNA的表达和培养液中的蛋白含量(于48 h达到最高值)均明显升高,以低浓度GA(0.5 g/L)组尤为明显。已知KIM-1在肾小管损伤中的表达积聚可诱导慢性小管间质炎性反应,促使肾脏纤维化而进一步导致肾功能下降。本研究结果提示GA(而非高糖或Alb)会导致近端肾小管上皮细胞中KIM-1的表达升高,且随时间延长而持续上调并释放,可能会进一步对肾小管功能造成损伤。
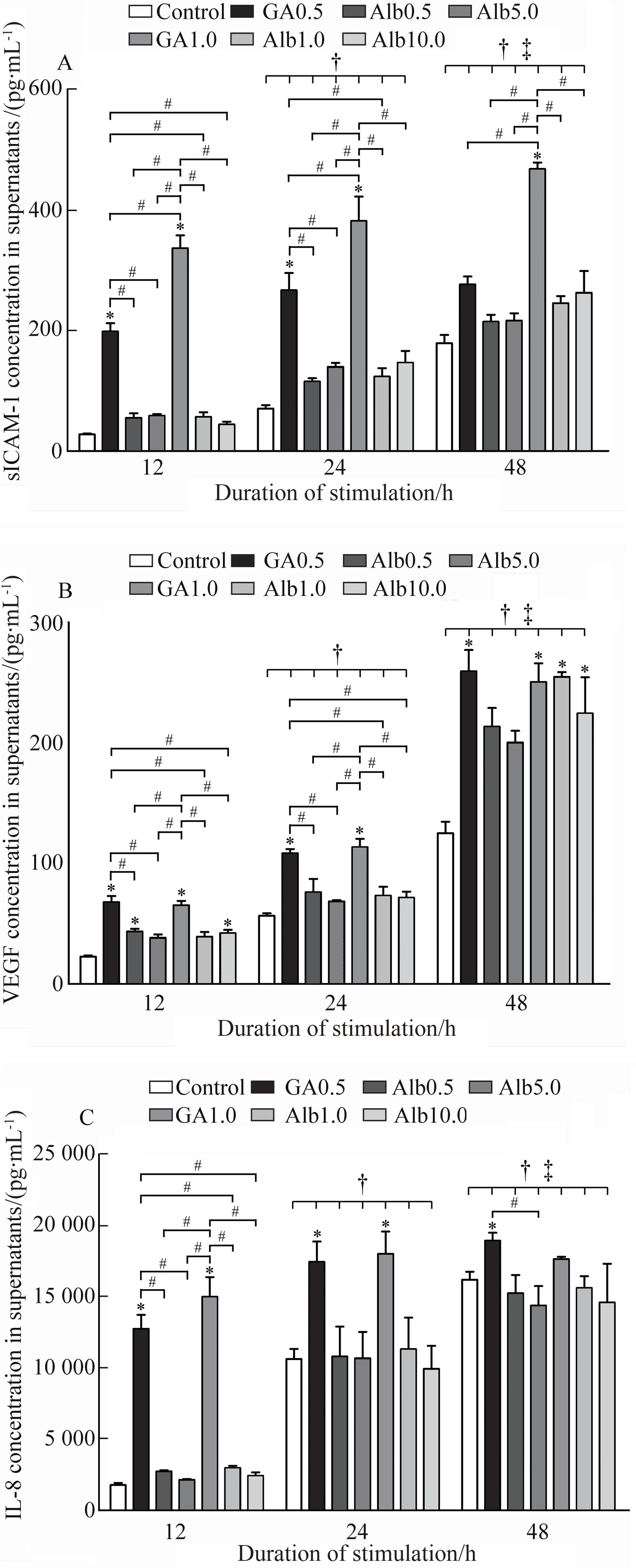
图3 不同浓度下各时间点GA与Alb对HK-2细胞释放细胞因子的影响
NGAL是一种小分子量分泌性蛋白,在肾脏受到损伤性刺激时由肾小管上皮细胞分泌至血液、尿液中,是诊断急性肾损伤最有效的生物学标志之一。在低蛋白饮食控制的Ⅰ型糖尿病病人中,尿NGAL每年升高15%并与终末期肾病和死亡密切相关[6]。也有研究[7]发现,糖尿病病人NGAL的出现早于肾小球损伤指标微量白蛋白尿,能早期预警糖尿病肾病的发生。本研究表明,HK-2细胞经GA处理后,各时间点NGAL的mRNA表达与蛋白释放显著高于对照组和Alb组,且蛋白释放在48 h达到最高值。因此,NGAL可能在糖基化诱导近端肾小管上皮细胞损伤中发挥作用,且一定程度上能早期评估糖尿病病人的肾脏受累情况。
有研究[8-10]显示糖尿病肾病属于非炎性疾病,但近年来发现糖尿病病人和实验动物模型的肾脏中均有巨噬细胞的浸润增加以及白细胞介素、细胞黏附分子的过量产生[11-12]。由内皮分泌到细胞外基质的VEGF能够调节肾小管上皮细胞的代谢过程并抑制其凋亡;慢性炎性反应中所涉及的T细胞和巨噬细胞及其释放的细胞因子均表现出促炎活性,其中主要为IL-1的表达增加,并进一步引起VEGF、ICAM-1、IL-6、IL-8和血管紧张素Ⅱ的升高[13-14]。本实验结果显示细胞中sICAM-1、VEGF和IL-8的释放随时间延长而上升并于48 h达到最高值,并且各因子在GA组中的浓度均高于对照组及Alb组。目前,动物实验[11]表明白细胞介素和细胞黏附分子参与糖尿病肾病的发生发展,并有体外实验[4]证实GA能促进近端肾小管上皮细胞表达sICAM-1和IL-8。本实验结果与这些研究基本一致,并发现不同浓度GA还能够刺激sICAM-1表达上调,且浓度为1.0 g/L GA的刺激效果强于文献[4]所报道的0.5 g/L。这些研究结果表明GA刺激肾小管细胞表达趋化因子与黏附分子等炎性细胞因子,使炎细胞在糖尿病肾小管病变期间迁移到间质空间(interstitial space),进一步对近端肾小管上皮细胞造成损伤。
综上所述,作为AGEs前体,GA能上调KIM-1和NGAL等肾损伤相关分子的表达与释放,促进炎性反应中sICAM-1、VEGF和IL-8等细胞因子的产生,对人近端肾小管上皮细胞造成损伤。因此,对糖尿病病人进行GA、肾损伤相关分子和细胞因子的检测,可提示与评估糖尿病病人肾脏受累情况,预测糖尿病肾病的发生发展,也对开发针对GA的药物或分子以干预糖尿病肾病提供理论依据。
[1] Zhang L, Long J, Jiang W, et al. Trends in chronic kidney disease in China[J]. N Engl J Med, 2016,375(9):905-907.
[2] 李海霞, 黄辰炜. 关注糖尿病肾病的蛋白质组学研究进展[J]. 中华检验医学杂志, 2016,39(12):885-887.
[3] Tang S C, Chan L Y, Leung J C, et al. Differential effects of advanced glycation end-products on renal tubular cell inflammation[J]. Nephrology:Carlton, 2011,16(4):417-425.
[4] Tang S C, Leung J C, Chan L Y, et al. Activation of tubular epithelial cells in diabetic nephropathy and the role of the peroxisome proliferator-activated receptor-gamma agonist[J]. J Am Soc Nephrol, 2006,17(6):1633-1643.
[5] Lim A I, Chan L Y, Tang S C. Albumin and glycated albumin activate KIM-1 release in tubular epithelial cells through distinct kinetics and mechanisms[J]. Inflamm Res, 2014,63(10):831-839.
[6] Nielsen S E, Hansen H P, Jensen B R, et al. Urinary neutrophil gelatinase-associated lipocalin and progression of diabetic nephropathy in type 1 diabetic patients in a four-year follow-up study[J]. Nephron Clin Pract, 2010,118(2):130-135.
[7] Mahfouz M H, Assiri A M, Mukhtar M H. Assessment of neutrophil gelatinase-associated lipocalin (NGAL) and retinol-binding protein 4 (RBP4) in Type 2 diabetic patients with nephropathy[J]. Biomark Insights, 2016,11:31-40.
[8] 荣光,胡佳卉,孟庆刚,等.重症急性肾损伤早期与晚期应用肾脏替代法疗效的Meta分析[J]. 首都医科大学学报,2016,37 (2) :188-195.
[9] 侯斌,石峻.2型糖尿病肾病患者血清hs-CRP、Hcy、TNF-α、IL-6和IL-8的水平检测及临床意义[J]. 中国煤炭工业医学杂志,2015 ,18(3):383-385.
[10]李凤婷,李梦,王馨瑶,等.固本通络汤对糖尿病肾病模型大鼠TGF-β1、MMP-9、TIMP-1表达的影响[J]. 首都医科大学学报, 2014,35 (1):118-121.
[11]Nguyen D, Ping F, Mu W, et al. Macrophage accumulation in human progressive diabetic nephropathy[J]. Nephrology:Carlton, 2006,11(3):226-231.
[12]Niu S, Bian Z, Tremblay, et al. Broad infiltration of macrophages leads to a proinflammatory state in streptozotocin-induced hyperglycemic mice[J]. J Immunol, 2016,197(8):3293-3301.
[13]Sulikowska B, Rutkowski B, Marszaek A, et al. The role of interstitial changes in the progression of chronic kidney disease[J]. Postepy Hig Med Dosw (Online), 2015,69:830-837.
[14]Qiu S, Sun G, Zhang Y, et al. Involvement of the NF-κB signaling pathway in the renoprotective effects of isorhamnetin in a type 2 diabetic rat model[J]. Biomed Rep, 2016,4(5):628-634.
编辑 慕 萌
Effects of glycated albumin on inducing injury and inflammation in human proximal tubular epithelial cells
Duan Nan,Liu Yi,Li Haixia*,Jiao Lili
(DepartmentofClinicalLaboratory,PekingUniversityFirstHospital,Beijing100034,China)
Objective To investigate the effects of glycated albumin (GA) on the expression of kidney injury molecule-1 (KIM-1), neutrophil gelatinase-associated lipocalin (NGAL) and inflammatory cytokines in human proximal tubular epithelial cells (HK-2 cells). Methods The HK-2 cells were treated with the different concentrations of GA and albumin (Alb) for 12h, 24h and 48h. The mRNA expressions of KIM-1 and NGAL were detected by real-time PCR. The release of KIM-1 and NGAL in the supernatants were detected by ELISA. The concentrations of VEGF, TNF-α, IL-8 and sICAM-1 were detected by cytometric beads array method. Results Compared with control and Alb groups, the mRNA levels of KIM-1 and NGAL in HK-2 cells were significantly up-regulated at 12 h, 24 h and 48 h after GA treatment (P<0.05); the protein levels of KIM-1 and NGAL released in supernatants of GA-treated cells were significantly higher than those in control group and Alb groups at the same time points (P<0.05); GA groups also had significantly higher levels of sICAM-1, VEGF and IL-8 than control group at each time point (P<0.05). Conclusion GA can up-regulate the expression and release of KIM-1 and NGAL and promote the secretion of inflammatory cytokines which could cause damage to renal tubules, suggesting that GA may reflect the diabetic renal involvement.
glycated albumin; proximal tubular epithelial cell; kidney injury molecule-1; neutrophil gelatinase-associated lipocalin; cytokines
时间:2017-04-13 19∶52
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1952.026.html
10.3969/j.issn.1006-7795.2017.02.024]
R692.6
2016-12-30)
*Corresponding author, E-mail:leehaixia@139.com
