截断逆挽方对慢加急性肝衰竭模型大鼠血清TNF-α、肝组织p-JNK及c-Jun的影响
2017-04-19穆凌云李金霞张秋云高连印杜宇琼
穆凌云 李金霞 张秋云 * 陈 煜 高连印 杜宇琼
(1.首都医科大学中医药学院 中医络病研究北京市重点实验室,北京 100069;2.首都医科大学附属北京佑安医院人工肝中心,北京 100069)
·基础研究 ·
截断逆挽方对慢加急性肝衰竭模型大鼠血清TNF-α、肝组织p-JNK及c-Jun的影响
穆凌云1李金霞1张秋云1*陈 煜2高连印1杜宇琼1
(1.首都医科大学中医药学院 中医络病研究北京市重点实验室,北京 100069;2.首都医科大学附属北京佑安医院人工肝中心,北京 100069)
目的 观察截断逆挽方对慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)大鼠血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)含量、肝组织磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)及转录因子c-Jun表达的影响,探讨该方干预ACLF大鼠的部分作用机制。方法 选择SPF级Wistar雄性大鼠70只,采用数字表法随机分为正常对照组、模型组、截断逆挽方组和JNK抑制剂SP600125(anthrapyrazolone)组,予猪血清免疫诱导大鼠形成肝纤维化模型,再联合D-氨基半乳糖/脂多糖(D-galactosamine/lipopolysaccharide,D-GalN/LPS)急性攻击,建立ACLF大鼠模型。截断逆挽方组在急性攻击前给予截断逆挽方连续灌胃3 d,SP600125组在急性攻击前0.5 h腹腔注射SP600125。各组大鼠分别在急性攻击后4、8、12 h取材。采用酶联免疫吸附法(enzyme-linked immune sorbent assay,ELISA)检测血清TNF-α含量,蛋白印迹法(Western blotting,WB)检测c-Jun蛋白表达量,免疫组织化学法检测肝组织中p-JNK蛋白表达量,HE染色观察肝脏结构病理变化。结果 与正常组相比,模型组各时间点血清TNF-α浓度均升高,差异具有统计学意义(P<0.01);与对应时间点模型组相比,截断逆挽方组及SP600125组4、8 h血清TNF-α含量明显降低(P<0.01),12 h有所升高;与正常组相比,模型组各时间点c-Jun、p-JNK表达量升高(P<0.01);与模型组相比,截断逆挽方组、SP600125组在4 h及8 h c-Jun、p-JNK表达减少(P<0.05),12 h表达增多。截断逆挽方组及SP600125组两两比较差异无统计学意义(P>0.05)。结论 截断逆挽方在一定程度上可以减轻ACLF大鼠肝细胞的损伤,其作用机制可能是通过影响JNK信号通路介导的细胞凋亡,从而保护肝细胞,抑制肝衰竭。
慢加急性肝衰竭;截断逆挽方;细胞凋亡;JNK信号通路
慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)主要表现为肝细胞发生大块或亚大块坏死[1],病情重,合并症多,病死率高而且缺乏特效治疗药物和手段。其病理变化的实质是大量肝细胞过度死亡,而且细胞凋亡作为细胞死亡的重要形式之一,是ACLF发生与发展的关键病理变化。
截断逆挽方是首都国医名师钱英教授临床用于治疗慢性重型肝炎(chronic severe hepatitis,CSH)的经验方[1]。本课题组前期实验结果表明:该方对ACLF大鼠模型的肝功能具有一定保护作用,可以减轻肝组织损伤,降低病死率,并延长其存活时间;并且可以降低血浆内毒素(endotoxin,ET)、细胞凋亡指数(apoptosis index,AI)、半胱氨酸蛋白酶-8(cysteine proteinase-8,Caspase-8)、半胱氨酸蛋白酶-3(cysteine proteinase-3,Caspase-3)、细胞周期蛋白 E(cyclin E)及其转录因子(DRTF-1-polypeptide-1,DP1)的表达量,可以降低血清丙氨酸氨基转移酶(alanine transaminase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)、白介素-1β(interleukin-1β,IL-1β)、白介素-6(interleukin-6,IL-6)、肝组织肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR1)的含量,并且可以通过抑制线粒体途径,从而抑制肝细胞凋亡[2-8]。本实验旨在通过观察截断逆挽方对ACLF大鼠血清TNF-α含量、肝组织磷酸化c-Jun氨基末端激酶(phosphorylated c-Jun N-terminal kinase,p-JNK)及c-Jun表达量的影响,进一步探讨该方干预ACLF大鼠的部分作用机制,为临床应用该方提供可行的实验依据。
1 材料与方法
1.1 实验动物
Wistar雄性大鼠70只,SPF级,体质量180~200 g,购于北京维通利华实验动物技术有限公司,实验动物合格证号:SCXK(京)2012-0001。首都医科大学动物房饲养,实验室合格证号:SYXK(京)2005-0022。每笼3只,自由饮食,室温18℃~23 ℃,湿度为(50.0±2.0)%,每隔12 h开灯照明。
1.2 主要试剂
猪血清(北京平睿生物有限公司,批号:20140713);D-氨基半乳糖(D-galactosamine/lipopolysaccharide,D-GalN),(P29/14/221,美国Inalco公司);脂多糖(lipopolysaccharide,LPS)(109K4075,美国Sigma公司);Rat TNF-α platinum ELISA(CA,美国eBioscience公司);DAB试剂盒(ZLI-9018,北京中杉金桥公司);封闭用羊血清原液(ZLI-9021,北京中杉金桥公司);兔二步法检测试剂盒(PV-9001,北京中杉金桥公司),Beta-tubulin rabbit Polyclonal 抗体(10094-1-AP,美国Proteintech),Anti-p-JNK 抗体及c-Jun(H-79)抗体(美国Santa Cruz公司)。
1.3 主要药物
截断逆挽方(苦味叶下珠30 g、瓜蒌30 g、金钱草30 g、生黄芪30 g、槲寄生30 g、三七6 g、莪术6 g、丹参20 g、生地20 g、黑附片15 g),药材购自北京同仁堂药店,浓煎成4.34 g/mL,4 ℃保存,使用前水浴加热。
1.4 主要仪器
Eclipse 80i共聚焦荧光显微镜(日本Nikon公司);Universal 320R低温离心机(德国Hettich公司);1-14高速离心机(美国Sigma公司);Multiskan MK3酶标仪;EG720EAU-SS微波炉(中国美的公司);F6/10超细匀浆器(德国Fluko公司);Western blotting电泳仪及附件(美国Bio-Rad公司);Odysseey2.1红外荧光扫描成像系统(美国LI-COR公司);JEM-1400高衬度投射电子显微镜(日本JEOL公司)。
1.5 实验方法
1.5.1 ACLF大鼠造模
课题组前期采用刘旭华等[9]制备的免疫诱导型ACLF大鼠模型,但造模期间病死率达58%。后采用崔丽娟等[5]改变的造模方法,运用猪血清连续腹腔注射13周造成肝纤维化模型,再联合D-GalN/LPS急性攻击,造模期间病死率降为4%。
ACLF大鼠模型建立方法分为两个阶段。(1)免疫阶段:大鼠采用数字表法随机分为正常对照组6只和处理组64只,处理组腹腔注射猪血清1周2次、1次1只注射0.5 mL,正常组大鼠注射等量0.9%(质量分数)氯化钠注射液,共13周,造模过程中无死亡。于13周末处理组中采用抽样法随机抽取1只大鼠处死,取肝组织做病理观察,根据《肝纤维化中西医结合诊疗指南》[10]判定免疫型肝纤维化造模是否成功。造模成功后,将处理组采用数字表法随机分为模型组、截断逆挽方组及SP600125组,每组21只。(2)急性攻击阶段:模型组、截断逆挽方组及SP600125组同时给予D-GalN 800 mg/kg联合LPS 100 μg/kg腹腔注射造成急性攻击,建立ACLF模型。
1.5.2 分组与给药方法
急性攻击前,截断逆挽方组给予生药量为21.7 g·kg-1·d-1浓度为4.34 g/mL的截断逆挽方连续灌胃 3 d,正常组及模型组给予同等剂量0.9%(质量分数)氯化钠注射液灌胃。各组大鼠分别于急性攻击4 h、8 h、12 h后进行平行取材,每组每个时间点7只。大鼠麻醉后腹主动脉取血,摘取肝右叶同一部分置于10%(体积分数)甲醛溶液固定,余下部分于液氮中快速冻存。
1.5.3 酶联免疫吸附法(enzyme-linked immunesorbent assay,ELISA)检测血清TNF-α含量
TNF-α应用ELISA法通过进行检测,具体步骤按照说明书操作,测定各组大鼠血清中TNF-α含量。
1.5.4 Western blotting法检测肝组织中c-Jun蛋白的表达
于-80℃冰箱取出冻存肝组织,每组每个时间点取5支进行匀浆、蛋白定量,按照蛋白定量试剂盒说明书步骤测定蛋白浓度。每支上样蛋白84μg,经10%质量分数SDS-聚丙烯凝胶电泳分离后300 mA电转1 h至0.22μm NC膜上,5%(质量分数)脱脂奶粉封闭1 h,c-Jun抗体(1∶100)4 ℃孵育过夜,TBST洗涤,加二抗(1∶5 000)室温孵育1 h,红外荧光扫描成像系统Oddsey扫膜。以β-tubulin作为参照蛋白,使用Image J软件获得目的蛋白条带的灰度值,通过灰度比较的方法来确定目的蛋白相对于内参的表达量,以分析样本之间目的蛋白表达量差异。
1.5.5 免疫组织化学法检测肝组织中p-JNK蛋白的表达
10%(体积分数)甲醛固定肝组织后进行石蜡包埋、切片,经二甲苯、梯度无水乙醇脱蜡、水化,微波抗原修复,3%(体积分数)过氧化氢封闭过氧化物酶,10%(体积分数)羊血清封闭1 h,p-JNK兔多克隆抗体(1:200)4 ℃过夜孵育,PBS洗涤后滴加HRP标记二抗37 ℃孵育1 h,DAB显色2 min,苏木素复染,经自来水冲洗反蓝,脱水之后中性树胶封片。每组每个时间点观察3张切片,随机选取10个高倍视野进行拍摄,并运用NIKON NIS-Elements BR软件进行阳性表达的标示及积分吸光度值(A值)检测。
每组选取5个肝组织样本,石蜡包埋切片,经苏木素-伊红染色,脱水之后予中性树胶封片。在200倍光镜下对肝脏病理变化进行观察。
1.6 统计学方法
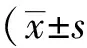
2 结果
2.1 大鼠一般情况观察
造模过程中大鼠无死亡。正常组大鼠一般状况良好,摄食、饮水正常、体质量增加较快、毛色光洁、反应灵敏、活动自如。猪血清免疫损伤期间,处理组大鼠饮食、饮水较正常组少,躁动不安,体质量较正常组无明显差异。急性攻击4 h后,大鼠毛发直立,身体颤抖,抱团;急性攻击8 h后,大鼠抗捕捉能力较弱,反应迟钝;急性攻击12 h后,大鼠抗捕捉能力明显降低。中药组较模型组症状均有所减轻。
2.2 各组大鼠血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)浓度比较
如表1、表2所示,正常组血清中TNF-α浓度较低,与正常组相比,模型组各时间点血清TNF-α浓度均升高,且差异均有统计学意义(P<0.01)。与模型组相比,截断逆挽方及SP600125 4 h、8 h组血清TNF-α含量明显降低,差异有统计学意义(P<0.01),在12 h TNF-α含量较模型组略有下降,差异无统计学意义(P>0.05),整体呈现升高趋势。经析因方差分析,截断逆挽方及SP600125组进行两两比较,差异无统计学意义(P>0.05)。

表1 各组大鼠血清TNF-α值比较
*P<0.05,**P<0.01vsthe same point in model group;##P<0.01vsthe same point in normal control group;△△P<0.01vsthe last point in the same treatment group;TNF-α:tumor necrosis factor-α;JDNW:Jieduan Niwan Formula.
2.3 截断逆挽方对ACLF大鼠肝组织p-JNK蛋白表达的影响
如图1、表2所示,p-JNK 免疫组织化学染色阳性结果显示为棕褐色,在细胞质表达。与正常组相比,模型组p-JNK表达量各时间点均明显升高(P<0.01),于8 h表达明显增多,并达到峰值,12 h较前降低;与模型组相比,截断逆挽方组及SP600125组在4 h、8 h表达明显降低(P<0.01),12 h表达略高。经析因方差分析,截断逆挽方及SP600125组进行两两比较,差异无统计学意义(P>0.05)。

图1 免疫组织化学法检测大鼠肝组织p-JNK蛋白表达
A:normal control group; B:model 4 h group; C:JDNW 4 h group; D:SP600125 4 h group; E:model 8 h group; F:JDNW 8 h group; G:SP600125 8 h group; H:model 12 h group;Arrow:expression of p-JNK;P-JNK:phosphorylated c-Jun N-terminal kinase;JDNW:Jieduan Niwan Formula.

表2 各组大鼠p-JNK表达A值比较
**P<0.01vsthe same point in model group;##P<0.01vsthe same point in normal control group;△△P<0.01vsthe last point in the same treatment group;p-JNK:phosphorylated c-Jun N-terminal kinase;A:absorbancy;JDNW:Jieduan-Niwan Formula.
2.4 截断逆挽方对ACLF大鼠肝组织c-Jun蛋白表达的影响
c-Jun蛋白在各组大鼠肝组织中表达的趋势如图2、表3所示。与正常组相比,模型组4 h时c-Jun蛋白表达增多,至8 h达到高峰,至12 h表达降低(P<0.01),但仍比正常组高;与模型组相比,截断逆挽方组及SP600125组4 h(P<0.01)、8 h(P<0.01)c-Jun蛋白表达较少,12 h表达较模型组增多,差异无统计学意义(P>0.05),整体呈现逐渐升高的趋势。经析因方差分析,截断逆挽方及SP600125组进行两两比较差异无统计学意义(P>0.05)。

图2 Western blotting法检测各组大鼠肝组织c-Jun蛋白表达情况
A:normal control group; B:model 4 h group; C:JDNW 4 h group; D:SP600125 4 h group; E:model 8 h group; F:JDNW 8 h group; G:SP600125 8 h group; H:model 12 h group; I:JDNW 12 h group; J:SP600125 12 h group;JDNW:Jieduan-Niwan Formula.

表3 各组大鼠肝组织c-Jun蛋白表达A值比较
2.5 各组大鼠肝脏病理表现
如图3所示,大鼠HE染色显示,正常组大鼠肝小叶结构完整,肝细胞以中央静脉为中心呈放射状,排列有序,肝细胞无坏死、变性,无炎性细胞浸润。模型组4 h可见肝小叶结构破坏,肝细胞排列不规整,纤维组织增生,部分增生纤维组织可构成假小叶;模型组8 h可见肝细胞呈点状或局灶性坏死,有炎性细胞浸润;模型组12 h可见肝细胞呈片状坏死或大块坏死,有大量炎性细胞浸润,部分肝细胞可见脂肪变性或气球样变。截断逆挽方组和SP600125组较相应时间点模型组,病理变化均有减轻,纤维组织增生较少,肝细胞坏死程度减轻。
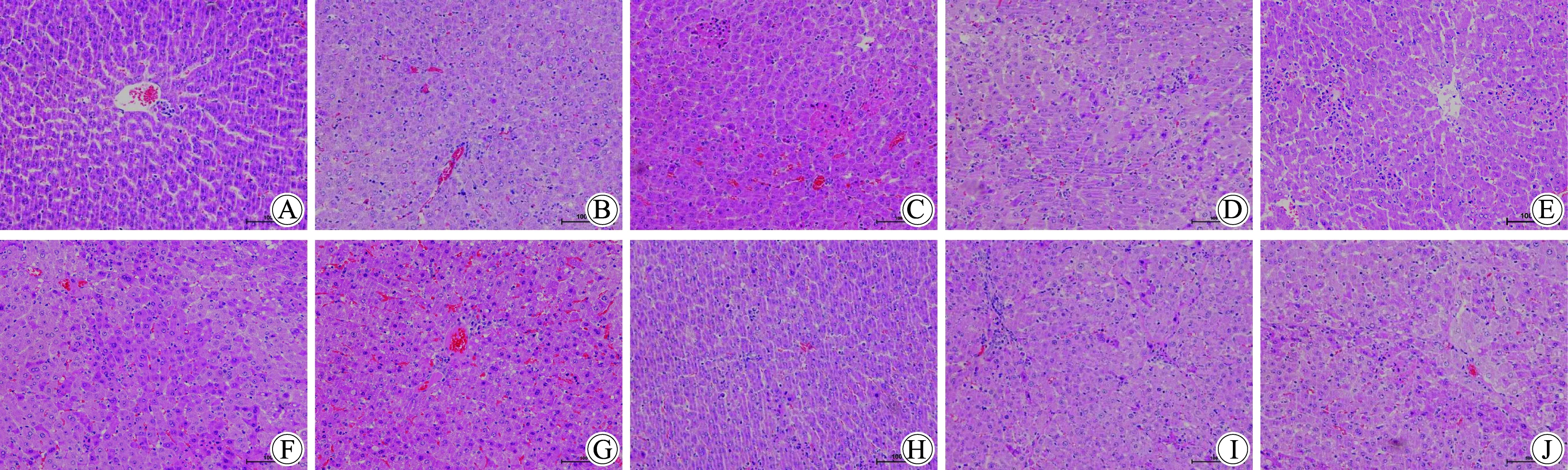
图3 各组大鼠肝组织HE染色
A:normal control group; B:model 4 h group; C:JDNW 4 h group; D:SP600125 4 h group; E:model 8 h group; F:JDNW 8 h group; G:SP600125 8 h group; H:model 12 h group; I:JDNW 12 h group; J:SP600125 12 h group,JDNW:Jieduan-Niwan Formula.
3 讨论
ACLF是我国肝衰竭中的主要类型,多是在慢性肝病的基础上因劳累、饮酒、感染、病毒复制等因素诱使肝脏发生大块或亚大块坏死,主要表现为肝细胞大面积凋亡。临床多将ACLF等同于慢性重型肝炎(chronic severe hepatitis,CSH),病情危重,发展快,病死率高(可达70%以上)[11]。国内多采用针对病因进行的抗病毒治疗及肝移植、人工肝等手段,而且广泛运用降酶保肝药物,但是这些方法对ACLF病人的预后效果尚不明确[12]。本实验采用D-GalN/LPS急性攻击构建ACLF大鼠模型,模拟人体发病过程,旨在为ACLF的发病机制和临床治疗提供新的思路。
TNF-α由活化的巨噬细胞/单核细胞产生,是调控细胞死亡、增生以及免疫等多种生理病理性反应的重要介质。其活化机制主要由3条信号转导通路来诱导产生:Caspase家族介导的细胞凋亡、衔接蛋白TRAF介导的转录因子NF-κB和JNK蛋白激酶的活化。TNF-α介导的细胞凋亡是ACLF大鼠模型重要的发病机制之一。在D-GalN/LPS诱导建立的ACLF大鼠模型中,TNF-α主要是通过与受体TNFR结合,促使上游蛋白激酶活化,招募TRAF2聚集激活下游丝裂原激活的蛋白激酶(mitogen-activated protein kinases,MAPKs)级联反应。其中MKK4/MKK7使JNK位点磷酸化,特异性激活JNK。JNK被激活后活化转录因子AP-1(由c-Jun、c-fos等蛋白合成),诱导下游蛋白级联反应,从而引起细胞凋亡。
在哺乳动物细胞中,MAPKs作为将凋亡信号由细胞表面传导至胞核内部的重要媒介,可以调控细胞内外不同的应激反应。而JNK是MAPKs家族重要成员之一,JNK信号通路已被证实在调控细胞凋亡方面起着重要作用。JNK主要位于细胞质,当受到外界刺激时,其氨基酸残基磷酸化从而被激活,研究发现持续的JNK活化会引起细胞凋亡。活化的JNK可以和转录因子c-Jun的氨基末端区域结合,使转录因子的活性区域发生磷酸化,促进下游相应靶基因及蛋白的表达。
而且在本实验中,与正常组相比,模型组在4 h至8 h p-JNK、c-Jun表达均呈现逐渐升高趋势,提示JNK持续活化,并激活c-Jun,高峰出现在急性攻击后8 h。在12 h,蛋白表达较8 h有所降低,但仍高于正常组,此时细胞凋亡活动减弱。考证其原因[13],可能是造模终末期肝细胞大量死亡,为不可逆损伤,细胞凋亡相应减少。
截断逆挽方组在4 h、8 h时血清TNF-α、p-JNK、c-Jun表达量均较模型组减少,证明该方抑制了JNK的活化及JNK信号通路上游关键蛋白的表达,将凋亡活动减弱;在12 h,截断逆挽方组血清TNF-α、p-JNK、c-Jun蛋白表达略高于模型组,而且4~12 h呈现表达持续升高的趋势,未见降低,表明截断逆挽方干预的模型大鼠肝细胞凋亡活动持续活跃,提示我们截断逆挽方抑制了细胞凋亡的活动,在一定程度上延缓了ACLF大鼠肝细胞死亡的进程。
JNK抑制剂SP600125可以对JNK信号通路产生特异性地抑制作用,目前已有相关动物实验证实SP600125可以直接抑制JNK并且在一定程度上干预治疗动物疾病模型[14]。如在海洛因诱导的小脑颗粒细胞凋亡中JNK/c-Jun通路被激活,JNK特异性抑制剂SP600125可以降低c-Jun磷酸化水平[15]。
另,SP600125组各细胞因子的表达趋势与截断逆挽方组一致:与模型组4 h、8 h相比,SP600125组蛋白表达均减少,在12 h较模型组增多,4~12 h呈逐渐上升的趋势。经过析因方差分析两组间比较得知,截断逆挽方与SP600125作用于ACLF大鼠血清TNF-α、p-JNK、c-Jun的表达无明显差异,证实了截断逆挽方与SP600125的作用机制相似,进一步提示截断逆挽方可能可以通过干预JNK信号通路从而减轻肝细胞损伤。
病理学检验作为诊断肝衰竭的重要指标,本实验中HE染色显示模型组有假小叶形成,广泛的纤维组织增生,肝细胞大片坏死。与模型组比较,截断逆挽方组及SP600125组在相应时间点,坏死减少,炎性反应细胞浸润较少。
综上分析,结合课题组前期实验结果,降低血清TNF-α、肝组织蛋白p-JNK、c-Jun表达,调控JNK信号通路从而减少肝细胞凋亡,可能是截断逆挽方改善ACLF模型大鼠肝功能和减轻其肝细胞损伤的部分作用机制。
[1] 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊疗指南(2012年版)[J].实用肝脏病杂志,2013,16(3):210-216.
[2] 刘增利,张秋云.截断逆挽方对慢加急性肝衰竭大鼠ET、TNF-α的影响[J].中国医药导刊,2011,13(4):650-652.
[3] 吴文秀,崔利娟,陈煜,等.截断逆挽方对慢加急性肝衰竭大鼠肝细胞凋亡指数及caspase8、caspase3表达的影响[J].北京中医药,2012,32(1):62-64.
[4] 吴文秀,崔利娟,张秋云.截断逆挽方降低慢加急性肝衰竭大鼠死亡率的机制探讨[J].中医药导报,2012,18(1):6-11.
[5] 崔利娟,党泽方,张秋云.截断逆挽方对慢加急性肝衰竭大鼠血清TNF-α、IL-1β、IL-6的影响[J].中医药导报,2013,19(1):8-11.
[6] 崔利娟,吴文秀,邢金丽,等.截断逆挽方对慢加急性肝衰竭大鼠血清及肝组织TNF-α含量及肝组织TNFR1表达的影响[J].北京中医药,2013,32(2):134-138.
[7] 党泽方,李金霞,张秋云,等.截断逆挽方对慢加急性肝衰竭大鼠肝细胞超微结构、周期蛋白Cyclin E及转录因子DP1的影响[J].河北医药,2015,37(9):1285-1289.
[8] 李金霞,穆凌云,张秋云,等.截断逆挽方对慢加急性肝衰竭大鼠线粒体凋亡途径的影响[J].中国中医药信息杂志,2016,23(4):45-48.
[9] 刘旭华,孟艳英,陈煜,等.采用免疫型肝硬化大鼠建立慢加急性肝衰竭模型方法的研究[J].胃肠病学和肝病学杂志,2008,17(10):790-793.
[10]中国中西医结合学会肝病专业委员会.肝纤维化中西医结合诊疗指南[J].中华肝脏病杂志,2006,14(11):866-870.
[11]Olson J C, Wendon J A, Kramer D J, et al. Intensive care of the patient with cirrhosis[J].Hepatology, 2011,54:1864-1872.
[12]曾庆磊,吕君,等.慢加急性肝衰竭的定义与治疗[J].肝脏,2016,21(1):66-67.
[13]吴人亮,李娜萍.细胞凋亡、胀亡和坏死———关于细胞死亡的新认识[J].中华病理学杂志,2002,31(5):455-456.
[14]王漫.JNK抑制剂SP600125对AD脑内突触损害和炎性反应治疗作用及其机制研究[D].西安:第四军医大学,2015.
[15]Lai B,Pu H,Cao Q,et al.Activation of caspase-3 and c-Jun NH2-terminal kinase signaling pathways involving heroin-induced neuronal apoptosis[J].Neurosci Lett,2011,502(3):209-213.
编辑 慕 萌
Effects of Jieduan Niwan Formula on the c-Jun,p-JNK of liver tissue in Acute-on-Chronic liver failure rats
Mu Lingyun1, Li Jinxia1, Zhang Qiuyun1*Chen Yu2,Gao Lianyin1, Du Yuqiong1
(1.TraditionalChineseMedicineAcademyofCapitalMedicineUniversity,BeijingKeyLaboratoryofTraditionalChineseMedicineCollateralDiseaseResearch,Beijing100069,China;3.ArtificialLiverCenter,BeijingYouanHospital,CapitalMedicalUniversity,Beijing100069,China)
Objective To observe the effect of the Jieduan-Niwan Formula (JDNW)on the serum tumor necrosis factor alpha(TNF-α)content,the expression of p-JNK and transcription factor c-Jun in acute-on-chronic liver failure(ACLF)rats,to discuss part of the action mechanism of intervention of in ACLF. Methods SPF 70 male Wistar rats were randomly divided into normal control group,model group,JDNW group and JNK inhibitor SP600125 group,to inject pig serum to induce rat liver fibrosis model,and then acute attack combined with D-GalN/LPS,ACLF model was established. Rats in JDNW group were orally given JDNW formula for 3 days before acute attack.Rats in SP600125 group giving intraperitoneal injection half an hour before acute attack.Rats were sacrificed, respectively at 4,8 and 12 h after model established.The expression of TNF-α,c-Jun,p-JNK were detected by enzyme-linked immune sorbent assay(ELISA),western blot method and immunohistochemical analysis, respectively. Results Compared with normal group,the expression of TNF-α,p-JNK,c-Jun of model group were gradually increased;compared with the model group,the expression of TNF-α,p-JNK,c-Jun of JDNW and SP600125 group in 4h and 8h was less(P<0.05),and the expression of 12h increased; the different expression of SP600125 group was in accordance with the JDNW group. Conclusion The prescription of JDNWcan reduce the damage of rat liver cell ACLF in a certain extent,its mechanism may be through cell apoptosis mediated by JNK signaling pathway,thereby protecting liver cells,inhibiting liver failure.
acute-on-chronic liver failure;Jieduan Niwan Formula;apoptosis;JNK signaling pathway
首都中医药研究专项(14ZY01)。This study was supported by Capital of Traditional Chinese Medicine Special Research(14ZY01).
时间:2017-04-13 19∶31
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.1931.004.html
10.3969/j.issn.1006-7795.2017.02.023]
R285.6
2016-07-13)
*Corresponding author, E-mail:zhangqiuyun8202@aliyun.com
