蚁狮多糖的提取工艺及体内免疫活性研究Δ
2017-04-19王颖娟李子忠罗丽平兴义民族师范学院生物与化学学院民族药用生物资源研究与开发实验室贵州兴义56400贵州大学昆虫研究所贵阳55005
王颖娟,张 培,李子忠,罗丽平(.兴义民族师范学院生物与化学学院民族药用生物资源研究与开发实验室,贵州兴义 56400;.贵州大学昆虫研究所,贵阳 55005)
蚁狮多糖的提取工艺及体内免疫活性研究Δ
王颖娟1*,张 培1,李子忠2,罗丽平2(1.兴义民族师范学院生物与化学学院民族药用生物资源研究与开发实验室,贵州兴义 562400;2.贵州大学昆虫研究所,贵阳 550025)
目的:优化蚁狮多糖的提取工艺,探究其对小鼠免疫功能的影响。方法:以蚁狮多糖含量为考察指标,比较水提取法、蛋白酶水解提取法(以酶用量、提取温度、提取时间为考察因素进行正交试验优选)和稀碱液提取法(以碱液浓度、提取温度、提取时间为考察因素进行正交试验优选)提取蚁狮多糖的效果。取128只KM小鼠随机分为4个研究组,每个研究组随机分为对照组(等体积生理盐水)与蚁狮多糖低、中、高剂量组(20、40、80 mg/kg),每组8只,尾静脉iv给药,0.2 mL/10 g,每日1次,连用1周,分别用于测定小鼠腹腔巨噬细胞吞噬百分率与吞噬指数、脾和胸腺指数、淋巴细胞转化率和血清溶血素水平。结果:3种方法所得提取液中蚁狮多糖含量分别为14.48%、38.66%、30.62%。蛋白酶水解提取法所得蚁狮多糖含量最高,其最优提取工艺条件为40℃下用100 μg/g的木瓜蛋白酶提取3 h。与对照组比较,蚁狮多糖低、中、高剂量组小鼠腹腔巨噬细胞吞噬百分率和吞噬指数、脾指数显著升高(P<0.05),胸腺指数显著降低(P<0.05),而淋巴细胞转化率无显著变化(P>0.05);蚁狮多糖中剂量组小鼠血清溶血素水平显著升高(P<0.05)。结论:蛋白酶水解提取法适于蚁狮多糖的提取,其优选工艺可靠。蚁狮多糖具有增强小鼠非特异性免疫、体液免疫的活性。
蚁狮;多糖;提取方法;免疫活性
蚁狮(Antlion),别名地牯牛、沙猴、倒退虫、沙牛等,隶属脉翅目(Neuroptera)蚁蛉科(Myrmeleontidae),是一种药用价值很高的昆虫。其有平肝熄风、解热镇痉、祛瘀散结、拔毒消肿、通便泻下、截疟杀虫之功效,主治小儿高热惊厥、癫痫、中风等症[1-2]。蚁狮作为传统的药用昆虫,全虫入药,但其有效部位尚不明确。笔者前期研究发现,蚁狮体内的多糖类物质具有一定的抗炎镇痛作用[3],多项研究表明植物多糖、菌类多糖具有增强免疫的活性,笔者据此推测蚁狮多糖也有类似活性,而其提取工艺是获取多糖及活性考察的基础。因此,笔者在本研究中比较了水提取法、正交试验优化后的蛋白酶水解提取法和稀碱液提取法3种方法提取蚁狮多糖的效果,并探讨其在小鼠体内的免疫活性,以为蚁狮药用资源的进一步开发利用提供依据。
1 材料
1.1 仪器
8453E型紫外-可见分光光度计(美国Aglient公司);FA2004型电子天平(上海精天电子仪器厂)。
1.2 药材、药品与试剂
蚁狮采自贵州省贵阳市森林公园,经中国农业大学王心丽教授鉴定为锈翅蚁蛉(Myrmeleon ferrugineipennis)幼虫[室内饲养至3龄(幼虫期最后1个龄期)后,先用蒸馏水洗去虫体表面的沙土,用75%乙醇润洗消毒,去离子水淋洗2遍,晾干体表水分,称质量,5.0 g分装,置于-80℃冰箱中保存,备用];瑞氏染液(成都市迈克科技有限公司,批号:1307025);植物血球凝集素(PHA,美国Sigma公司,批号:RT00281);木瓜蛋白酶(上海佳和生物科技有限公司,批号:CF4772);5%鸡红细胞(CRBC,广州鸿泉生物科技有限公司,批号:141021);氢氧化钠、无水乙醇、葡萄糖、石油醚等均为国产分析纯;水为去离子水。
1.3 动物
SPF级KM小鼠128只,♂♀各半,购于贵州医科大学实验动物中心[生产许可证号:SCXK(黔)2012-0001;使用许可证号:SYXK(黔)2012-0001]。
2 方法
2.1 蚁狮多糖的制备
精密称定蚁狮1.0 g,置于石油醚中回流脱脂、过滤,收集虫体,以水(或木瓜蛋白酶、稀碱液)为介质,按1∶10料液比,静置抽提6 h,过滤,滤液体积浓缩至原体积的1/3,然后加入4倍体积的95%乙醇混匀后,静置12 h,离心(离心半径7.5 cm,8 000 r/min)20 min。取沉淀,用无水乙醇洗脱2次,挥发乙醇后,用去离子水溶解并定容至50 mL,即得蚁狮多糖粗提液。
2.2 蚁狮多糖含量测定
采用硫酸-苯酚法测定粗提物中多糖含量[4]。精密称定105℃干燥至恒质量的葡萄糖1.0 g,以去离子水溶解、定容至200 mL量瓶中,即得质量浓度为5 g/L的标准葡萄糖贮备液;精确吸取10 mL贮备液至200 mL量瓶中,以去离子水定容,即得质量浓度为250 μg/mL的葡萄糖标准溶液。吸取0.1、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准溶液,分别置于比色管中,各自加入去离子水使体积为1.0 mL,再加入5%的苯酚1.0 mL,摇匀,迅速加入浓硫酸3.25 mL,室温(25℃)显色25 min左右。另取去离子水1.0 mL同上操作后作为空白对照。于490 nm波长处测定吸光度(A),以葡萄糖质量浓度(x,μg/mL)为横坐标、A为纵坐标绘制标准曲线,得回归方程A=0.000 4x-0.006 5(r=0.997 9),据此计算蚁狮多糖含量。
2.3 蚁狮多糖提取工艺优化
2.3.1 水提取工艺 精确称取5.0 g蚁狮幼虫,按“2.1”项下方法,于100℃下[5]进行水提取。
2.3.2 蛋白酶水解提取工艺 动物组织中的多糖常与蛋白质结合在一起,蛋白酶能水解多糖与蛋白质的连接键而分离多糖[6-7]。本试验采用木瓜蛋白酶,以蚁狮多糖含量为指标,选择提取温度、酶用量、提取时间为考察因素(根据预试验确定),每个因素选择3个水平。精确称取蚁狮各5.0 g,共9份,按“3.2”项下正交表进行蛋白酶水解提取[8]。
2.3.3 稀碱液提取工艺 以蚁狮多糖提取量为指标,选择碱液浓度、提取温度、提取时间为考察因素(根据预试验确定),每个因素选择3个水平。精确称取蚁狮各5.0 g,共9份,按“3.3”项下正交表进行稀碱液提取[9]。
2.4 蚁狮多糖免疫活性测定
2.4.1 蚁狮多糖溶液的制备及动物分组、给药 按“3.2”项下优化的提取方案提取蚁狮多糖,结果蚁狮多糖含量为37.8%,蚁狮多糖得率为8.5%。根据文献[10],成年人(体质量60 kg)每日口服7.5 g蚁狮,相当人每1 kg体质量口服4 mg蚁狮多糖,以成人摄入量的5、10、20倍[11]设置小鼠给药的低、中、高剂量,即20、40、80 mg/kg,折算为原动物生药含量分别为625、1 250、2 500 mg/kg。
“2.4.2”~“2.4.5”每项研究分别取KM小鼠32只,♂♀各半,随机分为对照组与蚁狮多糖低、中、高剂量组(20、40、80 mg/kg),每组8只。各组小鼠尾静脉iv给药,0.2 mL/10 g,每日1次,连用1周;对照组小鼠尾静脉iv等体积生理盐水。
2.4.2 各组小鼠腹腔巨噬细胞吞噬功能测定 末次给药后,各组小鼠ip 5%CRBC 0.5 mL,3 h后颈椎脱臼处死,剪开腹腔皮肤,ip 0.9%氯化钠溶液2 mL,轻揉小鼠腹部。吸取腹腔冲洗液,滴片,于37℃温育30 min后,于生理盐水中漂洗,吹干,甲醇溶液固定5 min,晾干,瑞氏染色30 min,油镜下观察,并计算吞噬百分率和吞噬指数。吞噬百分率(%)=具有吞噬能力的巨噬细胞数/巨噬细胞观察数×100%;吞噬指数=吞噬的鸡红细胞总数/巨噬细胞观察数[8,12]。
2.4.3 各组小鼠免疫器官指数测定 末次给药后24 h处死小鼠,取脾和胸腺,用滤纸吸干水分后称取质量,并计算免疫器官指数。免疫器官指数(mg/g)=免疫器官质量/体质量[8,13]。
2.4.4 各组小鼠淋巴细胞转化率测定 给药开始后第1~3天,各组小鼠im PHA 10 mg/kg。末次给药后剪尾,取血推片,瑞氏染色30 min,油镜下观察,共计数淋巴细胞100个,并计数其中转化细胞(淋巴母细胞、过渡态细胞)数,计算淋巴细胞转化率。淋巴细胞转化率(%)=转化细胞数/100个×100%[12]。
2.4.5 各组小鼠血清溶血素水平测定 各组小鼠ip5%CRBC 0.2 mL免疫后,按“2.4.1”项下方法给药,末次给药后摘眼球取血,离心(离心半径7.5 cm,3 000 r/min)10 min,取血清加入100倍生理盐水稀释。取稀释血清1 mL,与5%CRBC混合后,在37℃恒温箱中保温30 min后,0℃冰箱中中止反应。离心(离心半径7.5 cm,3 000 r/min)10 min,取上清液于540 nm波长处测吸光度。溶血素水平以半数溶血值(HC50,评价免疫调节功能的指标)表示,计算公式为HC50=样品的吸光度/ CRBC半数溶血时的吸光度×稀释倍数[14]。
2.5 统计学方法
3 结果
3.1 水提取工艺测定结果
按“2.3.1”项下方法提取后,再按“2.2”项下方法测定多糖含量,结果,蚁狮多糖的含量为14.48%。
3.2 蛋白酶水解提取工艺测定结果
按“2.3.2”项下方法,以正交试验安排的不同因素水平进行提取后,再按“2.2”项下方法测定多糖含量,结果见表1,方差分析见表2。
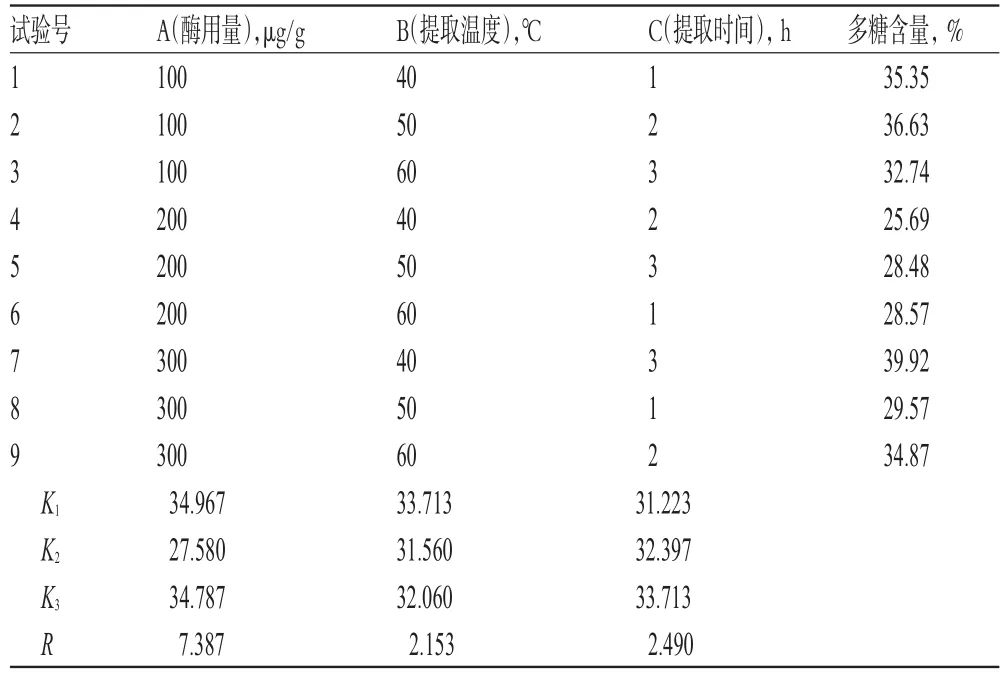
表1 蚁狮多糖蛋白酶水解提取工艺正交试验安排与结果Tab 1 Orthogonal test arrangement and results of protease hydrolysis extraction technology for polysaccharide from antlion

表2 蚁狮多糖蛋白酶水解提取工艺方差分析Tab 2 Variance analysis of protease hydrolysis extraction technology for polysaccharide from antlion
由直观分析和方差分析可知,各因素对酶提工艺的影响顺序为A>C>B。方差分析结果表明,各因素对蚁狮多糖提取均无显著影响。综合生产成本考虑,确定蚁狮多糖酶提取工艺为A1B1C3,即40℃下用100 μg/g的木瓜蛋白酶提取3 h。此工艺下进行3次验证试验,结果蚁狮多糖的平均含量为38.66%(RSD<5%,n=3)。
3.3 稀碱液提取工艺测定结果
按“2.3.3”项下方法,以正交试验安排的不同因素水平进行提取后,再按“2.2”项下方法测定多糖含量,结果见表3,方差分析见表4。

表3 蚁狮多糖稀碱液提取工艺正交试验安排与结果Tab 3 Orthogonal test arrangement and results of diluted alkali extraction technology for polysaccharide from antlion
由直观分析和方差分析可知,各因素对稀碱液提取工艺的影响顺序为C>A>B,因素C对蚁狮多糖提取有显著影响(P<0.05)。综合生产成本考虑,确定最优稀碱液提取工艺为A1B3C3,即80℃下用0.01 mol/L碱液提取3 h。此工艺下进行3次验证试验,结果蚁狮多糖的平均含量为30.62%(RSD<5%,n=3)。
3.4 各组小鼠腹腔巨噬细胞吞噬功能测定结果
与对照组比较,蚁狮多糖低、中、高剂量组小鼠腹腔巨噬细胞吞噬百分率和吞噬指数显著升高(P<0.05),详见表5。
3.5 各组小鼠免疫器官指数测定结果
与对照组比较,蚁狮多糖低、中、高剂量组小鼠脾指数显著升高(P<0.05)、指数明显降低(P<0.05),且呈现一定剂量依赖性(P<0.05),详见表5。
3.6 各组小鼠PHA刺激淋巴细胞转化测定结果
与对照组比较,蚁狮多糖低、中、高剂量组淋巴细胞转化率略有升高,但差异无统计学意义(P>0.05),详见表5。
3.7 各组小鼠血清HC50测定结果
与对照组比较,蚁狮多糖中剂量组小鼠血清HC50显著升高(P<0.05),结果详见表5。
表5 各组小鼠免疫活性测定结果(s,n=8)Tab 5 Determination results of immune activity of mice in each group(s,n=8)

表5 各组小鼠免疫活性测定结果(s,n=8)Tab 5 Determination results of immune activity of mice in each group(s,n=8)
注:与对照组比较,*P<0.05Note:vs.control group,*P<0.05
组别对照组蚁狮多糖低剂量组蚁狮多糖中剂量组蚁狮多糖高剂量组HC5031.06±3.32 27.20±2.48 51.43±4.14*30.12±3.85剂量,mg/kg 20 40 80吞噬百分率,% 17.50±2.45 30.50±5.45*40.25±4.27*33.50±3.51*吞噬指数22.25±3.58 37.38±3.93 48.50±2.33*38.25±5.60*胸腺指数,mg/g 4.99±0.13 4.32±0.17*4.17±0.16*3.76±0.13*脾指数,mg/g 5.40±0.09 6.40±0.19*6.57±0.18*7.28±0.11*淋巴细胞转化率,% 76.38±5.88 78.88±4.79 80.50±3.59 77.38±5.93
4 讨论
比较3种方法的蚁狮多糖提取率,蛋白酶水解提取法和稀碱液提取法均高于水提取法,说明多糖在蚁狮体内可能多以糖蛋白形式存在,而酶和稀碱有助于糖和蛋白结合键的断裂,利于多糖析出。蛋白酶水解提取法提取效果略优于稀碱液提取法,结合生产成本及环境保护等因素,蚁狮多糖的提取工艺宜采取蛋白酶水解提取法的优化工艺。
淋巴细胞是免疫系统中最重要的细胞,胸腺是T淋巴细胞分化成熟的场所,脾是人及哺乳动物体内重要的免疫器官,所以胸腺指数和脾指数是衡量机体细胞免疫的重要指标。多糖的免疫活性多见报道的为植物多糖[12-14]和菌类多糖[5,9],而动物类[8]尤其昆虫类多糖则鲜见报道。本研究中,在给予小鼠一定剂量的蚁狮多糖后,小鼠的脾指数有了显著增加,说明蚁狮多糖对小鼠的脾细胞有较强的增殖作用。然而,对小鼠的胸腺指数而言,各剂量组与对照组比较都表现出不同程度的降低,而且在高剂量时,这种趋势更加明显,这与报道的猴头菇多糖[15]、女贞子多糖[16]对胸腺的作用相似,但与人工虫草多糖[17]、黄芪多糖[18]可增加胸腺质量的结果不符。因此,蚁狮多糖的免疫机制有待进一步深入研究。
通过免疫活性的测定,发现蚁狮多糖具有一定的增强小鼠非特异性免疫、体液免疫功能,这可为进一步深入开发蚁狮有效部位提供依据,对进一步挖掘药用昆虫的价值及持续利用药用昆虫资源也有重要的现实意义。
[1] 药用动物志协作组.中国药用动物志:第2册[M].天津:天津科技出版社,1983:117-118.
[2]《广东中药志》编辑委员会.广东中药志:第1卷[M].广州:广东科技出版社,1994:745-747.
[3] 王颖娟,张培,李子忠.蚁狮多糖对小鼠炎症模型影响的实验研究[J].四川动物,2016,35(2):266-269.
[4] Taylor KACC.A modification of the phenol-sulfuric acid assay for total carbohydrates giving more comparable absorbances[J].Appl Biochem Biotechnol,1995,53(3):207-214.
[5] 白凤岐,牟建楼,陈志周,等.水提法提取灵芝多糖及其体外抗氧化研究[J].食品工业,2015,36(3):143-146.
[6] 张楠楠,朱志军,蒋亚超,等.星点设计-响应面法优化五味子多糖的酶提工艺[J].中国药房,2016,27(22):3142-3144.
[7] 吴叶莲,肖春玲.酶解法提取黑米多糖的研究[J].食品研究与开发,2015,36(6):38-41.
[8] 王竹清,张凯,侯虎,等.皱纹盘鲍性腺多糖的提取及其体内免疫调节活性研究[J].中国海洋药物,2015,34(2):34-38.
[9] 张擎,胡质毅,王荃,等.灵芝菌丝体碱提多糖对小鼠细胞免疫的作用[J].中山大学学报(自然科学版),2005,44(5):79-83.
[10] 吴钧俊.二金散治疗肾结石80例[J].上海中医药杂志,2003,37(9):29-30.
[11] 洪铁,杨振,吕传峰,等.玉米多糖对小鼠机体免疫功能的影响[J].中国免疫学杂志,2011,27(9):790-795.
[12] 李雪华,李福森,韦巍,等.荔枝多糖对小鼠免疫功能的影响[J].时珍国医国药,2008,19(9):2119-2120.
[13] 陈福星,陈文英,郝艳霜.蒲公英多糖对小鼠免疫器官的影响[J].动物医学进展,2008,29(4):10-12.
[14] 魏伟,王永宏,田义新,等.山兰多糖的免疫药理活性研究[J].上海中医药杂志,2016,50(4):84-87.
[15] 徐杭民,谢忠粗,张蔚羽,等.猴头菇多糖的免疫调节作用[J].中国中西医结合杂志,1994,14(7):427-428.
[16] 马学清.女贞子多糖免疫增强作用的体外实验研究[J].中国免疫学杂志,1996,12(2):101-103.
[17] 钟建春,张艳,丁振涛,等.人工冬虫夏草多糖提取物对小鼠免疫功能的影响[J].中山大学学报(自然科学版),2011,50(6):99-102.
[18] 高旭,李丽芬,刘斌钰.黄芪多糖对小鼠免疫功能影响的实验研究[J].山西大同大学学报(自然科学版),2010,26(4):42-44.
Study on the Extraction Technology of Polysaccharides from Antlion and Its Immune Activity in vivo
WANG Yingjuan1,ZHANG Pei1,LI Zizhong2,LUO Liping2(1.Key Laboratory on Research and Development of Ethnic Medicinal Biological Resources,School of Biology and Chemistry,Xingyi Normal University for Nationalities,Guizhou Xingyi 562400,China;2.Institute of Entomology,Guizhou University,Guiyang 550025,China)
OBJECTIVE:To optimize the extraction technology of polysaccharides from antlion and explore its effect on immune functions of mice.METHODS:Using content of polysaccharides as investigation index,the effects of extracting polysaccharides from antlion by water extraction method protease hydrolysis extraction(optimized by orthogonal test using extraction temperature,enzyme dosage,extraction time as indexes),and diluted alkali extraction(optimized by orthogonal test using alkali concentration,extraction temperature,extraction time as indexes)were compared.128 KM mice were randomly divided into 4 groups,then randomly divided into control group(normal saline),polysaccharides low-dose,medium-dose,high-dose groups(20,40,80 mg/ kg),8 in each group,iv in tail vein,0.2 mL/10 g,once a day,for 1 week,which were respectively used to determine the phagocytosis percentage and phagocytic index of peritoneal macrophages,spleen and thymus index,lymphocyte transformation rate and serum hemolysin levels.RESULTS:The contents of polysaccharides by 3 methods were 14.48%,38.66%,30.62%,respectively. The content of polysaccharides by protease hydrolysis extraction was the highest,the optimal extraction technology were as follows as using 100 μg/g papain extracting 3 h under 40℃.Compared with control group,phagocytosis percentage,phagocytic index,spleen index in polysaccharides low-dose,medium-dose,high-dose groups were significantly increased(P<0.05),thymus index was significantly decreased(P<0.05),while lymphocyte transformation rate had no significant changes(P>0.05);serum hemolysin in polysaccharides medium-dose group was significantly increased(P<0.05).CONCLUSIONS:Protease hydrolysis extraction is suitable for the extraction of polysaccharides from antlion,the optimal technology is reliable.Polysaccharides from antlion show activity in enhancing mice non-specific immunity and humoral immunity.
Antlion;Polysaccharide;Extraction method;Immune activity
Q969.97
A
1001-0408(2017)10-1338-04
2016-08-05
2017-02-02)
(编辑:刘明伟)
贵州省科学技术基金项目(No.黔科合J字〔2012〕2323号);贵州省中药现代化科技产业研究开发专项项目(No.黔科合中药字〔2013〕5038号);贵州省普通高等学校创新人才团队建设项目(No.黔教合人才团队字〔2013〕30号)
*副教授,博士。研究方向:药用昆虫资源的研究与开发。电话:0859-3296551。E-mail:wangyj1982@126.com
DOI10.6039/j.issn.1001-0408.2017.10.11
