我院超说明书用药的分级管理研究Δ
2017-04-19谭湘萍司徒冰广州医科大学附属第三医院药学部广州510150
王 颖,谭湘萍,司徒冰(广州医科大学附属第三医院药学部,广州 510150)
我院超说明书用药的分级管理研究Δ
王 颖*,谭湘萍,司徒冰#(广州医科大学附属第三医院药学部,广州 510150)
目的:促进临床超说明书用药的规范管理。方法:综合考量超说明书用法偏离标准操作的程度和风险程度,将我院超说明书用药分为3种情况进行审批分级及知情同意分级;对分级管理后的情况和效果进行评价。结果:我院制订的分级情况包括偶然或者小剂量超出说明书标示的用法(第1种)、常规性改变用法用量或给药途径等的用法(第2种)以及超适应证用药存在禁忌的用法(第3种);审批相应分级为医师再确认签名、医务科审批、药事会和伦理委员会审批;知情同意则分级为签署知情同意书、知情告知并记录在病历中、口头告知。从2014年2月我院正式启动超说明书用药审批流程起至2016年6月止,共收到13个科室的51份超说明书用药申请,其中16份属于审批的第2种情况,35份属于审批的第3种情况。最终42份超说明书用药通过了审批,9份未获审批。已获审批的超说明书用法在用药过程中未发生新的/严重的药品不良反应/事件;未发现未获审批的超说明书用药继续使用的情况。结论:我院超说明书用药的分级管理办法可操作性强,较大程度地改善了临床医师超说明书用药不规范的现象。
超说明书用药;分级管理;审批;知情同意
药品说明书是药品生产企业提供的、载有药品信息的法定文书,是指导医师和患者临床合理用药的主要依据。但是,随着临床医学实践的不断发展,药品的新适应证和用法被发现,药品说明书内容因更新较慢往往滞后于该药品的临床使用信息,这决定了超说明书用药行为的不可避免[1]。超说明书用药又称药品未注册用法,是指给药剂量、适应人群、适应证或给药途径等不在药品监督管理部门批准的说明书之内的用法[2]。超说明书用药在国内外均广泛存在[3-5]。对于这样一个不可回避的行为,原国家卫生部《三级综合医院评审标准实施细则(2011年版)》[6]要求,医疗机构必须有“超说明书用药管理的规定与程序”。很多医院都在探索超说明书用药的管理,而我院在探索中建立了不同于其他医院的、可操作性强的、综合考量超说明书用法偏离标准操作的程度和风险程度的分级管理体系,制定了《超说明书用药管理规定》,并通过了42份超说明书用药。现将我院的相关工作内容报道如下,供医院同行参考。
1 分级管理方法
对于临床上非试验研究、无替代药品时发生的超说明书用药,综合考量超说明书用法偏离标准操作的程度、用药目的及风险,我院将超说明书用药的临床使用情况分为3种,并采取不同的管理流程,如图1所示。

图1 我院超药品说明书用药分级审批流程Fig 1 Classification approval process of off-label drug use in our hospital
1.1 超说明书用药的不同情况
3种超说明书用药情况详情如下。
1.1.1 偶然或者小剂量超出说明书标示的用法(第1种) 这是因诊断或者治疗需求,偶然或者小剂量超出说明书用药剂量、改变药物溶剂或溶剂量的超说明书用药。例如,某冠心病患者由于心力衰竭限制输液量,在使用马来酸桂哌齐特注射液时溶剂量减少至250 mL(说明书标示溶剂量为500 mL)。
1.1.2 常规性改变用法用量、给药途径等的用法(第2种) 这是因诊断或者治疗需求,常规性改变给药途径、超剂量用药、改变溶剂或溶剂量、改变给药间隔的超说明书用药。例如,ST段抬高性急性心肌梗死患者,经皮冠状动脉介入治疗(PCI)术前顿服氯吡格雷片600 mg(属于氯吡格雷片的超剂量用药);为避免甲磺酸溴隐亭片口服用药引起的胃肠道不适,采用阴道给药(属于甲磺酸溴隐亭片的超给药途径用药)。
1.1.3 超适应证用药、存在禁忌的用药(第3种) 这是因诊断或者治疗需求,超适应证用药、存在禁忌的适应人群或用法的超药品说明书用药。例如注射用甲氨蝶呤超适应证用于异位妊娠。
1.2 超说明书用药的分级审批流程
针对上述3种情况,审批流程也各不相同,详见图1。
1.2.1 第1种 此类超说明书用药的风险相对较小,开嘱医师在超说明书用药处注明原因并再次确认签名,药师即可进行调配。
1.2.2 第2种 与第1种比较,此类超说明书用药偏离说明书的程度更大,风险较高,应在获得医务科审批备案后方可使用。
具体审批流程:①科室申请。用药科室经科室管理小组会议讨论同意后填写超说明书用药申请表,并附用药合理性的循证医学依据,提交到药学部临床药学室。②医务科审批。医务科联合药学部对申请进行初步审议,经审批同意的超说明书用药分别在医务科和药学部备案。③临床使用。④药事管理与药物治疗学委员会(以下简称药事会)定期集中审批。药事会成员根据医务科的初步审议结果进行审批,形成决议,内容包括本药品超说明书用药项目内容、主要依据、可能发生的风险、知情同意级别、需对患者特别告知的事项等。⑤药学部将审批后的超说明书用药编入医院处方集。
1.2.3 第3种 这种类型的用药偏离说明书的程度最大,风险也最高,获得药事会和伦理委员会审批后方可使用。
具体审批流程:①科室提交申请后,药学部组织3~5名相关专业的专家对申报品种进行论证,由药学部临床药学室整理汇总,形成《超说明书用药评估报告》,内容包括有无合理的可替代药品、用药目的是不是试验研究、有无合理的医学实践证据、有效性和安全性评估等。②专家论证通过后,提交医院伦理委员会审批,如审批同意,则根据该用法的危险程度、偏离标准操作的程度及用药目的等确定知情同意的分级。③提交药事会审批,其他程序与第2种情况相同。
对于第2、3种情况,接到申请表后,参照《医疗机构超药品说明书用药管理专家共识》[7]对超说明书用药应满足的5个条件,药学部临床药学室需对超说明书内容进行整理和查证,内容包括用药目的是不是试验研究、有无合理的可替代药品、有无合理的医学实践证据、有效性和安全性评估等。
1.3 超说明书用药的知情同意分级
在保护患者的知情权的前提下,为了提高临床的可操作性,根据超说明书用法的用药目的、偏离说明书的程度以及危险程度,知情同意也分为不同等级。A级:必须取得患者或家属或监护人的知情同意,告知接受超说明书用药的必要性、可能获益和可能的风险,并获签知情同意书;B级:需要告知患者或家属或监护人并记录在病历中;C级:需要口头告知患者或家属或监护人。
对审批的第2种情况,知情同意一般为C级。在第3种情况中,对存在禁忌的用法,或是涉及特殊人群(孕妇、新生儿等)用药的,知情同意为A级;但对第3种情况中的其他情况,知情同意一般为B级。如遇特殊情况,伦理委员会和药事会可以根据临床的实际情况对知情同意的分级进行微调。
1.4 后续追踪
经审批不同意使用的超说明书用药,不得继续使用。药师在审核处方时如发现此类处方,应拒绝调配药品。药学部定期对超说明书用药进行汇总、分析与反馈,并对超说明书用药进行监测及后续评估。对审批通过的超说明书用药,临床药师通过预警体系监测超说明书用药所致药品不良反应/事件;对审批未通过的超说明书用药,临床药师继续收集证据关注用药进展。
2 分级管理结果
2.1 审批结果
从2014年2月我院正式启动超说明书用药审批流程起至2016年6月止,共收到了51份超说明书用药申请,涉及到妇产科(含生殖中心)、普通儿科、新生儿科、皮肤科、产前诊断科、血液内科、风湿免疫科等13个科室;其中有31.4%(16份)属于审批的第2种情况,68.6%(35份)属于审批的第3种情况。最终有82.4%(42份)的超说明书用药通过了审批,涉及到超适应证、超剂量、超适用人群、超用药途径、禁忌人群用药等5种类型;有9份超说明书用药未通过审批。在通过审批的用法中,40.5%(17份)的知情同意级别是A级,需要签署知情同意书;40.5%(17份)是B级,需要知情告知并记录在病历中;19.0%(8份)是C级,需要口头告知患者。
用于评价超说明书用药的循证医学等级主要是采用MICROMEDEX有效性推荐级别和证据等级评价(Micromedex recommendation,evidence and efficacy rating)[8]。循证医学等级资料的收集由临床药师完成。下文就以申请超说明书用药数量最多的妇产科(含生殖中心)和新生儿科为例,介绍我院的超说明书用药管理情况。
2.1.1 妇产科 我院妇产科共提交了16份超说明书用药申请,通过审批的有11份,相应的循证医学等级见表1。
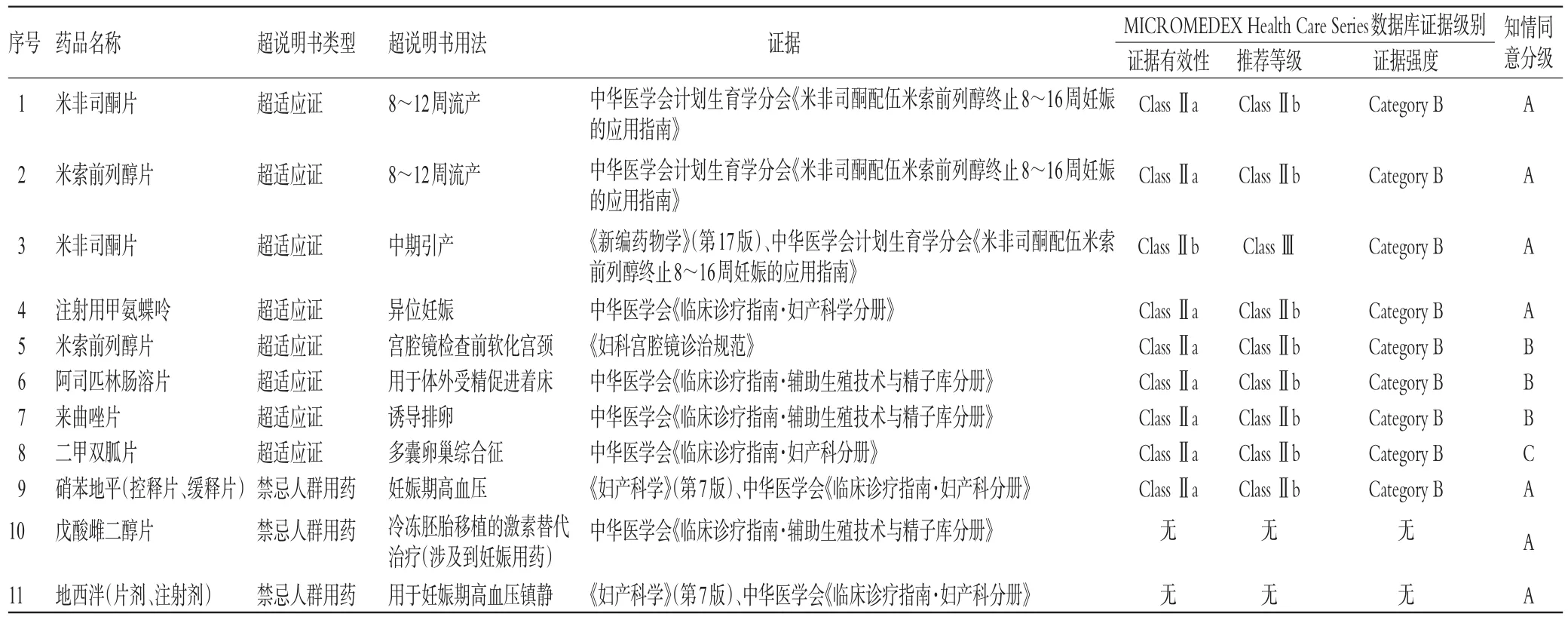
表1 我院妇产科通过审批的超药品说明书用药Tab 1 The approved off-label drug use in department of gynaecology and obstetrics in our hospital
审批通过的妇产科超说明书用药为超适应证或禁忌人群用药,属于审批的第3种情况,经过专家论证形成评估报告后,提交伦理委员会审批、确定知情同意分级,再由药事会审批。通过审批后,在患者的知情同意下使用。其中,米非司酮超适应证用于8~12周流产、中期引产等7种超说明书用法的知情同意级别是A级,必须取得患者或家属或监护人的知情同意并签署知情同意书;米索前列醇超适应证用于宫腔镜检查前软化宫颈等3种超说明书用法的知情同意级别是B级,需知情告知并记录在病历中;二甲双胍片超适应证用于多囊卵巢综合征的知情同意级别是C级,需要口头告知患者。一般非特殊人群的超适应证用药的知情同意级别为B级,但是考虑到二甲双胍是作为胰岛素增敏剂用于有高胰岛素血症、胰岛素抵抗的多囊卵巢综合征患者,这种超说明书的适应证与说明书内的适应证都是基于提高胰岛素的敏感性的,风险较小,因此将知情同意级别下调为C级。需要特别说明的是,米非司酮片用于中期引产在MICROMEDEX Health Care Series数据库中的推荐等级为ClassⅢ(不推荐),但是在我院仍通过了伦理委员会和药事会的审批,这是因为当时可用于中期引产的乳酸依沙吖啶注射液厂家供货不足导致我院缺货,影响了临床使用,在这种无药可用的情况下,通过了米非司酮用于中期引产的用法。后来随着乳酸依沙吖啶注射液的正常供应,米非司酮用于中期引产的超说明书用法在我院使用也受到了限制。
在妇产科的申请用药中,有5份未获审批,其中硝苯地平片抗早产、甲硝唑用于孕妇厌氧菌感染这2种用法因我院有合理的可替代药品而未通过伦理委员会审批;硫酸沙丁胺醇片抗早产、黄体酮软胶囊超剂量使用、米非司酮用于子宫内膜异位症这3种用法因循证医学证据不足而未通过药事会审批。
2.1.2 新生儿科 新生儿科共提交了7份超说明书用药,主要是说明书上无新生儿剂量的抗菌药物,如注射用头孢西丁、注射用阿奇霉素、注射用美罗培南等,均属于审批的第3种情况。证据来源于《中国药典·临床用药须知》(2010年版)和《热病-桑福德抗微生物治疗指南》(新译第43版),全部通过审批,知情同意级别均为A级,即必须取得患者家属或监护人的知情同意,并签署知情同意书。
2.2 后续追踪情况
超说明书用药审批结果在全院范围内公示,公示1个月后,定期进行处方点评。在处方点评过程中,未发现未获审批的超说明书用法继续使用的情况;但是发现了未提交申请的超说明书用药在临床使用的情况,如人血白蛋白用于治疗卵巢过度刺激综合征、地塞米松治疗新生儿支气管肺发育不良、氨茶碱治疗早产儿呼吸暂停、枸橼酸咖啡因预防早产儿呼吸暂停等。对于这些未提交申请的超说明书用药,临床药师将跟踪评价其合理性。
对于已审核通过的超说明书用药,临床药师监测超说明书用药所致药品不良反应/事件,继续关注后续用药情况。结果,已获审批的超说明书用药在用药过程中未发生新的/严重的药品不良反应/事件。需要说明的是,我院审批通过的超说明书用药如利伐沙班片超适应证用于治疗成人深静脉血栓形成,目前已经成为国家食品药品监督管理总局批准的适应证[9],且该药此用法已上报院药事会,从我院的超说明书用药目录中剔除。
3 讨论
目前,在国内多个学会发布的《超说明书用药专家共识》[7,10-12]中,均允许超说明书用法的临床使用,但是学会发布的专家共识是否具备法律效力仍值得商榷。即使超说明书用药有循证医学证据,在患者知情同意下使用,但一旦出现医疗纠纷,如何界定仍是棘手问题。但是超说明书用药行为不可回避,医疗机构必须制订与医疗行为相适应的超说明书用药管理规定,规范超说明书用药行为,加强监测超说明书用药的不良反应和获益,减少和避免用药不当引起的纠纷。
为规范超说明书用药,目前多家医院都出台了院内超说明书用药的管理规定,如广东省人民医院[13]、中国医科大学附属第一医院[14]、北京大学肿瘤医院[15]等,其中也不乏有医院采取分级管理的举措[14-16]。而国外暂未见超说明书分级管理的相关研究。目前国内文献报道的分级管理都需要先评估超说明书用药可能给患者带来伤害的风险程度,再予以不同的管理对策和使用限制。而我院的分级管理办法与已发表的文献不同,我院将分级的关卡前移,只需根据超说明书用药的类型和发生频率,即可判断出超说明书用法偏离标准操作的程度及风险高低,从而进入不同的审批程序,可操作性强;而且我院的超说明书分级管理办法不仅在审批上进行分级,知情同意也采用分级管理,更有利于临床医师与患者沟通,切实保护了患者的知情权。
与其他的超说明书用药管理方法比较,我院的超说明书分级管理具有以下优势:(1)临床接纳度高,可操作性强;(2)对超说明书用药进行循证医学证据的收集和评价,有利于推动临床合理用药;(3)医师、药师共同参与超说明书用药管理,提高合理用药水平;(4)临床药师参与超说明书用药管理,有助于提升临床药师的专业水平,更好地掌握专科用药规律及进展,协助医师为患者制订最佳药物治疗方案;(5)药学部对超说明书用药进行监测及后续评估,保障用药安全。
但是我院的超说明书用药管理也存在一定的局限性,如我院超说明书用药情况的回顾性调查尚未完成以及通过审批的超说明书用药知情同意的执行情况欠佳等。针对这些不足,我院拟将已通过审批的超说明书用药进行回顾性调查,获取基线数据,并结合循证医学证据进行分析,以提高我院超说明书用药水平;医务科对超说明书用药的知情同意情况进行抽查,以督促临床科室在超说明书用药时进行知情告知。
我院在探索中建立了超说明书用药的分级管理办法,依据超说明书用法偏离标准操作的程度、用药目的及风险等对不同的超说明书用药情况进行分级审批和管理,对知情同意也进行分级管理。从我院落实执行超说明书用药分级管理制度的2年来,在一定程度上改善了我院临床医师超说明书用药不规范的现象,对提高医院合理用药水平有重要意义。
[1] 唐蕾,韦炳华,何秋毅,等.超说明书用药的现状及其法律风险[J].中国药房,2014,25(45):4225-4228.
[2] Cuzzolin L,Zaccaron A,Fanos V.Unlicensed and off-label uses of drugs in paediatrics:a review of the literature [J].Fundam Clin Pharmacol,2003,17(1):125-131.
[3] Voigt F,Goecke TW,Najjari L,et al.Off-label use of misoprostol for labor induction in Germany:a national survey[J].Eur J Obste&Gynecol&Reprod Bio,2015,187:85-89.
[4] Pisa FE,Cosano G,Giangreco M,et al.Prescribing practice and off-label use of psychotropic medications in postacute brain injury rehabilitation centres:a cross-sectional survey[J].Brain Injury,2015,29(4):1-9.
[5] 卢运超.某院超说明书用药问题的现状与分析[J].中国医院药学杂志,2015,35(24):2247-2250.
[6] 卫生部.三级综合医院评审标准实施细则:2011年版[S].2011-11-25.
[7] 广东省药学会.医疗机构超药品说明书用药管理专家共识[S].2014-11-06.
[8] 张波,郑志华,李大魁.超药品说明书用药参考[M].北京:人民卫生出版社,2013:9-13.
[9] 拜耳医药保健有限公司.利伐沙班片说明书[S].2015-04-29.
[10] 广东省药学会.药品未注册用法专家共识[S].2010-03-18.
[11] 中国药理学会治疗药物监测研究专业委员会.超说明书用药专家共识[J].药物不良反应杂志,2015,17(2):101-103.
[12] 中华医学会儿科学分会临床药理学组.中国儿科超说明书用药专家共识[J].中华儿科杂志,2016,54(2):101-103.
[13] 劳海燕,王启仪,杨敏,等.广东省人民医院超说明书用药临床管理方法与流程研究[J].中国循证医学杂志,2014,14(9):1025-1029.
[14] 韩吉,梁宇,姜明燕.我院超说明书用药情况分析与分级管理[J].中国药房,2013,24(14):1318-1320.
[15] 王丹,彭炜,焦园园,等.循证医学视角下的超说明书用药分级管理研究[J].中国医院管理,2015,35(7):71-72.
[16] 李玉堂,杨昌云,李炎丹,等.超说明书用药的审核分级与综合处理[J].中国药房,2011,22(17):1574-1576.
Study on the Classification Management of Off-label Drug Use in Our Hospital
WANG Ying,TAN Xiangping,SITU Bing(Dept.of Pharmacy,the Third Hospital Affiliated to Guangzhou Medical University,Guangzhou 510150,China)
OBJECTIVE:To promote the normative management of clinical off-label drug use.METHODS:The degree of deviation from the drug instructions and the risk degree were comprehensively considered,and the off-label drug use were classified into three different situations for classifying approval and informed consent classifying;situation and effects after classifying were evaluated.RESULTS:The classifying included occasional or small amount off-label use on dosage and drugs solvent(the first),regular off-label use on route or administration(the second)and super-indications drug use with contraindications(the third).The approval was classified as follows as confirmed with signature by doctor,approved by medical department,approved by pharmaceutical committee and ethics committee accordingly;informed consent classifying were signing informed consent,informing and recording in medical record,informing orally.Off-label drug use approval process was officially initiated from Feb.2014 to Jun. 2016 in our hospital,51 off-label drug use applications from 13 clinical departments were received,with 16 items belonging to the second situation,35 items belonging to the third.Finally 42 applications were approved and 9 were not.No relevant new/serious adverse drug reactions/events occurred in process of the approved off-label drug use.And no off-label drug use not approved was found to continue to be used in our hospital.CONCLUSIONS:Classification management methods for off-label drug use in our hospital have shown high operability,improved the off-label drug use behavior of physicians.
Off-label drug use;Classification management;Approval;Informed consent
R95
A
1001-0408(2017)10-1306-05
2016-06-21
2016-09-20)
(编辑:刘 萍)
广东省科学技术厅科技发展专项资金项目(No. 2016A020218013);广州医科大学青年科研项目(No.2014A22)
*主管药师,硕士研究生。研究方向:临床药学。电话:020-81292702。E-mail:wy8611meng@163.com
#通信作者:主任药师,硕士。研究方向:临床药学、药物经济学。电话:020-81292050。E-mail:843234573@qq.com
DOI10.6039/j.issn.1001-0408.2017.10.03
