玄参多糖对正常生理小鼠和免疫低下状态小鼠免疫功能的影响Δ
2017-04-19李自辉董婉茹刘树民黑龙江中医药大学药物安全性评价中心哈尔滨150040
李自辉,张 宁,董婉茹,于 卉,刘树民(黑龙江中医药大学药物安全性评价中心,哈尔滨 150040)
玄参多糖对正常生理小鼠和免疫低下状态小鼠免疫功能的影响Δ
李自辉*,张 宁,董婉茹,于 卉,刘树民#(黑龙江中医药大学药物安全性评价中心,哈尔滨 150040)
目的:考察玄参多糖对正常生理小鼠和免疫低下状态小鼠免疫功能的影响。方法:将80只小鼠随机分为正常组,模型组,治疗高、中、低剂量组和生理高、中、低剂量组,每组10只。正常组和模型组小鼠ig蒸馏水(10 mL/kg),治疗高、中、低剂量组和生理高、中、低剂量组均按0.16、0.08、0.04 g/kg ig给药,每天1次,连续7 d;于给药第3天开始,模型组和治疗高、中、低剂量组小鼠分别ip环磷酰胺(100 mg/kg),连续4 d,复制免疫低下模型。采用碳廓清实验测定小鼠碳廓清指数和脏器(胸、脾)指数。另取80只小鼠分组、给药同上,采用绵羊红细胞致敏后测定其血清半数溶血值(HC50)。再另取80只小鼠分组、给药同上,采用1%二硝基氟苯法诱导小鼠迟发型变态反应测定其耳肿胀度,测定其血清中白细胞介素(IL)-2、IL-4、血清免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、γ-干扰素(IFN-γ)含量,并考察脾淋巴细胞的体外增殖情况。结果:高剂量玄参多糖可促进两种免疫状态下小鼠免疫器官及碳廓清指数的增长(P<0.05);增强小鼠迟发型变态反应的强度(HC50值升高)(P<0.01)及改善模型小鼠血清溶血素含量的降低(P<0.01);促进脾淋巴细胞增殖(P<0.05)及升高血清中IL-2、IL-4、IgG、IgM、IFN-γ含量(P<0.05或P<0.01)。结论:玄参多糖可增强正常生理和环磷酰胺所致免疫低下两种状态下小鼠的免疫功能。
玄参多糖;免疫功能;生理状态;免疫低下状态;小鼠
玄参为玄参科玄参属多年生草本植物玄参(Scrophularia ningpoensis Hemsl.)的干燥块根,是一种传统的中药,其中以浙江出产的玄参为佳品,公认为“浙八味”之一[1]。玄参味甘、苦、咸,性微寒,归肺、胃、肾经,有凉血滋阴、泻火解毒的作用,目前认为其主要的化学成分为环烯醚萜类、苯丙素类、黄酮类及芳香糖类等[2-3]。中药玄参能补虚劳损,临床常与潞党参合用,治疗阴气亏损、舌干无津、胃液消耗、口苦懒食[4]。近年来,已有大量关于中药多糖组分对免疫系统具有调节作用的报道,有研究表明玄参多糖具有一定抗疲劳和抗氧化作用[5-7],但鲜有关于其在不同状态下免疫调节功能和机制的研究。鉴于此,本研究通过对正常生理和环磷酰胺所致免疫低下两种状态的小鼠细胞免疫、体液免疫及非特异性免疫的综合评价,初步揭示玄参多糖对两种不同免疫状态小鼠免疫功能的调节特点,为今后的研究提供实验依据。
1 材料
1.1 仪器
UVmini-1240紫外-可见分光光度计(岛津国际贸易上海有限公司);AL204电子天平[梅特勒-托利多仪器(上海)有限公司];Anthos2010酶标仪(奥地利安图斯公司);KDC-160HR台式高速冷冻离心机(科大创新股份有限公司中佳分公司);Vert.A1倒置显微镜(德国Zeiss公司)。
1.2 药品与试剂
玄参多糖提取物(黑龙江中医药大学中医药研究院提供,批号:20130623012,多糖含量:>35%);白细胞介素2(IL-2)、IL-4、γ-干扰素(IFN-γ)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、肿瘤坏死因子α(TNF-α)酶联免疫吸附(ELISA)试剂盒(南京建成生物科技有限公司);印度墨汁(北京博奥拓达科技有限公司);绵羊红细胞(SRBC,石家庄华瑞创新生物科技开发中心);刀豆球蛋白A(ConA)、脂多糖(LPS)、二甲基亚砜(DMSO)均购自美国Sigma公司;DMEM高糖培养基(美国Hyclone公司);小牛血清(德国Capricorn公司)。
1.3 动物
ICR小鼠240只,SPF级,♀♂各半,体质量为18~22 g,由黑龙江中医药大学动物实验中心提供,许可证号:SCXK(黑)2013-004。适应性喂养3 d后进行实验,所有实验小鼠的使用和喂养严格遵照动物保护协会的规定进行。
2 方法
2.1 分组与给药
ICR小鼠240只随机分为3个部分(非特异性免疫实验、体液免疫实验、细胞免疫实验),每部分80只。将每部分的80只ICR小鼠随机分为8组,每组10只,即正常组,模型组,治疗高、中、低剂量组和生理高、中、低剂量组。其中,正常组和模型组小鼠ig给予蒸馏水,治疗高、中、低剂量组和生理高、中、低剂量组小鼠分别ig给予0.16、0.08、0.04 g/(kg·d)玄参多糖(分别为临床用药上限的4、2、1倍剂量)。各组小鼠均在每天上午9:00-10:00按照10 mL/(kg·d)ig相应溶液,每天1次,连续7 d。于第3天开始,模型组和治疗高、中、低剂量组小鼠分别按100 mg/(kg·d)ip环磷酰胺复制免疫低下模型,连续4 d。
2.2 非特异性免疫实验
各组小鼠于末次给药1 h后,尾iv 20%印度墨汁0.01 mL/g。分别于注射后2 min(t1)和6 min(t2)时眼静脉丛取血20 μL,立即加入2.0 mL 0.1%碳酸钠溶液中,充分摇匀后,于600 nm波长处测定其光密度(OD)值;以0.1%碳酸钠溶液作廓清指数的空白对照。小鼠颈椎脱臼处死,分别称定肝、胸腺和脾质量,计算廓清指数K、校正廓清指数(吞噬指数)α及脏器指数[8]:K=(lgOD1-=小鼠体质量/(肝质量+脾质量)脏器指数=脏器质量(g)/小鼠体质量(10 g)。
2.3 体液免疫实验
于给药第3天时,各组小鼠均ip 4%压积SRBC混悬液0.2 mL致敏,持续4 d。于末次给药1 h后,摘眼球取血,制备血清,用生理盐水将血清稀释200倍。取稀释后血清1.0 mL、4%压积SRBC混悬液0.5 mL、10%豚鼠血清1.0 mL(补体)于试管中,混匀;以等体积生理盐水代替小鼠血清作为空白对照。于37℃水浴30 min,取出后置于冰浴中终止反应,冷却后以离心半径为10.5 cm、1 500 r/min离心10 min。取上清液1.0 mL,加都氏液3.0 mL,混匀后静止10 min,然后于540 nm波长处测定吸光度;另取4%压积SRBC混悬液0.25 mL和都氏液3.75 mL于试管中,混匀,测定SRBC的半数溶血值(HC50)[9]。样品HC50=样品吸光度×200/SRBC的HC50。
2.4 细胞免疫实验
于第2天给药后,各组小鼠均腹部去毛,面积大小约为2 cm×2 cm。于腹部暴露皮肤处均匀涂抹1%二硝基氟苯(DNFB)50 μL,进行初次免疫,每天1次,连续致敏5 d;空白组小鼠涂抹丙酮和橄榄油。致敏小鼠于末次给药1 h后,再次于小鼠右耳正背两面均匀涂抹1%DNFB 10 μL进行抗原攻击,24 h后摘眼球取血,制备血清。采用ELISA法测定血清中IL-2、IL-4、IFN-γ、IgG、IgM水平。颈椎脱臼处死小鼠,剪下左右两耳,用8 mm打孔器在两耳相同部位打取耳片,称质量,测定耳肿胀度[耳肿胀度(mg)=右耳质量(mg)-左耳质量(mg)]和耳肿胀率[耳肿胀率(%)=耳肿胀度(mg)/左耳质量(mg)× 100%]。
2.5 脾淋巴细胞增殖能力测定
将“2.4”项下小鼠的脾脏在常规条件下制备成悬浊液,调整细胞密度为5×106mL-1。称取适量无菌尼龙绵装入注射器内,DMEM洗柱2次,加入脾细胞悬浊液,37℃孵育1 h后,用常温培养液淋洗3次,收集液离心,收集的沉淀即为T淋巴细胞。再将注射器放入4℃冷藏1 h,用4℃培养液冲洗,收集的悬浊液即为B淋巴细胞。经台盼蓝染色检测,细胞存活率>95%,说明可用于试验。将上述细胞按100 μL/孔接种于96孔板,孵育24 h后,T淋巴细胞孔分别加100 μL ConA(终质量浓度为5 μg/mL)以诱导细胞增殖,B淋巴细胞孔加100 μL LPS(终质量浓度为10 μg/mL)诱导细胞增殖,并另设加入培养基的空白对照孔,均设3个复孔。将培养板置于5%CO2、37℃条件培养44 h后,每孔加入MTT溶液20 μL,继续孵育4 h,弃上清液,加入DMSO溶液150 μL,充分振荡后静置10 min。采用酶标仪于570 nm波长处检测其OD值,计算脾淋巴细胞增殖率(%)[细胞增殖率(%)=(实验孔OD值-空白对照孔OD值)/空白对照孔OD值×100%]。
2.6 统计学方法
3 结果
3.1 非特异性免疫实验测定结果
与正常组比较,模型组小鼠的脾指数、胸腺指数、K以及α均显著降低(P<0.01),生理高剂量组小鼠各项指数均明显升高(P<0.05);与模型组比较,治疗高剂量组小鼠各项指数均显著升高(P<0.05),结果见表1。
表1 玄参多糖对正常生理小鼠和免疫低下状态小鼠非特异性免疫功能的影响(s,n=10)Tab 1 Effect of polysaccharides on nonspecific immune function in mice under normal physiological and hypoimmunical state(s,n=10)
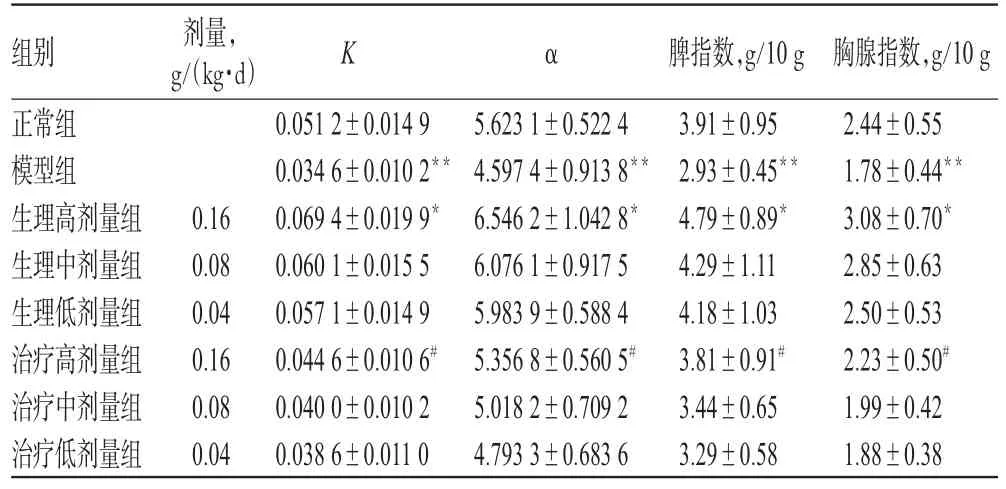
表1 玄参多糖对正常生理小鼠和免疫低下状态小鼠非特异性免疫功能的影响(s,n=10)Tab 1 Effect of polysaccharides on nonspecific immune function in mice under normal physiological and hypoimmunical state(s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05Note:vs.normalgroup,*P<0.05,**P<0.01;vs.model group,#P<0.05
胸腺指数,g/10 g 2.44±0.55 1.78±0.44**3.08±0.70*2.85±0.63 2.50±0.53 2.23±0.50#1.99±0.42 1.88±0.38组别正常组模型组生理高剂量组生理中剂量组生理低剂量组治疗高剂量组治疗中剂量组治疗低剂量组剂量,g/(kg·d)K α 0.16 0.08 0.04 0.16 0.08 0.04 0.051 2±0.014 9 0.034 6±0.010 2**0.069 4±0.019 9*0.060 1±0.015 5 0.057 1±0.014 9 0.044 6±0.010 6#0.040 0±0.010 2 0.038 6±0.011 0 5.623 1±0.522 4 4.597 4±0.913 8**6.546 2±1.042 8*6.076 1±0.917 5 5.983 9±0.588 4 5.356 8±0.560 5#5.018 2±0.709 2 4.793 3±0.683 6脾指数,g/10 g 3.91±0.95 2.93±0.45**4.79±0.89*4.29±1.11 4.18±1.03 3.81±0.91#3.44±0.65 3.29±0.58
3.2 体液免疫实验测定结果
与正常组比较,模型组小鼠的HC50明显降低(P<0.01),生理高剂量组小鼠的HC50明显升高(P<0.01);与模型组比较,治疗高、中剂量组小鼠的HC50明显升高(P<0.01),结果见表2。
表2 玄参多糖对正常生理小鼠和免疫低下状态小鼠体液免疫功能的影响(s,n=10)Tab 2 Effect of polysaccharides on humoral immune function in mice under normal physiological and hypoimmunical state(s,n=10)

表2 玄参多糖对正常生理小鼠和免疫低下状态小鼠体液免疫功能的影响(s,n=10)Tab 2 Effect of polysaccharides on humoral immune function in mice under normal physiological and hypoimmunical state(s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,#P<0.05,##P<0.01
HC50值,% 100.05±19.28 72.51±21.49**126.29±21.07**106.14±15.21 101.26±16.29 105.45±25.08##94.88±22.63#80.14±21.64组别正常组模型组生理高剂量组生理中剂量组生理低剂量组治疗高剂量组治疗中剂量组治疗低剂量组剂量,g/(kg·d)0.16 0.08 0.04 0.16 0.08 0.04
3.3 细胞免疫实验测定结果
3.3.1 对耳肿胀度和耳肿胀率的影响 与正常组比较,模型组小鼠耳肿胀度、耳肿胀率明显降低(P<0.01),生理高、中剂量组小鼠耳肿胀度、耳肿胀率明显升高(P<0.05或P<0.01);与模型组比较,治疗高剂量组小鼠的耳肿胀度、耳肿胀率显著升高(P<0.01),结果见表3。
表3 玄参多糖对正常生理小鼠和免疫低下状态小鼠耳肿胀度和耳肿胀率的影响(s,n=10)Tab 3 Effect of polysaccharides on cellular immune function in mice under normal physiological and hypoimmunical state(s,n=10)
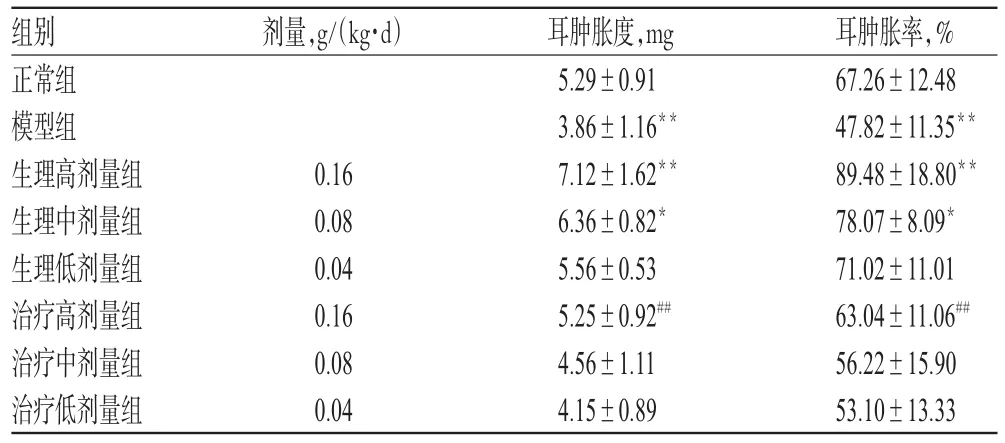
表3 玄参多糖对正常生理小鼠和免疫低下状态小鼠耳肿胀度和耳肿胀率的影响(s,n=10)Tab 3 Effect of polysaccharides on cellular immune function in mice under normal physiological and hypoimmunical state(s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,*P<0.05,**P<0.01;vs.model group,##P<0.01
耳肿胀率,% 67.26±12.48 47.82±11.35**89.48±18.80**78.07±8.09*71.02±11.01 63.04±11.06##56.22±15.90 53.10±13.33组别正常组模型组生理高剂量组生理中剂量组生理低剂量组治疗高剂量组治疗中剂量组治疗低剂量组剂量,g/(kg·d)0.16 0.08 0.04 0.16 0.08 0.04耳肿胀度,mg 5.29±0.91 3.86±1.16**7.12±1.62**6.36±0.82*5.56±0.53 5.25±0.92##4.56±1.11 4.15±0.89
3.3.2 对血清中生化指标的影响 与正常组比较,模型组小鼠血清中IFN-γ、IL-2、IL-4、IgG和IgM含量均明显减少(P<0.05或P<0.01),生理高剂量组小鼠血清中上述指标含量以及生理中剂量组小鼠血清中IgM含量均明显增加(P<0.05或P<0.01);与模型组比较,治疗高剂量组小鼠血清中上述指标含量以及治疗中剂量组小鼠血清中IL-2、IFN-γ、IgG和IgM含量均明显增加(P<0.05或P<0.01),结果见表4。
表4 玄参多糖对正常生理小鼠和免疫低下状态小鼠血清中IL-2、IL-4、IFN-γ、IgG和IgM含量的影响(s,n=10)Tab 4 Effect of polysaccharides on IL-2,IL-4,IFN-γ,IgG,IgM serum contents in mice under normalphysiologicaland hypoimmunical state(s,n=10)

表4 玄参多糖对正常生理小鼠和免疫低下状态小鼠血清中IL-2、IL-4、IFN-γ、IgG和IgM含量的影响(s,n=10)Tab 4 Effect of polysaccharides on IL-2,IL-4,IFN-γ,IgG,IgM serum contents in mice under normalphysiologicaland hypoimmunical state(s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal group,*P<0.05,**P<0.01;vs.model group,#P<0.05,##P<0.01
IgM,mg/mL 371.07±56.79 296.41±36.39**451.24±63.45**425.07±51.87*398.38±57.72 348.68±37.88##340.20±44.13#315.87±47.50组别正常组模型组生理高剂量组生理中剂量组生理低剂量组治疗高剂量组治疗中剂量组治疗低剂量组剂量,g/(kg·d)0.16 0.08 0.04 0.16 0.08 0.04 IL-2,pg/mL 16.58±3.10 12.93±2.94*19.54±2.12*18.17±1.95 17.80±2.37 16.23±2.01##15.69±2.70#14.94±3.34 IL-4,pg/mL 18.46±2.77 14.40±4.02*22.03±3.59*19.70±3.65 17.37±3.93 18.11±3.80#16.55±3.07 16.72±2.82 IFN-γ,pg/mL 21.19±2.34 17.34±2.56**24.37±3.87*21.21±2.29 20.52±1.43 20.34±1.98##19.48±1.34#17.40±1.94 IgG,mg/mL 4.22±0.55 3.57±0.36**4.84±0.37**4.54±0.31 4.39±0.47 4.05±0.38##3.97±0.42#3.89±0.35
3.4 脾淋巴细胞增殖能力测定结果
与正常组比较,模型组小鼠脾B淋巴细胞、T淋巴细胞增殖率明显降低(P<0.05或P<0.01),生理高剂量组小鼠脾T淋巴细胞增殖率明显升高(P<0.05);与模型组比较,治疗高剂量组小鼠脾B淋巴细胞、T淋巴细胞增殖率和治疗中剂量组小鼠脾B淋巴细胞增殖率均明显升高(P<0.05或P<0.01),结果见表5。
表5 玄参多糖对正常生理小鼠和免疫低下状态小鼠脾淋巴细胞增殖能力的影响(s,n=10)Tab 5 Effect of polysaccharides on splenic lymphocyte proliferation in mice under normal physiological and hypoimmunical state(s,n=10)
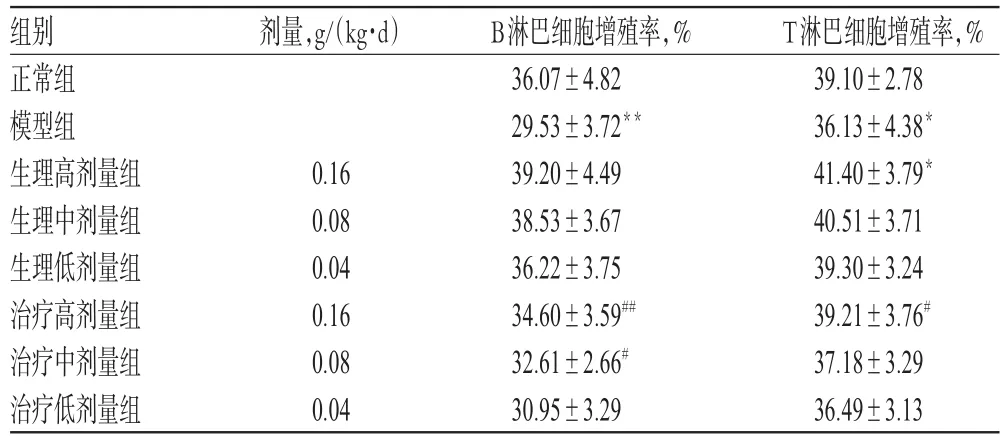
表5 玄参多糖对正常生理小鼠和免疫低下状态小鼠脾淋巴细胞增殖能力的影响(s,n=10)Tab 5 Effect of polysaccharides on splenic lymphocyte proliferation in mice under normal physiological and hypoimmunical state(s,n=10)
注:与正常组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal group,*P<0.05,**P<0.01;vs.model group,#P<0.05,##P<0.01
T淋巴细胞增殖率,% 39.10±2.78 36.13±4.38*41.40±3.79*40.51±3.71 39.30±3.24 39.21±3.76#37.18±3.29 36.49±3.13组别正常组模型组生理高剂量组生理中剂量组生理低剂量组治疗高剂量组治疗中剂量组治疗低剂量组剂量,g/(kg·d)0.16 0.08 0.04 0.16 0.08 0.04 B淋巴细胞增殖率,% 36.07±4.82 29.53±3.72**39.20±4.49 38.53±3.67 36.22±3.75 34.60±3.59##32.61±2.66#30.95±3.29
4 讨论
胸腺和脾是重要的外周免疫器官,机体的免疫应答主要以脾为主,T淋巴细胞分化的主要场所则以胸腺为主,影响机体溶血素的含量与巨噬细胞的分泌。碳粒廓清实验主要对能反映出清除血液中异物速率的吞噬细胞进行检测,是非特异性免疫的一个重要衡量指标[9-11]。本研究结果显示,玄参多糖可促进正常小鼠和免疫低下小鼠免疫器官的发育,刺激机体单核巨噬细胞分泌,这提示其对小鼠具有相应的预防(正常生理状态)与治疗(免疫低下状态)作用。
经小鼠体液免疫和细胞免疫的各项检测发现,玄参多糖不仅能升高生理或病理状态小鼠的脏器指数,还能增强小鼠的迟发型超敏反应能力。迟发型超敏反应是由T淋巴细胞经过2次相同抗原的刺激后产生免疫应答反应,释放出多种因子,并同时产生炎症因子。由于IL-2、IL-4是刺激和诱导B淋巴细胞增殖的重要因子,IgG、IgM是参与体液免疫并存在于淋巴细胞中最主要的免疫球蛋白,而IFN-γ是增强T细胞分化及自然杀伤细胞(NK细胞)活力的重要因子,所以本研究以其作为衡量T淋巴细胞、B淋巴细胞和NK细胞活力的客观判断指标[12-14]。本研究结果显示,玄参多糖能升高处于正常生理和免疫低下两种状态小鼠血清中IL-2、IL-4、IFN-γ、IgG、IgM含量,这提示玄参多糖免疫调节机制可能与T淋巴细胞、B淋巴细胞增殖和NK细胞活力提高的共同作用有关,但其具体机制的表达有待于进一步探索。
本课题组前期以盐酸左旋咪唑(40 mg/kg)为阳性药开展实验,结果显示玄参多糖高剂量组的上述指标多数趋近于阳性药的药效作用,部分略好于阳性药的作用。然而在本研究中,笔者重点在于比较玄参多糖对正常生理与免疫低下两种状态小鼠免疫功能的影响,而并非只是就玄参多糖与阳性药对小鼠的免疫调节作用进行简单对比,故在本研究中未设置阳性药物组。
本研究结果提示,玄参多糖高剂量对正常生理与免疫低下两种状态小鼠均具有显著的免疫增强作用。但玄参多糖中剂量组可提高两种状态的小鼠血清中IL-2、IFN-γ含量及改善迟发性免疫反应,增加血清中IgG、IgM的含量。从量效关系来看,玄参多糖0.04 g/kg可能是其最低有效剂量,随着剂量的增加,小鼠机体的免疫作用可能不断增强。但由于中药存在多药性、多靶点的特性,是一个复杂的系统,很难反映药物的整体作用规律;且一般药物在一定范围内药效会随着剂量的增加而增强,但超出一定范围后,药效很可能会降低或者消失,甚至产生毒副作用[15]。玄参多糖伴随着给药剂量的提高,是否符合上述规律,也有待进一步研究。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:117-118.
[2] 杜晓煌,方勇飞,李莉,等.玄参主要成分生物活性研究进展[J].中国药房,2015,26(15):2158-2160.
[3] 薛刚强,杜婧,潘新艳,等.玄参化学成分研究[J].中药材,2014,37(9):1597-1599.
[4] 邹霞,易萍,曹江,等.玄参多糖抗肿瘤作用的研究[J].中国医药指南,2015,13(10):69-70.
[5] 陈莉华,廖微,肖斌,等.玄参多糖体外清除自由基和抗氧化作用的研究[J].食品工业科技,2013,34(7):86-88.
[6] Gu WL,Chen CX,Wu Q,et al.Effects of Chinese herb medicine Radix Scrophulariae on ventricular remodeling [J].Pharmazie,2012,19(1):193-205.
[7] 段博文,李运,刘昕,等.柳茶多糖对小鼠免疫功能的影响[J].中国中药杂志,2010,35(11):1466-1468.
[8] 李厚兵,任爱农,彭蕴茹,等.野菊花多糖对小鼠免疫低下功能的保护作用[J].中国实验方剂学杂志,2012,18(13):223-225.
[9] 王艳红,王秋红,夏永刚,等.麻黄拆分组分的性味药理学评价:麻黄化学拆分组分的免疫抑制作用研究[J].中成药,2011,33(12):2044-2047.
[10] 雷霞,董文婷,笔雪艳,等.知母各化学拆分组分的抗炎及免疫调节活性[J].中药材,2015,38(9):1904-1907.
[11] Motoyoshi Y,Kaninoda K,Saitoh O,et al.Different mechanisms for anti-tumor effects of low-and high-dose cyclophosphamide[J].Oncol Rep,2006,16(1):141-146.
[12] Krüger K,Mooren FC.T cell homing and ecercise[J].Exerc Immunol Rev,2007,13(1):37-54.
[13] 杨杰,卫东锋,王文潇,等.五指毛桃水提物对免疫抑制小鼠细胞免疫的影响[J].中药药理与临床,2015,31(6):111-114.
[14] 李娜,于皎凌,姜素云,等.强壮灵合剂对小鼠免疫功能的影响[J].中成药,2015,37(4):862-864.
[15] 刘树民,张宁,周琦,等.药理药效法测定穿山龙总皂苷的药动学参数[J].中国实验方剂学杂志,2016,22(16):75-79.
Effect of Polysaccharides of Radix scrophulariae on Immune Functions in Mice under Normal Physiological and Hypoimmunical State
LI Zihui,ZHANG Ning,DONG Wanru,YU Hui,LIU Shumin(Drug Safety Evaluation Center,Heilongjiang University of Chinese Medicine,Harbin 150040,China)
OBJECTIVE:To study the effect of polysaccharides of Radix scrophulariae on immune function in mice under normal physiological and hypoimmunical state.METHODS:80 mice were randomly divided into normal group,model group,treatment high-dose,medium-dose,low-dose groups and physiological high-dose,medium-dose,low-dose groups,10 in each group. Mice in normal group and model group were received distilled water(10 mL/kg)intragastrically,treatment high-dose,mediumdose,low-dose groups and physiological high-dose,medium-dose,low-dose groups were administrated 0.16,0.08,0.04 g/kg drug,ig,once a day,for 7 d.From the third day,mice in model group and treatment high-dose,medium-dose,low-dose groups were respectively received cyclophosphamide(100 mg/kg),ip,for 4 d to induce hypoimmunical model.Carbon clearance test was adopted to determine the carbon clearance indexes and organs(chest,spleen)indexes of mice.Another 80 mice were grouped with the same administration,serum half hemolytic value(HC50)was determined after compressed Mianyang red blood cell sensitization.Then another 80 mice were grouped with the same administration,1%dinitrofluorobenzene method was used to induce delayed hypersensitivity in mice;its ear swelling was determined,as well as IL-2,IL-4,immunoglobulin G(IgG),immunoglobulin M(IgM),γ-interferon(IFN-γ)contents in serum,and the proliferation in vitro of splenic lymphocytes were detected.RESULTS:High-dose polysaccharides can promote the increasing of immune organ and carbon clearance indexes(P<0.05);enhance the intensity of delayed type hypersensitivity(HC50increasing)(P<0.01)and improve the decreasing of serum hemolysin in model mice(P<0.01);promote the splenic lymphocytes proliferation and increase IL-2,IL-4,IgG,IgM,IFN-γ contents in serum(P<0.05 or P<0.01).CONCLUSIONS:Polysaccharides can enhance the immune function in mice under normal physiological and hypoimmunical state induced by cyclophosphamide.
Polysaccharides;Immune function;Physiological state;Hypoimmunical state;Mice
R285
A
1001-0408(2017)10-1316-04
2016-08-22
2016-12-28)
(编辑:林 静)
国家重点基础研究发展计划“973”计划(No.2013CB531804)
*硕士研究生。研究方向:中药性味理论。电话:0451-82193278。E-mail:1831794073@qq.com
#通信作者:教授,博士生导师。研究方向:中药临床药效物质基础及中药药性理论。电话:0451-82193278。E-mail:lsm@hljucm.net
DOI10.6039/j.issn.1001-0408.2017.10.05
