龙葵果自然发酵过程中活性物质含量及体外抗氧化能力研究
2017-04-14李祎,王萍
李 祎,王 萍
(东北林业大学林学院,黑龙江哈尔滨 150040)
龙葵果自然发酵过程中活性物质含量及体外抗氧化能力研究
李 祎,王 萍*
(东北林业大学林学院,黑龙江哈尔滨 150040)
以龙葵果为原料,探讨龙葵果在分别添加红糖、蜂蜜以及绵白糖的条件下进行自然发酵,分析活性物质含量和体外抗氧化能力在发酵过程中的变化。实验结果表明,发酵60 d后三组龙葵果发酵物中总多酚、总黄酮、皂苷和原花青素含量显著升高(p<0.05),花色苷含量显著下降(p<0.05)。发酵60 d后红糖、蜂蜜及绵白糖三组的DPPH·清除能力分别提高14.68%、12.63%和10.26%(p<0.05);还原力分别提高81.9%、29.1%和34.2%(p<0.05)。相关性分析表明,还原力与总多酚含量具有极显著的正相关性(p<0.01),DPPH·清除率与总黄酮含量之间具有极显著的相关性(p<0.01)。发酵后蛋白酶和淀粉酶活力显著提高(p<0.05),多酚氧化酶活力显著降低(p<0.05)。经过综合比较三组龙葵果发酵物的生物活性物质含量、抗氧化能力和三种酶活力,得出添加红糖发酵得到的龙葵果发酵物功能性更显著。
龙葵果,自然发酵,体外抗氧化活性
龙葵(SolanumnigrumL.)为茄科(Solanaceas)茄属(Solanum)的一年生草本植物,又名黑星星、黑天天等[1]。近年来大量研究证明,龙葵果含有多糖、矿物质、维生素、色素、氨基酸等功能性成分,具有抗氧化、抗肿瘤、消炎抑菌、提高人体免疫力等功效[2]。
果蔬原料经过多种益生菌的发酵,不仅保存了果蔬原料中原有的营养物质,而且产生了新的生物活性物质和酶类,抗氧化能力有所提高[3-4]。经自然发酵的发酵饮品含有丰富的维生素、酶、矿物质和次生代谢产物等营养成分[5]。现已有文献报道,自然发酵过程中的微生物主要以乳酸菌、醋酸菌和酵母菌等益生菌为主[6-7],植物原料经益生菌发酵后发酵体系中的总多酚和有机酸等活性物质含量有所增加[4]。张惠香[8]等研究发现诺丽果自然发酵产物具有较强的抗氧化、抗菌和增强机体免疫力的功效。随着食品工业的发展,消费者越来越重视食品的功能性,期望可以通过食物来改善健康和预防疾病[9]。有研究表明,黄酮类物质含量与清除自由基能力显著相关[10],并且有文献报道[11],多酚类物质经微生物发酵后更易被人体利用,有益于人体健康。然而对食品发酵过程中的活性物质变化规律的研究相对较少,本研究的目的是研究活性物质在自然发酵过程中的变化,并比较其与抗氧化能力之间的相关性。
本实验以成熟龙葵果为原料,测定其自然发酵过程中总多酚、总黄酮、花色苷、原花青素、皂苷等活性物质的含量及龙葵果发酵物的抗氧化能力变化,通过相关性分析研究各指标对抗氧化活性的贡献,探讨龙葵果发酵物在自然发酵前后的变化规律,为龙葵果资源的进一步开发提供依据。
1 材料与方法
1.1 材料与仪器
龙葵果 2015年9月下旬采于哈尔滨市郊;红糖、绵白糖、蜂蜜 市售,均为食品级;DPPH Sigma公司;其他试剂 均为分析纯。
单人无菌操作台 北京东联哈尔仪器制造有限公司;HR600型榨汁机 飞利浦电子香港有限公司;PHS-3C型精密pH计 上海精密仪器有限公司;TU-1810型PC 722s分光光度计 上海精密实验仪器有限公司;TDL-5台式离心机 上海科兴仪器有限公司;DK-S12电热恒温水浴锅 上海森信实验仪器有限公司。
1.2 实验方法
1.2.1 龙葵果自然发酵物的制备 将成熟的新鲜龙葵果去梗,并用无菌水轻轻冲洗掉表面的尘土及杂质,在无菌条件下晾干表面水分。选用市面常见红糖、蜂蜜和绵白糖为碳源,使用前紫外杀菌30 min。在无菌条件下向已灭菌的玻璃瓶中,按质量比1∶1∶3的比例加入已破碎的龙葵果、碳源和无菌饮用水。将玻璃瓶封口,25 ℃恒温避光发酵60 d。每组做3份平行实验。在发酵过程中,每隔5 d在无菌条件下从各个实验组中取样,将样品于10000 r/min离心5 min,取上清液备用。
1.2.2 龙葵果发酵物活性物质测定
1.2.2.1 总多酚含量的测定 采用Folin-Ciocalteu法[12]。100 μL适当稀释后的样品加入试管中,加水7 mL,摇匀,再加0.5 mL福林试剂,1 min之后,加入1.5 mL 20%碳酸钠溶液,混匀后加入0.9 mL蒸馏水。于25 ℃水浴条件下避光反应1 h。在765 nm波长下测定吸光值,结果用没食子酸当量表示。每份样品平行测定3次取平均值。
1.2.2.2 总黄酮含量的测定 根据文献[13]的方法测定,略有改动。0.5 mL的样品加入30%的乙醇至5 mL,加入0.3 mL 5% NaNO2,摇匀。6 min后加入0.3 mL 10%硝酸铝,摇匀静置6 min后加入1.0 mol/L的氢氧化钠4 mL,反应15 min后于510 nm波长下测定吸光值,结果用芦丁当量值表示。每组样品平行测定3次取平均值。
1.2.2.3 花色苷含量的测定 采用pH示差法[14]。分别移取1 mL样品于试管中,用pH1.0、4.5的缓冲溶液定容到10 mL,置于暗处反应达平衡后(pH1.0为50 min,pH4.5为80 min)分别在510、700 nm波长下测定吸光值,根据公式(1)计算花色苷含量。每组样品平行测定3次取平均值。

式(1)
其中,A-吸光度,A=(A510 nmpH1.0-A700 nmpH1.0)-(A510 nmpH4.5-A700 nmpH4.5);ε-矢车菊花素-3-葡萄糖苷的消光系数,26900;DF-稀释因子;M-矢车菊-3-葡萄糖苷的分子量,449.2。
1.2.2.4 原花青素含量的测定 根据文献[15]的方法测定。移取0.5 mL样品于试管中,依次加入2.5 mL 4%香草醛-甲醇溶液和2.5 mL 30%浓硫酸-甲醇溶液,摇匀,于30 ℃水浴条件下避光反应20 min。用甲醇代替样品作为空白对照,在500 nm波长下测定反应体系的吸光值,结果用儿茶酚当量值表示。每组样品平行测定3次取平均值。
1.2.2.5 皂苷含量的测定 采用香草醛-冰醋酸法[16],略做改动。取一定量样品于10 mL具塞试管中,70 ℃水浴挥干溶剂,加入0.2 mL新配制的5%(w/v)香草醛-冰乙酸溶液和0.8 mL高氯酸,摇匀,60 ℃水浴25 min,取出置于冷水浴中终止反应15 min,加入5 mL冰乙酸,混匀,放置10 min,以不加样品的溶液做空白对照,在465 nm波长测定各样品吸光度。以薯蓣皂苷元作为标品,制作皂苷的标准曲线。每组样品重复3次测定取平均值。
1.2.3 龙葵果发酵物体外抗氧化能力的测定
1.2.3.1 还原力测定 采用铁氰化钾法[17],略作改动。依次加入50 μL样品、2.5 mL磷酸盐缓冲液(0.2 mol/L,pH6.6)和2.5 mL 1%铁氰化钾,摇匀后置于50 ℃水浴20 min。加入2.5 mL 10%三氯乙酸,摇匀,静置5 min。4000 r/min离心10 min,取上清液2.5 mL,加入2.5 mL蒸馏水和0.5 mL 0.1%三氯化铁。30 min后,于700 nm波长下测定吸光值。每组样品平行测定3次取平均值。结果以吸光值表示,吸光值越高,则表示还原力越强。
1.2.3.2 DPPH·清除率测定 DPPH·清除率的测定根据参考文献[14]的方法测定。移取50 μL样品加入0.1 mmol/L DPPH-乙醇溶液4 mL,避光反应30 min,以去离子水为参比,在517 nm波长下测定吸光值;对照组用4 mL无水乙醇代替0.1 mmol/L DPPH-乙醇溶液,空白组用50 μL无水乙醇代替样品,测定吸光值,根据公式(2)计算清除率。每组样品平行测定3次取平均值。

式(2)
其中,A1-样品组吸光值;A2-对照组吸光值;A3-空白组吸光值。
1.2.4 龙葵果发酵物中酶活力测定
1.2.4.1 蛋白酶活力测定 根据文献[18]的方法测定蛋白酶活力。取0.5 mL待测样品于试管中,加入2 mL 2%的干酪素,于37 ℃准确水浴10 min后迅速加入5 mL 0.4 mol/L三氯乙酸,摇匀后静置20 min,3000 r/min离心10 min。取1 mL滤液加入5 mL 0.55 mmol/L的碳酸钠溶液,加入1 mL福林酚试剂(稀释10倍)。30 min后测定OD660。定义每毫升酶液作用于底物,每分钟增加1 μg酪氨酸为一个酶活单位(IU)。
1.2.4.2 淀粉酶活力测定 根据文献[18]的方法测定淀粉酶活力。取1 mL溶于0.4 mol/L pH4.8醋酸缓冲液的可溶性淀粉于试管中,加入1 mL待测样品,于37 ℃水浴10 min后,加热灭活。适当稀释后,取2 mL稀释后样品加入DNS显色液1.5 mL,混匀后进行沸水浴5 min,取出后迅速冷却至室温。用蒸馏水定容到25 mL,摇匀。在520 nm波长下测定吸光值。以灭活酶液作为空白,计算葡萄糖增加量。定义每毫升酶液作用于底物,每分钟水解释放1 μg葡萄糖为1个酶活单位(IU)。
1.2.4.3 多酚氧化酶活力测定 取0.5 mL pH7.0的磷酸盐缓冲液,加入2 mL 0.02 mol/L邻苯二酚,于37 ℃水浴10 min,加入0.5 mL待测液,于37 ℃水浴处理5 min后,迅速在420 nm波长下测定OD值,每组平行测定3次。将每毫升酶液反应后每分钟吸光值变化(ΔA420)0.001定义为1个酶活单位(IU)。
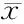
2 结果与分析
2.1 龙葵果发酵物活性物质含量变化
2.1.1 龙葵果发酵过程中总多酚含量的变化 由图1可知,三组龙葵果发酵物经自然发酵60 d后,与发酵前相比总多酚含量均显著增加(p<0.01)。实验前测定了三种碳源的总多酚含量,使用的红糖中总多酚含量为(0.317±0.01) mg/g,而蜂蜜与绵白糖中总多酚含量未测出。由于红糖相对于蜂蜜与白糖来说,酚类物质含量更多,并且其中含有的微量元素和其他营养物质更符合微生物生长代谢的需要[19]。因此,发酵开始0 d时红糖组的总多酚含量显著高于蜂蜜组及绵白糖组。红糖组在发酵35~45 d总多酚含量呈缓慢上升趋势,在45 d总多酚含量最高达到(2.48±0.03) mg/mL,是发酵初始总多酚含量的2.8倍,50~60 d总多酚含量有所下降,但含量下降差异不显著(p>0.05)。不考虑红糖本身带入的酚类物质,只比较在发酵过程中总多酚的增加量,发现红糖组发酵前后总多酚含量增加(1.28±0.07) mg/mL,显著高于(p<0.05)蜂蜜组总多酚含量增加量(0.85±0.03) mg/mL和绵白糖组增加量(0.64±0.06) mg/mL。现已有文献报道,自然发酵过程中主要以乳酸菌、醋酸菌和酵母菌等益生菌的代谢为主[6-7],Hur等[3]总结发现当乳酸菌控制发酵时,可将分子量较高的酚类化合物降解成简单的酚类。Filannino[11]等的研究证明了在微生物发酵过程中复杂的大分子酚类物质经乳酸菌代谢生成各种小分子酚类,如绿原酸会分解成咖啡酸和奎宁酸,使体系中总多酚含量增加。这是自然发酵前后各组总多酚含量增加的主要原因。

图1 发酵过程中总多酚含量变化Fig.1 Changes in the contents of total polyphenols during fermentation
2.1.2 龙葵果发酵过程中总黄酮含量的变化 如图2所示,龙葵果发酵物在发酵过程中总黄酮的含量略有升高,三组总黄酮含量的增加量均在0.2~0.3 mg/mL,与发酵0 d时总黄酮含量相比差异显著(p<0.05)。发酵0 d时,红糖组总黄酮含量最高,可能是由于加入的红糖中含有少量的黄酮类物质导致的。实验前测定了三种碳源的总黄酮含量,使用的红糖中总黄酮含量为(1.12±0.05)μg/g,蜂蜜中总黄酮含量为(0.38±0.04)μg/g,绵白糖中总黄酮未测出,三种碳源对发酵0 d的样品总黄酮含量均无显著影响(p>0.05),故不考虑碳源所带入的总黄酮含量。
红糖组总黄酮含量最高,且在发酵35 d时达到最高水平(1.57±0.04) mg/mL,显著高于发酵0 d的总黄酮含量,35 d之后总黄酮含量变化无显著差异(p>0.05);绵白糖组次之,在发酵35 d时含量最高为(1.25±0.02) mg/mL;蜂蜜组含量最低,在45 d时含量达到最高为(0.81±0.04) mg/mL,发酵50~60 d其含量变化无显著差异(p>0.05)。Hur等[3]指出水果或者谷物发酵过程中微生物产生的酶类,如淀粉酶、纤维素酶、几丁质酶、植酸酶及α-葡萄糖苷酶等可以分解植物细胞壁基质,促进黄酮的释放,这是总黄酮含量稍有升高的主要原因。
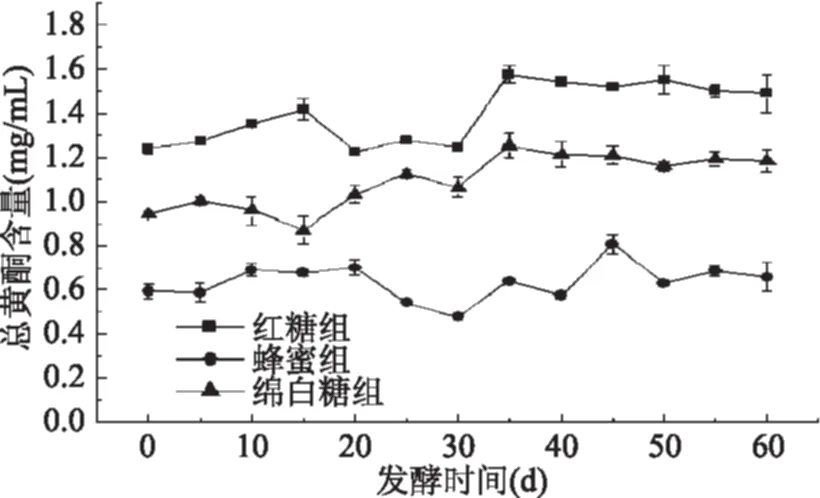
图2 发酵过程中总黄酮含量的变化Fig.2 Changes in contents of total flavonnoids during fermentation
2.1.3 龙葵果发酵过程中花色苷含量的变化 根据图3所示,随发酵时间延长,三组花色苷含量逐渐降低。红糖组、蜂蜜组及绵白糖组花色苷发酵60 d后含量与发酵前相比含量分别下降51.23%、54.43%和50.76%。因为花色苷是一类化学性质活泼的物质,在加工和贮藏的过程中容易造成损失,但可以通过结合多酚或黄酮类等具有辅色作用的物质来提高自身稳定性。实验结果显示,在龙葵果发酵物的发酵过程中总多酚及总黄酮含量都有所升高,因此增高了花色苷的稳定性,并且非酰化的花色苷在发酵前期发生的氧化、聚合反应中褪色[20],性质较为稳定的酰化的花色苷被保留下来[21],因此在发酵30 d后花色苷含量基本维持稳定。
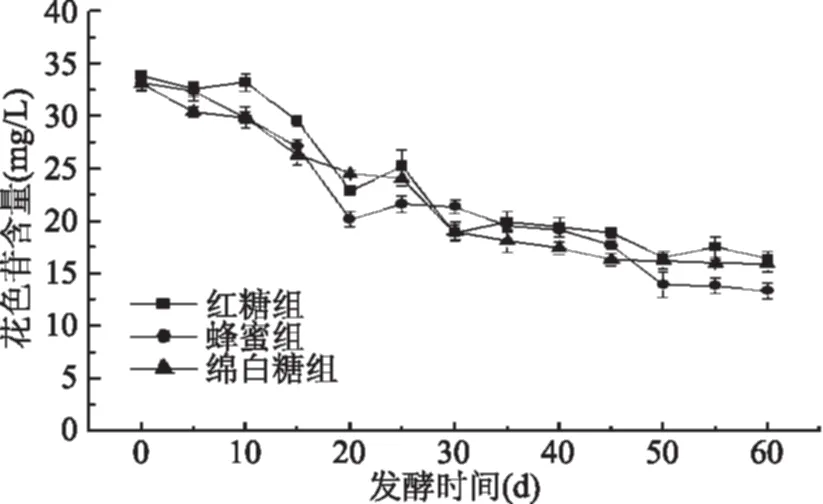
图3 发酵过程中花色苷含量的变化Fig.3 Changes in contents of total anthocyanins during fermentation
2.1.4 龙葵果发酵过程中原花青素含量的变化 龙葵果在发酵过程中原花青素的含量变化如图4所示。
图4 发酵过程中原花青素含量的变化Fig.4 Changes in content of procyanidine during fermentation
实验前测定了三种碳源的原花青素含量,使用的红糖中原花青素含量为(0.99±0.05) mg/g,对发酵0 d的样品原花青素含量影响显著(p<0.05);蜂蜜和绵白糖中原花青素未测出。根据图4所示,发酵60 d后与发酵前相比原花青素的含量显著增加(p<0.05),红糖组的含量先增加之后在发酵30 d时基本稳定,发酵60 d后含量为(1.17±0.01) mg/mL,发酵前后增加了(0.37±0.05) mg/mL。蜂蜜组在发酵前期并无明显增加,之后在35 d时开始明显升高,55 d时达到最高(0.75±0.03) mg/mL,60 d时发酵与0 d相比增加了(0.41±0.04) mg/mL。绵白糖组在发酵前35 d原花青素含量持续升高,之后基本稳定,发酵60 d后含量增加(0.545±0.05) mg/mL。比较三组原花青素增加量发现,绵白糖组>蜂蜜组>红糖组。
2.1.5 龙葵果发酵过程中皂苷含量的变化 龙葵果在发酵过程中皂苷含量的变化如图5所示。
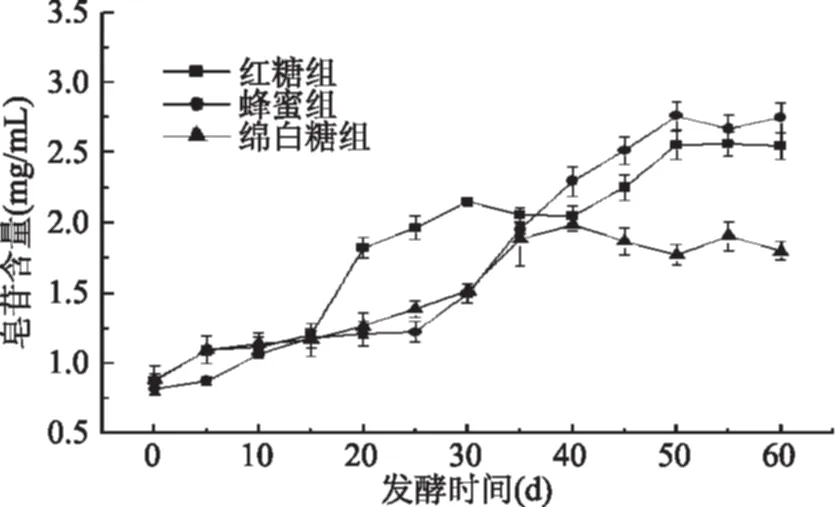
图5 发酵过程中皂苷含量的变化Fig.5 Changes in content of saponin during fermentation
三种碳源中皂苷含量均未检出,故不考虑碳源带入的皂苷对发酵液结果的影响。如图5所示,三组龙葵果发酵物在发酵60 d后皂苷含量均显著增加(p<0.05),红糖组皂苷含量发酵前后增加(1.67±0.11) mg/mL,蜂蜜组皂苷含量增加(1.93±0.11) mg/mL,绵白糖组发酵前后含量增加(0.92±0.12) mg/mL。由图5可以看出蜂蜜组含量增量最高,绵白糖组在发酵40 d后含量不再增加。
2.2 龙葵果发酵过程中体外抗氧化能力的变化
2.2.1 龙葵果发酵过程中总还原力变化 由于三种碳源中含有一定量的活性物质,为排除碳源的干扰,在实验前分别测定了三种碳源的还原力,发现三种碳源的还原力无显著差异(p>0.05),故不考虑碳源对发酵液还原力的影响。发酵过程中龙葵果发酵产物还原力变化如图6所示,发酵60 d后三组龙葵果发酵物还原力均显著提高(p<0.05),这是由于总多酚、原花青素等抗氧化物质含量增加的原因。发酵60 d后,红糖组的还原力显著高于其他两组(p<0.05),在第55 d时抗氧化性最高,是发酵之前的2.17倍。蜂蜜组、绵白糖组还原力分别提高了29.11%、34.26%。由于酚类物质和黄酮都是优良的抗氧化剂,并且都作为金属螯合剂发挥作用[3]。随着发酵的进行,三组样品总多酚和总黄酮含量均显著增加(p<0.05),这可能是三组样品发酵60 d后还原力显著提高的原因。
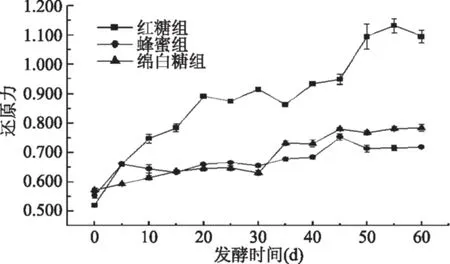
图6 发酵过程中龙葵果发酵产物还原力变化Fig.6 Changes in reducing power of Solanum nigrum fruits during fermentation
2.2.2 龙葵果发酵过程中清除DPPH·能力变化 龙葵果发酵过程中清除DPPH·能力的变化趋势如图7所示。

图7 发酵过程中龙葵果发酵产物DPPH·的清除作用变化Fig.7 Changes in DPPH value of Solanum nigrum fruits duringfermentation
同样为排除碳源的干扰,在实验前分别测定了三种碳源的DPPH·清除率,发现三种碳源的DPPH·清除率无显著差异(p>0.05),故不考虑碳源对发酵液DPPH·清除率的影响。由图7可以看出,三组龙葵果发酵物清除DPPH·的能力都是先增加后稍微降低最终维持在一定水平。红糖组在第15 d时清除率最高达到76.84%±1.40%,随后稍有降低,最终维持在69%左右,相较发酵之前提高了14.68%。蜂蜜组也在第15 d时清除率达到55.04%±0.26%,最终稳定在53.5%左右,与发酵之前相比提高了12.63%。绵白糖组的清除率持续增长,60 d时达到45.21%±0.29%,与发酵前相比提高了10.26%。三组样品清除DPPH·能力依次为红糖组>蜂蜜组>绵白糖组。

表1 活性物质含量间的相关系数
注:“*”表示相关性显著(p<0.05);“**”表示相关性极显著(p<0.01);表2同。

表2 抗氧化能力与活性物质之间的相关系数
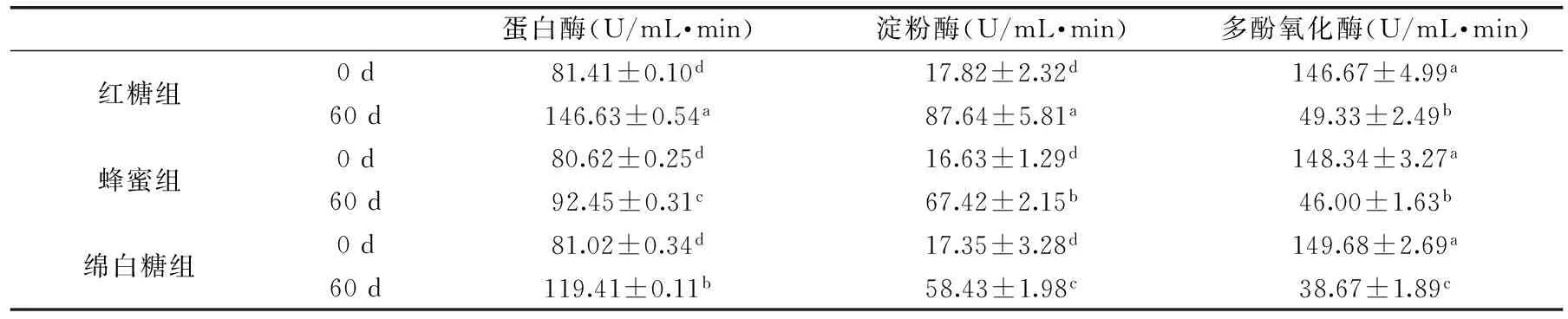
表3 发酵前后三种酶活力的比较
注:同列不同字母表示差异性显著,p<0.05。
2.3 相关性分析
如表1所示,总多酚含量与原花青素、总黄酮、皂苷含量都有极显著的正相关性(p<0.01),且与原花青素相关性最强,相关系数为0.881(p<0.01),说明在发酵过程中微生物代谢积累原花青素是导致总多酚含量的增加的主要原因。总黄酮含量也与原花青素含量极显著相关(p<0.01),相关系数为0.876,说明发酵过程中原花青素含量增加是也黄酮类化合物含量增加的主要原因。
龙葵果发酵物中相关活性物质含量与抗氧化能力之间的相关系数如表2所示。
如表2所示,龙葵果发酵物的还原力与各种活性物质之间都有极显著的相关性(p<0.01),其中与总多酚之间的相关性强于其他物质含量,相关系数为0.887。从表2可以看出DPPH·清除率与活性物质含量之间相关性不强。DPPH·清除率与总黄酮、原花青素含量之间显著相关(p<0.01),但相关性较弱。这说明龙葵果发酵物的DPPH·清除率是由多种生物活性物质共同作用的。
2.4 龙葵果发酵物中酶活力的测定
蛋白酶和淀粉酶都属于消化酶类,据文献[22]报道消化酶类可以作为食品补充剂添加到功能食品中,提高产品的助消化功能。由表3可以看出,三组发酵物中的蛋白酶、淀粉酶酶活力均显著升高(p<0.05),说明发酵后样品助消化能力增强,且发酵60 d样品红糖组显著高于(p<0.05)其他两组。多酚氧化酶会引起果蔬原料的酶促褐变,使多酚物质氧化,影响食品的营养及风味,发酵前后多酚氧化酶酶活力显著降低(p<0.05),说明经过自然发酵后发酵液的稳定性增强。
3 结论
添加三种不同碳源的龙葵果发酵60 d后,经比较红糖组总多酚增量、总黄酮含量及皂苷增量均显著高于(p<0.05)其他两组;同时,发酵物还原力及清除DPPH·能力也显著高于(p<0.05)其他两组,综合来看,红糖作为自然发酵的碳源可以使龙葵果发酵产物具有更佳的抗氧化功能。
为进一步确定各种活性物质对抗氧化的贡献,对实验结果进行了相关性分析。还原力与总多酚含量相关性最强(r=0.887);各种活性物质含量与DPPH·清除率间不存在相关性或相关性较弱,说明龙葵果发酵物的DPPH·清除率是由多种生物活性物质共同作用的结果。
三组发酵物中的蛋白酶、淀粉酶酶活力均显著升高(p<0.05),多酚氧化酶酶活力显著降低(p<0.05),说明经过自然发酵后发酵液的助消化能力及体系的稳定性增强。发酵60 d后,红糖组的蛋白酶及淀粉酶活力最高。
显然,比较三种碳源自然发酵60 d后的样品,红糖更适合作为龙葵果自然发酵的碳源,得到的发酵产物具有更显著的功能。然而,在发酵过程中活性物质转化的机理及发酵过程中的主要微生物尚需进一步探究。
[1]腾飞. 龙葵果花色苷分离、降解特性及体外抗氧化活性研究[D]. 哈尔滨:东北林业大学,2015.
[2]王晓英,王磊,段连海,等. 野生龙葵果在食品行业中的应用与进展[J]. 饮料工业,2014,17(1):40-43.
[3]Hur S J,Lee S Y,Kim Y C,et al. Effect of Fermentation on the Antioxidant Activity in Plant-based Foods[J]. Food Chemistry,2014,43(160):346-356.
[4]Dulf F V,Vodnar D C,Dulf E H,et al. Total Phenolic Contents,Antioxidant Activities,and Lipid Fractions from Berry Pomaces Obtained by Solid-State Fermentation of Two SambucusSpecies with Aspergillus niger[J]. Journal of Agricultural and Food Chemistry,2015,13(63):3489-3500.
[5]蒋增良. 天然微生物酵素发酵机理、代谢过程及生物活性研究[D]. 杭州:浙江理工大学,2013.
[6]Aguiar F,Menezes V,Rogez H. Spontaneous Postharvest Fermentation of Açai(Euterpe oleracea)Fruit[J]. Postharvest Biology and Technology,2013,86:294-299.
[7]Chakravorty S,Bhattacharya S,Chatzinotas A,et al. Kombucha Tea Fermentation:Microbial and Biochemical Dynamics[J]. International Journal of Food Microbiology,2016,220:63-72.
[8]张惠香,陈锦树,林金源. 诺丽果发酵产物对BALB/c小鼠脾脏细胞Th1/Th2细胞激素分泌之影响[J]. 台湾营养学会杂志,2007,32(1):30-36.
[9]Marsh A J,Hill C,Ross R P,et al. Fermented Beverages with Health-promoting Potential:Past and Future Perspectives[J]. Trends in Food Science and Technology,2014,38:113-124.
[10]Escudero-López B,Cerrillo I,Herrero-Martín G,et al. Fermented Orange Juice Source of Higher Carotenoid and Flavanone Contents[J]. Journal Agriccultuel and Food Chemistry,2013,61(37):8773-8782.
[11]Filannino P,Bai Y,Cagno R D,et al. Metabolism of Phenolic Compounds byLactobacillusspp. during Fermentation of Cherry Juice and Broccoli Puree[J]. Food Microbiology,2015,46:272-279.
[12]Li H,Wang X Y,Li Y,et al. Polyphenolic compounds and antioxidant properties of selected China wines[J]. Food Chemistry,2009,112(2):454-460.
[13]Dewanto V,Wu X,Adom K K. Thermal Processing Enhances the Nutritional Value of Tomatoes by Increasing Total Antioxidant Activity[J]. Journal of Agricultural and Food Chemistry,2002,50(10):3004-3010.
[14]Sun J,Yao J,Huang S,et al. Antioxidant activity of polyphenol and anthocyanin extracts from fruits ofKadsuracoccinea(Lem.)A.C. Smith[J]. Food Chemistry,2009,117(2):276-281.
[15]郑洪亮. 红皮云杉球果原花青素分离纯化、配合物及体外抗氧化研究[D]. 哈尔滨:东北林业大学,2014.
[16]向萍,王玉华,张秀艳,等. 蒙药参竹精片总皂苷的含量及抗氧化研究[J]. 现代中药研究与实践,2015,29(6):58-61.
[17]Sabokbar N,Khodaiyan F. Total Phenolic Content and Antioxidant Activities of Pomegranate Juice and Whey Based Novel Beverage Fermented by Kefir Grains[J]. Journal of Food Science and Technology,2016,53(1):47-739.
[18]Han S S,Hur S J,Lee S K. A Comparison of Antioxidative and Anti-inflammatory Activities of Sword Beans and Soybeans Fermented with Bacillus subtilis[J].Food and Function,2015,6(8):48-2736..
[19]何洁. 红糖及其产品开发[J]. 轻工科技,2013,11:21-22,56.
[20]Suh H J,Noh D O,Kang C S,et al. Thermal Kinetics of Color Degradation of Mulberry Fruit Extract[J]. Nahrung/Food,2003,47(2):132-135.
[21]陈媛. 桑椹生理活性成分在发酵过程中的变化[D]. 重庆:西南大学,2013.
[22]胡学智. “酵素”和酶的辨异—论酶和“酵素”制品的保健功能[J]. 工业微生物,2016,46(2):60-68.
权威·核心·领先·实用·全面
Study on active ingredients and antioxidant activityinvitroofSolanumnigrumfruits spontaneous fermentation
LI Yi,WANG Ping*
(School of Forestry,Northeast Forestry University,Harbin 150040,China)
This study was carried out to analyzed some active ingredients fromSolanumnigrumfruits spontaneous fermentation with brown sugar,honey and soft sugar respectively,and evaluated the ferments antioxidant capacityinvitro. The results showed that the contents of total polyphenols,total flavonoids,saponin and proanthocyanidins increased significantly(p<0.05),the contents of anthocyanins decreased significantly(p<0.01)after 60 days fermentation. Meanwhile,the scavenging DPPH· capacity ofSolanumnigrum-ferment with brown sugar,honey,and soft sugar increased by 14.68%,12.63%,and 10.26%(p<0.05)respectively,and the reducing power of three groups increased by 81.9%,29.1%,and 34.2%(p<0.05)respectively. Correlation analysis showed significant positive correlation(p<0.01)between reducing power and total polyphenols contents,and between the scavenging DPPH·capacity and contents of flavonoid. Furthermore,the activity of protease and amylase was significantly increased(p<0.05),and the activity of polyphenol oxidase was significantly decreased(p<0.05)after 60 days fermentation. The results suggested theSolanumnigrum-ferment with brown sugar was better than with honey or soft sugar.
Solanumnigrumfruits;spontaneous fermentation;antioxidant activityinvitro
2016-09-22
李祎(1992-),女,硕士研究生,研究方向:食品发酵工程,E-mail:lanny924@sina.com。
*通讯作者:王萍(1964-),女,博士,教授,主要从事功能食品研究与开发方面的研究,E-mail:wangpingnefu@126.com。
卓越农林人才教育培养计划改革试点项目(41110211)。
TS201.3
A
1002-0306(2017)06-0207-06
10.13386/j.issn1002-0306.2017.06.031
