壳聚糖溶解行为及溶液特性的探究
2017-04-14牛培阳张立彦
牛培阳,张立彦
(华南理工大学食品科学与工程学院,广东广州 510640)
壳聚糖溶解行为及溶液特性的探究
牛培阳,张立彦*
(华南理工大学食品科学与工程学院,广东广州 510640)
本实验主要测定了四种不同脱乙酰度、分子量的壳聚糖样品在浓度6%~12%,50 ℃下,定时滴加盐酸过程中溶液透光率、电导率、粘度和颗粒状态的变化,探索壳聚糖的溶解规律及溶液特性。结果表明:当盐酸浓度在0.23~0.39 mol/L时,壳聚糖浓度在6%~10%时,壳聚糖溶液透光率急剧上升;壳聚糖浓度越高,脱乙酰度越高,导致透光率急剧上升的起始盐酸浓度越高;分子量越小,加酸后,溶液最终透光率越高;随着酸的不断添加,壳聚糖溶液电导率先均匀小幅增加,盐酸超过一定浓度后增幅超过10 ms/cm,推测此时壳聚糖分子近乎完全质子化,壳聚糖脱乙酰度越高,溶液电导率大幅增加对应的盐酸浓度也越高;1#、2#、3#、4#壳聚糖溶液浓度为8%时,分别在盐酸浓度为0.29、0.29、0.34、0.34 mol/L时粘度最大,之后随加酸进行溶液粘度骤降;温度升高溶液粘度降低,但溶液粘度随盐酸浓度变化的规律不变;显微观察发现,随着加酸溶液中壳聚糖颗粒数显著减少,壳聚糖脱乙酰度越高,使颗粒全部崩解所需要的盐酸浓度越高,在颗粒全部崩解阶段溶液透光率、电导率剧烈变化,均显著升高。
壳聚糖,溶解行为,溶液特性,盐酸
壳聚糖在食品[1-2]、化工[3]、医药[4-6]等行业有广泛应用,但其分子量较大,不溶于水,即使在酸中以较低的浓度溶解,其粘度也非常大,极大限制了其应用。
壳聚糖溶液受溶剂种类及浓度、溶质浓度、离子强度、温度、脱乙酰度等各种因素的影响,最直观表现为粘度的变化。Calero和Hwang等[7-8]都发现只有壳聚糖浓度非常低时,才符合牛顿流体行为。Chen等[9]发现溶液pH相同、溶剂阴离子类型不同,会导致壳聚糖溶液粘度不同,这可能是质子化的氨基中和效应、阴离子位阻效应不同引起的。目前大多关于壳聚糖溶液的研究一般以充分溶解的低浓度壳聚糖溶液为研究对象,没有报道涉及浓度高于6%的壳聚糖溶液及其溶解过程的研究。而工业生产壳寡糖通常采用浓度高达8%~10%的壳聚糖为底物进行降解反应,如果能把底物浓度增大至12%,将极大提高工厂生产效率。因此,本文拟探索高浓度壳聚糖溶液溶解过程中透光率、电导率、粘度、显微结构的变化规律,以及溶解条件(壳聚糖浓度、脱乙酰度、温度等)对上述参数的影响,以便能够更全面地了解壳聚糖的溶解行为,为提高壳聚糖的浓度、认识壳聚糖溶液的特性变化、充分了解壳聚糖溶液的实际应用特性奠定基础。
1 材料与方法
1.1 材料与仪器
壳聚糖 购自长龙生物科技有限公司,1#,脱乙酰度(DD)75.57%,分子量164350 Da;2#,DD79.25%,140562 Da;3#,DD83.24%,136857 Da;4#,DD89.98%,118132 Da;盐酸 广东光华化学厂有限公司;冰乙酸 江苏强盛化工有限公司;无水乙酸钠 天津市福晨化学试剂厂;以上试剂均为分析纯。
0.6~0.7 mm乌氏粘度计 上海申立玻璃仪器销售有限公司;BS224S分析天平 德国赛多利斯集团;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;MODEL752紫外-可见分光光度计 上海现科分光仪器有限公司;DDS-307A电导率分析仪 上海仪电科学仪器股份有限公司;SNB-1A数显旋转粘度计 上海方瑞仪器有限公司;CX31型光学显微镜 OLYMPUS公司。
1.2 实验方法
1.2.1 壳聚糖溶液的制备 分别准确称取3.00、4.00、5.00、6.00 g壳聚糖,加入50 mL去离子水,在50 ℃下恒温20 min并不断搅拌以充分分散壳聚糖粉末,每5 min加入0.5 mL 6 mol/L的盐酸,共加入4 mL,以使壳聚糖溶解,分别配成浓度为6%、8%、10%、12%的壳聚糖溶液。
1.2.2 指标测定 自溶液加入盐酸开始计时,每隔5 min测定溶液的透光率[10]、电导率和粘度。透光率用紫外分光光度计在600 nm下以去离子水调零测定;电导率用电导率仪测定;粘度用旋转粘度计测定。平行实验三次。
显微结构的观察:加入盐酸后,每隔5 min观察溶液中壳聚糖颗粒的显微结构并拍照,在溶液透光率明显变化的时间段内每隔1 min观察并拍照。在加酸0、10、15、20、25、30、35、40 min时,相应的盐酸浓度分别为0、0.12、0.17、0.23、0.29、0.34、0.39、0.44 mol/L,记录各项指标数值并讨论。
1.2.3 数据处理与统计方法 采用SPSS19.0软件(SPSS公司)的单因素方差分析(one-way ANOVA)方法对数据进行显著性分析,Microsoft Excel 2003软件对数据进行平均值、标准差处理,并作图。
2 结果与讨论
2.1 壳聚糖溶解过程中溶液透光率的变化
2.1.1 加酸过程中壳聚糖-盐酸溶液透光率变化 经预实验研究发现,在40~60 ℃范围内,对同一样品同一加酸浓度、不同温度下的透光率进行显著性分析,发现同一时刻下,温度对溶液的透光率没有显著影响(p>0.05)。因此,这里只讨论50 ℃条件下不同特性壳聚糖溶液透光率随溶液中盐酸浓度的变化,结果如图1所示。从加酸开始到盐酸浓度达到0.44 mol/L,壳聚糖溶液透光率剧烈变化主要发生在盐酸浓度为0.23~0.39 mol/L时,溶液从最初发白、有明显颗粒感的悬浮液变为发黄、澄清的胶体溶液,其后继续加酸,样品溶液的透光率几乎不变。溶液透光率变化与壳聚糖颗粒的溶解密切相关,溶液中未溶解的壳聚糖颗粒多,光的透过性低,透光率低。随着盐酸不断加入,溶液中的氢离子增多,壳聚糖分子中的氨基不断质子化,颗粒逐渐溶解,溶液越来越澄清透明。
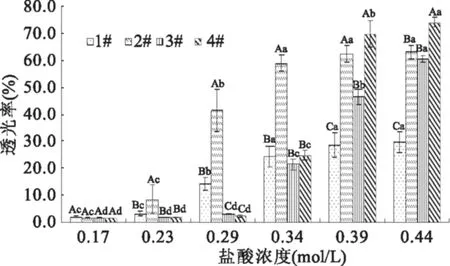
图1 壳聚糖样品溶液透光率随盐酸浓度的变化Fig.1 Changes in transmittance of chitosan solutions with HCl concentration注:壳聚糖浓度为8%(其他浓度的透光率变化规律基本相同,只以浓度8%为例分析);字母不同者表示有显著性差异(p<0.05);大、小写字母分别表示四种样品同盐酸浓度下的显著性、每种样品透光率随盐酸浓度变化的显著性;图3同。
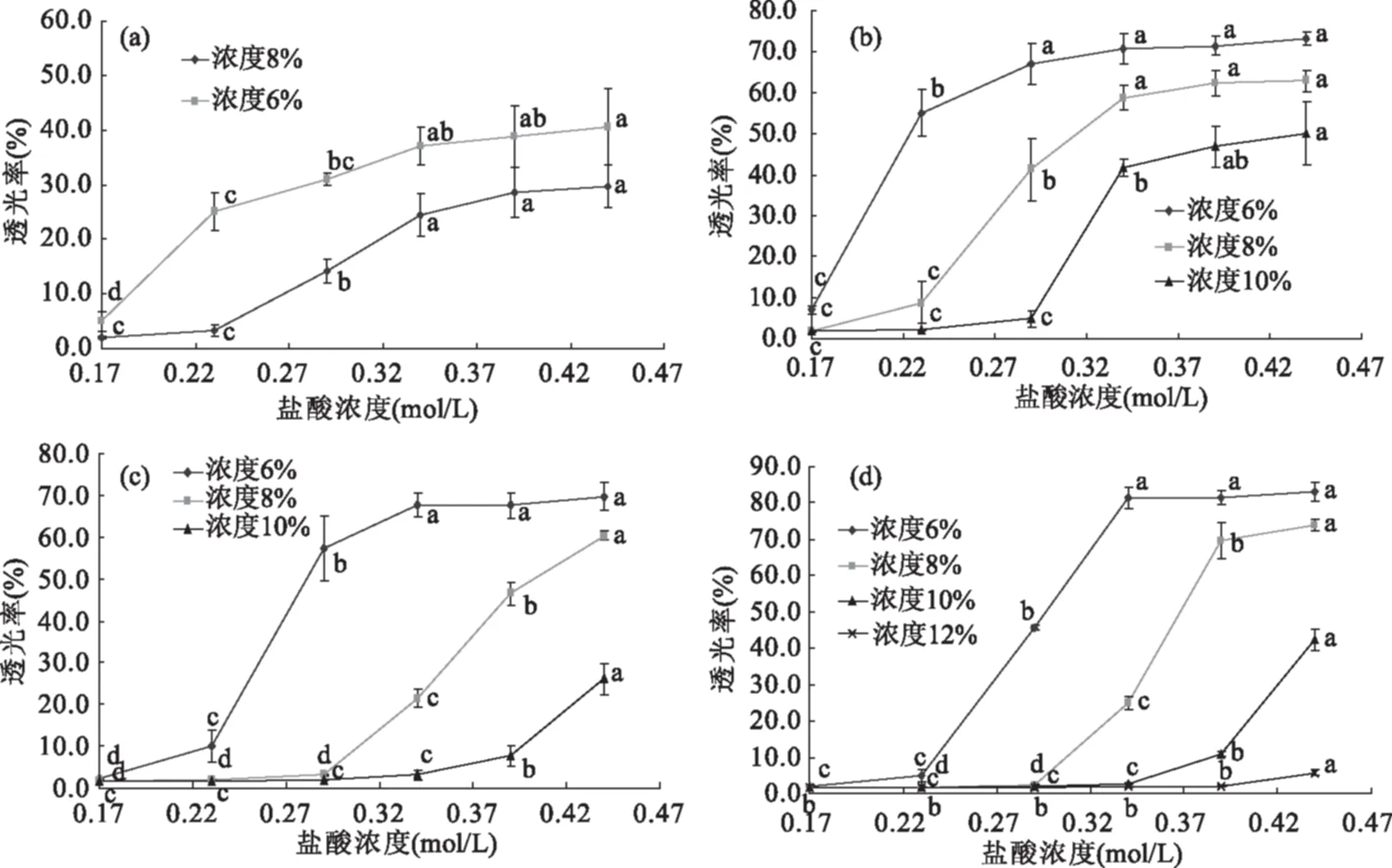
图2 不同浓度壳聚糖样品溶液透光率随盐酸浓度的变化Fig.2 Changes in transmittance of chitosan solutions with HCl concentration at different concentration注:不同小写字母表示样品透光率随时间变化存在显著性差异(p<0.05);(a)1#,(b)2#,(c)3#,(d)4#。
由图1可知,四种样品透光率随溶液中盐酸浓度变化的差异主要表现在透光率显著上升所对应的盐酸浓度范围不同。1#和2#样品溶液的透光率在加酸浓度为0.23~0.34 mol/L时显著升高(p<0.05),3#和4#样品溶液的透光率在加酸浓度为0.29~0.44 mol/L时显著上升(p<0.05)。张彬[11]指出在稀酸中,只有当氢离子活度足够高时,至少等于溶液中壳聚糖分子的氨基浓度,才可以使氨基质子化,破坏掉原来的氢键和晶格结构,最终全部溶解。3#和4#样品的脱乙酰度高于1#和2#,当浓度相同时,可以理解为3#和4#的氨基浓度高于1#和2#,因此酸液浓度较低时更有利于1#和2#溶解和质子化,溶液透光率相应也较高。3#和4#壳聚糖脱乙酰度高,含有的氨基较多,因此需要较高的酸液浓度才能使壳聚糖颗粒溶解,全部溶解所需时间也较长。
2.1.2 壳聚糖浓度对壳聚糖-盐酸溶液透光率的影响 图2(a)~图2(d)分别表示1#~4#不同浓度壳聚糖溶液透光率随盐酸浓度的变化规律。由图2可知,样品浓度越低,在较低的盐酸浓度下,溶液透光率就开始显著上升,如当1#壳聚糖浓度为6%时,溶液的透光率在盐酸浓度达到0.17 mol/L后就开始显著上升(p<0.05);浓度为8%时,溶液的透光率在盐酸浓度达到0.23 mol/L后溶液透光率才开始显著上升(p<0.05),其他样品也出现了同样的现象,即当样品浓度在6%~12%范围内时,浓度每增加2%,透光率开始显著上升的起始盐酸浓度增加约0.05 mol/L;样品浓度越低,对应相同盐酸浓度下的透光率高于较高样品浓度的溶液透光率。张彬[11]指出在稀酸中,只有当氢离子活度足够高时,至少等于溶液中壳聚糖分子的氨基浓度,才可以使氨基质子化,破坏掉原来的氢键和晶格结构,最终全部溶解。所以这可能是由于同一样品浓度越低,自由氨基总数量也越少,酸液浓度会较快等于壳聚糖分子的氨基浓度,容易最快达到完全质子化,透光率也会上升更快;另一方面壳聚糖颗粒越少,自由活动的空间相对较大,更容易接触到氢离子,流动性也较好,促使颗粒更快更多地发生质子化。
2.2 壳聚糖溶解过程中壳聚糖-盐酸溶液电导率的变化
经预实验测定发现,温度升高,溶液的电导率会稍有增加,但并不显著(p>0.05),说明温度对溶液电导率的影响不显著。因此,本文只讨论50 ℃条件下不同特性壳聚糖溶液电导率随盐酸浓度的变化,结果如图3所示。
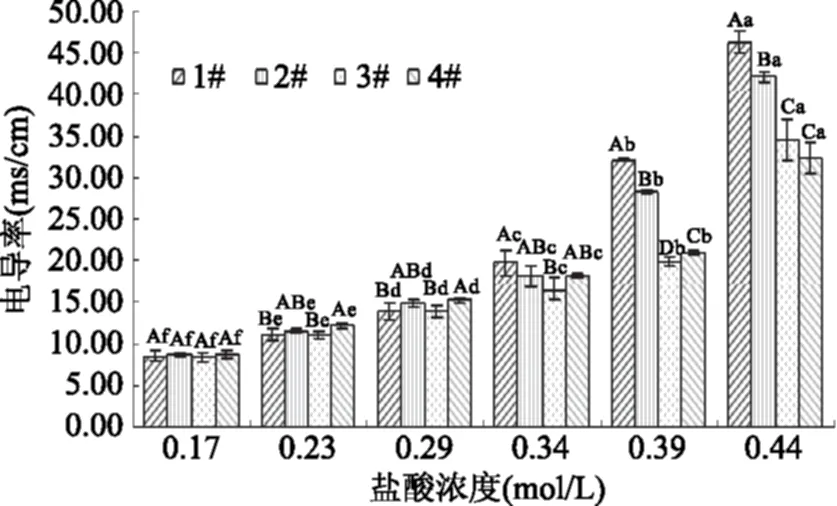
图3 不同温度下壳聚糖样品溶液电导率随盐酸浓度的变化Fig.3 Changes in conductivity of chitosan solutions with HCl concentration
由图3可知,四种壳聚糖样品溶液的电导率随盐酸加量增加而一直显著上升(p<0.05),但不同阶段上升幅度不同:当盐酸浓度小于0.29 mol/L时,每次滴加酸后四种样品溶液的电导率增加约3 ms/cm,但1#样品溶液在盐酸浓度为0.29~0.44 mol/L时,三次加酸后电导率增幅依次为5.91、12.34、14.2 ms/cm;2#样品溶液电导率增幅变大则始于盐酸浓度0.34 mol/L,此后至盐酸浓度达到0.44 mol/L,其电导率分别比前一次加酸增加10.1、13.8 ms/cm;3#和4#样品溶液则在盐酸浓度为0.39~0.44 mol/L时,两次加酸后电导率增幅分别达到14.67、11.37 ms/cm。
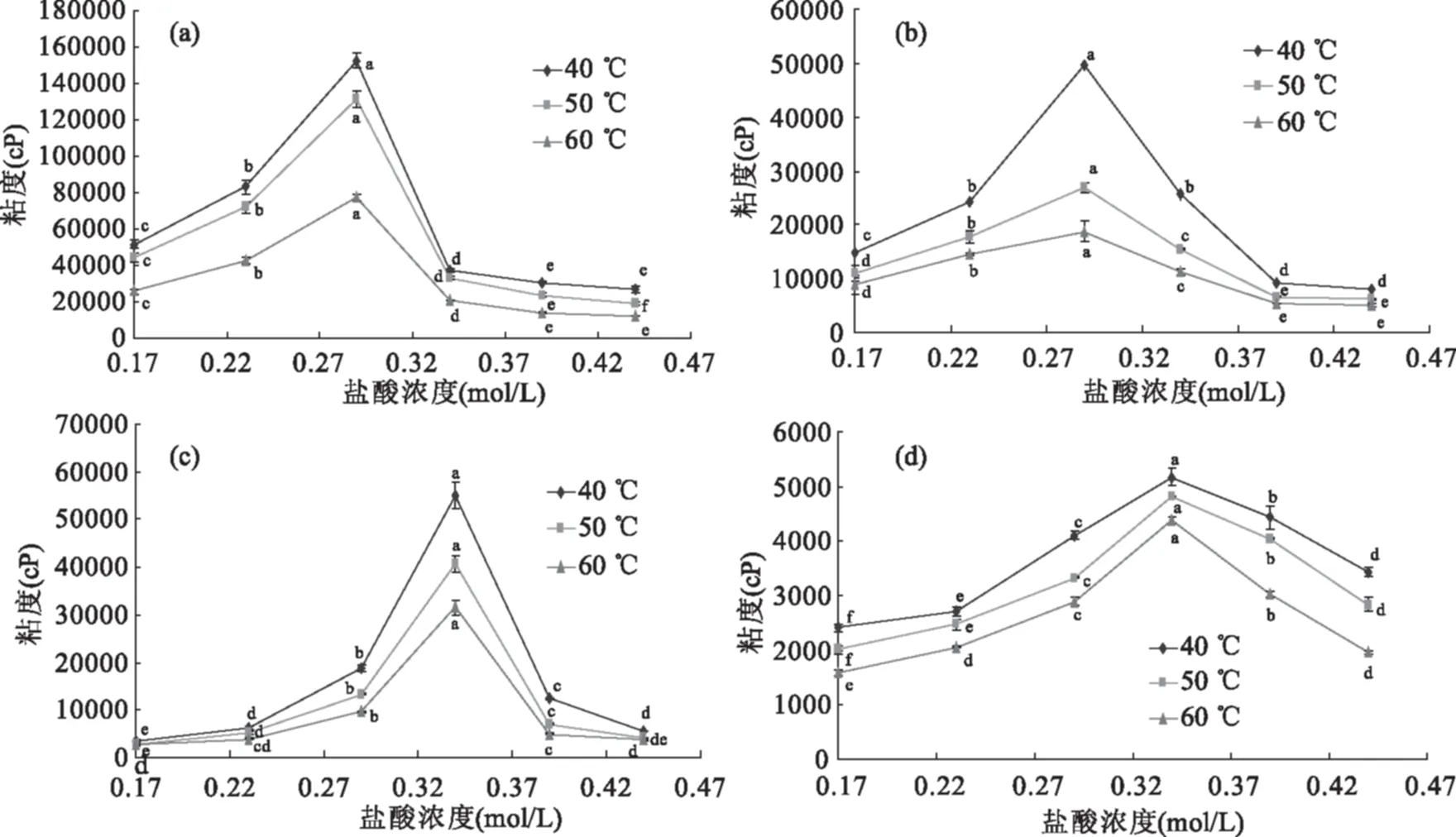
图4 不同温度下壳聚糖样品溶液粘度随盐酸浓度的变化Fig.4 Changes in viscosity of chitosan solutions with HCl concentration under different temperature注:壳聚糖浓度为8%;(a)1#,(b)2#,(c)3#,(d)4#。
溶液电导率是由溶液中的自由离子定向移动形成电流而产生的。而自由离子主要来源于氢离子和氯离子,其中氢离子会和氨基进行质子化作用,即氢离子会被消耗,而氯离子全部贡献于增加电导率。因此,样品溶液电导率增幅突然变大,即每5 min滴加盐酸后电导率增幅达到10 ms/cm以上时,可推测壳聚糖分子接近或完全质子化,氢离子主要作为溶液中的自由离子而贡献于增加电导率。因此推测出1#、2#、3#、4#样品完全质子化所对应的盐酸浓度范围分别在0.29~0.34、0.34~0.39、0.39~0.44、0.39~0.44 mol/L间。这正好与四种样品脱乙酰度大小排序一致。对四种样品来说,酸液浓度相同,可被利用的氢离子数量相同,因此脱乙酰度大的样品较晚完全质子化,最终电导率值也较低。
2.3 壳聚糖-盐酸溶液粘度的变化
图4(a)~图4(d)分别表示1#~4#不同温度下壳聚糖溶液粘度随盐酸浓度的变化规律。可知,在40~60 ℃时,温度升高,溶液粘度降低;不同温度下溶液粘度随盐酸浓度的变化趋势一致:先持续显著上升至最大值(p<0.05),然后粘度显著下降(p<0.05);1#和2#样品溶液粘度都在盐酸浓度为0.29 mol/L时达到最大,3#和4#溶液粘度则是在盐酸浓度为0.34 mol/L时达到最大;在盐酸浓度为0.44 mol/L时样品的粘度值大小排序为:1#>2#>3#>4#,与壳聚糖分子量大小排序相对应。
在溶解过程中,样品粘度先急剧增大再显著下降,其原因可能是:随着酸液不断加入,更多氢离子与壳聚糖分子链上的氨基结合生成-NH3+,破坏原有的壳聚糖分子中的氢键和晶体结构,壳聚糖大分子渐渐舒展,并相互缠绕、纠缠,致使溶液的流动阻力加大,表现为溶液的粘度逐渐增加;其后,随着酸液不断添加,溶液的电导率大幅增加,表明溶液中自由离子增加,离子强度增大,此时溶液中的氯离子会屏蔽-NH3+间的静电排斥作用[12],使壳聚糖分子卷曲为球状[13-14],大大降低了溶液的流动阻力,溶液粘度下降,如1#和2#样品在50 ℃下,盐酸浓度为0.29 mol/L时最粘,在盐酸浓度为0.34 mol/L时粘度分别骤降约75%、43%。王伟等[15]也指出在壳聚糖浓溶液中,分子间互相交叠、缠结、贯穿,过量的酸根离子则会降低静电斥力,降低粘度,也能为本文溶解过程中溶液粘度先增后骤降的现象提供合理的解释。
2.4 溶解过程中壳聚糖-盐酸溶液的显微观察
在40倍光学显微镜下观察四种样品在加酸过程中的显微结构变化,由图5~图8可知:未加酸时,水中壳聚糖颗粒分散、重叠,不同壳聚糖样品颗粒大小不同;加酸后,观察视野中壳聚糖颗粒数量减少,且随加酸进行显著变化,但颗粒直径总体变化不大,说明壳聚糖颗粒可能是在酸的作用下直接崩解,而不是先溶胀再崩解。
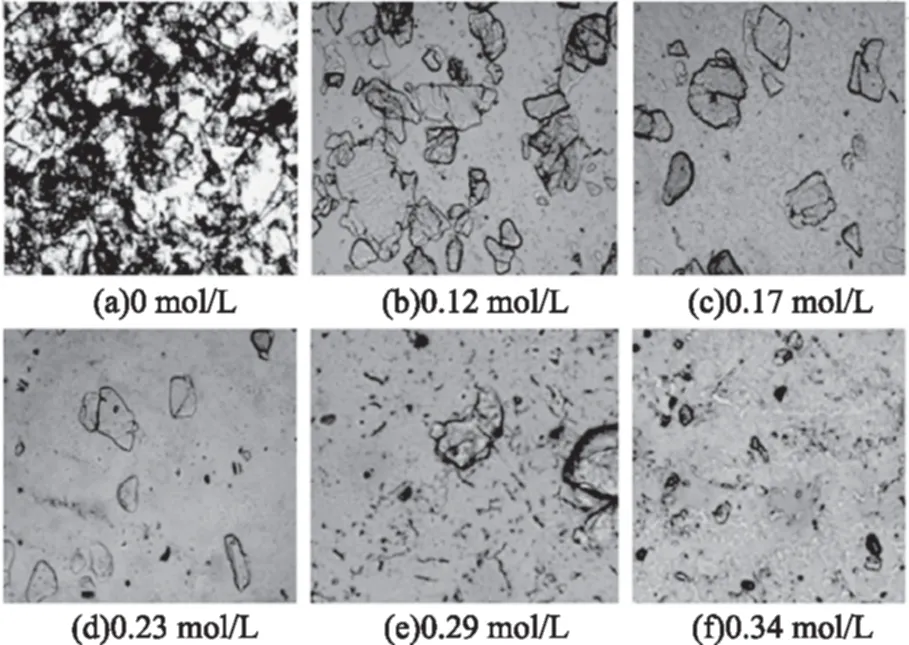
图5 1#样品溶液在不同盐酸浓度下的显微观察Fig.5 Microscopy photographs of 1# chitosan solutions at different HCl concentration注:壳聚糖浓度为8%,图6~图8同。

图6 2#样品溶液在不同盐酸浓度下的显微观察Fig.6 Microscopy photographs of 2# chitosan solutions at different HCl concentration
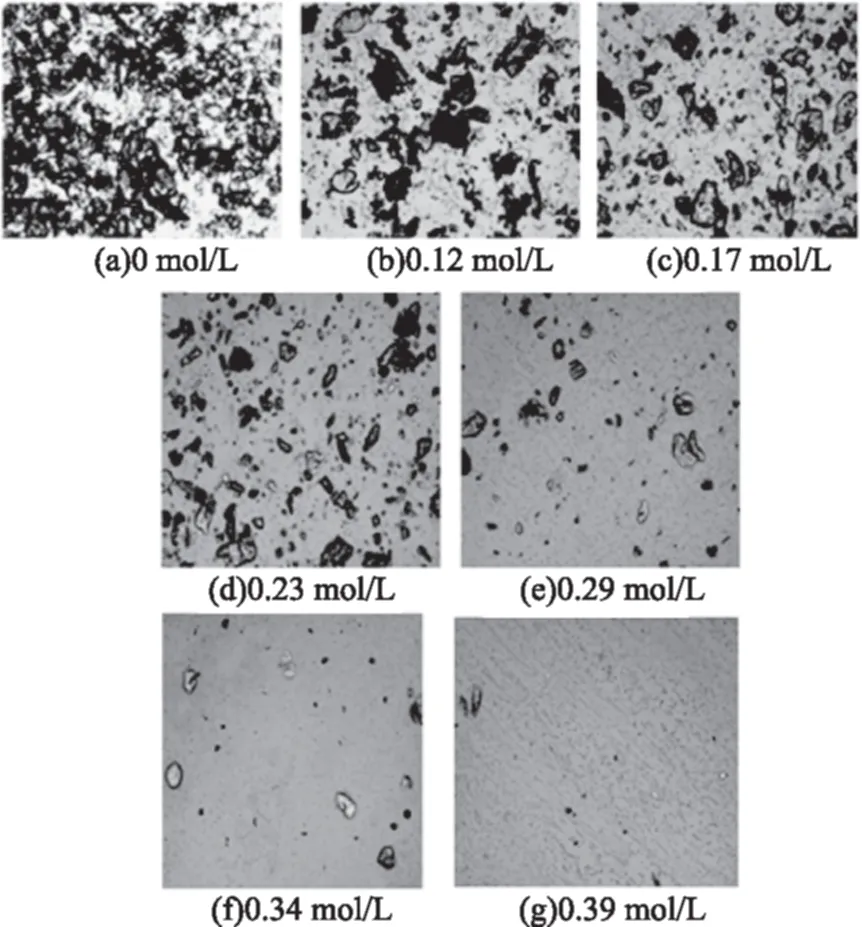
图7 3#样品溶液在不同盐酸浓度下的显微观察Fig.7 Microscopy photographs of 3# chitosan solutions at different HCl concentration
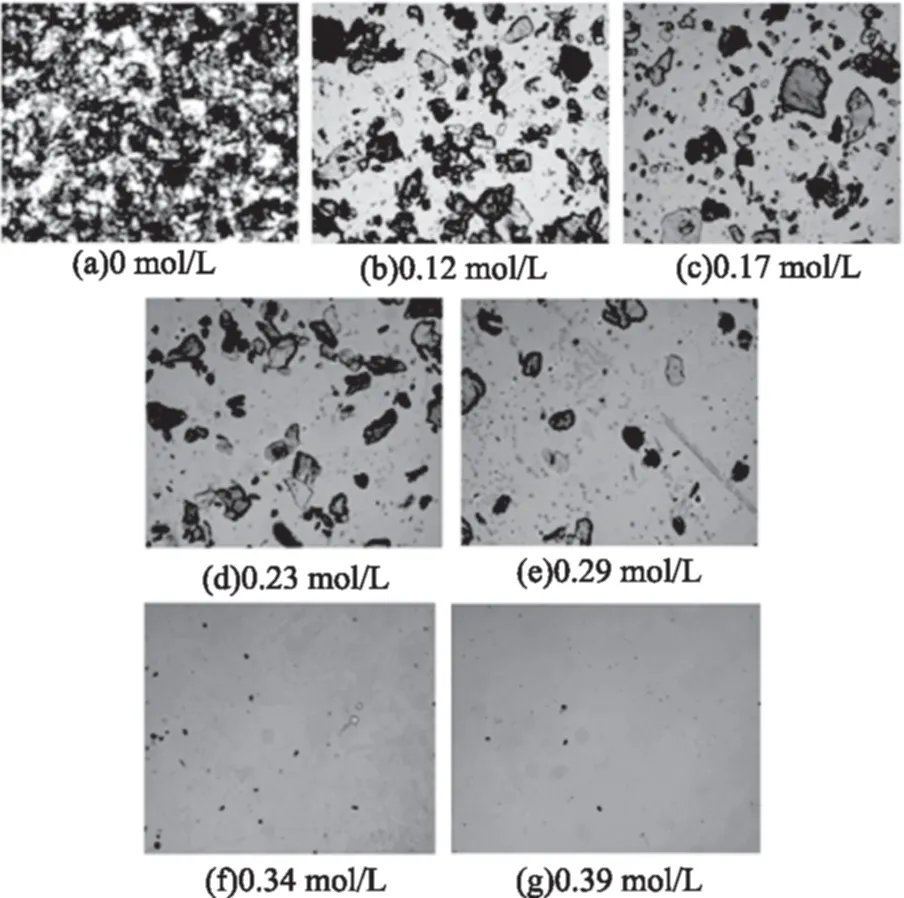
图8 4#样品溶液在不同盐酸浓度下的显微观察Fig.8 Microscopy photographs of 4# chitosan solutions at different HCl concentration
图1显示,当盐酸浓度小于0.17或0.23 mol/L时壳聚糖溶液透光率变化不大,但图5~图8的显微照片则显示各壳聚糖样品溶液中壳聚糖颗粒已经显著减少,表明壳聚糖颗粒已经大量崩解,但溶液中仍残留有部分颗粒,阻挡入射光线透过,致使溶液透光率仍较小。
另外,不同分子特性的壳聚糖颗粒全部崩解形成透明溶液所需要的酸量不同。对照上图可以发现2#样品在盐酸浓度约为0.26 mol/L时,溶液中颗粒近乎完全崩解,能观察到的颗粒数已经非常少,3#和4#样品颗粒完全崩解发生在盐酸浓度达到0.39 mol/L时,这与此阶段样品溶液透光率和电导率的变化结果一致。邵伟等[16]用粒度仪观察壳聚糖在0.1 mol/L HAc中的溶解行为,发现前期粒度先增大再变小,认为壳聚糖在溶解初期发生了吸附或自聚集过程,这与本文中显微观察结果不一致,原因可能是采用的酸溶液阴离子类型不同,浓度和实验过程也不同造成的。
3 结论
当盐酸浓度在0.23~0.39 mol/L时,壳聚糖溶液透光率急剧上升;壳聚糖脱乙酰度越高,浓度越大,溶液透光率显著上升的起始盐酸浓度越高;分子量越小,充分溶解后的溶液透光率越高。在本文加酸条件下,壳聚糖溶液电导率增幅达到10 ms/cm以上时,可推测壳聚糖分子几乎完全质子化,颗粒几乎完全溶解。壳聚糖脱乙酰度越高,需要较高的盐酸浓度才能实现完全质子化,最终电导率值也较低。升温可以降低壳聚糖溶液粘度;在加酸过程中,壳聚糖溶液粘度先持续增加,1#、2#、3#、4#壳聚糖溶液粘度值分别在盐酸浓度为0.29、0.29、0.34、0.34 mol/L时达到最大,随后继续加酸,溶液粘度骤降。显微观察结果表明不断加入盐酸,溶液中壳聚糖颗粒数明显减少,壳聚糖分子没有发生明显的溶胀;脱乙酰度越高,壳聚糖颗粒完全部崩解所需要的盐酸浓度也越大。上述四个指标综合表征了高浓度壳聚糖溶液的溶解过程,可以为提高壳聚糖浓度,提高工厂降解壳聚糖效率提供一条思路。
[1]Jeyakumari A,Ninan G,Joshy C G,et al. Effect of chitosan on shelf life of restructured fish products from pangasius(pangasianodon hypophthalmus)surimi during chilled storage[J]. Journal of Food Science and Technology-Mysore-,2016,53(4):1-9.
[2]Li H,Zou L,Yang Q,et al. Antimicrobial activities of nisin,tea polyphenols,and chitosan and their combinations in chilled mutton[J]. Journal of Food Science,2016,81(6):M1466-M1471.
[3]Saengkaew P,Chantanachai K,Cheewajaroen K,et al. Characterization and electrical properties of chitosan for waste water treatment[J]. Aip Conference Proceedings,2016,1728(1):603-632.
[4]Griffon D J,Cho J,Wagner J R,et al. Effects of hypoxia and chitosan on equine umbilical cord-derived mesenchymal stem cells[J]. Stem Cells International,2016,2016(5):1-11.
[5]Li S,Ren L,Xu H,et al. Effects of medical chitosan on capsular formation following silicone implant insertion in a rabbit model[J]. Aesthetic Plastic Surgery,2016,40(4):613-624.
[6]Matjaž F,Amra P U,Janja S,et al. Novel chitosan/diclofenac coatings on medical grade stainless steel for hip replacement applications[J]. Scientific Reports,2016,6:1-17.
[8]Hwang J K,Shin H H. Rheological properties of chitosan solutions[J]. Korea-Australia Rheology Journal,2000,12(3/4):175-179.
[9]Chen R H,Lin W C,Lin J H. Effects of pH,ionic strength,and type of anion on the rheological properties of chitosan solutions[J]. Acta Polymerica,1994,45(1):41-46.
[10]Cho J,Heuzey M C,Bégin A,et al. Viscoelastic properties of chitosan solutions:Effect of concentration and ionic strength[J]. Journal of Food Engineering,2006,74(4):500-515.
[11]张彬. 壳聚糖-明胶-聚乳酸复合薄膜的制备及其性能研究[D]. 天津:天津大学,2007.
[12]李星科,纵伟,章银良,等. 脱乙酰度、pH和离子强度对壳聚糖溶液流变性质的影响[J]. 现代食品科技,2013(1):11-14.
[13]李海涛,王美玲,张友玉,等. 壳聚糖在稀溶液中的聚集行为[J]. 应用化学,2004,21(2):159-163.
[14]吴迪,蔡伟民. 壳聚糖—盐酸溶液中温度敏感的相分离行为[J]. 物理化学学报,2002,18(6):554-557.
[15]王伟,徐德时,李素清,等. 聚电解质──壳聚糖浓溶液流变学性质研究:浓度、温度、溶剂pH和外加盐对粘度及流动性的影响[J]. 高分子学报,1994,1(3):328-334.
[16]邵伟,沈青. 壳聚糖在醋酸溶液中的溶解行为及动力学模型[J].纤维素科学与技术,2007,15(2):30-33.
Dissolution behavior and solution properties of chitosan
NIU Pei-yang,ZHANG Li-yan*
(College of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China)
The changes in transmittance,conductivity,viscosity and particle status of four kinds of chitosan solutions with different degree of deacetylation and molecular weight were mainly studied with different HCl and chitosan concentrations of 0~0.44 mol/L,6%~12%,respectively,under 50 ℃ and the dissolution trends and solution properties of chitosan were investigated. Results showed that when the HCl and chitosan concentration was 0.23~0.39 mol/L,6%~10% respectively,the transmittance of chitosan solution increased dramatically,the higher the chitosan concentration and degree of acetylation,the higher the HCl concentration at which transmittance began to increase sharply. After finishing adding HCl,the lower the molecular weight of chitosan,the higher the final transmittance of chitosan solution. The conductivity of chitosan solution increased at a small and even ratio when HCl concentration was low. After HCl concentration was higher enough,the conductivity of solution rose at a ratio over 10 ms/cm,which indicated that chitosan was almost fully protonated. The higher the degree of deacetylation of chitosan,the higher the HCl concentration at which conductivity of solution increase dramatically. 1#,2#,3#,4# chitosan solution reached the maximum viscosity at concentration of HCl of 0.29 mol/L,0.29 mol/L,0.34 mol/L,0.34 mol/L,respectively,then decreased significantly(p<0.05). Temperature increasing led to the decrease of solution viscosity,but the effect of temperature on viscosity was not changed. Microscopy observation showed that the number of chitosan particles decreased obviously with addition of hydrochloric acid. Chitosan with a higher degree of deacetylation fully disintegrated at a higher HCl concentration. The transmittance and conductivity of solution increased obviously at the stage at which of chitosan particles disintegrated fully.
chitosan;dissolution behavior;solution properties;hydrochloric acid
2016-08-16
牛培阳(1990-),女,硕士研究生,研究方向:食品加工与保藏,E-mail:18819455617@163.com。
*通讯作者:张立彦(1974-),女,博士,副教授,研究方向:食品加工与保藏,E-mail:liyanzh@scut.edu.cn。
广东省科技计划项目(2014B020204002)。
TS241
A
1002-0306(2017)06-0084-060
10.13386/j.issn1002-0306.2017.06.007
