甜瓜幼苗对逆境胁迫的生理响应及抗逆性综合评价
2017-04-13赵卫星刘喜存李晓慧徐小利常高正梁慎康利允高宁宁
赵卫星,刘喜存,李晓慧,徐小利,常高正,梁慎,康利允,高宁宁
(1.河南省农业科学院园艺研究所,河南郑州450002;2.新乡市农业科学院,河南新乡453000)
甜瓜幼苗对逆境胁迫的生理响应及抗逆性综合评价
赵卫星1,刘喜存2,李晓慧1,徐小利1,常高正1,梁慎1,康利允1,高宁宁1
(1.河南省农业科学院园艺研究所,河南郑州450002;2.新乡市农业科学院,河南新乡453000)
为阐明逆胁迫对甜瓜幼苗伤害的生理机制及综合抗逆性品种选育筛选与应用提供理论依据,以熟性不同的薄皮甜瓜F13-18、F14-20为试验材料,测定了幼苗期不同逆境胁迫条件下与抗逆性有关的可溶性蛋白质(SP)、叶绿素(Chl)、游离脯氨酸(Pro)、丙二醛(MDA)的含量和保护性酶活性等生理指标。结果表明,苗期逆境胁迫增加了SP、Pro、MDA含量及细胞膜的透性(TDS),提高了超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性,降低了Chl含量及叶绿素a与叶绿素b的比值(Chla/b),但不同逆境胁迫的生理机制有差异,整体表现为干旱、水分胁迫对叶片渗透调节物质含量及光合特性的影响较大,低温、盐胁迫对叶片保护性酶活性影响较大。利用主成分分析对苗期抗逆性生理指标进行评价,Chl、Chla/b、POD、SOD可作为早熟品种F13-18苗期综合抗逆性的鉴定指标,Chl、Pro、TDS、POD可作为中晚熟品种F14-20苗期综合抗逆性的鉴定指标。
甜瓜;逆境胁迫;生理响应;主成分分析;综合评价
甜瓜作为世界重要的十大果品之一,是近年来发展较快、产品增加较多的经济作物。据统计,2014年我国甜瓜栽培面积为43.89万hm2,产量1475.80万t[1],是世界上种植面积最大的国家之一。但在育苗过程中,经常会遇到不同程度的逆境条件,不仅给正常生长带来危害,严重时还会造成植株早衰[2-3]。因此,深入探讨甜瓜对逆境胁迫的生理响应,对逆境胁迫条件的提前预判和预防具有重要的理论和实际意义。近年来,国内外很多学者开展了甜瓜抗逆性方面的研究,并筛选出许多与抗逆性有关的生理指标。王霞霞等[4]的研究结果表明,随土壤湿度降低,薄皮甜瓜叶片细胞膜完整性降低,SP和Chl含量先降后升,Pro含量及POD活力先升后降;张玉鑫[5]研究认为,随着NaCl浓度的增加,甜瓜叶片的Pn逐渐减小,细胞膜相对透性、MDA含量逐渐增大,POD、SOD活性在短期内均有不同程度的提高;王兴虎[6]的研究结果显示,低温使甜瓜幼苗的细胞膜相对透性增大,MDA含量升高,SOD、POD活性随着温度降低和持续时间延长呈现先升后降的趋势,且细胞膜透性、MDA含量以及SOD、POD、CAT活性可以作为厚皮甜瓜耐低温性鉴定依据;户金鸽等[7]研究认为哈密瓜苗期干旱胁迫增加了Pro、甜菜碱、MDA和可溶性糖含量及SOD和POD的活性,同时减少了Chl含量,Pro、MDA、可溶性糖、SOD、POD、Chl均可作为哈密瓜苗期抗旱性的鉴定指标。但这些研究多集中在单一逆境条件下,甜瓜生理特性的变化趋势及抗逆指标的筛选,在抗逆品种选育与应用中有一定的局限性。而关于甜瓜对不同逆境胁迫共同生理应答反应的研究鲜有报道。本文以2种不同类型的薄皮甜瓜为研究对象,探讨其苗期对逆境胁迫的响应,并利用主成分分析法筛选各种逆境条件下共同的抗逆性鉴定指标,为诠释逆境对甜瓜幼苗伤害的作用机理和综合抗逆性品种选育、引进与应用提供理论依据。
1 材料与方法
1.1 供试材料
供试品种:F13-18、F14-20,分别为早熟和中晚熟薄皮甜瓜品种,由河南省农业科学院园艺研究所选育。
1.2 试验方法
将供试材料于60℃热水中搅拌10 min左右,自然冷却,浸种3 h置于28℃恒温培养箱中催芽,90%上的种子露白时即播种于穴盘中,基质以草炭和珍珠岩按体积比3∶1配制。当幼苗生长到2叶1心时,选择生长一致的幼苗,进行不同的胁迫处理:①低温胁迫处理:将幼苗置于8℃环境中处理6 h,每3 d处理1次,模拟低温条件;②干旱胁迫处理:喷淋50 mL含150 g/L聚乙二醇(PEG6000)的Hoagland完全营养液,每3 d处理1次,模拟干旱条件;③盐胁迫处理:喷淋50 mL含200 mmol/L NaCl的Hoagland完全营养液,模拟盐害条件;④水分胁迫处理:将穴盘放入装有水的托盘中,水面始终保持3 cm高度,模拟水淹条件。各处理均在生长过程中喷淋50mLHoagland完全营养液维持幼苗生长所需的营养,以正常生长条件下,喷淋相同数量的Hoagland完全营养液的幼苗为对照,每个处理3次重复。
1.3 测定项目及方法
甜瓜幼苗生长至4叶1心时,分别进行以下生理指标的测定。叶绿素(Chl)含量,采用采用浸泡提取法;可溶性蛋白含量(SP),采用考马斯亮蓝法;超氧化物歧化酶(SOD)活性,采用氮蓝四唑光化还原法;过氧化物酶(POD)活性,采用愈创木酚法;脯氨酸含量(Pro),采用酸性茚三酮法;丙二醛(MDA)含量,采用定用硫代巴比妥酸显色法;以测定方法上均参照李合生编著的《植物生理生化试验原理和技术》[8]。细胞膜相对透性(相对电导率TDS),采用电导法[9]。
1.4 数据分析
采用Excel 2007和DPS 7.05软件对试验数据进行分析,多重比较采用Duncan’s新复极差法。
2 结果与分析
2.1 逆境胁迫对叶片可溶性蛋白质(SP)和叶绿素总(Chl)含量影响
可溶性蛋白质是重要的渗透调节物质和营养物质,其增加和积累对细胞的生命物质及生物膜起到保护作用[10]。不同逆境胁迫均可提高甜瓜幼苗叶片可溶性蛋白质含量,不同甜瓜品种可溶性蛋白质含量对逆境胁迫的响应有明显差异(表1)。干旱、盐、水分胁迫处理F13-18幼苗叶片SP含量均显著高于CK,低温胁迫处理与CK差异不显著;干旱胁迫处理F14-20幼苗叶片SP含量显著高于CK,其他胁迫处理与CK无显著差异。结果表明,蛋白质在逆境胁迫中起到了渗透调节的作用,且对干旱胁迫的调节能力较强。
叶绿素是绿色植物进行光合作用的重要场所,其含量的提高有利于植物积累更多的光合产物,提高植物抗逆境的能力[11]。不同逆境胁迫甜瓜幼苗Chl含量均显著低于CK(表1),对于早熟品种F13-18而言,干旱胁迫处理对Chl含量影响最大,其显著低于其他处理,水分胁迫次之,其含量显著低于低温和盐胁迫处理,低温和盐胁迫处理之间无显著差异;不同逆境胁迫处理中晚熟品种F14-20,幼苗Chl含量无显著差异。说明,逆境胁迫抑制了甜瓜幼苗叶绿素的合成,且干旱、水分胁迫对早熟品种的影响较大。
Chla/b值的高低反映植物对光能的利用程度[12]。不同逆境胁迫处理甜瓜幼苗Chla/b值有明显差异(表1),除低温胁迫处理与CK间差异不显著外,其他处理均显著低于CK。各种逆境胁迫处理早熟品种F13-18,Chla/b之间无显著差异,盐胁迫处理中晚熟品种F14-20,其比值显著低于低温胁迫处理,且其他处理间无显著差异。说明,干旱、盐、水分胁迫不利于甜瓜幼苗对光能利用。
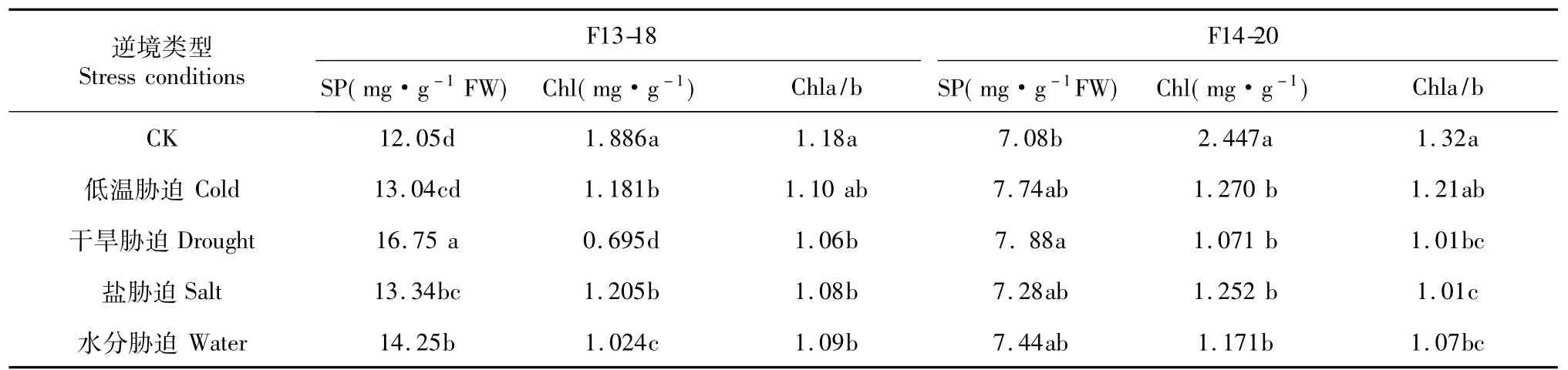
表1 逆境胁迫对甜瓜幼苗叶片SP和Chl含量影响Table 1 Effect of different adversity stresses on SP and Chl contents ofmelon leaves
2.2 逆境胁迫对叶片Pro、MDA含量及TDS的影响
当甜瓜幼苗受到逆境条件时,其体内Pro含量均显著高于CK(表1)。其中,干旱、水分胁迫处理对早熟品种F13-18幼苗Pro影响较大,其含量显著高于低温胁迫,但与盐胁迫处理间差异不显著;干旱胁迫处理对中晚熟品种F14-20幼苗Pro影响较大,其含量显著高于水分、低温胁迫处理,但与盐胁迫处理间差异不显著,低温胁迫处理对其影响较小,显著低于其他处理。说明,逆境胁迫处理会使Pro在甜瓜幼苗体内大量积累,以增加耐胁迫能力,干旱胁迫Pro的积累量最多,低温胁迫积累积累量最少。
丙二醛(MDA)是膜脂过氧化降解的主要产物,也是衡量膜脂过氧化程度的重要指标[13]。不同逆境胁迫均可提高甜瓜幼苗叶片MDA含量(表1),对于早熟品种F13-18而言,逆境胁迫处理,其含量显著高于CK,干旱胁迫处理甜瓜幼苗叶片MDA含量较高,显著高于其他处理,水分和盐胁迫处理次之,低温胁迫处理最小;除干旱、水分胁迫处理中晚熟品种F14-20甜瓜幼苗叶片MDA含量显著高于CK外,其他处理与CK间差异不显著。说明,干旱、水分胁迫处理细胞质膜受伤害程度较大,低温胁迫处理其受伤害程度较小。
细胞膜是细胞感受环境胁迫最敏感的部位,相对电导率是衡量细胞膜透性的重要指标[14]。不同逆境胁迫处理甜瓜幼苗叶片相对电导率均有不同程度的增加(表2),对于早熟品种F13-18而言,逆境胁迫处理与CK间差异达显著水平,盐胁迫处理相对电导率最高,干旱和水分胁迫处理次之,低温胁迫处理较低;对于早熟品种F13-18而言,除低温胁迫处理甜瓜幼苗叶片相对电导率与CK间差异不显著外,其他胁迫处理均显著高于CK,且水分迫处理相对电导率最高,盐胁迫处理次之,干旱相对较低。说明,逆境胁迫处理对甜瓜叶片细胞膜造成了一定伤害,引起细胞膜透性的增加;其中,干旱胁迫处理对早熟品种的伤害较重,水分胁迫对中晚熟品种的伤害较重。
2.3 逆境胁迫对叶片POD、SOD酶活性影响
POD、SOD是植物体内清除自由基的保护酶,其活性的高低影响植物体内自由基产生和清除之间的平衡,关系到细胞膜系统受保护程度[15]。不同逆境胁迫均可提高甜瓜幼苗叶片POD、SOD酶活性(表3),除盐胁迫处理F14-20叶片POD活性与CK差异不显著外,其他逆境处理均与CK间达显著水平,且水分、低温胁迫对叶片POD活影响较大,干旱、盐胁迫次之。盐胁迫处理甜瓜叶片SOD活性均与CK间达显著水平,其中,盐、低温胁迫影响较大,干旱、水分胁迫次之。说明,逆境胁迫处理使甜瓜启动自身的保护系统来清除体内因胁迫引起的活性氧,以保护膜系统。
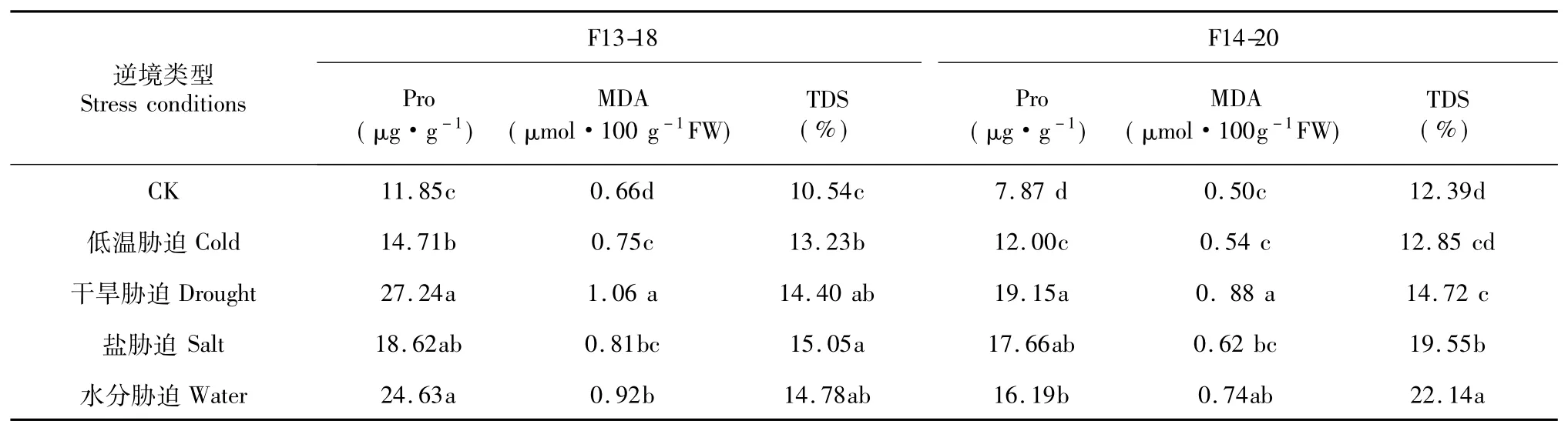
表2 逆境胁迫对甜瓜幼苗叶片Pro、MDA含量及TDS影响Table 2 Effects of different adversity stresses on Pro,MDA contents and TDS ofmelon leaves
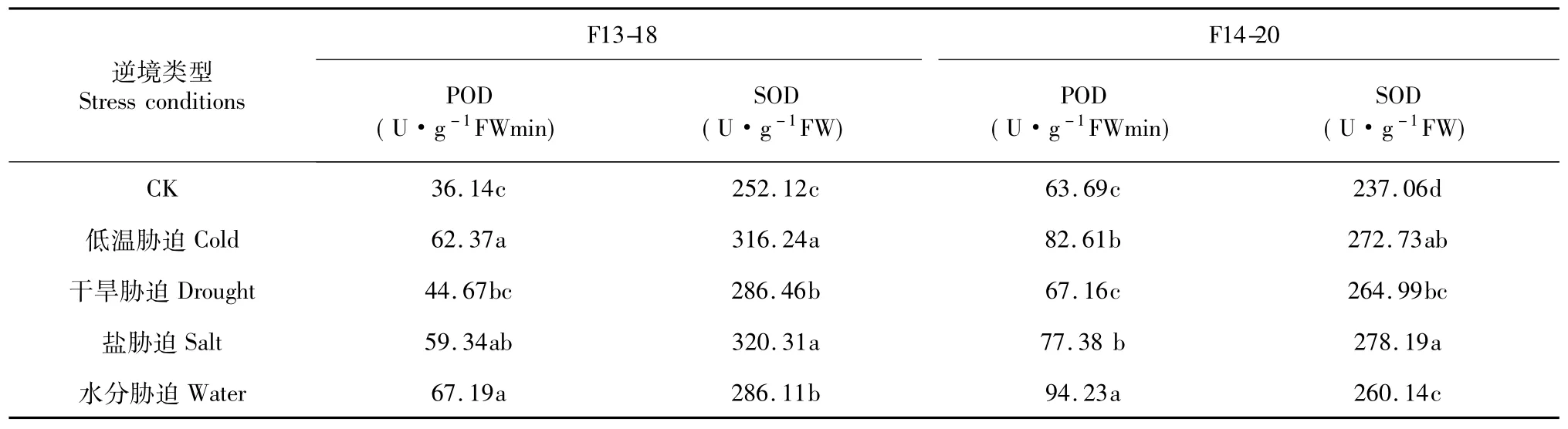
表3 逆境胁迫对甜瓜幼苗叶片POD、SOD酶活性影响Table 3 Effects of different adversity stresses on POD and SOD activity ofmelon leaves
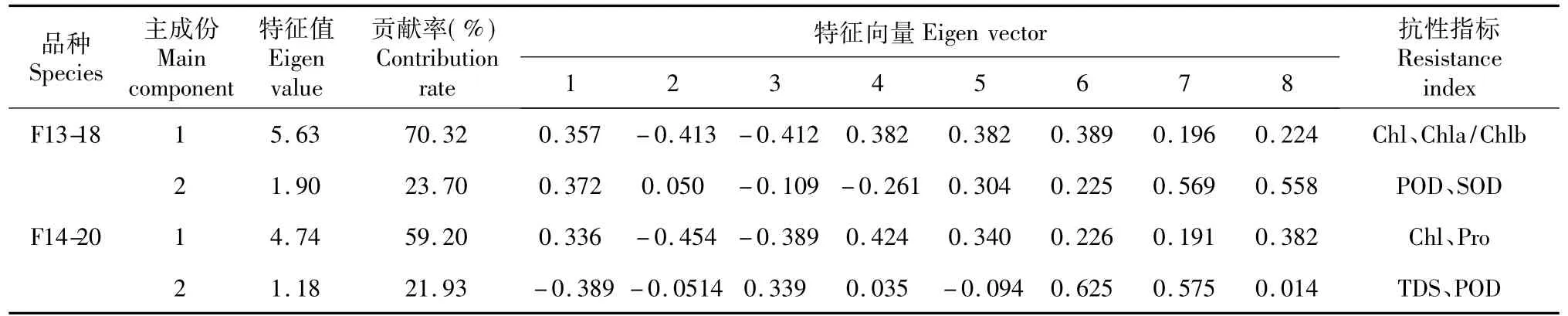
表4 2种甜瓜幼苗抗逆性综合评价主成分分析Table 4 The principal component analysis of comprehensive appraisal of two orientalmelon species stress-resistant abilities
2.4 2种甜瓜品种抗逆性综合评价
通过对2种甜瓜的8个生理特性指标进行抗逆性主成分分析,可将8个生理指标转化为4个主成份,以第1、2个主成份贡献率最大,其累计贡献率分别可达94.02%、81.13%,即第1、2个主成份已经基本携带了8个抗逆指标80%以上的信息(表4)。由表4可以看出,Chl、Chla/b、POD、SOD可作为早熟品种F13-18苗期综合抗逆性的鉴定指标,Chl、Pro、TDS、POD可作为中晚熟品种F14-20苗期综合抗逆性的鉴定指标。
3 讨论
相关研究发现,植物在受到不同环境胁迫时,会对其造成一定的伤害,产生一系列物质代谢上的变化,主要表现在细胞膜统受破坏、酶活性受影响,从导而致细胞代谢紊乱[16-17]。因而,植株体内SP、Chl、Pro、MDA含量及相关保护酶活性在一定程度上可以反映植物遭受逆境的情况及其对逆境的抵抗能力。本研究结果也证实了这一点,即逆境胁迫提高了2种甜瓜幼苗叶片SP、Pro、MDA含量和POD、SOD活性及降低Chl含量,通过体内相关生理特性的变化,有效缓解逆境造成的伤害,并在一定程度上提高了2种甜瓜对逆境的抵抗能力。但不同品种对逆境胁迫的生理反应有很大差异,这可能与品种自身耐受程度有很大关系,其具体原因还有待进一步研究。
由于植物抗逆性是受多基因控制的数量性状,利用单项指标评价其抗逆性,则具有一定的片面性[18-19]。因此本试验利用主成分分析方法将7个单项指标综合成为4个综合指标,从而使各种逆境胁迫下生理特性的响应值差异具有可比性,Chl、Chla/b、Pro、POD、SOD等分别可作为早熟品种F13-18和中晚熟品种F14-20苗期综合抗逆性的鉴定指标,这与田彦彦[20]及刘旻霞等[21]对其他作物的研究的观点基本一致,同时,本试验还证实细胞膜透性(TDS)与中晚熟品种苗期综合抗逆性也有一定关系。同一种植物在不同生育阶段或不同的生境条件下抗逆能力有所不同,本试验仅选择甜瓜4叶1心期和中度逆境条件下部分生理特性筛选抗逆性指标,可能会对试验结果造成一定误差。因此,应依据品种特性,选择适当的生育时期和逆境胁迫条件,探索多种逆境植株体内共同的生理应答,为诠释适应各种逆境共同途径的基因表达提供重要的信息。
4 结论
在本试验条件下,逆境胁迫均增加了2种甜瓜苗期叶片可溶性蛋白质、Pro、MDA含量和细胞膜的透性,提高了SOD、POD的活性,降低了Chl含量及Chla/b,说明逆境胁迫通过伤害甜瓜植株体细胞膜和破坏光合系统影响生长发育,同时植株体自身有通过维持细胞膨压、降低植物渗透势及启动保护系统,有效地清除氧自由基,保护生物膜的结构与功能免受进一步伤害。但不同逆境胁迫的生理机制有差异,整体表现为干旱、水分胁迫对植株渗透调节物含量及光合特性的影响较大,低温、盐胁迫对植株体保护性酶活性影响较大。Chl、Chla/b、POD、SOD可作为早熟品种F13-18苗期综合抗逆性的鉴定指标,Chl、Pro、TDS、POD可作为中晚熟品种F14-20苗期综合抗逆性的鉴定指标。
[1]中国蔬菜编辑部.2014年全国各地蔬菜、西瓜、甜瓜、草莓、马铃薯播种面积和产量[J].中国蔬菜,2016(1):17.
[2]冯嘉玥,邹志荣,陈修斌.土壤水分对温室春黄瓜苗期生长与生理特性的影响[J].西北植物学报,2005,25(6):1156-1161.
[3]吴雪霞,朱月林,朱为民,等.外源一氧化氮对NaCl胁迫下番茄幼苗生长和光合作用的影响[A].中国园艺学会第七届青年学术讨论会论文集[C],2006.
[4]王霞霞,陈年来.土壤干旱对甜瓜幼苗生理生化特性的影响[J].甘肃农业大学学报,2004,39(5):529-533.
[5]张玉鑫.NaCl胁迫对甜瓜种子萌发及幼苗生理生化特性的影响[D].兰州:甘肃农业大学,2005.
[6]王兴虎.低温对厚皮甜瓜幼苗生长及生理生化特性的影响[D].兰州:甘肃农业大学,2005.
[7]户金鸽,廖亮,杨军,等.哈密瓜苗期抗旱相关指标及主成分分析[J].新疆农业科学,2016,53(1):114-119.
[8]李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,2000.
[9]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2001.
[10]朱诚,曾广文.桂花花衰老过程中的某些生理生化变化[J].园艺学报,2000,27(5):356-360.
[11]Krause G H,Weis E.Chlorophll fluorescence and photosynthesis of the basics[J].Annu Rev Plant PhysiolMolBiol,1991,45:633.
[12]曾晓琳,王大伟,刘金平,等.坡向对3种冷季型草坪草表观性状及叶绿素含量的影响[J].草业科学,2015,32(11):1823-1831.
[13]韩冰,贺超兴,闫妍,等.AMF对低温胁迫下黄瓜幼苗生长和叶片抗氧化系统的影响[J].中国农业科学,2011,44(8):1646-1653.
[14]范双喜,谷建田,韩莹琰.园艺植物高温逆境生理研究进展[J].北京农学院学报,2003,18(2):147-151.
[15]冯方剑,宋敏,陈全家,等.棉花苗期抗旱相关指标的主成分分析及综合评价[J].新疆农业大学学报,2011,34(3):211-217.
[16]肖雯,贾恢先,蒲陆梅.几种盐生植物抗盐生理指标的研究[J].西北植物学报,2000,20(5):818-825.
[17]陈亚鹏,陈亚宁,李卫红,等.塔里木河下游干旱胁迫下的胡杨生理特点分析[J].西北植物学报,2004,24(10):1943-1948.
[18]冀天会,张灿军,谢惠民,等.小麦品种抗旱性鉴定产量指标的比较研究[J].中国农学通报,2006,22(1):103-106.
[19]Far shadfar E,Kszegi B,Tischner T,etal.Substitution analysisof drought tolerance in wheat(Triticum aestivum L.)[J].Plant Breeding,1995,114:542-544.
[20]田彦彦.逆境胁迫对菊花光合特性及相关生理指标的影响[D].郑州:河南农业大学,2009.
[21]刘旻霞,马建祖.甘南亚高山草甸植物对逆境胁迫的生理生态响应[J].农业系统科学与综合研究,2010,26(3):288-292.
(责任编辑 李洁)
Physiological Responses of M uskmelon Seedlings to Different Adversity Stresses and Synthetical Evaluation of Stress Resistance
ZHAOWei-xing1,LIU Xi-cun2,LIXiao-hui1,XU Xiao-li1,CHANG Gao-zheng1,LIANG Shen1,KANG Li-yun1,GAO Ning-ning1
(1.Institute of Horticulture,Henan Academy of Agricultural Sciences,Henan Zhengzhou 450002,China;2.Xinxiang Academy of Agricultural Sciences,Henan Xinxiang 453000,China)
The physiologicalmechanism of injury on Muskmelon under adversity stresseswaselucidated to provide theoretical basis for screening and application of resistant variety.Early-maturing variety F13-18 and middle-late variety F14-20 were used as the testmaterials,contents ofsoluble protein,chlorophyll,free proline,malondialdehyde and protective enzyme connected with resistance by cold,drought,salt and water stress at the seedlings stage were determined.Adversitystress of seedlings stage increased the contents of soluble protein,chlorophyll,free proline,malondialdehyde,raised the activity of SOD and POD,reduced the content of chlorophyll and Chla/b.But therewere different copingmechanismsbetween different typesof adversity stresses,in awhole,cold and water stresshad larger effectson osmoregulation matters content and photosynthetic characteristics,and drought and salt stress had larger effects onprotective enzyme activity.The physiological indexes of stress resistance were evaluated by principal component analysis.The contentsof chlorophyll,Chla/b and the activity of SOD and POD could be used as the indicators of Stress resistance identification at the seedlingsstage of Early-maturing variety F13-18,and the contents of chlorophyll,free proline,permeability of cellmembrane and PODactivity could be used as ones ofmiddle-late variety F14-20.
Muskmelon;Adversity stress;Physiological responses;Principal component analysis;Synthetical evaluation
S642
A
1001-4829(2017)2-0322-05
10.16213/j.cnki.scjas.2017.2.014
2016-04-13
国家西甜瓜产业技术体系建设项目(CARS-26);河南省科技攻关项目(162102110099);河南省农业科学院科研发展专项(20157804)
赵卫星(1978-),男,河南上蔡人,副研究员,博士,主要从事西甜瓜育种及栽培生理方面研究,Tel:0371-65748477,E-mail:wxzhao2008@163.com。
